Лимфома Беркитта
(ЛБ) – злокачественная опухоль из группы неходжкинских лимфом, образующаяся из зрелых В-лимфоцитов. Характеризуется повышенной агрессивностью, высокой пролиферативной активностью, коротким анамнезом (несколько недель) и склонностью к рецидивам. Обычно рецидивы развиваются в течение 6-9 месяцев после окончания курса химиотерапии, позже встречаются крайне редко.
Согласно МКБ-10 лимфоме Беркитта соответствует код 2A85.6.
В зависимости от причины болезни различают 3 типа ЛБ:
Эндемическая.
Чаще всего поражает темнокожих детей (особенно 5-8-летних мальчиков), проживающих в африканских странах. В 95-100% случаев связана с вирусом Эпштейн-Барра.
Спорадическая.
Встречается в неэндемической зоне.
ВИЧ-ассоциированная.
Развивается на фоне иммунодефицитных состояний (у ВИЧ-инфицированных людей, в основном у мужчин.
Для патогенеза ЛБ характерно усиление экспрессии протоонкогена c-MYC.
В большинстве случаев (30-50%) лимфома Беркитта поражает детей, мальчиков в 3-4 раза чаще, чем девочек. У взрослых встречается редко – в 2% случаев. (https://med4share.ru/media/files/clinic_recommend/lymphoma_berkitta.pdf)
Чаще всего опухоль локализуется в брюшной полости, крайне редко – в средостении.
1.Лимфома Беркитта и ее типы
Лимфома Беркитта – это одна из форм неходжкинской лимфомы,
при которой рак начинается в иммунных клетках. Лимфома Беркитта признана
самой быстрорастущей опухолью у человека
, и если вовремя не начать лечение, она быстро приводит к смертельному исходу. Но интенсивная химиотерапия более чем в половине случаев помогает существенно продлить жизнь пациентам с лимфомой Беркитта.
Лимфома Беркитта названа в честь британского хирурга Дениса Беркитта, который впервые диагностировал это заболевание в 1956 году среди африканских детей. В Африке лимфомой болеют дети, у которых также есть малярия и вирус Эпштейна-Барра, вызывающий инфекционный мононуклеоз. Вероятно, что малярия ослабляет реакцию иммунной системы на вирус Эпштейна-Барра, и это позволяет ему влиять на зараженные клетки, превращая их в раковые.
За пределами Африки лимфома Беркитта встречается редко. К появлению этого заболевания более склонны люди, инфицированные ВИЧ – вирусом иммунодефицита человека. По статистике, заболеваемость лимфомой Беркитта у ВИЧ-положительных людей в 1000 раз выше, чем у тех, кто не инфицирован.
Типы лимфомы Беркитта
В классификации Всемирной организации здравоохранения выделены три типа лимфомы Беркитта:
- Эндемическая
(африканская лимфома), о которой мы рассказали выше; - Спорадическая лимфома Беркитта
. Эта форма лимфомы встречается во всем мире. По статистике, на долю спорадической лимфомы Беркитта приходится от 1 до 2% всех случаев лимфомы у взрослого населения. - Лимфома, связанная с иммунодефицитом.
Этот тип лимфомы Беркитта чаще всего встречается у людей с ВИЧ/СПИДом. Но может развиться и у людей с врожденными условиями, вызывающими иммунодефицит, а также у пациентов, перенесших пересадку органов и принимающих иммуносупрессивные препараты (подавляющие иммунную систему).
Обязательно для ознакомления! Помощь в лечении и госпитализации!
Материалы и методы
С 2003 по 2014 г. в ФГБУ ГНЦ М.З. России, Федеральном медицинском исследовательском центре им. П.А. Герцена, Медицинском радиологическом научном центре им. А.Ф. Цыба, Оренбургской областной клинической больнице наблюдались 70 больных с диагнозом ЛБ: 45 мужчин и 25 женщин в возрасте от 15 до 62 лет, медиана возраста 31 год. Стадию заболевания определяли на основании классификации S. Murphy. I стадия заболевания диагностирована у 4 (5,7%) больных, II — у 9 (12,9%), III — у 25 (35,7%), IV — у 11 (15,7%), лейкоз Беркитта — у 21 (30%). У 23 (32,9%) пациентов отмечено вовлечение в опухолевый процесс КМ, у 15 (21,4%) — ЦНС (нейролейкемия у 12, интратумор спинного мозга у 3, интратумор головного мозга у 3). В-симптомы выявлялись у 56 (80%) пациентов, повышение активности лактатдегидрогеназы (ЛДГ) — у 50 (78,1%) из 64, при этом у 34 (56,2%) из 64 отмечено повышение активности ЛДГ более чем в 2 раза по сравнению с референсными значениями. Медиана уровня ЛДГ составила 2398 (238—20 300) ед/л. Острая почечная недостаточность (ОПН) в дебюте заболевания определялась у 17 (24,2%) больных, 8 химиотерапия (ХТ) начата на фоне терапии, замещающей функцию почек. Механическая желтуха вследствие вовлечения в опухолевый процесс головки поджелудочной железы и желчных протоков выявлена у 3 больных. В качестве первого этапа лечения пациентам проведено дренирование желчных протоков (у 1 — эндоскопическая ретроградная панкреатохолангиография, назобилиарное дренирование, у 1 — минилапаротомия, чреспузырное дренирование желчных протоков, у 1 — лапаротомия, интраоперационная холангиография, холецистостомия). У 6 больных на момент поступления в гематологическую клинику диагностировано состоявшееся желудочное кровотечение, у 1, помимо желудочного кровотечения, выявлены множественные субдуральные гематомы, кровоизлияния в склеру. В связи с постренальной анурией, обусловленной сдавливанием опухолью малого таза мочеточников, у 1 больного до поступления в клинику выполнена нефростомия.
Диагноз ЛБ устанавливали в соответствии с критериями ВОЗ 2008 г. на основании биопсии опухолевого новообразования, последующего гистологического, иммуногистохимического и цитогенетического исследований. Протокол обследования больного включал сбор анамнеза и физическое обследование, общий анализ крови, общий анализ мочи, биохимический анализ крови, коагулограмму, миелограмму, иммунохимическое исследование сыворотки крови и мочи, компьютерную томографию (КТ) грудной, брюшной полостей и органов малого таза, электрокардиограмму, биопсию лимфатического узла — ЛУ (опухолевого новообразования), гистологическое, иммуногистохимическое и цитогенетическое исследования, трепанобиопсию, люмбальную пункцию с цитологическим и биохимическим исследованиями ликвора. У всех больных оценивали ВИЧ-статус, наличие HBsAg (качественный тест), антител к антигену вируса гепатита С. По показаниям выполняли фиброгастродуоденоскопию, колоноскопию с множественной биопсией слизистых оболочек желудка и кишечника, КТ мягких тканей шеи и головного мозга, магнитно-резонансную томографию головного мозга, мягких тканей шеи, малого таза с внутривенным болюсным контрастированием, диагностическую лапароскопию или лапаротомию с биопсией опухолевого образования. Все женщины консультированы гинекологом, по показаниям назначалась овариопротекция на период проведения Х.Т. Иммуногистохимическая панель включала антитела к CD20, CD3, CD10, BCL2, BCL6, с-MYC, Ki-67, MUM1, cyclin D1, в отдельных случаях — TdT. Цитогенетическое исследование выполнено 70 больным. Стандартное цитогенетическое исследование (G-дифференциальная окраска хромосом) выполнено 8 больным, в 4 случаях исследовали клетки опухоли (ЛУ), в 4 — клетки КМ. У 29 пациентов проведено цитогенетическое исследование методом флуоресцентной гибридизации in situ
(FISH): в 9 случаях в качестве материала использовали суспензию опухолевые клетки, в 5 — суспензию клеток КМ, в 13 — отпечатки опухоли (гастробиоптата у 6, колонобиоптата у 1, миндалины у 1, трепанобиоптата у 1, ЛУ у 4), в 2 — мазки КМ. У 33 больных исследовали гистологические срезы парафиновых блоков [5]. FISH-исследование проводили с ДНК-зондами Vysis LSI IGH/MYC, CEP 8 Tri-color, Dual Fusion Translocation Probe («Abbott Molecular») для определения t (8;14)(q24;q32), Vysis LSI MYC Dual color, Break Apart Rearrangement Probe («Abbott Molecular») для выявления перестройки локуса гена
MYC
. Для исключения наличия перестроек генов
BCL2
и
BCL6
использовали зонды Vysis LSI BCL2 Dual color, Break Apart Rearrangement Probe («Abbott Molecular») и Vysis LSI BCL6 (ABR) Dual color, Break Apart Rearrangement Probe («Abbott Molecular») соответственно. Транслокация t (8;14)(q24;q32) выявлена в 56 из 63 случаев, t (8;22)(q24;q11) — у 2 из 63 больных, вариантные транслокации (наличие перестройки локуса гена
MYC
при отсутствие транслокации t (8;14)(q24;q32)) — у 6 из 63. В 7 случаях выявлена перестройка локуса гена
MYC
, FISH для выявления t (8;14)(q24;q32) не проводилась. Во всех случаях отсутствовали перестройки генов
BCL2
и
BCL6
.
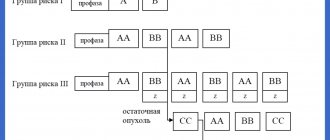
Лечение проводили по протоколу ЛБ-М-04±R, (4 последовательных блока А-С-А-С) [4]. С 2011 г. больным с поражением КМ проводили 6 блоков А-С-А-С-А-С с ритуксимабом. Блок, А включал внутривенное введение 10 мг/м2 дексаметазона в 1—5-е дни, 1500 мг/м2 метотрексата за 12 ч в 1-й день, 800 мг/м2 ифосфамида в 1—5-й дни, 1 мг/м2 винкристина в 1-й день, 50 мг/м2 доксорубицина в 3-й день, 150 мг/м2 цитарабина в 4—5-й дни и 100 мг/м2 этопозида в 4—5-й дни; блок С состоял из внутривенного введения 10 мг/м2 дексаметазона в 1—5-й дни, 1500 мг/м2 метотрексата за 12 ч в 1-й день, 5 мг/м2 винбластина в 1-й день, 2000 мг/м2 цитарабина 2 раза в день во 2—3-й дни, 150 мг/м2 этопозида в 3—5-й дни. Ритуксимаб вводили внутривенно в день 0 курса в дозе 375 мг/м2. Всем пациентам проводили профилактику нейролейкемии в 1-й день каждого блока путем интратекального введения 3 препаратов: 30 мг преднизолона, 30 мг цитарабина и 15 мг метотрексата. При выявлении нейролейкемии люмбальные пункции с интратекальным введением химиопрепаратов выполняли 2 раза в неделю до полной санации ликвора и получения 3 нормальных анализов спинномозговой жидкости. При прогрессировании заболевания больного выводили из протокола. Трем пациентам с вовлечением в опухолевый процесс миндалин, рото- и носоглотки в связи с угрозой асфиксии лечение начато в условиях реанимационного отделения на фоне искусственной вентиляции легких (ИВЛ) [6].
У 29 (41%) больных в анамнезе имелись хирургические вмешательства, связанные с основным заболеванием (табл. 1). Основная цель таких вмешательств, как правило, проводимых в хирургических стационарах широкого профиля, заключалась в уменьшении объема опухолевой массы или радикальное удаление случайно выявленной опухоли. Срочное гистологическое исследование не проводилось. Врачи и пациент узнавали о диагнозе лимфомы спустя 10—14 дней. За этот период в большинстве случаев отмечался продолженный быстрый рост опухоли.
Таблица 1. Хирургические вмешательства у 29 больных ЛБ до начала ХТ по протоколу ЛБ-М-04
Осложнения ХТ оценены в соответствии с CTCAE (Common Terminology Criteria for Adverse Events) 2009 г. [7].
Статистический анализ данных.
При статистическом анализе данных с помощью одно- и многофакторного анализов (регрессионного анализа Кокса) обнаружили и оценили ассоциированные с ЛБ неблагоприятные прогностические факторы. Основным критерием оценки факторов неблагоприятного прогноза выбрана общая выживаемость (ОВ), дополнительным — безрецидивная выживаемость (БРВ). Наряду со значениями выживаемости приводим стандартную ошибку (
SE
), отношение рисков (ОР) и соответствующий 95% доверительный интервал (ДИ). Пороговый уровень статистической значимости
р
выбран равным 0,05. Для расчетов использовали лицензионный статистический пакет SAS 9.1.
2.Симптомы лимфомы Беркитта
Симптомы лимфомы Беркитта зависят от ее типа. Эндемическая (африканская) лимфома обычно начинается с опухоли
челюсти или других лицевых костей. Кроме того, она может влиять на желудочно-кишечный тракт, грудь и яичники, а также распространяться на центральную нервную систему, вызывая повреждение нервов, слабость и паралич.
Спорадическая и иммунодефицитная лимфомы Беркитта обычно начинаются в кишечнике и образуют большие опухоли в брюшной полости. Позже зачастую поражается печень, селезенка и костный мозг. Рост раковых клеток при лимфоме Беркитта может начаться и в яичниках, яичках или других органах, распространяясь на мозг и спинномозговую жидкость.
Помимо роста опухоли симптомами лимфомы Беркитта могут быть
:
- Потеря аппетита;
- Потеря веса;
- Усталость;
- Потоотделение по ночам;
- Необъяснимое повышение температуры.
Посетите нашу страницу Онкология
Обсуждение
Как отмечалось ранее, ввиду редкости ЛБ количество исследований по терапии этого заболевания невелико, отсутствуют рандомизированные исследования, в большинстве представленных работ включено небольшое число пациентов. Основные международные результаты терапии ЛБ представлены в табл. 8 [9—27]. Данные исследования условно можно разделить на 3 группы: неинтенсивные программы [5—14], интенсивные протоколы (LMB, Hyper-CVAD, CODOX-M/IVAC, LMB, CALGB, NHL-BFM-83/86) без включения ритуксимаба [13—21] и интенсивные программы ХТ с ритуксимабом [22—27]. Как видно из представленных данных, несмотря на интенсификацию терапии и включение в протоколы ритуксимаба, ОВ и БРВ значительно не изменились.
Таблица 8. Мировые данные лечения ЛБ Примечание. н/д — нет данных.
В наиболее крупном проспективном исследовании по оценке терапии ЛБ взрослых включены 363 больных из 98 центров. Лечение проводилось по протоколу GMALL-B-ALL/NHL2002, представляющему модифицированную улучшенную версию протоколов немецкой группы B-NHL83, B-NHL86 и B-NHL90. Основными особенностями протокола явились включение ритуксимаба и уменьшение дозы метотрексата до 1500 мг/м2 для пациентов в возрасте 55 лет или моложе, до 500 мг/м2 — для больных старше 55 лет. Ремиссия достигнута у 88% больных, 5-летняя ОВ составила 80%. В то же время у пациентов старшей возрастной группы (старше 55 лет) ОВ существенно ниже — 62% (по сравнению с ОВ пациентов в возрасте 55 лет или моложе, составившей 86%) [26]. T. Intermesoli и соавт. [24] провели исследование по оценке эффективности лечения пациентов ЛБ по аналогичному протоколу GMALL-B-ALL/NHL2002. В исследование включены 105 больных в возрасте от 17 до 78 лет, медиана возраста составила 47 лет. 3-Летняя ОВ и БРВ составила 67 и 75% соответственно. Как видно, по результатам нашей исследовательской группы, 5-летняя ОВ, достигающая 85%, и 5-летняя БРВ — 95%, являются оптимистичными.
Как и в нашем исследовании, в работе D. Hoelzer и соавт. [26] показано, что в старшей возрастной группе наблюдалась более высокая летальность по сравнению с таковой у молодых пациентов — 11 и 2% соответственно; при этом 90% смертей обусловлено инфекционными осложнениями в период проведения Х.Т. Аналогичные результаты приводит T. Intermesoli и соавт. [24]: ранняя летальность, связанная с лечением, составила 13% и наблюдалась преимущественно у пациентов старше 45 лет с генерализованными стадиями заболевания (III—IV или лейкоз Беркитта). В нашем исследовании летальность, связанная с лечением, составила 8,6% (умерли 6 пациентов), 3 пациента были старше 40 лет. Стоит отметить, что медиана возраста наших пациентов была несколько ниже — 31 год. J. Hong и соавт. [27] отмечают, что помимо высокой летальности в группе больных старшего возраста именно у этих пациентов не удается провести лечение в полном объеме. У 25,6% пациентов не выполняется программа протокола (R-Hyper-CVAD) ввиду его высокой токсичности.
J. Kelly и соавт. [28] проанализированы данные SEER database (Surveillance, Epidemiology и End Results) с 1973 по 2004 г., а также публикации по данным PubMed, Web of Science, Cochrane Library с 1989 по 2007 г. В анализ вошли исследования, в которые включены 10 пациентов и более с впервые выявленной ВИЧ-негативной ЛБ. J. Kelly отобраны 13 публикаций (543 пациента). Пациенты старше 40 лет составили 42,2% (n
=229). ОВ больных старше 40 лет в исследованиях до 2000 г. составила 40%, после 2000 г. — 60%, что существенно ниже, чем ОВ молодых пациентов.
Факторы неблагоприятного прогноза.
В исследовании D. Hoelzer и соавт. [26] факторами неблагоприятного прогноза, влияющими на ОВ (однофакторный анализ), являлись женский пол, содержание лейкоцитов >30·109/л, тромбоцитов <25·109/л, поражение КМ, вовлечение ЦНС, III—IV стадии заболевания, активность ЛДГ >250 ед/л, высокие IPI и aaIPI. При проведении многофакторного анализа статистически значимыми факторами неблагоприятного прогноза оказались возраст старше 55 лет, поражение КМ и женский пол [26]. По данным T. Intermesoli и соавт. [24], возраст старше 60 лет и оценка по ECOG >1 балла влияют на ОВ и БРВ. В исследовании J. Hong и соавт. [27] при проведении многофакторного анализа выявлено, что возраст старше 60 лет, оценка соматического статуса по ECOG 2 балла и более, абсолютное число лимфоцитов менее 1,2·109/л, высокий IPI являются независимыми прогностическими факторами, влияющими на выживаемость. По нашим данным, КМ, плохой соматический статус (оценка по ECOG 3—4 балла), лейкоз Беркитта являются факторами неблагоприятного прогноза, влияющими на ОВ (по данным многофакторного анализа). Наши результаты полностью соответствуют данным зарубежных авторов.
3.Диагностика лимфомы Беркитта
Поскольку лимфома Беркитта распространяется очень быстро, ранняя диагностика имеет решающее значение для выздоровления пациента.
При подозрении на лимфому Беркитта проводится биопсия
увеличенных лимфатических узлов или других предполгагаемых очагов заболевания. Взятие образца ткани и его дальнейшее исследование под микроскопом помогут подтвердить или исключить диагноз лимофма Беркитта.
Дополнительными методами диагностики лимфомы могут быть:
- Компьютерная томография грудной клетки, живота и таза;
- Рентгенограмма грудной клетки;
- ПЭТ, или позитронно-эмиссионная томография;
- Биопсия костного мозга;
- Исследование спинномозговой жидкости;
- Анализы крови для оценки работы почек и печени;
- Тестирование на ВИЧ-инфекцию.
О нашей клинике м. Чистые пруды Страница Мединтерком!
Преимущества Топ Ихилов
- Онкологи и онкогематологи клиники — первоклассные врачи, эксперты в области терапии разнообразных лимфом. Они прошли многолетнюю подготовку и обладают исключительным опытом.
- Диагностические исследования проводятся с применением новейшей лабораторной техники и высокоточной аппаратуры.
- Для лечения используются уникальные методики, начиная от высокоэффективных схем химиотерапии и заканчивая применением иммунных препаратов.
- Пациенты клиники проживают в удобных палатах, окружены атмосферой уюта, а взаимодействием с врачами и переводом медицинской документации занимается персональный куратор-переводчик.
- 5
- 4
- 3
- 2
- 1
(12 голосов, в среднем: 4.4 из 5)
4.Лечение лимфомы Беркитта
Интенсивная внутривенная химиотерапия
, которая обычно проводится в стационаре – самый эффективный метод лечения лимфомы Беркитта. Поскольку лимфома Беркитта может распространяться на жидкости, окружающие головной и спинной мозг, химиотерапевтические препараты могут вводиться непосредственно в спинномозговую жидкость. Этот метод лечения называется
интратекальная химиотерапия.
Для лечения лимфомы Беркитта могут использоваться различные препараты
. Например, циклофосфамид, цитарабин, доксорубицин, этопозид, метотрексат, винкристин и другие.
Интенсивная химиотерапия может быть как самостоятельным методом лечения лимфомы Беркитта, так и составной частью сложного лечения. Наравне с химиотерапией используются:
- Ритуксимаб
– моноклональное антитело, которое прилипает к белкам раковых клеток и стимулирует иммунную систему атаковать раковые клетки; - Трансплантация аутологичных стволовых клеток
. Это стволовые клетки, которые ранее были взяты у пациента и сохранены в банке стволовых клеток; - Лучевая терапия;
- Терапия стероидами.
Лимфома Беркитта – смертельное опасное заболевание, если его не лечить. У детей своевременная интенсивная химиотерапия обычно помогает вылечить лимфому и спрогнозировать долгосрочную выживаемость в 60-90% случаев. У взрослых пациентов результаты бывают очень разными, но в среднем своевременное лечение – это долгосрочная выживаемость в 70-80% случаев, что тоже немало.
Результаты
Полная ремиссия заболевания достигнута у 62 (89%) больных (табл. 2). От осложнений терапии в период индукции ремиссии умерли 6 пациентов, у 2 наблюдалась прогрессия заболевания, у 3 развился рецидив заболевания (у 2 ранний, у 1 через 2 года после завершения лечения). 5-Летняя ОВ составила 85%, 5-летняя БРВ — 95% (рис. 1). Согласно данным, представленным в табл. 2, при рассмотрении частоты развития изучаемых исходов (рецидив, прогрессирование, смерть от осложнений ХТ) в разных возрастных группах, выявлялось более высокая индукционная летальность в группе пациентов старше 40 лет. Частота достижения полных ремиссий, а также ОВ и БРВ статистически значимо не различались.
Таблица 2. Результаты лечения по протоколу ЛБ-М-04 Примечание. Данные представлены в виде абсолютного числа больных (%), если не указано другое.
Рис. 1. 5-Летние ОВ и БРВ при ЛБ за период наблюдения 2003—2014 гг.
При проведении однофакторного анализа факторов неблагоприятного прогноза в качестве исследуемых параметров проанализированы пол, возраст, стадии заболевания, вовлечение КМ и ЦНС, в том числе сочетанное, оценка соматического статуса по шкале оценки общего состояния (ECOG), оценки Международного прогностического индекса (IPI) и скорректированного по возрасту Международного прогностического индекса (aaIPI), уровень ЛДГ, В-симптомы, множественные экстранодальные очаги поражения, ОПН, хирургические вмешательства в анамнезе, использование ритуксимаба в терапии. Результаты однофакторного анализа представлены в табл. 3. Выявлена статистически значимая зависимость ОВ от стадии заболевания, наличия поражения КМ, плохого соматического статуса и высокой концентрации ЛДГ. В область пограничных значений (р
=0,05) влияния на ОВ вошли мужской пол, высокий IPI и aaIPI, наличие В-симптомов, а также 3 экстранодальных очага и более. Прогностически значимыми факторами, влияющими на БРВ, оказались генерализованные стадии заболевания/лейкоз Беркитта и поражение КМ. 5-Летняя ОВ в зависимости от стадии заболевания, поражения КМ и оценки соматического статуса по ECOG представлена на рис. 2.
Таблица 3. Результаты однофакторного анализа неблагоприятных прогностических признаков при ЛБ (всего 70 пациентов)
Рис. 2. 5-Летняя ОВ при ЛБ в зависимости от стадии (включая стадию ОЛЛ — лейкоз Беркитта) заболевания (а), поражения КМ (б) и оценки соматического статуса по ECOG (в).
Для оценки сочетанного влияния факторов неблагоприятного прогноза у больных ЛБ проведен многофакторный регрессионный анализ Кокса с включением в исследование аналогичных параметров. Результаты многофакторного анализа представлены в табл. 4. Лейкоз Беркитта и поражение КМ оказались независимыми прогностическими факторами, влияющими как на ОВ, так и на БРВ. Плохой соматический статус (оценка по ECOG 3—4 балла по сравнению с 0—2 баллами) оказался статистически значимым для ОВ, но не для БРВ.
Таблица 4. Результаты многофакторного регрессионного анализа Кокса неблагоприятных прогностических признаков при ЛБ
Осложнения ХТ.
Средняя продолжительность миелотоксического агранулоцитоза составила 5,2 (0—29) дня, максимальная длительность отмечалась после первого курса ХТ — 7,2 (0—25) дня, что связано с исходно тяжелым состоянием пациентов, большой опухолевой массой, вовлечением КМ, часто наличием ОПН. Осложнения, развившиеся в период лечения по протоколу ЛБ-М-04, представлены в табл. 5. Дополнительным подтверждением тяжести состояния пациентов является развитие синдрома цитолиза опухоли (СЦО) у 19 (27%) больных. СЦО диагностирован у 10 больных лейкозом Беркитта: у 3 — с IV стадией, у 5 — с III, у 1 — с I стадией по S. Murphy. Согласно данным табл. 4 все курсы сопровождались развитием лейкопении, преимущественно IV степени, тромбоцитопении III—IV степени, анемии, как правило III—IV степени. Степень лейкопении, тромбоцитопении и анемии статистически значимо не различалась в зависимости от курса. В период проведения первого курса чаще наблюдались тяжелые инфекции и состояния, требующие перевода больных в реанимационное отделение: сепсис, пневмония, менингит, некротическая энтеропатия, острая дыхательная недостаточность с ИВЛ. Индукционная летальность в период проведения первого курса составила 5,7% (умерли 4 пациента; во всех случаях причиной смерти являлись сепсис, септический шок, полиорганная недостаточность), второго курса — 3% (умерли 2 больных: 1 от синегнойного сепсиса, 1 от травматической субдуральной гематомы). На последующих курсах ХТ не наблюдалось случаев смерти, связанной с лечением. Среди 6 пациентов, умерших от осложнений, связанных с лечением, 3 были в возрасте 40 лет и старше (см. табл. 2), что еще раз подтверждает большую токсичность интенсивных режимов ХТ у пациентов старше 40 лет [8]. Если мы рассмотрим отдельно осложнения, возникающие в процессе лечения у пациентов старшей возрастной группы (табл. 6), то увидим, что количество тяжелых осложнений (сепсис, септический шок, пневмония и т. д.) существенно больше. Кроме того, длиннее был период миелотоксического агранулоцитоза. Среди 18 пациентов старшей возрастной группы 3 умерли от осложнений ХТ, 2 выведены из протокола после трех курсов ввиду высокой токсичности, 2 после двух блоков переведены на более легкий курс (блок B) в связи с длительной цитопенией. Удлинение интервалов между курсами (суммарное число курсов 61) наблюдалось на 18 (29,5%) курсах, уменьшение доз химиопрепаратов цитарабина и метотрексата на 30—50% отмечено в 11 (18%) случаях.
Таблица 5. Осложнения, развившиеся в период проведения лечения по протоколу ЛБ-М-04, и потребность в гемотрансфузиях Примечание. Здесь и в табл. 6, 7 данные представлены в виде медианы (разброс) или абсолютного числа больных (%). ОДН — острая дыхательная недостаточность; ОКС — острый коронарный синдром.
Таблица 6. Осложнения, развивающиеся в период проведения ХТ по протоколу ЛБ-М-04, и их следствия у пациентов старше 40 лет
Отдельному рассмотрению подлежит группа пациентов с лейкозом Беркитта. В табл. 7 для сравнения представлены продолжительность миелотоксического агранулоцитоза, наиболее тяжелые осложнения, развившиеся в процессе лечения, и объем трансфузионной поддержки у больных лейкозом Беркитта. Как видно, СЦО наблюдается в 52,4% случаев (в общей группе у 27% больных), продолжительность агранулоцитоза после первого курса составляет 11, 3 дня (по сравнению с 7,2 дня в общей группе), наиболее тяжелые инфекционные осложнения: сепсис, септический шок, пневмония, ОДН, менингит наблюдаются значительно чаще — в 33,3, 9,5, 33,3, 28,6 и 14,3% случаях соответственно. Для сравнения, в общей группе указанные осложнения развиваются в 15,7, 5,7, 15,7, 8,6 и 7,1% случаев соответственно. Потребность и объем трансфузионной поддержки (см. табл. 7) в 1,5 раза больше, чем в общей группе (см. табл. 5). Подобная ситуация объясняется тем, что пациенты с лейкозом Беркитта являются наиболее тяжелой группой. Это обусловлено большой опухолевой массой, интоксикацией, СЦО, электролитными нарушениями. Среди 8 пациентов, нуждавшихся в проведении гемодиализа, у 7 имелся лейкоз Беркитта. Основные сложности при лечении больных лейкозом Беркитта возникали именно в период проведения первого курса ХТ, в дальнейшем продолжительность миелотоксического агранулоцитоза, количество инфекционных осложнений и объем трансфузионной поддержки не отличались от таковых в общей группе.
Таблица 7. Осложнения, развивающиеся в период проведения ХТ по протоколу ЛБ-М-04, и потребность в гемотрансфузиях у пациентов с лейкозом Беркитта