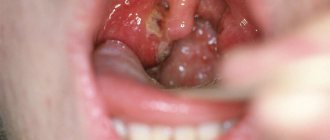
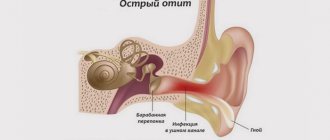
Паратонзиллярный абсцесс — это гнойная полость, расположенная в тканях, на уровне мягкого нёба над нёбной миндалиной. Чаще всего такое гнойное воспаление возникает на фоне перенесённой ангины или обострения хронического тонзиллита. Гнойное поражение может быть справа или слева в глотке, а может быть двусторонним. Лечение паратонзиллярного абсцесса, как правило, хирургическое. Консервативная терапия проводится на начальном этапе воспаления. Паратонзиллярный абсцесс часто приводит к удалению гланд. Причины, симптомы и методы лечения абсцесса — тема нашей новой статьи.
Паратонзиллярный абсцесс представляет собой загноившуюся полость. Она локализуется в тканях, на уровне мягкого нёба над нёбной миндалиной. Эти ткани называются паратонзиллярной клетчаткой. Понятие «паратонзиллярный абсцесс» — это уже гнойный процесс. Ему предшествуют такие диагнозы, как паратонзиллит и флегмонозная ангина. Все эти три диагноза описывают перетекание одного состояния в другое, более тяжёлое.
Болезнь является высшей степенью воспаления гланд и одной из самых тяжёлых форм гнойного поражения глотки. Одна треть случаев развития паратонзиллита приходятся на осложнения болезни «хронический тонзиллит». Также флегмона может образоваться в средостении — диагноз звучит как медиастинит. Это может произойти, если проигнорировать лечение болезни.
Чаще всего этот диагноз ставят в молодом возрасте — до тридцати — тридцати пяти лет.
Воспаление может протекать в нескольких формах в зависимости от места его локализации. Также может быть односторонним (при поражении слева мы говорим про левосторонний паратонзиллярный абсцесс, при поражении справа — про правосторонний паратонзиллярный абсцесс), реже — двусторонним.
Лечение левостороннего абсцесса горла, равно как и лечение правостороннего абсцесса, должно проводиться только под контролем врача — оториноларинголога. Попытки лечить заболевание в домашних условиях не только неэффективны, но и опасны, поскольку могут спровоцировать серьёзные осложнения заболевания.
Причины, признаки, симптомы и лечение паратонзиллярного абсцесса — темы нашей новой статьи.
Причины заболевания
Паратонзиллит возникает при попадании болезнетворных микроорганизмов в ткани, находящиеся вокруг гланд.
Возбудители заболевания — стрептококки, стафилококки, грибы.
Как же попадает в околоминдаликовую клетчатку патогенные микроорганизмы? Причин запуска воспалительного процесса может быть несколько:
- недолеченная ангина, когда бактерии из нёбных миндалин проникают в близлежащие ткани;
- обострение хронического тонзиллита, когда патогенная микрофлора также проникает из гланд;
- стоматологические заболевания — например, кариес (инфекция попадает из ротовой полости), при этом необязательно, что и сами гланды воспалятся;
- травмирование тканей вокруг миндалин, в процессе чего возникает инфицирование;
- попадание инфекции с кровотоком;
- хронические скопления инфекции в организме (например, хронический гайморит);
- сахарный диабет;
- сниженный иммунитет;
- курение.
Обычно гнойное воспаление выступает как осложнение хронического или острого тонзиллита (ангины) — это наиболее частая причина болезни.
Почему необходимо вскрытие и дренирование паратонзиллярного абсцесса
Паратонзиллярный абсцесс относится к ургентным состояниям в отоларингологии. Близость жизненно важных структур (дыхательное горло, крупные сосуды головы и шеи) требует незамедлительной диагностики и лечения. В начальных этапах, когда еще не успел сформироваться абсцесс, патология хорошо поддается медикаментозной терапии. Назначается курс антибиотикотерапии, противовоспалительных и обезболивающих средств. При малой эффективности консервативного лечения гнойник вскрывают хирургически.
Паратонзиллярный абсцесс опасен своими осложнениями, чреватыми развитием флегмоны, медиастинита и даже сепсиса. В отделении отоларингологии клиники GMS есть все, что необходимо для точного диагностирования и лечения паратонзиллярных абсцессов.
Вскрытие гнойника осуществляется с помощью современного хирургического оборудования. При проведении операции активно используется потенциал лазерной и радиоволновой хирургии, что позволяет выполнить процедуру в наиболее щадящем режиме, исключив развитие п/операционных осложнений. Вскрытие абсцессов у детей проводится под наркозом, что значительно повышает комфортность проведения вмешательства.
Разновидности заболевания
Воспалительный процесс может возникнуть слева или справа в глотке. Такое воспаление называют односторонним — соответственно левосторонним абсцессом или правосторонним. Если воспаление возникает и слева, и справа одновременно, это двусторонний тип воспаления.
Если за основу классификации брать место расположения гнойного «кармана», выделяют следующие разновидности заболевания:
- переднюю — наиболее распространённый тип диагноза; воспалению подвергаются ткани над гландами;
- заднюю, когда гнойное воспаление возникает между задней нёбной дужкой и гландой; такое воспаление может перекинуться на гортань;
- нижнюю, когда воспаление располагается у нижнего полюса миндалины, при этом передняя нёбная дужка смещается вперёд и вниз;
- наружную (боковую) — менее распространённая, но наиболее тяжёлая разновидность, при которой нагноившаяся полость возникает между краем миндалины и стенкой глотки. При этой форме болезни гной может прорваться в здоровые ткани шеи.
Причины возникновения и течение болезни
Развитие паратонзиллярного абсцесса происходит в несколько этапов. Сначала формируется паратонзиллит, потом следует флегмонозный (гнойный разлитой очаг) процесс и абсцедирование, происходит процесс самопроизвольного опорожнения гноя в пространство около миндалин или в полость глотки.
Причиной развития этого заболевания может быть нагноение миндалины при ангине или обострении хронического тонзиллита. Кроме того паратонзиллярный абсцесс может возникнуть из-за распространения гнойного процесса, который развился в десне при кариесе зубов, а также при затрудненном прорезывании восьмого зуба на нижней челюсти. В зависимости от места локализации очага, по аналогии с паратонзиллитом, абсцесс по расположению к небной миндалине может быть передним, задним, нижним и наружным.
Симптомы паратонзиллярного абсцесса горла
Основной признак болезни — острая, нестерпимая боль в горле: признаки абсцесса справа — болевые ощущения, сосредоточенные в правой части глотки, слева — в её левой части, соответственно. Лишь в десяти процентах случаев боль возникает по обеим сторонам горла. Сначала боль ощущается во время глотания, затем перерастает в постоянную. Она может «отдавать» в ухо или зубы.
Затем присоединяются другие симптомы заболевания: увеличение температуры тела до высоких отметок (40℃), ломота в теле, головные боли.
В отдельных случаях могут наблюдаться специфические симптомы болезни:
- спазмы жевательных мыщц, в силу чего пациент с трудом открывает рот;
- ощущения присутствие в глотке постороннего предмета или кома;
- увеличение лимфоузлов;
- появление гнусавости в голосе;
- зловонный запах из ротовой полости;
- болевые ощущения во время поворота головы;
- наклон головы в сторону поражённой области или вперёд;
- затруднённое дыхание, появление одышки.
Иногда происходит самопроизвольное вскрытие гнойной полости, что приводит к стиханию признаков болезни и улучшению состояния больного.
Клиническая картина
Наблюдается боль в глотке, которая усиливается при глотании, повороте головы и кашле. Пациент испытывает затруднения при открывании рта, которое сопровождается резкой болью. Отмечается тризм (невозможность полностью открыть рот) жевательной мускулатуры. Больной вынужден отказываться от приема пищи и питья, боль мешает его нормальному сну.
Температура тела повышена, больные жалуются на слабость и недомогание. При проведении фарингоскопии определяется гиперемия (выраженная краснота) слизистой оболочки и инфильтрация одной половины мягкого нёба и нёбных дужек на стороне поражения.
Небная миндалина несколько смещена в здоровую сторону и напряжена. Лимфатические узлы, расположенные под челюстью и на шее несколько припухают. Из-за того, что мягкое небо почти неподвижно голос становится гнусавым. Наиболее часто встречаются околоминдальниковые абсцессы с передней и верхнепередней локализацией.
Диагностика
Вовремя и, главное, правильно поставить диагноз — важный шаг на пути к выздоровлению. Постановку диагноза, также, как и лечение горла при абсцессе, осуществляет врач — оториноларинголог. Клиническая картина заболевания, как правило, настолько показательная, что поставить верный диагноз не составляет особой сложности.
На первичной консультации лор-врач собирает анамнез и жалобы пациента: уточняются наличие перенесённых недавно ангины или обострения хронического тонзиллита, стоматологических проблем или механических повреждений стенок глотки. Лор-врач выясняет, как проводилось лечение воспаления гланд (в случае тонзиллита), и когда самочувствие больного ухудшилось.
Затем производится непосредственный осмотр больного: у некоторых пациентов сразу заметен непроизвольный наклон головы в сторону воспалённой области глотки, чувствуется неприятный запах из ротовой полости, хорошо прощупываются увеличенные лимфоузлы.
Самым наглядным методом исследования при таком состоянии является фарингоскопия, которая позволяет определить область локализации абсцесса.
Если мы имеем дело с боковой формой расположения флегмоны или при подозрении на развитие осложнений, пациенту назначают УЗИ и КТ шеи.
Если вовремя не диагностировать проблему и не начать лечить горло, могут развиться опасные осложнения:
- флегмона шеи (гнойное воспаление тканей шеи);
- медиастинит — воспаление средостения;
- заражение крови;
- стеноз гортани, который может привести к удушью.
Подобные осложнения левостороннего абсцесса, равно как и правостороннего, могут закончиться летальным исходом.
Лечение
При паратонзиллярном абсцессе показано оперативное (хирургическое) вмешательство. Вскрытие абсцесса выполняют через переднюю небную дужку, отступив от свободного края кнаружи 1-1,5 см в месте, где наблюдается наибольшее размягчение и выпячивание. В случае если определить место размягчения очень сложно, рекомендуется проводить разрез на середине линии, которая соединяет последний коренной зуб и основание язычка. Слизистую обрабатывают анестетиком и скальпелем делают разрез в месте наибольшего выбухания инфильтрата, длиной не более 1 см. При помощи корнцанга мягкие ткани раздвигают на глубину от 1 до 2 см. После того, как абсцесс будет вскрыт, назначают лечение, такое же как при фолликулярной и лакунарной ангине.
В случае если человек перенес паратонзиллярный абсцесс, то это является показанием к операции по полному удалению небных миндалин (двусторонней тонзилэктомии).
Запишитесь на приём прямо сейчас!
Позвоните нам по телефону или воспользуйтесь формой обратной связи
Записаться
Хирургическое лечение этого заболевания дополняется медикаментозной терапией, которая включает в себя все компоненты, используемые при лечении паратонзиллита.
В случае если паратонзиллярные абсцессы часто рецидивируют или длительно не разрешается (не проходит) паратонзиллит, то выполняют абсцесстонзилэктомию (полное удаление небных миндалин).
Показания для проведения вскрытия абсцесса
Возможность развития такого рода осложнений можно предполагать при наличии следующих симптомов:
- ангины, продолжительность которой превышает 5-6 дней: за это время может сформироваться абсцесс;
- сильных выраженных болей в горле, которые ощущаются при глотании или движениях головы;
- повышения температуры более 39 градусов;
- значительного увеличения одной или двух миндалин;
- признаков интоксикации и лихорадки (слабости, недомогания, болей в мышцах, апатии и сонливости);
- увеличения лимфатических узлов;
- учащённого сердцебиения и дыхания.
Развитие абсцесса, которому сопутствуют такие симптомы, является прямым показанием к вскрытию гнойника.
Обычно операция проводится на 4-5 день от начала воспалительного процесса – к этому моменту абсцесс уже полностью сформирован. Чтобы проверить готовность полости к удалению, доктор может назначить диагностическую пункцию – прокол полости толстой иглой в месте, которое больше всего выпирает над миндалиной. Ход процедуры, чаще всего, контролируется эндоскопическим или УЗ-наблюдением. Если в полости шприца, которым проводится пункция, обнаруживается гной, значит, абсцесс сформировался и готов к удалению.
Вскрытие производится в амбулаторных условиях, то есть для его проведения больному не нужно ложиться в ЛОР-отделение медицинского учреждения.
Результаты
Разработан способ усовершенствования методики чрескожного дренирования стилет-катетером под УЗ-наведением путем инфильтрации межпетельной клетчатки (брыжейка кишки, сальник) раствором анестетика. Инъекция жидкости в прилежащую клетчатку позволяет увеличить пространство для акустического доступа, сместив стенку кишки, и наметить траекторию дренирования, минуя крупные сосуды и стенку кишки и тем самым избегая их повреждения.
Дренирование выполнено 103 больным. Длительность манипуляции составила 20±8,2 мин. У 97 из 103 больных потребовалось одно вмешательство для адекватного дренирования полости. В 6 наблюдениях выполнено дополнительное дренирование на 3—11-е сутки в связи с недостаточной эффективностью первичного дренирования. У 3 пациентов повторное дренирование выполнено на 60-е сутки после операции из-за несостоятельности кишечного анастомоза, не- закрытия внутреннего свища. Излечение наступило у 101 (98%) больного в течение 10—73 дней. Летальность составила 1,9% (n
=2). Пациентка 53 лет умерла от тромбоэмболии легочной артерии через 2 мес после перенесенного оперативного вмешательства (лапароскопическая гастрэктомия по поводу рака желудка, желудочного кровотечения). Вторая пациентка 74 лет умерла в связи со спаечной кишечной непроходимостью, потребовавшей оперативного вмешательства — лапаротомии, адгезиолизиса. Течение послеоперационного периода осложнилось множественными кишечными свищами, абсцессами брюшной полости, нагноением послеоперационной раны. Ни в одном из наблюдений не потребовалось повторное открытое дренирование абсцесса. В 2 случаях формирования наружных кишечных свищей в послеоперационном периоде потребовалась обструктивная резекция кишки.
Проанализированы результаты динамического УЗИ и фистулографии. Выявлено, что в 67% данные совпадают, что позволяет отказаться от фистулографии на заключительном этапе лечения при положительном клиническом течении. Следовательно, для оценки остаточной полости достаточно только УЗИ. Кроме того, дренирование под УЗ-наведением является эффективным самостоятельным способом лечения абсцессов со связью с полыми органами без дополнительных вмешательств по закрытию свища.
Материал и методы
Проанализировано 103 клинических наблюдения в период с 2012 по 2017 г., потребовавших чрескожного дренирования внутрибрюшных абсцессов под УЗ-наведением. Из исследования исключены пациенты, которым выполнено дренирование внутриорганных и забрюшинных абсцессов вследствие панкреонекроза. Средний возраст пациентов составил 54±16 лет (минимальный возраст — 21 год, максимальный — 85 лет), мужчин было 59 (53,7%), женщин — 48 (44,3%).
Распределение абсцессов по этиологии представлено в табл. 1.
Таблица 1. Распределение абсцессов брюшной полости в зависимости от заболевания У 75 (73,5%) пациентов это осложнение хирургических заболеваний органов брюшной полости.
У 28 (26,5%) пациентов отмечены послеоперационные абсцессы (табл. 2).
Таблица 2. Распределение послеоперационных абсцессов по виду операции Распределение по локализации представлено в табл. 3.
Таблица 3. Распределение абсцессов по локализации В среднем объем абсцесса составил 35±7 мл (минимальный объем 5 мл, максимальный — 300 мл). У 3 (3%) пациентов выявлены множественные абсцессы, локализованные более чем в одной анатомической области (подпеченочный, поддиафрагмальный, межпетельный), что требовало одномоментной раздельной установки нескольких дренажей.
УЗИ брюшной полости выполнено всем пациентам. Использовали ультразвуковой аппарат Siemens Acuson Antares с конвексным датчиком 3,5 МГц и линейным датчиком 5—7 МГц. При острых хирургических заболеваниях органов брюшной полости сонографию осуществляли при поступлении пациента в стационар. Показанием к УЗИ при осложненном течении острых хирургических заболеваний органов брюшной полости являлись позднее обращение в стационар (3—7-е сутки от начала заболевания или осложнения), наличие клинических и лабораторных признаков воспалительной реакции — субфебрильная или гектическая температура, локальный болевой синдром, пальпируемый инфильтрат брюшной полости. В послеоперационном периоде динамический УЗ-контроль осуществляли со 2—3-го дня после операции. У больных, перенесших операцию на органах брюшной полости, к признакам воспалительных осложнений следует отнести замедленный прогресс выздоровления, температурную реакцию, не снижающийся лейкоцитоз и сдвиг лейкоцитарной формулы влево.
Аппендикулярный абсцесс в нашем исследовании — наиболее частое осложнение острого хирургического заболевания брюшной полости — 45 (59,85%) наблюдений. Эхографические признаки аппендикулярного абсцесса проявлялись на 3—20-е сутки заболевания (в среднем на 5—9-е сутки) в виде наличия у слепой кишки фрагмента деструктивного червеобразного отростка диаметром более 0,7 см с утолщенной (>0,3 см) стенкой, местами его стенка не дифференцировалась, а при компрессии отросток был ригиден. В 7 случаях отросток не визуализировали. При формировании абсцесса на стадии флегмоны у деструктивно измененного отростка лоцировали гипо- или анэхогенные скопления неправильной формы, без четкой капсулы с неоднородным содержимым, газовыми включениями, взвесью. Трансформацию флегмоны в зрелый абсцесс в виде гипоэхогенного неоднородного скопления с пиогенной капсулой объемом от 5 до 90 мл наблюдали у 12 пациентов в течение 3—6 дней. Стенка слепой кишки во всех наблюдениях была вовлечена в воспалительный инфильтрат, утолщена (>0,4—0,5 см), слои стенки дифференцировались. Абсцесс опеределен у 39 пациентов в правой подвздошной области, у 1 — в подпеченочном постранстве, у 3 — в полости малого таза, у 1 — в забрюшинном пространстве. Окружающая клетчатка в зависимости от локализации отростка (брыжейка отростка, слепой кишки, тонкой кишки, параколитическая, паранефральная клетчатка, большой сальник) была обычно расширена, повышенной эхогенности, неоднородной структуры.
Паравезикальный абсцесс как осложнение острого деструктивного холецистита наблюдали у 2 (2,66%) пациентов на 6—14-е сутки заболевания в виде гипоэхогенного жидкостного неоднородного скопления в клетчатке размером 3—6 мл, соединяющегося с просветом желчного пузыря через дефект стенки. Клетчатку ложа пузыря, гепатодуоденальной связки лоцировали утолщенной, повышенной эхогенности (инфильтрат).
Параколитический абсцесс как осложнение дивертикулярной болезни толстой кишки вследствие перфорации дивертикулов наблюдали у 4 (6,1%) пациентов на 6—14-е сутки заболевания. Его УЗ-признаки: визуализация в большинстве случаев в левой подвздошной области, в гипогастрии фрагмента сигмовидной кишки с неровным наружным контуром из-за дивертикулов, стенка утолщена от 0,5 до 1 см, дифференцировка слоев сохранена, выраженный отек подслизистого, мышечного слоя, прилежащая параколитическая клетчатка утолщена, повышенной эхогенности. При перфорации дивертикула в клетчатке лоцируются мелкие гиперэхогенные включения с эффектом реверберации (газовые пузырьки), нередко встречаются гиперэхогенные включения с акустической тенью (копролиты), при формировании абсцесса — гипоэхогенные, неоднородные скопления округлой формы с пиогенной капсулой объемом 5—100 мл (в большинстве случаев располагались в клетчатке по брыжеечному краю).
Абсцесс при перфорации опухоли толстой кишки наблюдали у 7 (9,33%) пациентов на 2—7-е сутки заболевания. Характерной особенностью эхографической картины в этом случае являются изменение стенки кишки на протяжении 3—10 см в виде значительного (0,9—2,5 см), неравномерного ее утолщения, нечеткость наружных контуров, отсутствие дифференцировки слоев кишечной стенки, усиление и деформация сосудистого рисунка в режиме цветового допплеровского картирования, сужение просвета кишки. Кроме того, установить опухолевое поражение кишки помогает визуализация увеличенных (>1,5 см) регионарных лимфатических узлов, пониженной эхогенности, округлой формы с нарушенной кортико-медуллярной дифференцировкой, а также отдаленных метастазов.
Особенностью абсцесса при перфорации толстой кишки на фоне опухоли является его большой (200—300 мл) объем, что указывало на связь полости с просветом кишки, т. е. на наличие внутреннего кишечного свища. Дифференциальную диагностику осложненной формы дивертикулярной болезни помогает провести отсутствие явной положительной динамики со стороны кишечной стенки в течение недели после дренирования абсцесса на фоне проводимой антибактериальной терапии, что характерно для дивертикулярной болезни.
Сонографические признаки абсцесса при перфорации язвы желудка (n
=3) или двенадцатиперстной кишки (
n
=1) выявлены у 4 (6,1%) больных на 8—21-й день от начала заболевания. У них при поступлении в стационар наблюдали клинико-инструментальную картину прикрытой перфорации язвы — выраженный локальный болевой синдром. Но при пальпации живот оставался мягким, при рентгенологическом обзорном исследовании органов брюшной полости выявлен свободный газ. При динамическом УЗИ установлено отсутствие нарастания свободной жидкости в брюшной полости и обнаружен абсцесс с нечетко выраженной капсулой, окруженный инфильтратом с газом и взвесью в центре, объемом 10—150 мл, локализованный в подпеченочном пространстве, сальниковой сумке, поддиафрагмальном пространстве с вовлечением стенок двенадцатиперстной кишки или желудка. Фрагмент стенки кишки (желудка), прилегающей к абсцессу, утолщен до 0,5—0,7 см, пониженной эхогенности, слои стенки дифференцируются, клетчатка вдоль сосудов, ткани малого, большого сальника, паравезикальная клетчатка (в зависимости от локализации перфорации) расширены, повышенной эхогенности. Инфильтрат ограничен сальником, желчным пузырем, поджелудочной железой. Пациентам с клинико-инструментальной картиной прикрытой перфорации оперативное вмешательство не производили, им установлен назогастральный зонд с постоянной аспирацией содержимого.
Абсцесс в результате перфорации тонкой кишки инородным телом (со слов пациента, кость животного) наблюдали у 1 (1,5%) пациента на 6-й день заболевания. При этом отмечены неспецифические эхографические признаки воспалительных изменений стенок фрагмента кишки, абсцесс в виде неоднородного скопления с газом, взвесью объемом 15 мл без четкой капсулы лоцировали в инфильтрированной брыжейке тонкой кишки, инородное тело четко не визуализировалось.
Развитие клинических проявлений формирования абсцессов как осложнений хирургического вмешательства в брюшной полости зачастую происходило медленно на фоне антибактериальной, обезболивающей, противовоспалительной терапии. Абсцессы брюшной полости диагностированы в среднем на 5,3±2,2-е сутки (минимально на 3-и, максимально на 10-е сутки) после операции. Абсцессы после операций на желудке выявлены у 8 (28,6%) пациентов на 7—20-е сутки в области анастомоза или в месте ушивания стенки полого органа, они располагались в поддиафрагмальном пространстве, слева над селезенкой или в ложе удаленной селезенки, по переднему скату диафрагмы, в сальниковой сумке, в подпеченочном пространстве в виде ограниченного жидкостного скопления неправильной формы со взвесью и газом объемом 10—150 мл.
После видеолапароскопической холецистэктомии абсцесс, диагностированный на 4—6-е сутки после операции, дренирован у 4 (14,2%) пациентов. В ложе удаленного желчного пузыря при УЗИ лоцировали ткани повышенной эхогенности с жидкостным скоплением неправильной формы и с взвесью объемом 6—75 мл.
Срок формирования абсцессов (5—30 мл) после видеолапароскопической аппендэктомии, по нашим данным, 5—20-е сутки после операции, они дренированы у 5 (17,85%) пациентов. Обычно такие абсцессы располагались в области культи отростка межпетельно в малом тазу.
После правосторонней гемиколонэктомии, резекции толстой кишки с наложением анастомоза, концевой колостомии абсцесс (15—50 мл) формировался во всех случаях в области анастомоза или в месте ушивания кишки в прилежащей клетчатке на 8—30-е сутки. У 3 пациентов отмечено повторное образование абсцесса на 60-е сутки после операции при повторной госпитализации вследствие неполного закрытия внутреннего кишечного свища из-за несостоятельности швов анастомоза.
В 2 случаях после операции на 5-е и 10-е сутки по поводу спаечной болезни произвели дренирование межпетельных абсцессов объемом 15—70 мл. У всех пациентов при фистулографии отмечена связь с полым органом, тем не менее внутренний кишечный свищ закрылся самостоятельно после дренирования абсцесса.
Совокупность клинико-инструментальной картины внутрибрюшного абсцесса являлась показанием к дренированию жидкостного скопления (рис. 1, 2).
Рис. 1. Сонограмма полости малого таза (виден абсцесс после перфорации дивертикула сигмовидной кишки).
Рис. 2. Сонограмма абсцесса полости малого таза после дренирования под УЗ-наведением. 1 — полость абсцесса, 2 — дренаж в полости абсцесса, 3 — опухоль сигмовидной кишки. Противопоказанием служило отсутствие безопасного акустического окна.
Малоинвазивное пункционно-дренирующее лечение выполняли в условиях операционного блока. Использовали ультразвуковой аппарат Siemens Acuson Antares с конвексным датчиком 3,5 МГц и линейным датчиком 5—7 МГц. Манипуляцию проводили датчиком с пункционной насадкой и методом свободной руки. Вмешательства выполняли под местной инфильтрационной анестезией 0,5% раствором новокаина или лидокаина в объеме 5—40 мл с предварительной премедикацией наркотическим анальгетиком.
Применяли доступы через брюшную стенку и чресплевральный. В последнем случае гнойных осложнений со стороны плевральной полости не наблюдали. При межпетельном расположении абсцесса траектория для пункции или дренирования проходила, минуя полые органы, крупные сосуды брыжейки и передней брюшной стенки, для этого использовали технологию цветного допплеровского картирования. Для увеличения акустического доступа в межпетельном промежутке прилежащую клетчатку инфильтрировали раствором анестетика (гидравлическая препаровка) у 17 (16,5%) пациентов. При расположении абсцесса в поддиафрагмальном пространстве избегали прохождения пункционной иглы или дренажа через плевральную полость, полые и паренхиматозные органы, крупные сосуды. При дренировании паравезикальных абсцессов пункционный канал проходил через ткань печени (около 2—3 см от края), минуя крупные сосуды и протоки печени, одномоментно дренируя полость абсцесса и полость желчного пузыря.
Для пункции применяли иглы 16—18 G, для длительного дренирования дренажи типа Pig Tail 6—16 F. Во всех случаях использовали методику стилет-катетера и дренажи . Метод одномоментного дренирования стилет-катетером в отличие от метода Сельдингера позволяет проводить манимуляцию в 3—4 раза быстрее, не требует обязательного рентгенологического контроля положения проводника и дополнительного набора инструментов (бужи, струны). Дренаж фиксировали П-образным швом к коже и несколькими узлами на самом дренаже с использованием специального хомута из набора для дренирования.
Пункционным способом проводили лечение при минимальных размерах гнойной полости, с однородным содержимым, несформированной капсулой и сформированном перифокальном инфильтрате. При больших размерах жидкостных скоплений, их неправильной форме, с отрогами, с неоднородным содержимым (секвестры, сгустки, густой гной) дренирующие мероприятия проводили с использованием нескольких дренажей с последующим аспирационно-промывным методом лечения по Н.Н. Каншину. Наибольший объем абсцессов (200—300 мл) выявлен у 7 пациентов со злокачественными опухолями толстой кишки, что указывало на связь полости абсцесса с просветом кишки, т. е. на наличие внутреннего кишечного свища. При сонографии внутренний кишечный свищ лоцировали у 6 пациентов (3 случая при перфорации дивертикулов сигмовидной кишки, 2 — после левосторонней гемиколонэктомии, 1 — после аппендэктомии). Своим вмешательством мы трансформировали внутренний кишечный свищ в наружный трубчатый, который самостоятельно закрылся у 91 (97,8%) пациента.
У ряда пациентов с диагностированными по УЗИ параколитическими абсцессами, такими как осложнение дивертикулярной болезни толстой кишки, оперативное лечение не проводилось. При УЗИ у этой группы пациентов лоцировали спавшуюся полость абсцесса, что позволило предположить самопроизвольное опорожнение содержимого абсцесса в кишку.
После установки дренажа/пункции многократно фракционно промывали полости малыми порциями водным раствором хлоргексидина до получения чистых промывных вод. В последующем пациентам назначали антибактериальную терапию (цефазолин 1 мл 2 раза внутримышечно), которую при необходимости корректировали с учетом данных бактериологического исследования полученного содержимого. В качестве сопутствующей терапии использовали противовоспалительные препараты (диклофенак, кетонал). Полость абсцесса промывали 2—4 раза в сутки растворами антисептиков. Дренаж удаляли, обязательно постепенно раскручивая кончик дренажа, чтобы не повредить стенку прилежащих органов или сосудов.
Для оценки адекватности выполненного дренирования, динамики размера полости, а также для исключения сообщения с брюшной полостью и полыми органами выполняли динамическое УЗИ непосредственно после вмешательства (для исключения осложнений) и на следующий день, затем осуществляли динамический контроль каждые 2—3 дня.
Фистулография полости абсцесса (рис. 3)
Рис. 3. Фистулограмма остаточной полости абсцесса. 1 — остатки контрастного вещества в полости. после дренирования выполнена у 71 (76,3%) пациента, в том числе в первые 3 дня у 30 (42%) человек, в последующие дни в период 4—36 дней у остальных, что связано с нецелесообразностью контрастирования больших полостей сразу после дренирования. У 44 (61,9%) пациентов связи полости абсцесса с полыми органами и свободной брюшной полостью не выявлено, связь со слепой кишкой установлена у 14 (19,7%), с червеобразным отростком — у 6 (8,4%) пациентов, причем одновременно контрастировали отросток и слепую кишку в 2 случаях, связь с подвздошной кишкой выявлена у 8 (11, 4%) пациентов, в том числе у 2 после адгеолизиса. Кроме того, связь полости абсцесса с двенадцатиперстной кишкой нашли у 2 (2,8%) пациентов, с полостью желчного пузыря — у 1 (1,4%), с толстой кишкой — у 3 (4,2%), с просветом прямой кишки — у 2 (2,8%).
При оценке динамики состояния использовали критерии излечения, предложенные А.В. Гаврилиным в 1999 г. и D. Nakamoto в 2004 г., а именно:
— данные УЗИ и рентгеновской фистулографии;
— практически полное исчезновение остаточной полости по данным УЗИ;
—практически полное исчезновение остаточной полости, дефектов наполнения и затеков контрастного вещества по данным рентгеноконтрастной фистулографии и КТ-фистулографии;
— нормализация температуры тела без применения антибиотиков;
— стойкая тенденция к нормализации лабораторных показателей и особенно лейкоцитоза;
— отсутствие гнойного отделяемого при промывании дренажей;
— количество серозного отделяемого по дренажу меньше 20 мл;
— исчезновение сочетанного выпота в брюшной полости.
Вскрытие гематомы (абсцесса) носовой перегородки
Травматические повреждения носа часто сопровождаются наружным кровотечением различной степени интенсивности, которое останавливается самостоятельно, либо при помощи тампонады полости носа. При нормальной свертываемости крови и отсутствии тяжелой сопутствующей патологии кровотечения неопасны и организм очень быстро компенсирует данную кровопотерю.
Очень важно наблюдение за пациентом с травмой носа в первые дни после травмы, так как возможны осложнения в виде гематомы перегородки носа и последующем ее абсцедировании. По статистике в 1 из 100 случаев травм носа мы сталкиваемся с подобными осложнениями. Учитывая обильную кровеносную сеть в полости носа и прямую связь с сосудами головного мозга, становится очевидной высокая важность и своевременность первичной диагностики этих заболеваний носа для профилактики внутричерепных серьезных осложнений.
Причины возникновения гематомы носовой перегородки
Непосредственной причиной возникновения гематомы носовой перегородки является травма носа, вследствие которой происходит повреждение сосудов надхрящницы в хрящевом отделе перегородки носа и кровоизлиянию в полость между слизистой оболочкой полости носа и хрящом. Предрасполагающими факторами являются нарушения свертывающей системы крови, острые респираторные заболевания, при которых гематома перегородки носа может появиться и при самой незначительной травме носа.
Симптомы гематомы перегородки носа
Основной и первый симптом при развитии гематомы перегородки носа – затрудненное носовое дыхание, развивающееся через несколько дней после травмы носа, с одной или обеих сторон, нарастающее по своей интенсивности с каждым днем. Присоединение головной боли, повышения температуры тела, недомогания свидетельствуют о присоединении патогенной микрофлоры и формированию абсцесса носовой перегородки.
Диагностика гематомы перегородки носа
В связи с высоким риском развития внутричерепных осложнений диагностика гематомы перегородки носа и ее возможного абсцедирования должна быть своевременной и основывается на характерных жалобах, анамнезе заболевания и данных риноскопии.
Лечение гематомы носовой перегородки
Лечение гематомы носовой перегородки заключается в опорожнении полости гематомы оставлении дренажа и тампонады полости носа с обеих сторон на 1-2 дня. Общее лечение заключается в назначении антибиотиков, кровоостанавливающих средств при изменениях гемостаза. При абсцессе носовой перегородки производят вскрытие и опорожнение абсцесса, введение дренажа в полость абсцесса и системной антибиотикотерапии.
Как правило, при своевременной диагностике и адекватном лечении, выздоровление наступает через 5-7 дней.
В «ЛОР-Клинике в Чертаново» оказывается полноценная помощь пациентам после травм носа, осложненных развитием гематомы носовой перегородки и ее абсцедированием.
Лечение после процедуры
После проведения операции врач назначает комплекс медикаментов для полного уничтожения бактерий и поддержания организма. Выписка домой происходит уже через пару часов или на следующий день (при тонзиллэктомии). Некоторым пациентам рекомендуют нахождение под наблюдением врача в течение 2-3 дней.
Лечение после вскрытия абсцесса включает:
- внутримышечный или оральный прием антибиотиков в течение 5-10 дней;
- прием обезболивающих и противоаллергических препаратов, поливитаминных комплексов;
- полоскание горла антисептическими составами.
Через несколько дней нужен контрольный визит к ЛОР-врачу для осмотра. При необходимости врач предложит удаление гланд.