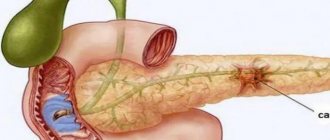
Классификация патологии
Существует несколько систем классификации расслоения аорты. Кардиохирургом Майклом де Бейки предложена система, основанная на анатомической локализации и протяженности поражения сосудистой стенки. Типы расслоения следующие:
• I тип – в патологический процесс вовлекаются восходящая часть, дуга и, часто, нисходящая часть аорты;
• II тип – поражается только восходящая аорта;
• III тип – расслоению подвергается нисходящая часть аорты:
a – процесс ограничивается грудным отделом;
b – процесс затрагивает и брюшной отдел.
Клиническая классификация, получившая название Стенфордской, разделяет два варианта:
• А – поражается восходящий отдел, независимо от локализации первоначального надрыва внутренней сосудистой оболочки;
• В – поражение не затрагивает восходящую часть, то есть, начинается ниже места отхождения левой подключичной артерии.
По течению процесс расслоения аорты делят на острый и хронический. Хроническим принято считать расслоение, с начала которого прошло более 14 дней, или оно обнаружено случайно при отсутствии клинических проявлений.
Осложнения при операции на аорте
Открытые операции имеют больший риск ранних послеоперационных осложнений и смертности, чем эндоваскулярная установка стент-графта в аорту. Летальность после открытых операций составляет около 5%, в то время как после эндопротезирования 0,5%.
Другие возможные осложнения после резекции аневризмы аорты:
- Острая почечная недостаточность
- Инсульт спинного мозга с параличом ног
- Высокая перемежающаяся хромота (боль в ягодицах при ходьбе) хромота
- Ишемия толстой кишки
- Эмболия нижних конечностей с острой ишемией
- Кровотечение из места операции и геморрагический шок
- Нагноение сосудистого протеза
Эти осложнения встречаются достаточно редко. В нашей клинике наблюдались единичные случаи подобных осложнений.
Причины, ведущие к развитию патологии
Расслоение аортальной стенки является мультифакторным заболеванием, но практически всегда происходит на фоне неполноценности ее средней сосудистой оболочки. Дефекты гладкомышечных клеток и эластических волокон могут быть врожденными, а также приобретенными в процессе жизни.
Этиологические факторы развития расслоения таковы:
• гипертоническая болезнь, резкие колебания артериального давления;
• атеросклеротические изменения;
• генетические дефекты строения соединительной ткани (синдромы Марфана, Элерса-Данлоса);
• врожденная патология сердца (двустворчатый аортальный клапан, коарктация аорты);
• васкулиты (системные, инфекционные, токсические);
• повреждения при проведении диагностических или лечебных манипуляций (катетеризация, пластика, протезирование и др.);
• травмы грудной клетки и брюшной полости;
• чрезмерное физическое и нервно-эмоциональное напряжение;
• заключительный триместр беременности.
Данная патология в два раза чаще диагностируется у пациентов мужского пола. С возрастом, особенно после 60-70 лет, риск развития заболевания повышается.
Расслоение аорты у лиц моложе 40 лет обычно обусловлено врожденными процессами. Женщины этого возраста наиболее подвержены недугу на последних месяцах вынашивания плода.
Острое травматическое повреждение аорты: визуализация и тактика ведения
Острое травматическое повреждение аорты (ОТПА) в большинстве случаев является летальным — при таком повреждении около 80 % пострадавших погибает еще до прибытия в стационар. Среди причин смертей в результате ДТП ОТПА по частоте уступает только черепно-мозговой травме. С улучшением вариантов визуализации, развитием хирургических методов лечения и чрескожных вмешательств смертность среди пациентов с ОТПА снизилась с 50 до 5 %. ОТПА встречается примерно в 2 % случаев тупой травмы грудной клетки, приблизительно 70 % из них — у жертв ДТП.
Точный патогенез ОТПА не совсем понятен, но предлагаемые механизмы заключаются в резком повышении внутрисосудистого давления (по типу эффекта гидравлического удара) и разрыве аорты, зажатой между телом позвонка и смещенной к позвоночнику грудиной (рис. 1). .
Рисунок 1 | Механизмы повреждения аорты у пациентов с тупой травмой грудной клетки
Методом выбора для диагностики ОТПА является КТ-ангиография, заменяющая обычную ангиографию. Она позволяет оценить нарушения интимы и косвенные признаки повреждения аорты, такие как периаортальная гематома. В экстренных условиях выполнять КТ с ЭКГ-синхронизацией для визуализации аорты нецелесообразно из-за длительной настройки, необходимости дополнительной подготовки и продолжительной задержки дыхания пациентами. С появлением новых КТ-сканеров с двумя источниками излучения и сверхбыстрой скоростью захвата стало возможно получение практически «неподвижных» изображений без двигательных артефактов, наблюдаемых в сердце и корне аорты при традиционной компьютерной томографии. С этими изображениями радиологическая оценка ОТПА может применяться для определения тактики ведения больного и прогноза.
Далее мы расскажем об актуальных аспектах визуализации, радиологической классификации, диагностике и тактике ведения больных с ОТПА, а также о последних достижениях, которые значительно влияют на точность визуализации у пациентов с этой травмой.
Благодаря своим диагностическим возможностям и доступности метода КТ-ангиография является исследованием выбора для диагностики ОТПА. Наиболее часто повреждаются перешеек аорты, восходящая аорта и аортальное отверстие диафрагмы, поэтому у пациентов с тупой травмой следует проводить КТ-сканирование грудной клетки и верхней части живота в артериальную фазу. Чаще всего КТ-ангиография выполняется как часть общей компьютерной томографии при обследовании пациентов с политравмой.
Появление КТ-сканеров с двумя источниками излучения и сканеров с 64 или более срезами произвело революцию в применении КТ при визуализации сердца и сосудов. Эти сканеры имеют пространственное разрешение в диапазоне от 0,25 до 0,47 мм, причем большинство новых сканеров предоставляют разрешение 0,33 мм. Также у таких сканеров очень быстрое вращение гентри, что приводит к более высокой скорости получения изображений — неподвижные изображения даже восходящей аорты могут быть получены без ЭКГ-синхронизации (рис. 2). Кроме того, артефакты движения от дыхания пациента минимальны, что дает необходимое диагностическое качество изображения.
Рисунок 2
Не синхронизированное с помощью ЭКГ КТ-изображение в аксиальном срезе на уровне синусов Вальсальвы (пространства между полулунными заслонками и стенкой аорты), полученное с помощью нового КТ-сканера с двумя источниками излучения (А) МСКТ на 64-срезовом сканере у того же пациента. Обратите внимание на отсутствие артефактов пульсации (указаны стрелками) в новом сканере с двумя источниками даже без ЭКГ-синхронизации.
Основанием для визуализации грудной клетки и верхней части живота в артериальную фазу является то, что большинство сосудистых повреждений анатомически происходит именно в этих областях, если только у пациента нет дополнительных факторов риска, таких как перелом таза, а значит возможного повреждения сосудов таза. Кроме того, визуализация грудной клетки только в артериальной фазе не препятствует обнаружению каких-либо серьезных патологий легких.
Низкодозированная отсроченная фаза сканирования живота и таза выполняется, если подтверждено повреждение в портальную венозную фазу исследования или есть подозрение на повреждение почек или мочевого пузыря. Начальная бесконтрастная фаза полезна для диагностики интрамуральной гематомы, однако она не выполняется как часть протокола при травме. Протокол КТ грудной клетки и живота для пациентов с тупой травмой приведен в Таблице 1.
Таблица 1 | Протокол КТ-обследования при тупой травме груди, живота и таза
В каждом случае сагиттальные и фронтальные трехмерные модели формируются через изображения в аксиальной плоскости. Другие трехмерные методы, включая проекции максимальной интенсивности (MIP — maximum intensity projection) и объемные изображения (VR — volume rendering), создаются на отдельной рабочей станции. Изогнутые реконструкции аорты создаются только в случаях, когда впоследствии при операции планируется размещение стента. Это трехмерное моделирование данных всегда считывается в сочетании с необработанными данными, что значительно помогает при планировании оперативных вмешательств.
МРТ почти никогда не используется для выявления повреждений у пациентов с тупой травмой. Тем не менее МР-ангиография также используется для диагностики травм: в основном к этому методу прибегают после установки эндоваскулярного стента или если почечная недостаточность исключает проведение КТ-ангиографии. Протокол МРТ для визуализации аорты выделен в Таблице 2. Если КТ- и МР-ангиография не могут быть выполнены из-за почечной недостаточности (СКФ < 30), пациентам лучше всего проводить КТ без контрастирования для интервального изменения диаметра аорты.
Таблица 2 | Протокол МР-ангиографии аорты
Хотя определяющим методом в большинстве случаев является КТ-ангиография, первоначальная оценка травмы часто начинается с рентгенографии органов грудной клетки. Данные, подозрительные для ОТПА при этом методе исследования, включают в себя:
- расширение средостения 8 см на уровне дуги аорты (или верхнее средостение, измеряющее приблизительно как 25 % ширины грудной клетки);
- неровность контура дуги аорты;
- невозможность определения аортопульмонального окна;
- затемнение границы легкого с аортой;
- отклонение трахеи или назогастральной трубки вправо;
- опущение левого главного бронха;
- расширенная левая паратрахеальная полоса.
КТ-ангиография обладает очень высокой чувствительностью (приблизительно 98 %) и почти 100 % специфичностью для диагностики. Признаки ОТПА на КТ-ангиографии могут быть разделены на прямые и косвенные.
Косвенные признаки ОТПА включают средостенную или периаортальную гематому, ретрокруральную гематому или небольшой калибр аорты дистальнее места повреждения. Местоположение средостенной гематомы имеет решающее значение, поскольку если между аортой и гематомой есть четко выраженный слой жировой ткани, следует рассмотреть альтернативные источники кровотечения (из вены, межреберной артерии или кости) (рис. 3). Периаортальная гематома без каких-либо явных признаков повреждения аорты может быть связана со скрытым повреждением интимы. Обычная ангиография может не давать достаточной диагностической визуализации у пациентов со скрытым повреждением интимы, поэтому дополнительно лучше использовать внутрисосудистое ультразвуковое исследование или трансэзофагеальную эхокардиографию. .
Рисунок 3
36-летний мужчина с медиастинальной гематомой и гемотораксом. Сагиттальное (А) и фронтальное изображение (В, С) КТ-ангиографии. Определяется четко выраженный слой жировой ткани между нисходящей аортой и гематомой (указана стрелками). Это предполагает, что аорта не является источником гематомы. Источником продолжающегося кровотечения служит межреберная артерия (стрелка на изображении С)
Прямые признаки ОТПА включают активную контрастную экстравазацию, разрыв (или травматическую псевдоаневризму), интрамуральный тромб, смещение аорты и аномалию контура аорты (включая внезапное изменение калибра, также известное как псевдокоарктация). При высоком риске наличия механизма повреждения, как при автотравме, оценка других возникающих при этом состояний также имеет решающее значение. Обычно ОТПА сопутствуют тяжелые травмы головы, повреждения легких и сердца, разрыв диафрагмы, внутрибрюшное кровотечение, переломы костей таза и длинных трубчатых костей.
Термин «минимальное повреждение аорты» (MПА) представляет собой развивающуюся концепцию, которая была введена в 1999 году в «Системе КТ оценки травм аорты Центра Пресли» (Таблица 3) для описания травм, которые носят незначительный характер.
Malhotra с соавт. первыми описали это повреждение и определили его как небольшой (< 1 см) посттравматический клапан интимы с минимальной периаортальной гематомой или без нее. Большинство из этих травм не могут быть диагностированы другими методами визуализации перед рутинным использованием КТ-ангиографии. Первоначально МПА обнаруживали примерно у 10 % пациентов с ОТПА, но более поздние исследования показали, что оно наблюдается примерно в 25–35 % случаев ОТПА. Увеличение частоты обнаружения МПА может быть связано с рядом факторов, таких как повышение доступности КТ-ангиографии, улучшение технологии КТ и повышение безопасности транспортных средств. Нисходящая аорта является наиболее распространенной локализацией MПА, на втором месте по частоте — перешеек аорты. Хотя общепринятым критерием МПА служит минимальная или отсутствующая средостенная гематома, не существует стандартного признака, который определял бы MПА. Варианты определения минимального или незначительного повреждения аорты в различных исследованиях даны в Таблице 3.
Таблица 3 | Определение группы пациентов с незначительными/минимальными повреждениями аорты в различных исследованиях
Использование различных признаков минимального или незначительного повреждения аорты вводит в заблуждение радиологов и хирургов, поскольку это может повлиять на тактические решения. Среди ключевых признаков в большинстве исследований рассматривался «маленький» интимный лоскут, внутрипросветный тромб или интрамуральная гематома без каких-либо аномалий внешнего контура и с минимальной периаортальной гематомой или без таковой в качестве MПА (рис. 4, 5). В большинстве исследований лоскут интимы считался «малым» при его размерах менее 1 см, так как у нелеченных лоскутов или тромбов интимы размерами более 1 см выявляется более высокая частота прогрессирования заболевания. .
Рисунок 4
Фронтальное (А) и сагиттальное (В) КТ-изображение органов грудной клетки 32-летнего мужчины (прыгнул с крыши здания). Определяется крошечный внутрипросветный тромб (стрелки) в аорте на уровне перешейка, без наружной гематомы или неправильной формы контура, позволяющей думать о повреждении аорты.
Рисунок 5
КТ-изображение органов грудной клетки в аксиальной плоскости 41-летнего мужчины (падение с мотоцикла). Определяетсянебольшой лоскут интимы (указан черной стрелкой) в переднем нисходящем отделе грудной аорты без наружной гематомы или деформации наружного контура, что соответствует минимальному повреждению аорты. Также мы видим перелом левого ребра (указан белой стрелкой) и двустороннее скопление жидкости в плевральной полости.
Как и в случае с диагностикой MПА, также нет единого мнения относительно ведения и наблюдения за этими травмами. В большинстве исследований предполагается, что их можно лечить неинвазивно путем контроля частоты сердечных сокращений и артериального давления, а также антикоагулянтной или антиагрегантной терапии. Выбор подходящей тактики лечения должен проводиться индивидуально с учетом других сопутствующих заболеваний. Предлагается первоначальное использование отрицательных инотропов (чаще всего бета-адреноблокаторов) для достижения целевых значений АД и ЧСС для уменьшения напряжения сдвига сосудов — систолического АД 120 мм рт. ст. или среднего значения АД 80 мм рт. ст., а также частоты сердечных сокращений менее 80 ударов в минуту. Препаратами второго ряда являются блокаторы кальциевых каналов или артериальные вазодилататоры. В рекомендациях Общества сосудистой хирургии (SVS) предлагается «выжидательная» тактика с последовательным наблюдением за состоянием интимы.
В последних руководствах Восточной ассоциации хирургии травм (EAST) отмечается, что нет достаточных доказательств для формулирования рекомендаций по консервативному лечению МПА с необходимостью проведения дополнительных исследований. Даже в рекомендациях SVS отсутствуют какие-либо конкретные рекомендации по «ожидаемому» течению заболевания и протоколу последующих действий. Визуальное наблюдение за MПА обычно варьируется в зависимости от опыта каждого конкретного учреждения и его текущих наблюдений. Хотя в последнем исследовании медицинского центра Harborview Heneghan с соавт. предполагают, что после проведения консервативного лечения МПА нет необходимости в последующей визуализации, в предыдущем исследовании, проведенном тем же институтом в 2014 году, Gunn с соавт. предложили использовать КТ-ангиографию на 3-й день, через 1 неделю и 1 месяц после травмы. В другом исследовании Mosquera с соавт. рекомендовали проводить КТ-ангиографическое исследование через 1, 3, 6 и 12 месяцев после травмы с последующим ежегодным МР-сканированием сердца и сосудов. Хотя нет единого мнения относительно графика профилактических исследований, большинство исследователей предполагает, что наблюдение обычно заканчивается, когда аорта возвращается к нормальному виду. Почти все исследования показывают, что у большинства пациентов заболевание не прогрессирует, а если это и происходит, то в первый месяц после травмы. Такой характер прогрессирования заболевания также подтверждается экспериментальными исследованиями на животных, которые показывают, что максимальная клеточная активность интимы и ее утолщение происходят через 3–4 недели после травмы. Если через это время отмечаются признаки стабилизации или улучшения визуализационной картины травмы, дальнейшее наблюдение может не потребоваться. В конечном счете существует необходимость в проспективном многоцентровом исследовании с использованием «фиксированного» анатомического определения «незначительного» повреждения аорты, при котором группу пациентов с MПА следует последовательно контролировать с заранее определенной частотой проведений КТ и продолжительностью наблюдения.
Существует несколько различных классификационных систем ОТПА (Таблица 4). Одна из наиболее широко используемых оценок ОТПА была предложена Azizzadeh с соавт. (одобрена Обществом сосудистой хирургии) и делит травмы на 4 степени: 1 класс — разрывы интимы (рис. 5), 2 класс — внутригрудная гематома или большой клапан интимы (рис. 6), 3 класс — псевдоаневризма (рис. 7,  и 4 класс — свободный разрыв (рис. 9). Хотя эта система оценок дает прямое описание травмы, она не является руководством по лечению.
и 4 класс — свободный разрыв (рис. 9). Хотя эта система оценок дает прямое описание травмы, она не является руководством по лечению.
Таблица 4 | Классификации ОТПА
Рисунок 6
Мужчина 45 лет с тупой травмой грудной клетки. Аксиальная (А), фронтальная (В) и сагиттальная (С) плоскости изображении КТ-ангиографии. Определяется ОТПА в проксимальной части нисходящей аорты, вызвавшее интрамуральную гематому в области дуги аорты, ветвей дуги аорты (изогнутая стрелка на изображении С) и нисходящей грудной аорты (белые стрелки) с тромбом (полые стрелки на изображениях А и С).
Рисунок 7
Женщина 63 лет, пострадала в результате мототравмы. Аксиальный (А) и сагиттальный (В) срезы КТ органов грудной клетки. Определяется небольшая псевдоаневризма (указана белыми стрелками) в области перешейка аорты с медиастинальной гематомой (указана полой стрелкой).
Рисунок 8
Мужчина, 33 года, ОТПА. Аксиальное (А) и фронтальное (В) изображения КТ-ангиографии с ЭКГ-синхронизацией. Визуализируется псевдоаневризма восходящей грудной аорты из области над синотубулярным соединением. Размеры псевдоаневризмы 1,4 х 0,7 см. Нет признаков активной экстравазации контраста. Открытая стрелка указывает на небольшое кровотечение из жировой клетчатки средостения.
Рисунок 9
70-летняя женщина с травматическим разрывом аорты. Аксиальное (А) и фронтальное (В) КТ-изображения. Есть признаки полного разрыва передней стенки нисходящей грудной аорты (указаны стрелкой), вызывающего экстравазацию контрастного вещества (указано звездочкой). Обратите внимание на медиастинальную гематому и билатеральные скопления жидкости в плевральных полостях.
Существует множество вариантов лечения пациента с ОТПА, такие как традиционное открытое вмешательство, эндоваскулярное стентирование и выбор консервативной тактики для некоторых групп пациентов. Таким образом, оценка КТ-ангиографии ОТПА является в высшей степени ценной для планирования лечения. В дополнение к информации о степени тяжести и типе травм результаты КТ должны включать описание анатомии дуги аорты, признаков доминирования позвоночной артерии, любого существенного ранее существующего атеросклеротического заболевания или стеноза, предшествующие послеоперационные изменения (такие как аортокоронарный шунт), длину повреждения аорты, диаметр аорты выше и ниже травмы, а также близость расположения левой подключичной артерии (в случае травмы перешейка аорты). Эта информация помогает врачу выбирать варианты лечения и вид оперативного вмешательства. Например, хирургическое восстановление аорты обычно включает левую задне-боковую торакотомию, часто требующую подключения пациента к аппарату искусственного кровообращения. Визуализация помогает хирургу определить точную область травмы и предоставляет информацию о других травмах, которые можно лечить, используя тот же доступ.
Несколько дополнительных важных рентгенологических результатов, на которые следует обратить внимание при планировании эндоваскулярного стентирования — наличие какого-либо очагового поражения или тромба, информация о проксимальной и дистальной зоне установки стента (предпочтительная длина — 2 см), наличие кальцификации в зоне установки стента, извитость аорты и диаметр сосудов доступа.
Существуют разные мнения относительно лучшего варианта ведения пациентов с такой травмой. Исследования показали, что рост использования эндоваскулярных стентов среди пациентов, нуждающихся в оперативном лечении, привел к снижению частоты ранних осложнений и уменьшению сроков пребывания в стационаре. В последних руководствах EAST рекомендуется использовать эндоваскулярное протезирование у пациентов, у которых нет противопоказаний к процедуре.
Рекомендации также предполагают, что у гемодинамически стабильных пациентов окончательное лечение ОТПА должно быть отложено до тех пор, пока не будут устранены другие острые опасные для жизни травмы. Раннее лечение ОТПА может быть связано с более высокой частотой возникновения параплегии и почечной недостаточности. Но если пациент гемодинамически нестабилен и на КТ имеются прямые признаки повреждения аорты, необходимо неотложное лечение повреждения аорты. Предлагаемый алгоритм тактики при ОТПА у пациентов с тупой травмой, основанный на рекомендациях EAST Practice Work Group, приведен в таблице 5.
Таблица 5 | Тактика при ОТПА, основанная на рекомендациях Восточной Ассоциации Хирургов-Травматологов (EAST practice work group)
Анализ национальной стационарной выборки Ultee et al. показали, что лечение с помощью эндоваскулярных методов (TEVAR — thoracic endovascular aortic repair) увеличилось с 6,5 % от оперативного объема в 2005 году до 87 % в 2011 году. Общая смертность от травмы аорты также снизилась, что объясняется использованием TEVAR, расширением показаний к применению, улучшением навыков хирургов и расширением технических возможностей. Травма аорты, относительно распространенная в младшей возрастной группе, приводит ко многим уникальным проблемам, связанным с ее лечением и исходами. Средний размер аорты в этой популяции намного меньше, чем при аневризматических заболеваниях, и поэтому ранний опыт применения EVAR (endovascular aortic repair — эндоваскулярные вмешательства на аорте) столкнулся с проблемами при определении размеров трансплантата. Геометрия дуги у более молодых пациентов также является более острой, что связано с плохой совместимостью эндотрансплантата с дугой аорты. Сообщается о 0–18 % степени инфолдинга, миграции, коллапса стента и даже острой окклюзии аорты, требующих повторного вмешательства, при этом большинство осложнений происходит на ранних сроках после операции. Ремоделирование аорты у этих пациентов может также отличаться тем, что аорта, дистальная к левой подключичной артерии, расширяется с большей скоростью, чем проксимальные сегменты. Помимо технических достижений, было предложено использование процедурных модификаций, таких как ограничение избыточного размера трансплантата до 10 % для приспособления к последующему ремоделированию. Влияние этих факторов на отдаленные результаты требует дальнейшего изучения.
Благодаря тому, что гибридные операционные залы и становятся все более распространенными, параллельные улучшения в визуализации, такие как КТ с конусным пучком, термоядерная визуализация и IVUS (intravessel ultrasound — внутрисосудистое ультразвуковое исследование), также облегчают оперативные и интервенционные процедуры, сводя к минимуму облучение и использование контрастных препаратов. Это, а также лучшее качество изображения, имеют решающее значение для технического успеха сложных эндоваскулярных процедур на аорте. Лучшее программное обеспечение для планирования и визуализация слияния полезны для точного развертывания трансплантата, и это может быть дополнительно подтверждено IVUS. Использование IVUS при вмешательствах на аорте улучшает понимание сложной анатомии и, как показано, уменьшает количество используемого контраста и общее время операции.
Пациент с тупой травмой требует междисциплинарного подхода к лечению. Поскольку ОТПА является жизнеугрожающим состоянием, исходы которого почти всегда непредсказуемы, необходимо формирование многопрофильных бригад для быстрой оценки, сортировки и ведения пациентов с подозрением на ОТПА (на основании физикального осмотра, внешних или КТ-признаков, или известного предшествующего анамнеза). В эту группу входят специалисты по визуализации сердечно-сосудистой системы, интервенционной радиологии, кардиохирургии, сосудистой и эндоваскулярной хирургии, кардиологии, анестезиологии-реаниматологии. Команда должна обеспечить экспертную оценку для всех острых ситуаций и обсудить различные варианты подходов к лечению ОТПА, включая использование эндоваскулярных методов, минимально инвазивных и открытых операций. По опыту исследователей, именно междисциплинарный командный подход к ведению пациентов с ОТПА имеет решающее значение для надлежащего лечения.
Источники:
- Fox N, Schwartz D, Salazar JH, et al. Evaluation and manage- ment of blunt traumatic aortic injury: a practice management guideline from the Eastern Association for the Surgery of Trauma. J Trauma Acute Care Surg. 2015;78(1):136–46.
- Neschis DG, Scalea TM, Flinn WR, Griffith BP. Blunt aortic injury. N Engl J Med. 2008;359(16):1708–16.
- Heneghan RE, Aarabi S, Quiroga E, Gunn ML, Singh N, Starnes BW. Call for a new classification system and treatment strategy in blunt aortic injury. J Vasc Surg. 2016;64(1):171–6.
- Ungar TC, Wolf SJ, Haukoos JS, Dyer DS, Moore EE. Derivation of a clinical decision rule to exclude thoracic aortic imaging in patients with blunt chest trauma after motor vehicle collisions. J Trauma. 2006;61(5):1150–5.
- Steenburg SD, Ravenel JG, Ikonomidis JS, Schonholz C, Reeves S. Acute traumatic aortic injury: imaging evaluation and man- agement. Radiology. 2008;248(3):748–62.
- Nagpal P, Khandelwal A, Saboo SS, Bathla G, Steigner ML, Rybicki FJ. Modern imaging techniques: applications in the management of acute aortic pathologies. Postgrad Med J. 1078;2015(91):449–62.
- Seimens Healthineers USA
- Starnes BW, Lundgren RS, Gunn M, et al. A new classification scheme for treating blunt aortic injury. J Vasc Surg. 2012;55(1): 47–54.123
- Lamarche Y, Berger FH, Nicolaou S, et al. Vancouver simplified grading system with computed tomographic angiography for blunt aortic injury. J Thorac Cardiovasc Surg.2012;144(2):347–54.
- Rogalla P, Kloeters C, Hein PA. CT technology overview: 64-slice and beyond. Radiol Clin North Am. 2009;47(1):1–11.
- Voitle E, Hofmann W, Cejna M. Aortic emergencies-diagnosis and treatment: a pictorial review. Insights Imaging. 2015;6(1):17–32.
- Nagpal P, Saboo SS, Khandelwal A, Duran-Mendicuti MA, Abbara S, Steigner ML. Traumatic right atrial pseudoaneurysm. Cardiovasc Diagn Ther. 2015;5(2):141–4.
- Soto JA, Anderson SW. Multidetector CT of blunt abdominal trauma. Radiology. 2012;265(3):678–93.
- Fishman EK, Ney DR, Heath DG, Corl FM, Horton KM, Johnson PT. Volume rendering versus maximum intensity projection in CT angiography: what works best, when, and why. Radiograph- ics. 2006;26(3):905–22.
- Sammer M, Wang E, Blackmore CC, Burdick TR, Hollingworth W. Indeterminate CT angiography in blunt thoracic trauma: is CT angiography enough? AJR Am J Roentgenol. 2007;189(3):603–8.
- Fabian TC, Richardson JD, Croce MA, et al. Prospective study of blunt aortic injury: Multicenter Trial of the American Association for the Surgery of Trauma. J Trauma.1997;42(3):374–80 (dis- cussion 80–83).
- Kram HB, Appel PL, Wohlmuth DA, Shoemaker WC. Diagnosis of traumatic thoracic aortic rupture: a 10-year retrospective analysis. Ann Thorac Surg. 1989;47(2):282–6.
- Gavant ML. Helical CT grading of traumatic aortic injuries. Impact on clinical guidelines for medical and surgical manage- ment. Radiol Clin North Am. 1999;37(3):553–74.
- Malhotra AK, Fabian TC, Croce MA, Weiman DS, Gavant ML, Pate JW. Minimal aortic injury: a lesion associated with advancing diagnostic techniques. J Trauma.2001;51(6):1042–8.
- Forman MJ, Mirvis SE, Hollander DS. Blunt thoracic aortic injuries: CT characterisation and treatment outcomes of minor injury. Eur Radiol. 2013;23(11):2988–95.
- Gunn ML, Lehnert BE, Lungren RS, et al. Minimal aortic injury of the thoracic aorta: imaging appearances and outcome. Emerg Radiol. 2014;21(3):227–33.
- Paul JS, Neideen T, Tutton S, et al. Minimal aortic injury after blunt trauma: selective nonoperative management is safe. J Trauma. 2011;71(6):1519–23.
- de Mestral C, Dueck A, Sharma SS, et al. Evolution of the inci- dence, management, and mortality of blunt thoracic aortic injury: a population-based analysis. J Am Coll Surg. 2013;216(6):1110–5.
- Osgood MJ, Heck JM, Rellinger EJ, et al. Natural history of grade I–II blunt traumatic aortic injury. J Vasc Surg. 2014;59(2):334–41.
- Kidane B, Abramowitz D, Harris JR, DeRose G, Forbes TL. Natural history of minimal aortic injury following blunt thoracic aortic trauma. Can J Surg Journal canadien de chirurgie.2012;55(6):377–81.
- Mosquera VX, Marini M, Lopez-Perez JM, et al. Role of conservative management in traumatic aortic injury: comparison of long-term results of conservative, surgical, and endovascular treatment. J Thorac Cardiovasc Surg. 2011;142(3):614–21.
- Erbel R, Aboyans V, Boileau C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treat- ment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J. 2014;35(41):2873–926.
- Lee WA, Matsumura JS, Mitchell RS, et al. Endovascular repair of traumatic thoracic aortic injury: clinical practice guidelines of the Society for Vascular Surgery. J Vasc Surg. 2011;53(1):187–92.
- Neville RF, Padberg FT Jr, DeFouw D, Hernandez J, Duran W, Hobson RW 2nd. The arterial wall response to intimal injury in an experimental model. Ann Vasc Surg.1992;6(1):50–4.
- Azizzadeh A, Keyhani K, Miller CC 3rd, Coogan SM, Safi HJ, Estrera AL. Blunt traumatic aortic injury: initial experience with endovascular repair. J Vasc Surg. 2009;49(6):1403–8.
- Forcillo J, Philie M, Ojanguren A, et al. Outcomes of traumatic aortic injury in a primary open surgical approach paradigm. Trauma Mon. 2015;20(2):e18198.
- Fanelli F, Dake MD. Standard of practice for the endovascular treatment of thoracic aortic aneurysms and type B dissections. Cardiovasc Intervent Radiol. 2009;32(5):849–60.
- Ultee KH, Soden PA, Chien V, et al. National trends in utilization and outcome of thoracic endovascular aortic repair for traumatic thoracic aortic injuries. J Vasc Surg.2016;63(5):1232–9.
- Forbes TL, Harris JR, Lawlor DK, Derose G. Aortic dilatation after endovascular repair of blunt traumatic thoracic aortic inju- ries. J Vasc Surg. 2010;52(1):45–8.
- Farber MA, Mendes RR. Endovascular repair of blunt thoracic aortic injury: techniques and tips. J Vasc Surg. 2009;50(3):683–6. 36. Kolbel T, Dias N, Resch T, Holst J, Sonesson B, Malina M. In situ bending of thoracic stent grafts: clinical application of a novel technique to improve conformance to the aortic arch.
- J Vasc Surg. 2009;49(6):1613–6.
- Neschis DG, Moainie S, Flinn WR, Scalea TM, Bartlett ST, Griffith BP. Endograft repair of traumatic aortic injury—a tech- nique in evolution: a single institution’s experience. Ann Surg. 2009;250(3):377–82.
- Stangenberg L, Shuja F, Carelsen B, Elenbaas T, Wyers MC, Schermerhorn ML. A novel tool for three-dimensional roadmap- ping reduces radiation exposure and contrast agent dose in com- plex endovascular interventions. J Vasc Surg. 2015;62(2):448–55.
- Song TK, Donayre CE, Kopchok GE, White RA. Intravascular ultrasound use in the treatment of thoracoabdominal dissections, aneurysms, and transections. Semin Vasc Surg. 2006;19(3):145–9.
- Guo BL, Shi ZY, Guo DQ, et al. Effect of intravascular ultrasound- assisted thoracic endovascular aortic repair for ‘‘complicated’’ type B aortic dissection. Chin Med J (Engl). 2015;128(17):2322–9.
- Dijkstra ML, Eagleton MJ, Greenberg RK, Mastracci T, Her- nandez A. Intraoperative C-arm cone-beam computed tomogra- phy in fenestrated/branched aortic endografting. J Vasc Surg. 2011;53(3):583–90.
- Bashore TM, Bates ER, Berger PB, et al. American College of Cardiology/Society for Cardiac Angiography and Interventions Clinical Expert Consensus Document on cardiac catheterization laboratory standards. A report of the American College of Car- diology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2001;37(8):2170–214.
- Alberta HB, Secor JL, Smits TC, et al. Comparison of thoracic aortic diameter changes after endograft placement in patients with traumatic and aneurysmal disease. J Vasc Surg. 2014;59(5):1241–6.
- Watson J, Slaiby J, Garcia Toca M, Marcaccio EJ Jr, Chong TT. A 14-year experience with blunt thoracic aortic injury. J Vasc Surg. 2013;58(2):380–5.
- Fearn S, Lawrence-Brown MM, Semmens JB, Hartley D. Follow- up after endovascular aortic aneurysm repair: the plain radio- graph has an essential role in surveillance. J Endovasc Ther. 2003;10(5):894–901.
- Riesenman PJ, Brooks JD, Farber MA. Acute blunt traumatic injury to the descending thoracic aorta. J Vasc Surg. 2012;56(5):1274–80. 47. Estrera AL, Miller CC 3rd, Guajardo-Salinas G, et al. Update on blunt thoracic aortic injury: fifteen-year single-institution expe- rience. J Thorac Cardiovasc Surg. 2013;145(3 Suppl):S154–8. 48. Rabin J, DuBose J, Sliker CW, O’Connor JV, Scalea TM, Griffith BP. Parameters for successful nonoperative management of trau- matic aortic injury. J Thorac Cardiovasc Surg. 2014;147(1):143–9.
Клинические проявления
Множество вариантов локализации и протяженности расслоения, возможность окклюзии различных ветвей аорты дают такое многообразие клинических проявлений, что делают достаточно трудной их систематизацию. Наиболее типичные симптомы следующие:
• резкая боль, максимально интенсивная в момент возникновения, чаще – за грудиной, в области сердца, реже – в межлопаточной области, эпигастрии, пояснице;
• двигательное возбуждение;
• одышка;
• бледность или синюшность кожи;
• повышение артериального давления (более высокие значения характерны для низкого расположения расслоения);
• гипотония (часто является результатом тампонады сердца и недостаточности клапанов аорты);
• потеря сознания;
• аритмия;
• асимметрия пульса;
• преходящие нарушения чувствительности, движений в конечностях;
• расстройства зрения, речи.
Прогноз после протезирования аорты
Ближайший послеоперационный период занимает обычно 10-14 дней и зависит от непосредственных результатов операции. В течение 1-3 дней пациенты нуждаются в интенсивной терапии, возможно проведение продлённой искусственной вентиляции лёгких. Поднимать пациентов мы обычно начинаем на 3 сутки после вмешательства. Ходить разрешаем к 5 суткам. Если послеоперационный период протекает гладко, то пациент на 10 сутки выписывается домой.
После выписки необходимо ношение специального бандажа на животе в течение месяца. Через месяц выполняется контрольное ультразвуковое сканирование, для оценки проходимости искусственного протеза и состояния кровотока в ногах.
К обычной повседневной деятельности пациент после открытой операции на аорте возвращается через 3-6 месяцев. Проходимость сосудистых протезов сохраняется на уровне 93% в течение пятилетнего периода после операции. УЗИ контроль позволяет выявлять возможное развитие проблем и своевременно принять меры по их устранению.
Лечение
Расслоение аорты требует быстрейшей доставки пациента в отделение сосудистой хирургии. Оснащенность высокотехнологичным оборудованием и квалификация наших специалистов позволяют оказывать необходимую помощь на должном уровне и в полном соответствии с современными стандартами.
Оперируют в экстренном порядке расслоение, затрагивающее восходящую часть и дугу. Давность заболевания, в данном случае во внимание не берется – риск осложнений слишком высок. Такой же тактики требует и патология нисходящего отдела, когда реальна возможность дальнейшего отслоения сосудистой стенки. Если прямой угрозы жизни нет – операция может быть отсрочена.
Тяжелая сопутствующая патология вынуждает лечить больных консервативно. Следует отметить, что, все же, самый эффективный метод лечения – хирургический. Суть операции – устранение ложного хода и замещение пораженного участка синтетическим протезом, при необходимости, восстановление функции аортального клапана.
Определение
Аневризма грудной аорты — патология, которая развивается в том случае, когда стенки верхней части главной артерии вашего организма (аорты) становятся ослабленными и выпуклыми. Аневризма грудной аорты представляет собой ослабленную и выпуклую область в верхней части аорты, главного кровеносного сосуда, по которому кровь поступает к различным частям вашего тела. Аорта, толщина которой приблизительно равна толщине садового шланга, проходит от сердца через центр груди и живота.
Аневризмы образуются на любом участке вдоль аорты, которая проходит от сердца через живот. Когда они встречаются в верхней части аорты, их называют аневризмами грудной аорты. Чаще всего аневризмы образуются в нижней части аорты, и их называют аневризмами брюшной аорты. В редких случаях аневризма развивается и в верхней, и в нижней частях аорты. Такой тип аневризмы называется торакоабдоминальной аневризмой.
Поскольку по аорте осуществляется доставка крови к различным частям тела, ее разрыв может вызвать опасные для жизни кровотечения. Большинство небольших и медленно растущих аневризм аорты грудного отдела не разрываются, но при больших и быстро растущих аневризмах риск разрыва очень высок. В зависимости от размера и скорости роста аневризмы грудной аорты, лечение может варьировать от выжидательной тактики до проведения экстренной операции. При выявлении аневризмы грудной аорты, врачи будут внимательно следить за ее состоянием, чтобы запланировать хирургическое вмешательство в случае необходимости. Экстренная операция при разрыве аневризмы грудной аорты очень рискованна.
Описание
Аорта — это один из крупных сосудов человека, по которому артериальная кровь, насыщенная кислородом, из левого желудочка поступает ко всем органам и тканям, за исключением легких. Поскольку стенки аорты даже в норме постоянно испытывают кровяное давление со средней величиной в 100 мм рт. ст., при воздействии различных патологических факторов может нарушиться структура сосуда.
Стенка аорты состоит из трех слоев, которые от середины наружу имеют соответствующие названия — интима, медиа и адвентиция.
В самом начале повреждается только интима. Патологическое образование может быть вовсе незначительное, но из-за высокого давления в сосуде интима постепенно разрушается и когда повреждение доходит до медиального слоя, кровь начинает распространяться в среднем слое сосуда, способствуя его расслаиванию. Если на этом этапе не оказывается медицинская помощь, может произойти полный разрыв аорты и мгновенная смерть больного.
Существуют различные типы диссекции аорты, которые между собой отличаются местом расслоения. В Стэнфордском университете в 1970 году предложили разделение ДА на два типа:
- Тип А — расслоение начинается в области восхождения аорты, которое либо остается в этой же области, либо распространяется на дугу и нисходящую часть сосуда.
- Тип В — расслоение располагается только по нисходящей аорте (от подключичной артерии и ниже), но может распространяться и на абдоминальную часть сосуда.
Учет различий между этими двумя типами крайне важен, поскольку это позволяет проводить более эффективное лечение болезни. Тип А требует немедленной операции, чтобы предотвратить смерть от инсульта, сердечного приступа, застойной сердечной недостаточности или кровотечения. Расслоение типа В считается не ургентным состоянием, которое первоначально может лечиться усиленным контролем артериального давления. Дополнительные процедуры, как правило, дополняют защитить больного от осложнений, возникающих в результате разрыва.
Симптомы
Классическая триада признаков дает установить диагноз. При наличии всех трех симптомов отмечают 100% вероятность. Если имеются лишь некоторые проявления, тогда говорят о большей или меньшей вероятности.
- Тяжелое резкое начало разрывающей или рвущей боли в груди, которая может передаваться в спину.
- Дефицит или разность пульса на верхних конечностях, также может определяться разное артериальное давление > 20 мм рт.ст.
- Расширение средостения при рентгенографии груди.
Дополнительно пациенты часто чувствуют, что у них возник как бы сердечный приступ. Также могут отмечаться следующие признаки:
- Невозможность занять удобное положение.
- Чрезвычайно высокое артериальное давление.
- Потеря сознания.
- Сбивчивое дыхание.
- Чувство сильной слабости.
- Ощущение обреченности (крайняя тревога).