Акушерские кровотечения являются ведущей причиной материнской смертности во многих странах и одной из основных причин перинатальной заболеваемости и смертности. Этиологические факторы кровотечений во время беременности зависят от срока гестации.
Наиболее частыми причинами кровотечений в I половине беременности является самопроизвольные аборты, внематочная беременность и даже физиологическая беременность. Кровотечения в III триместре беременности наблюдаются в 3-4% случаев и могут иметь акушерские и неакушерские причины. Акушерские кровотечения могут быть дородовой и послеродовой. Основными причинами акушерских кровотечений в III триместре беременности является предлежание плаценты (20% всех случаев акушерских кровотечений) и преждевременная отслойка нормально расположенной плаценты (30% случаев).
- Предлежание плаценты
- Преждевременная отслойка плаценты
- Геморрагический шок
- Разрыв матки
- Разрыв плодных сосудов
Предлежание плаценты
Терминология. Предлежание плаценты возникает вследствие аномальной имплантации над внутренним зевом шейки матки. Выделяют несколько типов предлежание плаценты:
Полное предлежание плаценты — плацента полностью перекрывает внутренний зев.
Частичное предлежание плаценты — плацента частично перекрывает внутренний зев.
Краевое предлежание плаценты — край плаценты достигает края внутреннего зева.
Низкое прикрепление плаценты (низкая плацентация) — плацента размещается в нижнем маточном сегменте, но не достигает края внутреннего зева.
Кровотечение при предлежании плаценты возникает вследствие частичного отслоения ее небольших участков в течение нормального развития и утончения нижнего сегмента матки в III триместре беременности.
Кровотечение при предлежании плаценты может стать профузным и привести к геморрагическому шоку, материнской и перинатальной заболеваемости и смертности. Перинатальная смертность по этой патологии в 10 раз выше, чем в общей популяции. Значительную долю риска для плода, связанную с предлежанием плаценты, составляет преждевременное родоразрешение (60% случаев перинатальной смертности), а также другие сопутствующие осложнения со стороны плода.
Осложнения со стороны плода при предлежании плаценты
- Преждевременное родоразрешение и его осложнения
- Преждевременный разрыв плодных оболочек при недоношенной беременности
- Задержка внутриутробного развития плода
- Аномалии положения и предлежания плода
- Предлежание сосудов пупочного канатика
- Врожденные аномалии
Предлежание плаценты может быть осложненным патологической инвазией плаценты в стенку матки:
1) приросшая плацента — патологическая инвазия плаценты в поверхностный слой миометрия с полным или частичной отсутствием базальной децидуальной оболочки;
2) врослая плацента — патологическая инвазия плаценты во всю толщу миометрия;
3) пророслая плацента — патологическая инвазия плаценты со сквозным проникновением в миометрий и периметрий, иногда с проникновением в близлежащие структуры (мочевой пузырь и т.д.).
Приросшая плацента ведет к невозможности отделения плаценты от стенки матки после рождения плода, что может привести к массивной кровотечения и шока, следовательно, материнской заболеваемости, инвалидности и смертности. Около 2/3 пациенток с предлежанием плаценты и сопутствующим приращением плаценты требуют гистерэктомии при родах (послеродовая гистерэктомия).
Другие аномалии плаценты, которые могут повлечь дородовые кровотечения, включают более редкие состояния:
Валоподобная плацента — оболочки удваиваются позади ее края, образуя плотное кольцо вокруг периферии плаценты. Нередко ассоциируется с преждевременной отслойкой плаценты.
Плацента в форме покрывала — плодовые сосуды проходят между амнионом и хорионом, на расстоянии от края плаценты, поэтому они являются незащищенными и более чувствительными к компрессии и травмы.
Резервная плацента — дополнительная доля плаценты, которая имплантируется на некотором расстоянии от остальных плаценты. Плодовые сосуды могут проходить между двумя частями плаценты, возможно, над шейкой матки, что делает их незащищенными и увеличивает риск их повреждения.
Предлежание сосудов пупочного канатика — оболочечное прикрепление пупочного канатика, когда сосуды плода проходят над внутренним зевом.
Эпидемиология
Предлежание плаценты встречается в 0,5% беременностей (1 200 родов) и составляет 20% случаев дородовых кровотечений. Предлежание плаценты ассоциируется с приросшей плацентой в 5-15% случаев. Риск приросшей плаценты увеличивается у пациенток с предшествующим кесаревым сечением (25-30%), особенно при повторном предыдущем кесаревом сечении (50-65%).
Патогенез
Аномалии плацентации является следствием явлений, которые мешают нормальной миграции плаценты на протяжении развития нижнего маточного сегмента при прогрессировании беременности.
Факторы, которые способствуют развитию предлежания плаценты
- Предыдущее кесарево сечение
- Предыдущая маточная хирургия (миомэктомия)
- Аномалии развития матки
- Повторные роды
- Многоплодная беременность
- Эритробластоз
- Курение
- Предлежание плаценты в анамнезе
- Возраст матери более 30 лет
Предыдущая аномальная имплантация плаценты и предыдущее кесарево сечение увеличивают риск аномальной плацентации при последующих беременностях. Предыдущая маточная хирургия (миомэктомия), аномалии развития матки, повторные роды, старший возраст матери, курение и предлежание плаценты в анамнезе также являются факторами риска.
С другой стороны, низкое прикрепление плаценты и даже краевое предлежание не является редким при рутинном ультразвуковом обследовании во II триместре беременности. Большинство этих случаев регрессируют спонтанно (феномен «миграции» плаценты в течение III триместра беременности при развитии нижнего маточного сегмента).
Клиника
У беременных с предлежанием плаценты развивается внезапное профузное вагинальное кровотечение. Первый эпизод кровотечения обычно наблюдается после 28 нед гестации. В этот период происходит развертывание и истончение нижнего маточного сегмента, нарушает связь плаценты со стенкой матки и вызывает кровотечение. В некоторых случаях у пациенток может развиваться гематурия или ректальное кровотечение.
Объективное обследование
При подозрении на предлежание плаценты влагалищное исследование противопоказано в связи с опасностью увеличения участка отделения плаценты при пальцевом исследовании и развития катастрофической кровотечения. Большинство таких пациенток имеют предварительные результаты ультразвукового исследования, которое свидетельствует о наличии предлежания плаценты.
При отсутствии ультразвукового оборудования и при подозрении на предлежание плаценты осторожное влагалищное исследование проводят при готовности операционного блока к ургентной операции. Во время вагинального исследования можно выявить мягкую губчатую ткань около или в области внутреннего зева. В связи с увеличением васкуляризации при обследовании шейки матки в зеркалах и пальцевом исследовании можно заметить выраженный варикоз нижнего маточного сегмента или шейки матки.
Диагностика
Диагноз предлежания плаценты должен быть определен при ультразвуковом исследовании (диагностическая точность> 95%). Если диагноз определен до начала III триместра беременности, назначают ультразвуковой мониторинг (серию ультрасонографических исследований) для контроля за миграцией плаценты. У пациенток с подтвержденным диагнозом или подозрением на предлежание плаценты трансвагинальная сонография не должна выполняться.
Если УЗИ проводится при наполненном мочевом пузыре, возможна гипердиагностика предлежания плаценты вследствие компрессии нижнего маточного сегмента.
Лечение
В III триместре беременности пациенткам с предлежанием плаценты назначают строгий постельный режим, запрещают половые отношения и обычно госпитализируют после первого эпизода кровянистых выделений.
Развитие родовой деятельности, гипоксия плода и усиления кровотечения являются показаниями для ургентного кесарева сечения независимо от гестационного возраста плода (по жизненным показаниям со стороны матери). При несильном кровотечении и незрелости плода возможна активно-выжидательная тактика. Около 70% пациенток с предлежанием плаценты имеют повторные эпизоды кровотечения и требуют родоразрешения до 36 нед гестации. Пациенткам, у которых роды могут быть отложены до 36 нед гестации, выполняют амниоцентез для определения зрелости легких плода. При подтверждении достаточной зрелости легких, выполняют кесарево сечение между 36 и 37-й неделями гестации.
Алгоритм действий врача при предлежании плаценты включает следующие мероприятия:
1. Стабилизация жизненных функций пациентки (госпитализация, катетеризация центральной или периферических вен, внутривенная инфузионная терапия для нормализации гемодинамики, фетальный мониторинг). Исследования группы крови, резус-фактора, показателей коагулограммы (протромбиновое время, частичное тромбопластиновое время, фибриноген, продукты деградации фибриногена).
Резус-отрицательным пациенткам выполняют тест Кляйнера — Бетке на наличие плодовых эритроцитов (степень фетоматеринской трансфузии определяет количество необходимых доз антирезусного иммуноглобулина для профилактики аллоиммунизации).
2. Подготовка к массивному кровотечению. Выжидательная тактика при условии стабильного состояния пациентки заключается в госпитализации, строгом постельном режиме. Заготавливают кровезаменители (рефортан и др.), кровь (не менее двух флаконов), плазму, проводят пробы на совместимость.
3. Подготовка к преждевременному родоразрешению. При сроке гестации менее 34 нед для ускорения созревания легких плода назначают дексаметазон или бетаметазон. Для продолжения беременности возможно применение токолиза р-адреномиметиками.
Кровотечения в беременности и родах
Грошев С., Студент 6 курса леч. отд. мед. фака ОшГУ, Кыргызская республика; Исраилова З.А., Ассистент кафедры акушерства и гинекологии
Общие данные.
Акушерские кровотечения всегда были основной причиной материнской летальности, поэтому знание этого осложнения беременности является обязательным для любого человека, имеющего лечебный диплом.
Тяжесть кровопотери зависит от индивидуальной переносимости кровопотери, преморбидного фона, акушерской патологии и метода родоразрешения. Особенности развития кровопотери при различной акушерской патологии различны.
Источником острой массивной кровопотери в акушерской практике могут быть:
- преждевременная отслойка нормально расположенной плаценты;
- предлежание плаценты;
- кровотечения в последовом и раннем послеродовом периоде;
- повреждения мягких тканей родовых путей (разрывы тела и шейки матки, влагалища, половых органов);
- повреждения сосудов параметральной клетчатки с формированием больших гематом.
Особенности состояния системы гемокоагуляции при физиологической беременности.
По данным литературы и наших исследований в III триместре при физиологической беременности отмечается повышение суммарной активности факторов свертывания крови, составляющих внутренний путь активации гемостаза – VIII, IX, X, XI, XII и как проявление этого укорочение хронометрических тестов (АЧТВ, АВР) (таблица).
Уровень фибриногена в конце вышеуказанного триместра увеличивается на 20-30% (в сравнении со средненормативными значениями), а возрастание количества факторов, составляющих внешний путь активации свертывания крови — незначительное, о чем свидетельствуют данные протромбинового комплекса (ПТИ в среднем 100–110%).
Конечный этап свертывания, а именно превращение фибриногена в фибрин, соответствует нормативным показателям у женщин вне беременности. Уровень растворимых фибрин-мономерных комплексов перед родами повышен в среднем в 1,5 раза в сравнении с нормой, а в первые сутки послеродового периода их количество может увеличиваться в среднем на 50% от исходного. Такой уровень РФМК сохраняется в течение 3–4 суток и имеет тенденцию к снижению лишь на 6–7 сутки послеродового периода.
Таблица. Динамика показателей гемостаза при физиологической беременности
| Тесты гемостаза | Этапы исследования | |||
| До родов | 1 сутки | 3 сутки | 5 сутки | |
| Ht | 0,31±0,01 | 0,31±0,01 | 0,31±0,01 | 0,32±0,01 |
| ПТИ, % | 102,0±0,9 | 102,1±0,6 | 101,7±0,6 | 103,0±0,8 |
| ТВ, сек | 14,1±0,2 | 14,3±0,2 | 14,1±0,2 | 14,6±0,2 |
| ТВ, донор, сек | 14,7±0.1 | 15,1±0,1 | 14,9±0,1 | 15,2±0,1 |
| АВСК | 1,99±0,5 | 1,89±0,5 | 2,11±1,3 | 2,38±1,4 |
| АЧТВ, сек | 35,5±0,8 | 33,7±0,8 | 34,5±0,4 | 35,9±0,6 |
| АЧТВ контроль, сек | 38,8±0,3 | 38,9±0,3 | 37,9±0,2 | 38,1±0,4 |
| ОФТ, мг% | 9,1±1,1 | 14,2±1,2 | 12,8±1,5 | 7,3±0,8 |
| ХЗФ, мин | 11,6±0,9 | 28,2±3,5 | 29,7±3,5 | 17,0±2,4 |
| Фибриноген, г/л | 3,6±0,1 | 3,8±0,2 | 3,9±0,2 | 3,7±0,1 |
| Тромбоциты, тыс. | 233±8,4 | 247±13,1 | 295±12,2 | 283±11,2 |
| АТ III, % | 103,9±3,6 | 96,1±1,9 | 97,1±2,4 | 97,6±2.1 |
| ПДФ, мкг/мл | 6,3±1,2 | 8,8±1,1 | 4,0±0,7 | 3,2±0,5 |
| ПДФ, контроль | 3,3±0,3 | 2,8±0,3 | 3,0±0,3 | 2,8±0,1 |
| ЛИС, сек | 89,0±2,5 | 98,3±3,1 | 96,2±4,2 | 84,7±2,3 |
| ЛИС контроль, сек | 84,2±0,6 | 80,5±1,1 | 85,6±2,8 | 80,8±1,8 |
| ИРП, % | 96,7±2,1 | 83,1±3,4 | 90,9±4,5 | 96,1±3,5 |
| Д-димеры, нг/л | Отр. | Отр. | Отр. | Отр. |
| Агрегация с АДФ, сек | 22,0±1,1 | 20,0±0,3 | 23,0±1,0 | 24,0±1,1 |
| Агрегация с АДФ (контроль), сек | 28,3±0,4 | 27,9±0,3 | 28,4±0,5 | 28,4±0,4 |
Это подтверждает факт повышенной активности свертывающего звена гемостаза и тромбинемии.
В сосудисто–тромбоцитарном звене гемостаза отмечается повышение агрегационной способности тромбоцитов на 20 – 30%, при нормальном их количестве.
Из–за высокой скорости обмена фибриногена в организме беременных, может наблюдаться небольшое увеличение ранних ПДФ по данным клампинг-теста, при отсутствии Д–димеров (поздних продуктов деградации фибрина) на фоне нормальной концентрации плазминогена. Данные изменения расцениваются как умеренная активация фибринолиза.
Уровень АТ-III в родовом и послеродовом периодах остается в пределах нормативных значений.
Несмотря на повышенную активность основных прокоагулянтов при физиологической беременности патологической активации гемостаза не выявляется – это достигается в результате сбалансированной и компенсированной работой всех звеньев системы гемостаза, что является уникальной особенностью во время беременности.
Таким образом, физиологические изменения в системе гемостаза относятся к проявлениям общей циркуляторной адаптации организма беременной женщины к гестационному процессу, что и способствует эффективному гемостазу, однако данные физиологические изменения создают фон для срыва адаптационных механизмов при любой критической ситуации во время беременности и родов.
Методы определения объема кровопотери.
Для определения величины кровопотери существует несколько способов, достоверность которых неодинакова. Существуют прямые и непрямые методы оценки кровопотери.
Прямые методы оценки кровопотери:
- колориметрический
- гравиметрический
- электрометрический
- гравитационный — по изменениям показателей гемоглобина и гематокрита.
Непрямые методы:
- оценка клинических признаков;
- измеренение кровопотери с помощью мерных цилиндров или визуальным методом;
- определение OЦК, почасового диуреза, состава и плотности мочи.
Первый, наиболее распространенный способ – собирание крови, выделяющейся из половых путей, в тазик и последующее измерение ее объема в градуированной колбе емкостью 1-2 л. К количеству крови, излившейся таким образом, прибавляют массу крови, излившейся на подкладные пеленки; ее определяют по разнице в массе сухой подкладной пеленки и смоченной кровью.
Второй способ – определение процента потерянной крови от массы тела роженицы перед родами. Кровопотеря до 0,5% обычно является физиологической; кровопотеря 0,7-0,8% и больше, как правило, патологическая и может обусловить возникновение симптомов декомпенсированной кровопотери.
Более точно оценить величину кровопотери можно спектрофотометрическим методом, но основной его недостаток – продолжительность выполнения (свыше 20 мин), между тем быстрота определения объема потерянной крови имеет жизненное значение при массивной, острой кровопотере.
Для определения величины кровопотери можно использовать совокупность клинических признаков и гемодинамических показателей. По ним выделяют три степени тяжести:
- I степень тяжести – слабость, тахикардия – 100 ударов в минуту, кожные покровы бледные, но теплые систолическое артериальное давление (САД) не ниже 100 мм.рт.ст., гемоглобин 90г/л и более;
- II степень тяжести – выраженная слабость, тахикардия – более 100 ударов в минуту, САД 80-100 мм.рт.ст., кожные покровы влажные, ЦВД ниже 60 мм.вод.ст., гемоглобин 80г/л и менее;
- III степень – геморрагический шок – резкая слабость, кожа бледная, холодная, пульс нитевидный, САД 80 мм.рт.ст. Анурия.
I степень – кровопотеря 15-20%, II степень – до 29%, III степень – 30 и более процентов.
Ориентировочно объем кровопотери может быть установлен путем вычисления шокового индекса Альговера (отношение частоты пульса к уровню систолического артериального давления).
Шоковый индекс Объем кровопотери (% ОЦК)
- 0,8 и менее 10
- 0,9-1,2 20
- 1,3-1,4 30
- 1,5 и более 40
Кровотечения в первом триместре беременности.
Основные причины кровотечений в первом триместре беременности:
- Самопроизвольные выкидыши
- Кровотечения, связанные с пузырным заносом
- Шеечная беременность
- Патология шейки матки – полипы цервикального канала, децидуальные полипы, рак шейки матки – встречают реже, чем первые 3 группы.
Самопроизвольные выкидыши.
Клиническая диагностика основана на:
- определении сомнительных, вероятных признаков беременности: задержка менструаций, появление прихотей, нагрубание молочных желез, появление молозива. Данные влагалищного исследования: увеличение размеров матки, размягчение в области перешейка, что делает матку более подвижной в области перешейка, ассиметричность матки (выбухание одного из углов матки);
- при непроизвольном прерывании беременности двумя ведущими симптомами является: болевой синдром и симптомы кровопотери. Самопроизвольные выкидыши характеризуются своим поэтапным течением: угрожающий выкидыш, начавшийся выкидыш, аборт в ходу, неполный и полный самопроизвольный выкидыш. Дифференциальная диагностика между этими состояниями основывается на выраженности симптомов кровотечения и структурных изменениях шейки матки.
Угрожающий выкидыш: кровянистые выделения могут быть очень скудными, боли или отсутствуют или носят ноющий, тупой характер внизу живота. При влагалищном исследовании мы находим неизмененную шейку матки.
Начавшийся выкидыш: кровотечение может быть медленным, боли носят схваткообразный характер, шейка матки может быть слегка укорочена, наружный зев может быть приоткрыт. Угрожающий и начавшийся выкидыш протекают на фоне удовлетворительного состояния женщины. Неотложных мероприятий по остановке кровотечения не требуется. На госпитальном этапе женщине необходимо создать покой, применить седативные препараты, внутримышечно можно ввести спазмолитики (ганглерон, но-шпа, баралгин, сернокислая магнезия 10 мл 25% раствора, прогестерон). В стационаре решается вопрос о сохранении беременности, если женщина не заинтересована (необходимо произвести выскабливание полости матки).
Аборт в ходу: кровотечение обильное, боли носят схваткообразный характер; общее состояние меняется, и зависит от величины кровопотери. При влагалищном исследовании или осмотре в зеркалах: шейка матки укорочена, цервикальный канал проходим для одного загнутого пальца. Необходима неотложная помощь в виде срочной госпитализации, в стационаре выполняется выскабливание полости матки, с возмещением кровопотери, в зависимости от ее объема и состояния женщины.
При неполном самопроизвольном аборте кровянистые выделения носят темно-красного цвета, со сгустками, могут быть значительны. Все это сопровождается схваткообразными болями внизу живота. При влагалищном исследовании или осмотре в зеркалах: в цервикальном канале определяется плацентарная ткань, части плодного яйца, шейка матки значительно укорочена, цервикальный канал свободно пропускает 1,5 – 2 пальца. Неотложная помощь заключается в выскабливании полости матки, удалении остатков плодного яйца; возмещение кровопотери в зависимости от ее объема и состояния женщины.
При полном самопроизвольном выкидыше кровотечения нет, плодное яйцо полностью выделилось из матки. Неотложной помощи не требуется. Необходимо проверить полость матки путем выскабливания, для того чтобы удостовериться, нет ли там остатков плодного яйца.
Пузырный занос.
Основная характеристика этой патологии заключается в том, что ворсины хориона превращаются в гроздевидные образования. И все ворсины могут превратиться в пузырьки, содержащие большое количество эстрогенов, а может быть частичное превращение. В группу риска по развитию пузырного заноса входят:
- женщины, перенесшие пузырный занос,
- женщины с воспалительными заболеваниями гениталий,
- женщины с нарушениями гормональной функции яичников.
Клиническая диагностика основана на:
- определении беременности по вероятным, сомнительным и др. признакам беременности. В отличие от нормально протекающей беременности симптомы раннего токсикоза выражены значительно сильнее, чаще всего это рвота средней или тяжелой степени;
- при пузырном заносе очень рано появляются симптомы позднего токсикоза: отечный синдром, протеинурия. Гипертензия также появляется, но только позже. Диагноз пузырного заноса ставится на основании несоответствия размеров матки сроку задержки менструации, что можно определить по данным влагалищного исследования и УЗИ. Важнейшим критерием диагностики пузырного заноса является титр хорионического гонадотропина, который по сравнению с нормально протекающей беременностью, увеличивается более чем в тысячу раз.
Кровотечение может быть остановлено только одним путем – выскабливание полости матки. Характерной особенностью этого выскабливания является то, что оно должно проводится обязательно под внутривенным введением утеротоников и необходимо удалить как можно больше измененной ткани абортцангом. Утеротоники вводятся для того, чтобы вызвать сокращение матки, чтобы хирург был лучше ориентирован в полости матки. Необходимо быть осторожным, так как пузырный занос может быть деструирующим, то есть проникающим в мышечную стенку матки, вплоть до серозной оболочки. При перфорации матки при выскабливании необходимо выполнить ампутацию матки.
Шеечная беременность.
Практически никогда не бывает доношенной. Беременность прерывается чаще всего до 12 недель. К группе риска по развитию шеечной беременности относятся:
- женщины с отягощенным акушерским анамнезом,
- перенесшие воспалительные заболевания, заболевания шейки матки, нарушение менструального цикла по типу гипоменструального синдрома.
Имеет значение высокая подвижность оплодотворенного яйца не в теле матки, а в нижнем сегменте или в шеечном канале.
Диагноз может быть поставлен при специальном гинекологическом или акушерском исследовании: при осмотре шейки в зеркалах шейка матки выглядит бочкообразной, со смещенным наружным зевом, с выраженным цианозом, легко кровоточит при исследовании. Тело матки более плотной консистенции, размеры меньше предполагаемого срока беременности. Кровотечение при шеечной беременности всегда очень обильно, потому что нарушается структура сосудистых сплетений матки – сюда подходит нижняя ветвь маточной артерии, пудендальная артерия. Поскольку толщина шейки матки значительно меньше толщины матки в области тела, то нарушается целостность сосудов и кровотечение не удается остановить без оперативного вмешательства. Ошибочно можно начать оказание помощи с выскабливания полости матки, а так как выраженность бочкообразных, цианотичных изменений шейки матки, зависит от срока беременности, то кровотечение усиливается. Как только установлен диагноз шеечной беременности, который может быть подтвержден данными УЗИ – нельзя проводить выскабливание полости матки, а должно быть остановлено это кровотечение путем эсктирпации матки без придатков. Другого варианта остановки кровотечения при шеечной беременности не бывает и быть не должно, так как кровотечение идет из нижних ветвей маточной артерии.
Полипы цервикального канала.
Редко дают значительные кровотечения, чаще это незначительные кровотечения. Децидуальный полип – разрастание децидуальной ткани, и ее избыток спускается в цервикальный канал. Такой полип чаще всего отпадает сам, или его можно удалить осторожно откручивая. Кровоточащий полип должен быть удален, но без выскабливания полости матки, с проведением гемостатической терапии, и сохраняющей беременность терапии.
Рак шейки матки.
Рак шейки матки у беременной женщины встречается крайне редко, так как чаще всего эта патология развивается у женщин старше 40 лет, у женщин с большим количеством родов и абортов в анамнезе, у женщин, часто меняющих половых партнеров. Рак шейки матки, как правило, диагностируется при обязательном осмотре шейки матки в течение беременности 2 раза – при поступлении беременной на учет, при выдаче декретного отпуска. Рак шейки матки выглядит в виде экзофитных (вид цветной капусты) и эндофитных разрастаний (бочкообразная шейка матки). Чаще всего эта женщина имела фоновые заболевания шейки матки. При раке шейки матки в зависимости от срока беременности проводится оперативное родоразрешение с последующей экстирпацией матки – при больших сроках, удаление матки при небольших сроках беременности с согласия женщины. Никаких консервативных методов остановки кровотечения при раке шейки матки не используется!
К акушерским кровотечениям относятся кровотечения, связанные с внематочной беременностью. Если раньше женщина погибала от кровотечения при внематочной беременности, то ее смерть рассматривалась как гинекологическая патология, то теперь она рассматривается как акушерская патология. В результате локализации беременности в истмическом трубном углу матки, в интерстициальном отделе может быть разрыв матки, и давать клинику внематочной беременности.
Кровотечения во второй половине беременности.
Основные причины акушерских кровотечений во второй половине беременности:
- Предлежание плаценты
- Преждевременная отслойка нормально расположенной плаценты (ПОНРП)
- Разрыв матки.
В настоящее время, после появления УЗИ, стали ставить диагноз предлежания плаценты до появления кровотечения, и основную группу материнской летальности составляют женщины с ПОНРП.
Предлежание плаценты и ПОНРП.
Предлежание плаценты составляет 0,4-0,6% от общего числа родов. Различают полное и неполное предлежание плаценты. Группой риска по развитию предлежания плаценты являются женщины с перенесшими воспалительными, дистрофическими заболеваниями, гипоплазией гениталий, с пороками развития матки, при истимикоцервикальной недостаточности.
В норме плацента должна располагаться в области дна или тела матки, по задней стенке, с переходом на боковые стенки. По передней стенке плацента располагается значительно реже, и это охраняется природой, потому что передняя стенка матки подвергается значительно большим изменениям, чем задняя. Кроме того, расположение плаценты по задней стенке предохраняет ее от случайных травм.
При ПОНРП остановка кровотечения производится только путем операции кесарева сечения, независимо от состояния плода + ретроплацентарная гематома не менее 500 мл. легкая степень отслойки практически может не проявлять себя.
Таблица. Тактика ведения беременных и рожениц с предлежанием плаценты
| кровотечение | срок беременности | тактика врача |
| Обильное при полном предлежании плаценты | независимо от срока беременности | кесарево сечение, восполнение кровопотери |
| Небольшое при полном предлежании плаценты | менее 36 недель | наблюдение, токолитики, кортикостероиды. · Магнезия, но-шпа, ганглерон, дибазол, папаверин, бета-адреномиметики — нельзя, так как они, обладают периферическим вазодилатирующим действием, усилят кровотечение. · Борьба с анемией, при гемоглобине 80 г/л и ниже — гемотрансфузия. · Профилактика дистресс-синдрома плода (при кесаревом сечении ребенок умрет не от анемии которой не должно быть, а от болезни гиалиновых мембран). Применяют глюкокортикостероиды — преднизолон, дексаметазон (2-3 мг в сутки, поддерживающая доза 1 мг/сут). |
| Кровотечение при неполном предлежании плаценты | независимо от срока | вскрытие плодного пузыря. Если кровотечение остановилось, то ведут роды через естественные родовые пути; если кровотечение продолжается то, выполняют кесарево сечение. |
Разрыв матки.
Во второй половине беременности к причинам акушерских кровотечений кроме вышеперечисленных причин, может относиться разрыв матки в результате наличия рубца на матке после консервативной миомэктомии, кесарева сечения, или в результате деструирующего пузырного заноса и хорионэпителиомы. Симптоматика: наличие внутреннего или наружного кровотечения.
Если разрыв матки происходит во вторую половину беременности, то очень часто эта ситуация заканчивается летально, так как никто не ждет этого состояния. Симптоматика: боли постоянные или схваткообразные, яркие кровянистые выделения, на фоне которых изменяется общее состояние с характерной клиникой геморрагического шока. Необходима неотложная помощь – лапаротомия, ампутация матки или ушивание разрыва матки при позволяющей сделать это локализации, восполнение кровопотери.
Таблица. Дифференциальная диагностика между предлежанием плаценты, ПОНРП и разрывом матки
| Симптомы | Предлежание плаценты | ПОНРП | Разрыв матки |
| Сущность | Предлежание плаценты – расположение ворсин хориона в нижнем сегменте матки. Полное предлежание – полное прикрывание внутреннего зева, неполное предлежание – неполное прикрывание внутреннего зева (при влагалищном исследовании можно достичь оболочек плодного яйца). | ||
| Группа риска | Женщины с отягощенным акушерскогинекологическим анамнезом (воспалительные заболевания, выскабливания и т.д.). | Женщины с чистым гестозом (возник на соматически здоровом фоне) и сочетанным гестозом (на фоне гипертонической болезни, сахарного диабета и др.). В основе гестоза лежит сосудистая патология. Так как гестоз идет на фоне полиорганной недостаточности, то симптом кровотечения протекает более тяжело | Женщины с наличием отягощенного акушерскогинекологического анамнеза, с рубцами на матке – после оперативных вмешательств на матке, при перерастянутой матке, многоводие, многоплодие |
| Симптом кровотечения | При полном предлежании плаценты всегда наружное, не сопровождается болевым синдромом, алой кровью, степень анемизации соответствует наружной кровопотере; это повторяющееся кровотечение, начинается во второй половине беременности. | Начинается всегда с внутреннего кровотечения, реже сочетается с наружным. В 25% случаев наружного кровотечения вообще нет. Кровотечение темной кровью, со сгустками. Развивается на фоне полиорганной недостаточности. Степень анемизации не соответствует величине наружной кровопотери. Состояние женщины не адекватно объему наружного кровотечения. Кровотечение развивается на фоне хронической стадии синдрома ДВС. При отслойке начинается острая форма ДВС-синдрома. | Кровотечение сочетанное – наружное и внутреннее, алой кровью, сопровождающееся развитием геморрагического и травматического шока. |
| Другие симптомы | Прирост ОЦК чаще небольшой, женщины имеют малый вес, страдают гипотонией. Если развивается гестоз, то, как правило, с протеинурией, а не с гипертензией. На фоне предлежания плаценты, при повторяющихся кровотечениях снижается свертывающий потенциал крови. | ||
| Болевой синдром | Отсутствует | Всегда выражен, боли локализуются в области живота (плацента располагается по передней стенке), в поясничной области (если плацента по задней стенке). Болевой синдром больше выражен при отсутствии наружного кровотечения, и меньше при наружном кровотечении. Это объясняется тем, что ретроплацентарная гематома, не находящая выхода наружу дает больший болевой синдром. Болевой синдром больше выражен при распложении гематомы в дне или теле матки, и значительно меньше, если идет отслойка низкорасположенной плаценты, с более легким доступом крови из гематомы. | Может быть выражен незначительно, например, в родах, если начинается разрыв матки по рубцу, то есть при гистопатических состояниях миометрия. |
| Тонус матки | Тонус матки не изменен | Всегда повышен, матка болезненна при пальпации, можно пропальпировать выбухание на передней стенке матки (плацента расположена по передней стенке). | Матка плотная, хорошо сократившаяся, в брюшной полости можно пропальпировать части плода. |
| Состояние плода | Страдает вторично при ухудшении состояния матери, в соответствии с кровопотерей. | Страдает вплоть до гибели при отслойке более чем 1/3 плаценты. Может быть антенатальная гибель плода. | Плод |
Неотложная помощь при кровотечении включает:
- Остановка кровотечения
- Своевременное восполнение кровопотери
Лечение осложняется тем, что при ПОНРП на фоне гестоза имеется хронический ДВС-синдром, при предлежании плаценты может быть приращение плаценты, учитывая небольшую толщину мышечного слоя в нижнем сегменте и дистрофические изменения, которые там развиваются.
Кровотечение в первом периоде родов.
Причинами кровотечения в 1 периоде родов:
- Разрыв шейки матки
- ПОНРП
- Разрыв матки
- Разрыв шейки матки.
Из разрыва шейки матки редко бывают обильные кровотечения, но бывают обильные, если разрыв доходит до свода влагалища или переходит на нижний сегмент матки.
Группа риска:
- женщины, вступающие в роды с незрелыми родовыми путями (ригидная шейка матки),
- женщины с дискоординированной родовой деятельностью,
- женщины с крупным плодом,
- при чрезмерном использовании утеротоников, при недостаточном введении спазмолитиков.
Разрыв шейки матки проявляется клинически яркими алыми кровянистыми выделениями, различной интенсивности. Разрыв чаще начинается после раскрытия маточного зева на 5-6 см, то есть когда начинается продвижение головки по родовому каналу. Разрыв шейки матки бывает у женщин с быстрыми родами. Разрыв шейки матки может быть и не диагностирован, то есть быть бессимптомным, из-за тампонирующего действия продвигающейся головки. Как правило, разрыва шейки матки не бывает при тазовом предлежании и при слабости родовой деятельности. Окончательный диагноз устанавливается при осмотре мягких родовых путей в послеродовом периоде. Особенностью ушивания разрыва матки 3 степени является контроль пальцем наложения шва на верхний угол раны, с тем, чтобы убедиться, что разрыв шейки матки не перешел на область нижнего сегмента.
Профилактика разрыва шейки матки: подготовка шейки матки во время беременности, введение спазмолитиков в первом периоде роде (внутримышечно, внутривенно, самый лучший эффект оказывает длительная перидуральная анестезия.
ПОНРП.
ПОНРП в первом периоде родов проявляется появлением болей в области матки, не совпадающих со схваткой, напряжением матки между схватками, то есть матка не расслабляется или плохо расслабляется, появлением кровянистых сгустков. В родах ПОНРП может развиться в результате чрезмерной родостимуляции, когда не регулируется введение утеротоников, и особенно у рожениц с наличием гестоза, дискоординированной родовой деятельности, гипертонической болезни, то есть когда имеется какая-то предпосылка к патологии сосудов. Как только поставлен диагноз в первый период родов – остановка кровотечения путем операции кесарева сечения. Очень редко лечение проводится консервативно, лишь в том случае если нет симптомов нарастания гипоксии плода, у повторнородящих женщин при полном раскрытии маточного зева – у таких рожениц возможно быстрое родоразрешение.
Разрыв матки.
Характеризуется неадекватным поведением женщины на фоне схваток. Врач оценивает схватки как недостаточные по силе, а женщину беспокоят сильные схватки и непроходящая боль. Появляются кровянистые выделения из влагалища. Возможно развитие симптомов внутриутробной гипоксии плода. При появлении симптомов несостоятельности рубца на матке, роды должны быть закончены операцией кесарева сечения.
Кровотечение во втором периоде родов.
Основные причины кровотечения во втором периоде родов:
- Разрыв матки
- ПОНРП
Если имеет место разрыв матки, то развивается очень быстро тяжелое состояние женщины, связанное с травматическим и геморрагическим шоком, наступает интранатальная гибель плода, и тогда диагноз ясен. Но может быть стертая симптоматика.
Диагноз ПОНРП поставить очень сложно, потому что к схваткам присоединяются потуги, тонус матки значительно повышен, и чаще всего диагноз ставится после рождения плода, на основании выделения вслед за плодом темных кровянистых сгустков. Если имеет место разрыв матки во втором периоде и головка находится на тазовом дне, то необходимо наложение акушерских щипцов или извлечение плода за тазовый конец. При ПОНРП — укорочение периода изгнания перинеотомией или наложением акушерских щипцов.
Кровотечение в третьем периоде родов.
Причины кровотечений в третьем периоде родов связаны с нарушением отделения и выделения последа:
- Плотное прикрепление
- Истинное приращение (только при частичном истинном приращении или частичном плотном прикреплении возможно кровотечение)
- Ущемление последа в области внутреннего зева (спазм зева)
- Остатки плацентарной ткани в матки
Кровотечение может быть очень обильным.
Неотложная помощь при кровотечении в последовом периоде заключается в немедленной операции ручного отделения плаценты и выделения последа на фоне внутривенного наркоза и обязательного введения утеротоников, с обязательной оценкой общего состояния роженицы и величины кровопотери с обязательным ее возмещением. Приступать к этой операции необходимо при кровопотере в объеме 250 мл и продолжающемся кровотечении, никогда нельзя ждать объема кровопотери в патологическом количестве (более 400 мл). Каждое ручное вхождение в полость матки равняется само по себе потере ОЦК в 1 л.
Кровотечение в раннем послеродовом периоде.
Основные причины кровотечения в раннем послеродовом периоде совпадают с факторами риска:
- Женщины с отягощенным акушерско-гинекологическим анамнезом
- Беременность, осложненная гестозом
- Роды крупным плодом
- Многоводие
- Многоплодие
Варианты гипотонических кровотечений.
- Кровотечение сразу, обильное. За несколько минут можно потерять 1 л крови.
- После проведения мероприятий по повышению сократительной способности матки: матка сокращается, кровотечение прекращается через несколько минут — небольшая порция крови — матка сокращается и т.д. и так постепенно, небольшими порциями увеличивается кровопотеря и возникает геморрагический шок. При этом варианте снижается бдительность персонала и именно отсутствие внимания приводит чаще к летальному исходу так как нет своевременного возмещения кровопотери.
Основная операция, которая проводится при кровотечении в раннем послеродовом периоде, называется ручное обследование полости матки (РОПМ).
Задачи операции РОПМ:
- установить, не осталось ли в полости матки задержавшихся частей последа, удалить их;
- определить сократительный потенциал матки;
- определить целость стенок матки — нет ли разрыва матки (клинически трудно иногда поставить диагноз);
- установить, нет ли порока развития матки или опухоли матки (фиброматозный узел часто является причиной кровотечения).
Последовательность выполнения операции РОПМ.
- Определить объем кровопотери и общее состояние женщины.
- Обработать руки и наружные гениталии.
- Дать внутривенно наркоз и начать (продолжить) введение утеротоников.
- Ввести руку во влагалище и далее в полость матки.
- Опорожнить полость матки от сгустков крови и задержавшихся частей последа (если есть).
- Определить тонус матки и целость стенок матки.
- Осмотреть мягкие родовые пути и ушить повреждения, если таковые есть.
- Повторно оценить состояние женщины и кровопотерю, возместить кровопотерю.
Последовательность действий при остановке гипотонического кровотечения.
- Оценить общее состояние и объем кровопотери.
- Внутривенный наркоз, начать (продолжить) введение утеротоников.
- Приступить к операции ручного обследования полости матки.
- Удалить сгустки и задержавшиеся части плаценты.
- Определить целость матки и ее тонус.
- Осмотреть мягкие родовые пути и ушить повреждения.
- На фоне продолжающегося внутривенного введения окситоцина одномоментно ввести внутривенно струйно 1 мл метилэргометрина и можно ввести 1 мл окситоцина в шейку матки.
- Введение тампонов с эфиром в задний свод.
- Повторная оценка кровопотери, общего состояния.
- Возмещение кровопотери.
Атонические кровотечения.
Акушеры выделяют еще атонические кровотечения (кровотечение при полном отсутствии сократительной способности — матка Кувелера). Они отличаются от гипотонических кровотечений тем, что матка находится совершенно в отсутствующем тонусе, и не реагирует на введение утеротоников.
Если гипотоническое кровотечение не останавливается при РОПМ то дальнейшая тактика такая:
- наложить шов на заднюю губу шейки матки толстой кетгутовой лигатурой — по Лосицкой. Механизм гемостаза: рефлекторное сокращение матки, так как огромное количество интерорецепторов находится в этой губе;
- этот же механизм при введении тампона с эфиром;
- наложение зажимов на шейку матки. Два окончатых зажима вводится во влагалище, одна раскрытая бранша находится в полости матки, а другая – в боковом своде влагалища. Маточная артерия отходит от подвздошной в области внутреннего зева, делится на нисходящую и восходящую части. Эти зажимы пережимают маточную артерию.
Эти методы иногда позволяют остановить кровотечение, а иногда являются этапами подготовки к операции (так как они уменьшают кровотечение).
Массивной кровопотерей считается кровопотеря в родах 1200-1500 мл. Такая кровопотеря диктует необходимость оперативного лечения — удаление матки.
Приступив к операции удаления матки, можно попробовать еще один из рефлекторных методов остановки кровотечения:
- перевязка сосудов по Цицишвили. Лигируют сосуды проходящие в круглых связках, собственной связке яичника и в маточном отделе трубы, и на маточные артерии. Маточная артерия проходит по ребру матки. Если не помогает, то эти зажимы и сосуды буду подготовлены к операции удаления;
- электростимуляция матки (сейчас от нее отходят). Накладываются электроды на брюшную стенку или прямо на матку и подают разряд;
- иглорефлексотерапия.
Наряду с остановкой кровотечения ведут возмещение кровопотери.
Основные источники данных.
А.П. Колесниченко, Г.В. Грицан. Особенности этиопатогенеза, диагностики и интенсивной терапии ДВС-синдрома при критических состояниях в акушерско-гинекологической клинике. Методические рекомендации. Красноярск – 2001 г.
Преждевременная отслойка плаценты
Преждевременная отслойка плаценты (ПВП) — преждевременное отделение нормально имплантированной плаценты от стенки матки, что вызывает кровотечение между маточной стенкой и плацентой. Около 50% случаев преждевременной отслойки нормально расположенной плаценты возникают до 30 нед гестации, 15% — во время родов и 30% диагностируются только после родов при обследовании поверхности плаценты. Отслоение значительной поверхности плаценты может привести к преждевременным родам, тетании матки, развития диссеминированной внутрисосудистой коагуляции и гиповолемического шока.
Первичная причина отслоения плаценты неизвестна, хотя это состояние ассоциируется с многочисленными факторами риска и провоцирующими факторами. Эти факторы включают гипертензию матери, предыдущее преждевременная отслойка плаценты, употребление матерью кокаина, внешнюю травму, быструю декомпрессию перерастянутой матки.
В начале отслоения плаценты кровь не свертывается, вытекает из участка отслойки плаценты. Растущее количество крови может вызывать дальнейшее отслоение большей части плаценты. В 20% случаев преждевременная отслойка плаценты кровотечение ограничена полостью матки (скрытая, внутренняя). В остальных 80% случаев отслойка плаценты кровь вытекает в шейку матки и возникает открытая, или внешняя, кровотечение. В связи с возможным вытеканием крови при открытом кровотечении менее вероятно наличие большого ретроплацентарной гематомы, которая может привести к гибели плода.
Кровотечение при отслойке плаценты приводит к анемии матери, более тяжелые случаи могут осложниться гиповолемическим шоком, острой почечной недостаточностью и смертью матери. Гибель плода наступает в 35% случаев при клинически диагностированной преждевременной отслойке плаценты и в 50-60% случаев — при тяжелых формах. Причиной гибели плода является острая гипоксия вследствие уменьшения площади поверхности плаценты и материнской кровотечения.
Эпидемиология
Отслойка плаценты возникает в 0,5-1,5% всех беременностей и составляет 30% случаев кровотечений в III триместре и 15% случаев перинатальной смертности. Наиболее частыми факторами риска преждевременной отслойки плаценты являются гипертензивные заболевания матери (хроническая гипертензия или преэклампсия).
Тяжелые случаи отслоения плаценты, сопровождающихся гибелью плода, в 50% случаев связаны с гипертензией матери: 25% — с хронической гипертензией и 25% — с преэклампсией. Повторный риск ПВП составляет 10%, после двух случаев преждевременной отслойки плаценты в анамнезе этот риск увеличивается до 25% случаев.
Клиника
Классическими симптомами преждевременной отслойки плаценты является влагалищное кровотечение в III триместре беременности, что сопровождается болью в животе или болезненностью матки при пальпации и частыми, сильными сокращениями матки. Но около 30% случаев преждевременной отслойки плаценты (при отслойке небольшой части плаценты) являются бессимптомными или имеют невыраженную клиническую симптоматику и диагностируются только при обследовании плаценты после родов.
Объективное обследование. При объективе обследования пациенток с преждевременной отслойкой плаценты обычно обнаруживают влагалищную кровотечение и твердую, болезненную при пальпации матку. При токометрии проявляют как частые короткие сокращения матки, так и тетанические сокращения.
При мониторинге ЧСС плода проявляют неблагоприятные изменения, которые являются следствием гипоксии. Классическим симптомом отслойки плаценты, проявляющимся во время кесарева сечения, является пенетрация (экстравазация) миометрия кровью, которая может достигать серозного покрова матки — матка Кувелера. Количество крови в матке Кувелера обычно не мешает послеродовым сокращениям матки и не увеличивает риск послеродовых кровотечений. В США при отсутствии других осложнений (например, нарушений коагуляции) матка Кувелера не является показанием к гистерэктомии.
Диагностика
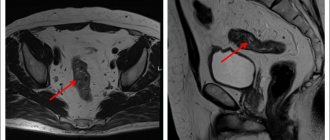
Диагноз преждевременной отслойки плаценты базируется преимущественно на клинических данных. Только 2% случаев ПВП диагностируются при ультразвуковом исследовании (визуализация ретроплацентарной гематомы). Но, учитывая, что ПВП может иметь клиническую симптоматику, сходную с таковой при предлежании плаценты, ультразвуковое исследование выполняется с целью исключения диагноза ПВП. Наличие преждевременной отслойки плаценты подтверждается при осмотре поверхности плаценты после родоразрешения. Присутствие ретроплацентарного сгустка (гематомы) с деструкцией подчиненной участка плаценты подтверждает диагноз.
Лечение
Учитывая возможность быстрого развития катастрофических осложнений при ПВП (массивное кровотечение, диссеминированная внутрисосудистая коагуляция, гипоксия плода), обычно выполняется ургентное родоразрешение путем операции кесарева сечения. Но в некоторых случаях отслойка плаценты является небольшим, не приводит к серьезным осложнениям и не требует немедленного родоразрешения.
Алгоритм действий врача при подозрении на преждевременную отслойку плаценты включает следующие моменты:
1. Стабилизация жизненных функций пациентки. Срочная госпитализация, катетеризация центральной или периферических вен, внедрение мониторинга ЧСС плода. Лабораторное исследование: общий анализ крови — группа крови и резус-фактор, коагулограмма (протромбиновое время, частичное тромбопластиновое время, уровень фибриногена и продуктов деградации фибриногена. Резус-отрицательным пациенткам назначают антирезусный иммуноглобулин для профилактики аллоиммунизации.
2. Подготовка к возможному массивному кровотечению. Осуществление стандартных антишоковых мероприятий (катетеризация вены, инфузия растворов, заготовка крови, плазмы, проведение проб на совместимость. Общая кровопотеря при преждевременной отслойке плаценты обычно является более ожидаемой («скрытая» кровотечение).
3. Подготовка к преждевременному родоразрешению. Для ускорения созревания легких плода назначают дексаметазон (бетаметазон); при стабильном состоянии пациентки и незрелости плода возможно проведение токолиза для продолжения беременности до 34 нед.
4. Родоразрешение в случае усиления кровотечения или гипоксии плода. Срочное родоразрешение путем кесарева сечения выполняют пациенткам с угрозой массивного кровотечения, нестабильным состоянием или при появлении начальных признаков коагулопатии. При незначительной контролируемой кровотечения, отсутствие гипоксии плода, нарушений коагуляции и ожидании скорых родов возможно проведение влагалищного родоразрешения с предыдущей амниотомии.
Полагают, что амниотомия способствует уменьшению экстравазации крови в миометрий и ограничивает попадание тромбопластических веществ в материнский кровоток. При гипоксии плода методом выбора будет кесарево сечение.
Акушерские кровотечения – основная причина материнской смертности в мире: от них ежегодно умирают 127 000 женщин, что составляет 25% всех материнских смертей. В РФ материнская смертность от акушерских кровотечений в структуре ее причин составляет 14-17%, занимая стабильно 2-е место после смертности, связанной с абортом. По отношению к общему числу родов частота акушерских кровотечений колеблется от 2,7 до 8%, при этом 2-4% связаны с гипотонией матки. В среднем в России умирает 1 женщина в сутки от причин, связанных с беременностью и родами, причем каждая седьмая из них – от кровотечения. Применение баллонной тампонады Жуковского возможно не только при уже начавшемся кровотечении, но и как превентивная мера.
Послеродовое кровотечение (ПРК) считается наиболее опасным послеродовым осложнением для матери. Хорошо известно, что в случае неоказания надлежащей медицинской помощи ПРК характеризуется наименьшим количеством времени до наступления смерти среди всех неотложных акушерских состояний – всего 2 часа; это означает, что несвоевременная идентификация заболевания и отсутствие надлежащего лечения ПРК являются решающими факторами, которые могут привести к неблагоприятному исходу.
ПРК является не самостоятельным диагнозом, а лишь симптомом множества нарушений послеродового гемостаза, когда при наблюдении влагалищного кровотечения акушеры не могут сразу определить причину возникновения осложнения. Как только лечащий врач распознает данное острое и неопределенное состояние, требующее принятия неотложных мер, единственным безошибочным, испытанным на практике действием будет агрессивное и безотлагательное выполнение последовательности процедур, направленных на лечение ПРК.
Выбор наилучших и наиболее эффективных инструментов и техник лечения, несомненно, имеет первостепенное значение. Очередность мероприятий при маточном кровотечении в раннем послеродовом периоде
. Обзор стандартов лечения послеродового кровотечения Материалы подготовлены Жуковским Я. Г.
Основные причины
Кровотечение, возникшее в первые 2 часа послеродового периода, называется ранним послеродовым кровотечением. Причинами его являются, чаще всего, задержка частей последа в полости матки, гипотония или атония матки, нарушение свертывающей системы крови, разрыв матки. При задержке в полости матки частей последа послеродовая матка имеет большие размеры, из половых путей выделяются кровяные сгустки. Диагностика основывается на тщательном осмотре плаценты и оболочек после рождения последа. При наличии дефекта плаценты или сомнении в ее целости показано ручное обследование послеродовой матки и удаление остатков плаценты. Наиболее частой причиной ранних послеродовых кровотечений является нарушение сократительной способности миометрия — гипотония и атония матки. Гипотония матки — это снижение ее тонуса, недостаточная сократительная способность. Атония матки — это состояние, при котором матка полностью теряет способность к сокращениям и не отвечает на медикаментозные и другие виды стимуляции. Причинами гипо- и атонических кровотечений являются нарушения функционального состояния миометрия к началу родов вследствие гестозов, заболеваний сердечно-сосудистой системы, почек, печени, ЦНС, эндокринопатий, рубцовых изменений миометрия, опухолей матки, перерастяжения матки в связи с многоплодием, многоводием, крупным плодом. Возможно нарушение функционального состояния миометрия при затяжных родах, применении средств, снижающих тонус матки, длительном применении сокращающих средств. Имеют значение также аномалии прикрепления плаценты, задержка в полости матки последа и его частей, преждевременная отслойка нормально расположенной плаценты.
Клиника гипотонических и атонических кровотечений
Клинически выделяют 2 варианта раннего послеродового кровотечения:
- кровотечение сразу принимает массивный, профузный характер. Матка атоничная, дряблая, не отвечает на наружный массаж, ручное обследование полости матки, на введение сокращающих средств. Быстро развивается гиповолемия, геморрагический шок, ДВС-синдром;
- кровотечение волнообразное. Происходит периодическое расслабление матки и выделение крови порциями по 150-300 мл. В ответ на введение сокращающих средств, наружный массаж матки сократительная способность миометрия и тонус временно восстанавливаются, кровотечение прекращается. В связи с дробностью кровопотери некоторый промежуток времени состояние женщины может быть компенсированным.
Если помощь оказывается вовремя и в достаточном объеме, тонус матки восстанавливается и кровотечение прекращается. При неоказании своевременной помощи компенсаторные возможности организма истощаются, кровотечение усиливается, присоединяются нарушения гемостаза, развиваются геморрагический шок, ДВС-синдром.
Лечение гипотонических и атонических кровотечений
Методы борьбы с гипотоническими и атоническими кровотечениями в раннем послеродовом периоде делятся на медикаментозные, механические и оперативные. После опорожнения мочевого пузыря кладут холод на живот, приступают к наружному массажу матки через переднюю брюшную стенку. Одновременно вводят внутривенно 5 ЕД (1мл) окситоцина, 1 мл 0,02 % раствора метилэргометрина в 20 мл 40 % раствора глюкозы. Если это не приводит к стойкому эффекту, срочно приступают к ручному обследованию стенок послеродовой матки под внутривенным наркозом. При этом убеждаются в отсутствии в матке частей последа, исключают нарушение целости матки; оказывают мощное рефлекторное воздействие на сократимость миометрия двуручным массажем. Операция высокоэффективна на ранних стадиях кровотечения. Хороший кровоостанавливающий эффект достигается при введении простагландинов в шейку матки. Следует обратить внимание на таблетированный препарат, содержащий простагландины, — мизопростол. Все мероприятия по остановке кровотечения проводятся параллельно с адекватной инфузионно-трансфузионной терапией. Если эффект от ручного обследования матки отсутствует, это чаще всего свидетельствует о коагулопатическом характере кровотечения. Необходимо помнить, что недопустимо повторно применять манипуляции, оказавшиеся неэффективными при первом их выполнении. Отсутствие эффекта от своевременно проведенной консервативной терапии и продолжающееся кровотечение являются показанием для лапаротомии и применения хирургических методов остановки кровотечения. Нельзя недооценивать эффективность проведения «промежуточных» мероприятий между консервативным и хирургическим этапами, включающих в себя введение внутриматочного баллона или сдавление брюшного отдела аорты. Тампонада полости матки, описанная группой зарубежных авторов, позволяет в ряде случаев избежать оперативного лечения. В нашей стране получил распространение метод баллонной тампонады матки с помощью внутриматочного катетера «Оптимисс». По данным В.Е. Радзинского с соав. (2008), при массивном акушерском кровотечении тампонада внутриматочным баллоном как способ его остановки оказывается эффективным в 90% случаев. Поэтому применение внутриматочного баллона как метода остановки кровотечения или как временной меры, снижающей скорость кровопотери и дающей время для подготовки оперативного вмешательства, по мнению ведущих отечественных акушеров, следует считать обязательным. Хирургический этап имеет также четкий алгоритм действий. При обнажении матки в мышцу вводят простагландины. Если объем кровопотери составляет более 1500 мл, в первую очередь показана перевязка внутренних подвздошных артерий. При кровопотере 1000-1500 мл или при отсутствии условий для перевязки подвздошных артерий необходимо лигировать сосуды матки с последующим наложением гемостатических компрессионных швов. В литературе описана методика одновременного использования компрессионных гемостатических швов на матку и внутриматочного гемостатического баллона. При перерастяжении нижнего сегмента накладывают стягивающие швы. При продолжающемся кровотечении производят экстирпацию матки. Если имеется возможность, то вместо перевязки сосудов и удаления матки производят эмболизацию маточных сосудов
Поздние послеродовые кровотечения
Поздние послеродовые кровотечения возникают спустя 2 ч и более после окончания родов. Причинами их могут быть гипотония матки, задержка частей последа в полости матки, нарушения в свертывающей системе крови, травмы родовых путей, заболевания системы крови. Гипотонические кровотечения возникают в первые сутки после родов. Патогенез, клиника аналогичны таковым при ранних послеродовых гипотонических кровотечениях. При задержке части последа в полости матки размеры матки увеличены, консистенция ее мягкая, цервикальный канал проходим для 1-2 пальцев. Проводят ручное обследование полости матки и удаление частей последа, проводят кровоостанавливающую, антибактериальную терапию, назначают сокращающие матку средства. Кровотечение в позднем послеродовом периоде может быть обусловлено травмами родовых путей при нарушении техники наложении швов. При этом образуются гематомы влагалища или промежности. В этом случае необходимо снять все ранее наложенные швы, лигировать кровоточащий сосуд, соединить края раны. Эти манипуляции проводят под общим обезболиванием.
Геморрагический шок
Тяжелым материнским осложнением массивного кровотечения является геморрагический (гиповолемический) шок. При кровопотере более 25% объема циркулирующей крови (ОЦК), или более 1500 мл, развивается клиническая картина геморрагического шока. В 10% случаев ПВП, которые закончились смертью плода, то есть при отслойке > 2/3 площади плаценты, возможно развитие диссеминированной внутрисосудистой коагуляции, или синдрома диссеминированного внутрисосудистого свертывания крови (ДВС-синдрома).
Этот синдром развивается вследствие попадания массивных доз тканевого тромбопластина (с мест повреждения плаценты) в материнскую сосудистую систему, способствует активации коагуляционного каскада, в первую очередь, в микрососудистой русле. Это приводит к развитию ишемических некрозов паренхиматозных органов — почек, печени, надпочечников, гипофиза.
Ишемический некроз почек может развиваться вследствие острого тубулярного некроза или двустороннего кортикального некроза, манифестирует олигурией и анурией. Двусторонний кортикальный некроз является фатальным осложнением, что требует проведения гемодиализа и может привести к смерти женщины вследствие уремии через 1-2 нед.
Ведение пациенток с гиповолемическим шоком требует быстрого восстановления утраченного объема крови. Выполняется катетеризация центральной вены, измеряется центральное венозное давление для контроля за восстановлением кровопотери, вводится катетер в мочевой пузырь для контроля за диурезом, внедряется ингаляция кислорода и начинается инфузия крови и кровезаменителей до достижения уровня НЕТ более 30% и диуреза > 0,5 мл / кг / час. Исследования количества тромбоцитов, уровня фибриногена и сывороточного калия выполняют после вливания каждых 4-6 флаконов крови.
Исследование показателей коагуляции крови (тесты на ДВС-синдром) проводятся каждые 4 ч до родоразрешения. Наиболее чувствительным клиническим тестом на развитие ДВС синдрома является уровень продуктов деградации фибриногена (ПДФ), хотя прогностическое значение имеет лишь однократное исследование уровня ПДФ, т.е. по уровню ПДФ нельзя делать вывод об эффективности лечения. Хотя нормальные результаты уровня ПДФ не исключают возможности синдрома ДВС, уровень фибриногена и количество тромбоцитов является важнейшим маркером ДВС-синдрома.
Срочное родоразрешение является основным компонентом лечения синдрома ДВС, и приводит к регрессии его проявлений. Методом выбора является кесарево сечение. При смерти плода и стабильном состоянии пациентки возможно проведение влагалищного родоразрешения. При уменьшении уровня тромбоцитов <50 000 или уровня фибриногена <1 г / л эти компоненты крови должны быть восстановлены. Восстановление уровня фибриногена достигается переливанием свежезамороженной плазмы или криопреципитата. Гепарин обычно не применяется.
Поздние послеродовые кровотечения: актуальность проблемы и пути ее решения
- Белоусова Александра Андреевна
- Арютин Дмитрий Геннадьевич
- Тониян Константин Александрович
- Добровольская Дарья Алексеевна
- Духин Армен Олегович
РезюмеЦели
исследования — улучшить исходы лечения пациенток с установленным диагнозом «позднее послеродовое кровотечение» и разработать алгоритм их ведения.
Материал и методы.
В ходе ретро- и проспективного исследования проведен анализ лечения 75 пациенток с кровотечением позднего послеродового периода, которым в зависимости от тяжести состояния и результатов обследования выполнено консервативное или оперативное лечение.
Результаты
. Комплексная грамотно подобранная консервативная терапия с учетом объема кровопотери и ее восполнением в ряде случаев позволяет избежать хирургического вмешательства. При неэффективности инструментального опорожнения полости матки повторное хирургическое лечение нецелесообразно, методом выбора должна быть эндоваскулярная окклюзия маточных и внутренних подвздошных сосудов, являющаяся высокоэффективным безрецидивным методом остановки кровотечения.
Выводы
. Проблема поздних послеродовых осложнений до настоящего момента остается крайне актуальной. Перспективна разработка современных алгоритмов лечения, основанных на знаниях патогенеза и на использовании новейших фармакологических и хирургических технологий.
Ключевые слова:материнская смертность, осложнения послеродового периода, поздние послеродовые кровотечения, эндометрит, геметометра, коагулопатия, эмболизация маточных артерий
Акуш. и гин.: новости, мнения, обучение. 2021. Т. 6, № 3. С. 119-126. doi: 10.24411/2303-9698-2018-13014
В последние годы в России наблюдается снижение уровня материнской смертности. Во всем мире за последние 25 лет ее уровень снизился на 44%. В России показатель материнской смертности за 2015 г. практически сравнялся с мировым уровнем и составил 10,7 на 100 тыс. живорожденных (по данным Росстата, число случаев материнской смертности за 2015 г. составило 217, по данным Минздрава — 207). Сегодня кровотечения остаются одной из наиболее частых причин гибели рожениц и родильниц [2-4, 6] — стоят на 2-м месте, уступая лишь экстрагенитальной патологии. По данным Всемирной организации здравоохранения (ВОЗ), в 2015 г. в мире от акушерских кровотечений умерло более 30 тыс. женщин, что, несомненно, является трагедией современного акушерства.
В Российской Федерации в структуре материнской смертности кровотечения также занимают 2-е место после экстрагенитальных заболеваний (по данным Министерства здравоохранения Российской Федерации за 2013 г.) — в 2021 г. составили 14,2% [3, 4]. Одним из факторов снижения этого показателя стало выполнение утвержденного протокола и приказа Минздрава России № 572н от 01.11.2012.
Наряду со снижением смертности возрастает риск увеличения числа заболеваний послеродового периода; если алгоритм снижения частоты воспалительных осложнений и кровотечений во время родов и раннего послеродового периода хорошо освещен в отечественной и зарубежной научной литературе, то проблема поздних послеродовых осложнений остается малоизученной и по-прежнему дис-кутабельной [1, 9, 14, 15]. Основными причинами развития кровотечения в позднем послеродовом периоде являются задержка частей плаценты в полости матки и гематометра. Оба состояния приводят к нарушению сократительной способности матки с развитием ее субинволюции, воспалительной реакции эндометрия и, как результат, маточного кровотечения на фоне прогрессирующей клинической картины послеродового эндометрита. Такие пациентки требуют экстренной госпитализации в стационар для комплексной терапии с возможным инструментальным опорожнением полости матки и последующей профилактикой перехода воспалительного процесса в хроническую стадию. Ведение таких пациенток значительно осложняется ростом антибиотикорезистентности микроорганизмов, увеличением количества стертых форм заболеваний, неадекватностью проводимой антибактериальной терапии и поздним обращением за медицинской помощью [2, 5, 7, 8].
Ряд авторов рассматривают послеродовые кровотечения как следствие развивающихся при кровопотере коагулопатии, анемии, тромбоцитопении, предрасполагающих факторов развития и прогрессирования данного осложнения и в зависимости от объема потерянной крови предлагают различные алгоритмы ведения таких пациенток [12, 13]. Например, в последнее время все чаще встречаются работы, посвященные малоинвазивным методам лечения послеродовых кровотечений — эндоваскулярной окклюзии маточных артерий — с убедительно высокими положительными результатами эффективности остановки кровотечения без традиционного хирургического вмешательства [16, 17].
Таким образом, интерес к проблеме поздних послеродовых осложнений и ее актуальность связаны не столько с увеличивающимся количеством родов, сколько с тем, что в настоящее время отсутствует единый лечебно-диагностический алгоритм профилактики, выявления и ведения данного контингента больных, систематизированной маршрутизации пациенток с поздними послеродовыми кровотечениями, связывающий в единую сеть родильный дом, амбулаторию и гинекологические отделения многопрофильных больниц. А понятный трепет акушеров-гинекологов перед теми самыми 42 днями повышает и без того значительную долю осложнений и необоснованной акушерской агрессии по отношению к этой группе больных [11].
Цели исследования — улучшить исходы лечения пациенток с установленным диагнозом «позднее послеродовое кровотечение» и разработать алгоритм их ведения.
Материал и методы
Исследование выполнено на базе кафедры акушерства и гинекологии с курсом перинатологии ФГАОУ ВО «Российский университет дружбы народов» и отделения гинекологии и репродуктивной хирургии ГБУЗ «Городская клиническая больница № 29 им. Н.Э. Баумана» Департамента здравоохранения г. Москвы. Нами проведен ретро- и проспективный анализ ведения и лечения 75 пациенток с осложнениями позднего послеродового периода с 2021 по 2021 г.
Результаты
Возраст больных варьировал от 19 до 40 лет, в среднем составлял 28,6±5,06 года.
Среди обследованных было 49 (64,5%) женщин, родивших впервые (1-я группа), и 26 (35,5%) — повторно (2-я группа).
Акушерский анамнез показал, что у 14 (18,6%) пациенток родоразрешение было оперативным, у остальных 82,4% — самопроизвольные роды через естественные родовые пути. Группы были сопоставлены по методу родоразрешения, при этом как в 1-й, так и во 2-й группе доля самопроизвольных родов превалировала над оперативными (рис. 1).
У 1 пациентки из 1-й группы последовый период осложнился плотным прикреплением плаценты, что потребовало ручного отделения плаценты и выделения последа, у 3 возникло кровотечение в раннем послеродовом периоде. Во 2-й группе внутриматочное вмешательство было выполнено у 3 больных, и у 1 пациентки возникло кровотечение в раннем послеродовом периоде.
Таким образом, общее число внутриматочных вмешательств в раннем послеродовом периоде составило 4 (6,5%).
В позднем послеродовом периоде в условиях акушерских стационаров, по данным скринингового ультразвукового исследования (УЗИ) органов малого таза, только у 7 больных непосредственно в роддоме (из них 3 первородящие и 4 повторнородящие) была выявлена субинволюция матки и выполнена вакуум-аспирация содержимого ее полости (после ручного обследования полости матки — 0) с последующим назначением антибактериальной терапии защищенными пенициллинами в дозировке 1000 мг 2 раза в сутки в течение 7 сут.
Большинство пациенток (68%) было выписано на 34-е сутки в удовлетворительном состоянии. Более поздняя выписка (5-7-е сутки — 32% пациенток) была связана с состоянием ребенка.
Через 14±8,9 сут после родов у родильниц появились жалобы на боли в нижних отделах живота (45% больных), усиление кровяных выделений из половых путей (57,6%), повышение температуры тела и иные жалобы (34,3%), в связи с чем пациентки были госпитализированы в стационар (рис. 2).
Всем пациенткам было выполнено стандартное клинико-лабораторное обследование с обязательным анализом крови на содержание С-реактивного белка (СРБ), прокаль-цитонина, развернутой коагулограммы с изучением уровней D-димера и фибриногена, бактериологического и бактериоскопического исследования отделяемого из цервикального канала, полости матки, обследование молочных желез, консультация смежных специалистов, трансвагинальное УЗИ органов малого таза.
По данным анализа на СРБ и прокальцитонин, у 15,7% пациенток уровень СРБ варьировал от 0,3 до 173 мг/л, уровень прокальцитонина у 2 пациенток (2,6%) достигал 2 нг/мл, что значительно превышало норму (до 0,05 нг/мл) (см. таблицу).
По данным бактериологического исследования из мочеполовых путей, в большинстве случаев выделялись условнопатогенные грамположительные (Staphylococcus epider-midis — 12,6%, Enterococcus faecalis
— 15,5%) и грамотрицательные (
Escherichia coli
— 26,9%) микроорганизмы (более 104 КОЕ/мл), в 5% исследований — микст-инфекция, что влияло на выбор антибактериальной терапии. Однако наряду с ними выявлялись
Streptococcus aureus
(4,22%),
Streptococcus agalactiae
(2%) и
Klebsiella pneumonia
(1,4%).
Отягощающие факторы состояния больных: анемия легкой степени у 13% пациенток, средней — у 8%, тяжелой — у 3%, геморрагический шок I степени — у 2% и II степени — у 1%.
Лечение включало комплексную антибактериальную, противовоспалительную, утеротоническую, гемостатическую терапию, физиотерапевтические процедуры, промывание полости матки растворами антисептиков (хлоргексидин, диоксидин), ультразвуковую кавитацию полости матки. Удовлетворительные результаты лечения без оперативного вмешательства были достигнуты у 42 (59,2%) пациенток, из них 26 (35,5%) пациенток из 1-й группы, 16 (23,7%) пациенток из 2-й группы.
При назначении антибактериальной терапии до получения результатов бактериологического исследования предпочтение отдавалось препаратам первой линии (учитывая сохраненную лактацию пациенток): группам защищенных пенициллинов — амоксициллин + клавулановая кислота в дозировке 1000 мг 2 раза в сутки (57 пациенток — 75%) и цефалоспоринам III поколения — цефтриаксон в дозировке 2 г в сутки (19 пациенток — 25%). При неэффективности проводимой антибактериальной терапии (8 пациенток — 11%) назначали антимикробные препараты группы фторхинолонов или проводили комбинированную терапию (у 14%). При отсутствии эффекта от проводимой терапии в течение 72 ч назначали препараты из группы кабрапенемов (менонем) — у 1,3% больных и оксалидинонов (линезолид) — у 2,6% обследованных.
В качестве гемостатической терапии и профилактики кровотечения у 100% пациенток применяли транексамовую кислоту (100%) как препарат первой линии и эптаког альфа (у 6%) как препарат второй линии при развитии массивного коагулопатического кровотечения.
У 26 из 75 пациенток (40,8%) выполняли вакуумаспирацию содержимого полости матки под внутривенным обезболиванием с обязательным ультразвуковым контролем. 6 (5,6%) из них в связи с обильным кровотечением операция была выполнена экстренно в 1-е сутки госпитализации (5 первородящих, 1 повторнородящая), 20 (35,5%) — в отсроченном порядке, на 2-е сутки от момента поступления после предварительный подготовки в виде антибактериальной, противовоспалительной, утеротонической терапии. 5 пациенткам оперативное лечение выполнено в связи с неэффективностью проводимой консервативной терапии (4 первородящие, 1 повторнородящая), что увеличивало длительность пребывания больных в стационаре. Во 2-й группе оперативное вмешательство проведено только пациенткам с самопроизвольными родами.
Сравнительная характеристика групп пациенток, которым выполнялось консервативное и оперативное лечение представлена на рис. 3 и 4.
2 пациенткам в связи с развитием некупируемой кровопотери в объеме >500 мл была выполнена эндоваскулярная окклюзия маточных и внутренних подвздошных артерий -1 из 1-й группы из-за неэффективности инструментального опорожнения полости матки, 1 из 2-й группы при неэффективности консервативной терапии.
По результатам гистологического исследования у 9 (11,8%) пациенток обнаружены остатки плацентарной ткани, у 14 (18,4%) больных выявлены признаки острого эндометрита.
Критерии излеченности
: уменьшение интенсивности кровяных выделения из половых путей, нормализация лабораторных показателей при их первоначальных изменениях, удовлетворительные результаты УЗИ органов малого таза.
Большая часть обследованных была выписана в течение 5 сут от момента госпитализации (61 пациентки — 80,2%), до 10 сут в стационаре провели 15 (19,3%) больных, >10 сут — 1 (1,3%) пациентка. Дополнительные факторы увеличения сроков пребывания — тяжесть заболевания, продолжающееся кровотечение, которое у 7 (10,5%) больных потребовано дополнительного переливания свежезамороженной плазмы и эритроцитной взвеси, назначение препаратов факторов свертывания крови, а у 1 (1,3%) — наблюдение в условиях реанимационного отделения.
Обсуждение
По результатам проведенного анализа качества лечения пациенток с осложнениями позднего послеродового периода были разработаны 2 сценария ведения и лечения данного контингента больных (рис. 5, 6).
При стабильном состоянии пациентки (95,6%) предпочтение отдавалось консервативной терапии (44%) или (в случае УЗ-признаков остатков плацентарной ткани) подготовке к оперативному лечению в отсроченном порядке (9%).
Раннее выявление коагулопатии потребления с последующим стандартным назначением кристаллоидных и коллоидных растворов, восполнением объема циркулирующей крови в зависимости от объема кровопотери (его оценка усложняется отсутствием данных о количестве потерянной крови до поступления в стационар) позволило избежать необоснованного оперативного вмешательства у 50% больных.
По нашим наблюдениям, при неэффективности опорожнения гематометры повторное внутри маточное вмешательство, а также трансвагинальное наложение гемостатических зажимов выполнять нецелесообразно и неэффективно, поэтому следующим этапом лечения должна быть эндоваскулярная окклюзия маточных и внутренних подвздошных артерий или, при отсутствии необходимого оборудования и специалистов, перевязка данных артерий лапаротомическим доступом. В случае выполнения окклюзии или перевязки маточных и внутренних подвздошных артерий кровотечение в 100% случаев прекращалось в течение первого часа от момента выполнения операции, рецидивов кровотечения не отмечено.
Таким образом, по нашему мнению, основные проблемы поздних послеродовых осложнений — отсутствие тщательной оценки и прогнозирования факторов риска развития осложнений уже на этапе послеродового отделения родильного дома с последующим информированием амбулаторного звена о данном факте, персонифицированного назначения полного, а не только на этапе акушерского стационара, курса антибактериальной терапии (при наличии показаний) с обязательным информированием пациентки о причинах и целях назначений. В позднем послеродовом периоде на этапе амбулатории важно ограничить назначение антибактериальной терапии (учитывая возможность высокого риска развития осложнений) и направлять пациенток на консультацию и госпитализацию в стационар.
На этапе стационарного лечения целесообразно дифференцировать подход к тактике ведения и лечения данного контингента больных согласно разработанному алгоритму действий, что не только существенно снижает процент необоснованной хирургической агрессии, но и улучшает клинические результаты лечения, при этом заметно снижаются финансовые потери системы здравоохранения и ускоряется возвращение пациенток к привычному образу жизни.
Методом выбора хирургической остановки кровотечения при развитии воспалительного процесса (независимо от способа родоразрешения) должна быть эндоваскулярная окклюзия маточных и внутренних подвздошных сосудов, которая является не только малоинвазивным, но и высокоэффективным методом остановки кровотечения у послеродовых больных, не требующих проведения анестезиологического пособия.
Учитывая, что большинство массивных кровотечений в позднем послеродовом периоде проходят по коагулопатическому механизму (исключая остатки плацентарной ткани в полости матки), целесообразно раннее начало терапии, направленной на коррекцию системы гемостаза при нестабильной гемодинамической картине компонентами крови, факторами свертывания, что также улучшает исход проводимого лечения.
Другой важной проблемой является отсутствие адекватной системы маршрутизации, несмотря на то что существующая реформа здравоохранения подразумевает объединенную структуру амбулаторного и стационарного уровней оказания помощи больным акушерско-гинекологического профиля, проблема преемственности не решена даже в крупных городах.
Заключение
Проблема поздних послеродовых осложнений до настоящего момента остается крайне актуальной. Перспективны разработка современных алгоритмов лечения, основанных на знаниях патогенеза и на использовании новейших фармакологических и хирургических технологий, выстраивание механизмов преемственности между всеми этапами оказания акушерской и гинекологической помощи родившей женщине.
Литература
1. Пушкарский О.А., Удовика Н.А. Поздние послеродовые кровотечения: возможно ли избежать и как оказывать помощь // Жточий Лжар. 2011. № 6. С. 10-13.
2. Жаркин Н.А. Кровотечения в акушерской практике // Вестник Волгоградского государственного медицинского университета. 2013. № 3 (47). С. 3-8.
3. Фролова О.Г., Шувалов М.П., Гусева Е.В., Рябинкина И.Н. Материнская смертность на современном этапе развития здравоохранения // Акуш. и гин. 2021. № 3 (17). С. 25-32.
4. Гинекология / под ред. В.Е. Радзинского, А.М. Фукса. М. : ГЭОТАР-Медиа, 2014.
5. Абрамченко В.В. Послеродовый эндометрит и субинволюция матки. СПб., 2008.
6. Акушерство : национальное руководство / под ред. Э.К. Айлама-зяна. М. : ГЭОТАР-Медиа, 2009.
7. Беда Ю.В. К вопросу о пуэрперальных осложнениях // Мед. альманах. 2009. № 2 (7). С. 85-87.
8. Коротких И.Н., Ходасевич Э.В., Бригадирова Ю.В., Панова Н.Э. Группы риска и проблемы диагностики осложнений послеродового периода // Системный анализ и управление в биомедицинских системах. 2007. Т. 6, № 3. С. 707-713.
9. Комличенко Э.В., Беликова М.Е., Иванов А.В. О проблемах организации оказания гинекологической помощи на современном этапе // Журн. акуш. и жен. бол. 2010. № 3. С. 83-86.
10. Радзинский В.Е., Акушерская агрессия. М. : StatusPraesens, 2017.
11. Rath W.H. Postpartum hemorrhage: update on problems of definitions and diagnosis // Acta Obstet. Gynecol. Scand. 2011. Vol. 90. P. 421-428.
12. Cortet M., Deneux-Tharaux C., Dupont C. et al. Association between fibrinogen level and severity of postpartum haemorrhage: secondary analysis of a prospective trial // Br. J. Anaesth. 2012. Vol. 108. P. 984-989.
13. Cantwell R., Clutton-Brock T., Cooper G. Saving Mothers’ Lives: reviewing maternal deaths to make motherhood safer: 2006-2008. The Eighth Report of the Confidential Enquiries into Maternal Deaths in the United Kingdom // Br. J. Obstet. Gynaecol. (BJOG: An International Journal of Obstetrics and Gynaecology). 2011. Vol. 118, N 1. P. 1-203.
14. Rubio-Alvarez A., Molina-Alarcon M., Arias-Arias A., Hernandez-Martinez A. Development and validation of a predictive model for excessive postpartum blood loss: a retrospective, cohort study // Int. J. Nurs. Stud. 2021. Vol. 79. P. 114-121.
15. Park H.S., Shin J.H., Yoon H.K., Kim J.H. et al. Transcatheter arterial embolization for secondary postpartum hemorrhage: outcome in 52 patients at a single tertiary referral center // J. Vasc. Interv. Radiol. 2014. Vol. 25, N 11. P. 1751-1757.
16. Spreu A., Abgottspon F., Baumann M.U., Kettenbach J. et al. Efficacy of pelvic artery embolisation for severe postpartum hemorrhage // Arch. Gynecol. Obstet. 2021. Vol. 296, N 6. P. 1117-1124.
17. Urushiyama D., Yoshizato T., Kora S., Higashihara H. et al. Predictive factors related to the efficacy of pelvic arterial embolization for postpartum hemorrhage: a retrospective analysis of 21 cases // Taiwan J. Obstet. Gynecol. 2014. Vol. 53, N 3. P. 366-371.
References
1. Pushkarsky O.A., Udovika N.A. Late postpartum bleeding: is it possible to avoid and how to help? Zhinochiy Likar [Female Doctor]. 2011 (6): 10-3. (in Russian)
2. Zharkin N.A. Bleeding in obstetrical practice. Vestnik Volgograd-skogo gosudarstvennogo meditsinskogo universiteta . 2013; 3 (47): 3-8. (in Russian)
3. Frolova O.G., Shuvalova M.P., Guseva E.V., Ryabinkina I.N. Maternal mortality at the present stage of development of the healthcare system. Akusherstvo i ginekoiogiya . 2017; 3 (17): 25-32. (in Russian)
4. Gynecology. Ed. by V.E. Radzinsky, A.M. Fuks. Moscow: GEOTAR-Media, 2014. (in Russian)
5. Abramchenko V.V. Postpartum endometritis and subinvolution of the uterus. Saint Petersburg, 2008. (in Russian)
6. Obstetrics: national leadership / edited by E.K. Ailamazyan. Moscow: GEOTAR-Media 2009. (in Russian)
7. Beda Yu.V. To the question of puerperal complications. Meditsinskiy al’manakh . 2009; 2 (7): 85-7. (in Russian)
8. Korotkikh I.N., Khodasevich EV, Brigadirova Yu.V., Panova N.E. Risk groups and problems of diagnosis of postpartum complications Sistemnyy analiz i upravlenie v biomeditsinskikh sistemakh . 2007; 6 (3): 707-13. (in Russian)
9. Komlichenko E.V., Belikova M.E., Ivanov A.V. Nowadays problems of gynaecological care organization. Zhurnal akusherstva i zhenskikh bolezney . 2010; (3): 83-6. (in Russian)
10. Radzinsky V.E. Obstetric aggression. Moscow: StatusPraesens, 2017. (in Russian)
11. Rath W.H. Postpartum hemorrhage: update on problems of definitions and diagnosis. Acta Obstet Gynecol Scand. 2011; 90: 421-8.
12. Cortet M., Deneux-Tharaux C., Dupont C., et al. Association between fibrinogen level and severity of postpartum haemorrhage: secondary analysis of a prospective trial. Br J Anaesth. 2012; 108: 984-9.
13. Cantwell R., Clutton-Brock T., Cooper G. Saving Mothers’ Lives: reviewing maternal deaths to make motherhood safer: 2006-2008. The Eighth Report of the Confidential Enquiries into Maternal Deaths in the United Kingdom. Br J Obstet Gynaecol. (BJOG: An International Journal of Obstetrics and Gynaecology). 2011; 118 (1): 1-203.
14. Rubio-Alvarez A., Molina-Alarcon M., Arias-Arias A., Hernandez-Martinez A. Development and validation of a predictive model for excessive postpartum blood loss: a retrospective, cohort study. Int J Nurs Stud. 2017; 79: 114-21.
15. Park H.S., Shin J.H., Yoon H.K., Kim J.H., et al. Transcatheter arterial embolization for secondary postpartum hemorrhage: outcome in 52 patients at a single tertiary referral center. J Vasc Interv Radiol. 2014; 25 (11): 1751-7.
16. Spreu A., Abgottspon F., Baumann M.U., Kettenbach J., et al. Efficacy of pelvic artery embolisation for severe postpartum hemorrhage. Arch Gynecol Obstet. 2017; 296 (6): 1117-24.
17. Urushiyama D., Yoshizato T., Kora S., Higashihara H., et al. Predictive factors related to the efficacy of pelvic arterial embolization for postpartum hemorrhage: a retrospective analysis of 21 cases. Taiwan J Obstet Gynecol. 2014; 53 (3): 366-71.
Разрыв матки
Патогенез. Разрыв матки — это акушерская катастрофа, которая часто приводит к смерти матери и плода. Большинство разрывов матки возникает во время родов. Более 90% разрывов матки ассоциированы с предшествующим кесаревым сечением или другими операциями на матке (консервативная миомэктомия и др.). В остальных 10% случаев разрыв матки происходит при отсутствии в анамнезе любых рубцов на матке.
В этих случаях разрыв матки может быть вынужденным, связанный с абдоминальной травмой (автокатастрофа, внешний и внутренний акушерский поворот плода) или родами и родоразрешением (высокие дозы окситоцина, избыточное давление на дно матки), или спонтанным, «гистопатичным» (при вросшей плаценте, многоплодной беременности, у многородящих женщин старшего возраста, при пузырном заносе, хориокарциноме).
При полном разрыве матки повреждаются все слои стенки матки, включая серозную оболочку; при неполном — целостность серозного слоя не нарушается.
Основными осложнениями для матери при разрыве матки является массивное кровотечение и гиповолемический шок. Разрыв матки среди причин материнской смертности составляет 1%, но она значительно увеличивается при запоздалом оказании акушерской помощи. Перинатальная смертность при этом осложнении может превышать 15% случаев.
Эпидемиология. Разрыв матки является редким осложнением и составляет 1:15 000 всех родов у пациенток, не имевших предыдущих операций на матке. Факторами риска этого осложнения являются состояния, которые сопровождаются повреждением или истончением стенок матки (рубцы на матке, перерастяжение матки, неадекватное применение высоких доз утеротоников в родах, врожденные аномалии развития матки и аномалии плацентации).
Факторы риска разрыва матки
- Предыдущая маточная хирургия
- Применение неадекватных доз окситоцина
- Многородящие женщины старшего возраста
- Значительное растяжение стенок матки
- Аномалии положения плода
- Крупный плод
- Внешний или внутренний акушерский поворот плода
- Травма
Клиника. Клинические симптомы разрыва матки очень вариабельны. Классическими симптомами являются внезапная острая боль в животе, вагинальное кровотечение (от небольшой до массивной), изменение контуров матки и удаления предлежащей части плода, прекращение родовой деятельности, острая гипоксия или смерть плода.
Лечение разрыва матки заключается в срочном родоразрешении путем лапаротомии. По возможности место разрыва матки зашивают и достигают полного гемостаза; в других случаях выполняют гистерэктомию. При сохранении матки и последующей беременности родоразрешение таких пациенток выполняют путем кесарева сечения в 36 нед гестации при подтверждении зрелости легких плода.
Акушерское кровотечение.
J. Sudharma Ranasinghe, Loren Lacerenza, Lester Garcia, Mieke A. Soens, Department of Anesthesiology, Jackson Memorial Medical center, Miami, Florida, USA
Кровотечение – это ведущая причина материнской смерти. В развивающихся странах это происходит в 25% случаев.[1] Во время беременности происходит физиологическая адаптация к кровопотере:
- ОЦК увеличивается (1000-2000 мл), количество эритроцитов повышается
- Организм находится в состоянии гиперкоагуляции (увеличение факторов свертывания крови, включая фибриноген)
- Инволюция матки после родов обладает «эффектом турникета» для спиральных артерий
Кровопотеря возникает очень быстро, так как скорость маточного кровотока к доношенному сроку составляет 600-900 мл/мин. При развитии атонии матки кровопотеря составляет 1 единицу крови в минуту. В послеродовом периоде объем восполненной кровопотери может быть недостаточным вследствие следующих факторов:
- Во время КС точно оценить кровопотерю практически невозможно вследствие разного количества околоплодных вод. Послеродовую кровопотерю очень часто переоценивают. В исследовании Prasertcharoensuk и коллег[2] показано, что истинная кровопотеря обычно на 100 мл меньше подсчитанной. Повышается значение переоценки кровопотери.
- Изменений систолического АД может и не наблюдаться при кровопотере менее 25% от исходного ОЦК.
- Беременность повышает вероятность развития диссеминированного внутрисосудистого свертывания (ДВС)
Причины акушерского кровотечения:[3]
- Кровотечения во время беременности наблюдается в 4% случаев вследствие предлежания плаценты, отслойки плаценты и разрыва матки.
- Раннее послеродовое кровотечение наблюдается в 10% случаев при атонии матки (1:20 случаев), разрыв наружных половых органов, задержки отделения последа, выворота матки (1:6400).
Атония матки наиболее частая причина значительного маточного кровотечения в послеродовом периоде. Факторы риска:
- Перерастянутая матка — многоплодие, крупный плод, многоводие
- «Уставшая матка» — многородящие пациентки, длительные роды, длительное использование окситоцина
- «Больная матка» — хориоамнионит
Препараты при послеродовом кровотечении Одним из компонентов лечения послеродового кровотечения является применение утеротонических препаратов (чаще всего окситоцин или алкалоиды спорыньи). Препаратом первого выбора при развитии послеродового кровотечения (ПРК) является окситоцин, который стимулирует силу и частоту маточных сокращений. Он обладает мгновенным эффектом, и период его полураспада составляет 5-12 минут. Окситоцин, введенный в/м циркулирует в крови 2-3 минуты.[4] Основным консервантом окситоцина является хлоробутанол, который обладает отрицательным инотропным эффектом к сердечной мышце.[5,6] Исходя из того, что окситоцин обладает прямым действием на сердце, рекомендуется вводить данный препарат в/в капельно из расчета 20-40 ЕД на литр. Болюсный окситоцин, введенный в/в или в/м, понижает систолическое и диастолическое давление. Он также увеличивает сердечный выброс, при этом возникает тахикардия и усиливается периферический кровоток. При использовании окситоцина описываются случаи отека легких, субарахноидального кровоизлияния, сердечной аритмии и анафилактические реакции. Эргометрин, алкалоид спорыньи, повышает силу и частоту сокращений посредством влияния на альфа-адренорецепторы, триптаминергические рецепторы. Данный препарат, при введении терапевтической дозы 0,2 мг в/м, приводит к вазоконстрикции (как вен, так и артерий), повышая АД. Эргометрин противопоказан при повышенных показателях АД и перед введением данного препарата необходимо рутинно измерить давление. Алкалоиды спорыньи вызывают коронарный спазм и очень часто являются причиной болью за грудиной и ишемических изменений на ЭКГ (у пациентов с ИБС) [7]. Эргометрин используется отдельно, либо в комбинации с окситоцином (синтометрин), с целью профилактики и лечения ПРК. У синтометрина преимущество окситоцина в быстром начале действия и эргометрина в реакции миометрия. Однако большее количество побочных эффектов при рутинном использовании не позволяет применять его постоянно. Синтометрин (500 мкг эргометрина и 5 ЕД окситоцина) не следует использовать при наличии гипертензии, преэклампсии или болезни сердца. Окситоцин и эргометрин не должны подвергаться воздействию высоких температур и прямого света. При исследовании было выяснено, что при хранении в температурном режиме 21-25 С в течение года, теряется 90% активности препарата. В развивающихся странах температурный режим хранения является важной составляющей успешного применения препарата. Было высказано предположение, что простагландины могут стать идеальными препаратами для рутинной профилактики кровотечения в 3 периоде родов. В отличии от эргометрина они не вызывают гипертонию[10] и оказывают сильный утеротонический эффект. Мизопростол, аналог простагландина Е1, один из последних препаратов используемых для профилактики и лечения ПРК. Вагинальное введение мизопростола более мощное и при этом наблюдается меньше побочных эффектов, чем при п/о приеме. Однако вагинальный способ введения не всегда бывает подходящим вследствие кровотечения. Описывается эффективное применение мизопростола 800-1000 мкг ректально.[11,12] Практически во всех исследованиях описываются следующие побочные эффекты: лихорадка и озноб. Хотя мизопростол не является препаратом первого выбора для рутинного применения в третьем периоде родов, в развивающихся странах, где финансирование ограничено, а условия для хранения не всегда подходящие, данный препарат можно было бы использовать вследствие дешевизны, легкости в применении и условий хранения. Короткая продолжительность действия натуральных простагландинов, в сочетании с большим количеством побочных эффектов привело к разработке производного метилированного простагландина. Hemabate (15-метил-ПРГ 2 альфа) 250 мкг настолько же эффективен как синтометрин при лечении рефлекторной атонии.[12] При введении в миометрий препарат начинает действовать через 5 минут, при внутримышечном применении через 45 минут после введения[13]. Hemabate очень дорогой препарат. При его применении часто наблюдается побочный эффект со стороны ЖКТ в виде диареи. Пациентки с бронхиальной астмой имеют повышенную чувствительность к препарату, так как он потенциально может привести к бронхоспазму и внутрилегочному сбросу крови.[14]
Нефармакологические методы лечения послеродового кровотечения Лечение атонии матки начинается с простых манипуляций. Однако при усилении кровотечения все может закончиться удалением матки. Начальные методы лечения следующие:
- Массаж матки. Первой и доступной манипуляцией после КС является массаж матки. Гемостаз в месте плацентарной площадки является механическим процессом, во время которого миометрий пережимает спиральные артерии и кровотечение прекращается. Если этого не происходит, кровотечение усиливается. Постоянный контакт между акушером и анестезиологом в данной ситуации чрезвычайно важно. Без промедлений необходимо начать утеротоническую и инфузионную терапию.
- Тампонада матки. Тампонирование матки специальными тромбиновыми салфетками является простой и неинвазивной процедурой. Данную технику можно применять после вагинальных и оперативных родов. Существует вероятность инфекции, поэтому необходимо предусмотреть профилактическую антибактериальную терапию.
- Компрессионные швы. Были разработаны альтернативные варианты остановки кровотечения вследствие высокого риска инфекции при тампонаде матки. Lynch и коллеги применяли вертикальный шов для создания оболочки и компрессии матки. При противопоставлении передней и задней стенки матки кровотечение останавливается.[15] Данный метод является простой процедурой, однако недостаточно доказанной. Модификация данного метода подразумевает возможность наложения компрессионных швов без нарушения целостности стенки матки.[16]
- Перевязка внутренней подвздошной артерии. Двусторонняя перевязка внутренней подвздошной артерии является эффективным методом остановки кровотечения в послеродовом периоде. Хотя тазовый кровоток уменьшатся лишь на 49%, пульсовое давление снижается на 85%, тем самым снижая давление и обеспечивая гемостаз.[17] Лигирование артерии простой, безопасный и успешный метод терапии тяжелого ПРК, особенно при необходимости сохранения матки.[18] Ангиографические исследования выявили образование поясничных, крестцовых и прямокишечных анастомозов, что обеспечивает отсутствие ишемии и некроза.[19] При наличии кровотечения первоначально необходимо использовать все консервативные методы остановки кровотечения. При наличии продолжающегося кровотечения необходимо выполнить гистерэктомию.[19]
- Для тампонады матки также используется пищеводный зонд Блэкмора, который вводится в полость матки и заполняется физ. раствором. Описывается применение катетера Фолея, однако его небольшой объем (30 сс) не позволяет использовать в раннем послеродовом периоде. Данный метод успешно применяется при атонии матки[20,21] и placenta accreta.[22]
- Баллонная окклюзия маточной артерии. Эмболизация маточной артерии с помощью катетера был разработан в 1960-х годах, и в дальнейшем успешно использовалась для остановки кровотечения в послеродовом периоде. Данный метод обладает преимуществами, учитывая селективность эмболизации определенной зоны, сохранения матки и фертильности, меньшим кровотечением из коллатералей вследствие дистальной окклюзии кровоточащих сосудов[23]. Эмболизация – это достоверно успешный метод остановки кровотечения с низким уровнем осложнений.[24] Одно из исследований показало, что частота успешной эмболизации составляет 95% из 138 случаев, осложнения наблюдались в 8,7%.[25] Наиболее частым осложнением является незначительная лихорадка. Для применения данного метода необходимо наличие врача функциональной диагностики и полностью укомплектованное отделение лучевой диагностики 24 часа в сутки. Для эмболизации не нужна лапаротомия, а при продолжающемся кровотечении перевязку артерии можно выполнить позже. Командная работа акушера и анестезиолога позволяет выявлять пациенток из группы высокого риска по развитию кровотечения. При этом можно профилактически поставить катетер для эмболизации и в случае необходимости выполнить процедуру. На данный момент точно не определено время когда нужно проводить эмболизацию. Однако в клиниках, где проводится данная процедура, выработаны алгоритмы, согласно которым эмболизацию надо проводить как можно быстрее после неудачных консервативных методов остановки кровотечения.[26]
- Гистерэктомия. При развитии кровотечения, которые угрожают жизни пациентки необходимо выполнить гистерэктомию. Эта операция считается технически трудной и ее не надо откладывать до наступления декомпенсации состояния матери. Во время предоперационной подготовки необходимо катетеризировать периферическую вену катетером большого калибра, начать инфузионную терапию кристаллоидами и коллоидами, обеспечить наличие компонентов крови для переливания. Очень важно поддерживать нормальную температуру тела подогретым воздухом и теплыми растворами. Катетеризация периферической артерии и вазопрессоры могут быть полезными. Необходимо взять полный анализ крови, коагулограмму, электролиты, обеспечить контроль диуреза. Если операция началась под местным обезболиванием, то в случае нестабильности гемодинамики или необходимости массивной инфузионной терапии возможен переход на общее обезболивание. Внутривенные анестетики (кетамин) могут быть полезными, так как все летучие вещества ухудшают атонию матки. Надвлагалищная ампутация матки является операцией выбора при отсутствии кровотечения из цервикальных веточек маточной артерии.[27]
Другие методы лечения Фактор Vlla Человеческий рекомбинантный фактор VIIa – это витамин К зависимый протеин, который одобрен FDA США для лечения гемофилии А и В, недостаточности VII фактора свертывания крови. Рекомбинантый фактор формирует тромбы, образуя комплекс с тканевым фактором, который находится на субэндотелии поврежденного сосуда.[28] Данный комплекс активирует IX и Х факторы свертывания, которые образуют тромбин.[29] На данный момент опубликованы результаты нескольких исследований по применению VIIa для остановки РПК.[30,31] Научных доказательств успешного использования данного препарата в акушерстве нет. Во всех исследованиях VII фактор вводился болюсно по 60-120 мкг/кг. Эффект наблюдался лишь в течение 10 минут. Недостатками фактора VIIa являются небольшой период полураспада (2 часа) и высокая стоимость ($ US 1400 за миллиграмм).[32] Введение повторных доз увеличивает стоимость. Побочными эффектами являются ДВС-синдром, тромбоз и инфаркт миокарда.[33] Некоторые клинические ситуации могут повысить риск развития осложнений. При ДВС происходит выброс тканевого фактора в кровоток, а применение VIIa может теоретически привести к более тяжелой коагулопатии и микротромбозам.[34] При наличии кровотечения ДВС может развиться очень быстро. Рекомбинантный фактор может оказаться полезным при угрожающих жизни РПК в случае неудачных попытках хирургического лечения и переливания крови.[35] Хотя его безопасность еще надо доказать.
Реинфузия Интраоперационная реинфузия относительна противопоказана в акушерстве вследствие риска попадания в материал амниотической жидкости и последующей эмболии. Вследствие отсутствия знаний по поводу механизма действия данного метода, нельзя оценить адекватность процесса промывки. Тканевой фактор амниотической жидкости может вызвать ДВС-синдром.[36] Некоторые исследователи полагают, что в данный процесс могут быть вовлечены чашуйки кожи плода, волосяной покров и/или фосфолипиды.[37] Не зная точных причин амниотической эмболии мы не можем быть уверены в то, что убираем вредные компоненты во время очистки. В 2000 году Waters и коллеги оценили кровь, которую получили во время КС и профильтровали через лейкоцитарный фильтр.[37] Затем сравнили ее с кровью, взятой из маточной вены и полой вены. После фильтрации было выявлено значительное снижение пластинчатых телец и чашуек кожи плода, но при этом наблюдалось повышение уровня эритроцитов плода. Учитывая тот факт, что эритроциты плода рутинно попадают в кровоток матери во время родов, то только вследствие резус конфликта могут возникнуть определенные проблемы. Для предотвращения изоиммунизации матери вводится анти-Д иммуноглобулин. При использовании лейкофильтра существует один недостаток – скорость инфузии снижается до 30-80 мл/минуту под давлением в 300 мм рт. ст. Еще одним недоказанным методом снижения «загрязнения» крови является использование двойного отсоса. Важно помнить, что вследствие редкого возникновения эмболии околоплодными водами (1 на 8000-80000 родов)[37], исследований, описанных в литературе недостаточно для оценки риска применения реинфузии в акушерстве. Мало вероятно, что данный метод займет твердую нишу в борьбе с ПРК. Реинфузию стоит применять в крайнем случае когда это единственный вариант для повышения кислорода в крови и спасения жизни, как это описано в практическом случае.
Практический случай Повторнородящая свидетельница Иегова 36 лет (Б-6, Р-5), в анамнезе 5 КС поступает с полным предлежанием плаценты. При сроке 37 недель планируется плановое КС. Уровень гемоглобина перед операцией составлял 10 г/дл. Факторы риска для placenta accreta:
- Предлежание плаценты
- КС в анамнезе
- Возраст старше 35 лет
- Паритет
- Кюретаж полости матки в анамнезе
У пациентки имелись практически все факторы риска по развитию placenta accreta. The American College of Obstetrics and Gynecology предупреждает, что риск развития placenta accreta после 2-хи более КС, при наличии частичного или полного предлежания плаценты составляет 40%. После 5-ти КС риск превышает 50%. Для анестезиолога единственным поводом для беспокойства должно являться кровотечение. Готовить пациентку к операции нужно заранее. Необходимо провести обследование с целью подтверждения патологического расположения плаценты. Это можно сделать с помощью МРТ или более дешевого метода – трансвагинального цветного Допплера. Специфичность данного метода составляет 96%, положительные предрасполагающие факторы – 87%, негативные предрасполагающие факторы в 95% случаев.[41] В качестве предоперационной подготовки необходимо катетеризировать как минимум 2 периферические вены катетерами большого калибра. При наличии возможности можно катетеризировать бедренную вену для проведения возможной эмболизации. Во время операции необходимо проводить реинфузию, так как большинство свидетелей Иеговы поддерживают именно данный метод. Хотя гистерэктомия является самым распространенным методом остановки кровотечения при наличии placenta accrete[47], это ставит крест на фертильности. В 1986 году Arulkumaran и коллеги[48] впервые описали консервативный метод лечения placenta accreta. Они вводили 50 мг метотрексата в/в, а течение послеоперационного периода еще 250 мг. Плацента отделилась через 11 дней. Было описано еще насколько случаев применения метотрексата, хотя дозировка и методы введения были различными.[49] Хотя консервативные методы лечения placenta accreta с помощью метотрексата является подходящей альтернативой хирургическому лечению, необходимо разработать четкий протокол. Во время лечения необходимо профилактическое введение антибиотиков.
Выворот матки Выворот матки это редкое осложнение, которое связано с развитием массивного кровотечения и шока. Выворот возникает при давлении на дно матки, неверных тракциях за пуповину в третьем периоде родов при наличии атонии матки, особенно при расположении плаценты в дне. Самыми частыми клиническими проявлениями являются массивное кровотечение и болевой синдром. Дно матки невозможно пальпировать, а тело матки находится во влагалище или за его пределами. Выворот матки подразделяется по степени на полный или неполный. Это зависит от отношения дна матки к шейке. Также разделяется на острый и подострый, в зависимости от сокращения шейки матки.[42] Выворот матки приводит к профузному и длительному кровотечению. Кровотечение из плацентарной площадки усиливается вследствие ограниченного маточного венозного оттока. Степень кровопотери зависит от длительности выворота. Вследствие вазовагального рефлекса возникают гипотония и брадикардия. Вывернутая матка натягивает симпатические нервы, что приводит к тяжелому шоку.[43,44] Выворот матки является уникальной проблемой для анестезиолога. Во-первых, необходимо компенсировать гиповолемию. Во-вторых, анестезия должна дать возможность акушеру вправить матку. В-третьих, если ручное вправление невозможно вследствие сокращения шейки, необходимы фармакологические мероприятия по быстрому расслаблению матки. Анестезиолог может столкнуться с еще одной проблемой – необходимости введения летучих препаратов или нитроглицерина на фоне гиповолемии. Вследствие продолжающегося профузного кровотечения из вывернутой матки время является критическим фактором в лечении. В то время как акушер вправляет матку необходимо проводить быструю инфузионную терапию и осуществлять введение вазопрессоров для поддержания или повышения АД. Быстрая репозиция требует быстрого обезболивания вследствие выраженного болевого синдрома. При этом необходимо сделать выбор между общим и местным обезболиванием. Местный блок может привести к симпатической блокаде, что очень опасно при сниженном ОЦК. Общее обезболивание ингаляционными анестетиками для расслабления матки и применение больших, чем обычно, доз летучих анестетиков повышают риск депрессии ССС. Нитроглицерин приводит к быстрому расслаблению матки и при этом может понадобиться общее обезболивание. Некоторые исследования описывают успешное в/в введение нитроглицерина.[45,46] Нитроглицерин начинает действовать быстро (30-40 сек), период распада составляет 1 минуту. 50-200 мкг вызовет расслабление матки без выраженной гипотонии или других побочных эффектах.[47] Такое быстрое начало действия невозможно добиться при применении других анестетиков. Использование эпидуральной анестезии в родах в сочетании с низкими дозами нитроглицерина позволяет добиться хорошего расслабления матки без нарушения гемодинамики. Сублингвальные формы нитроглицерина легки в применении и также быстро действуют. Более того он всегда доступен. Начало действия регистрируется через 30-45 секунд после применения, с пиком на 90-120 секунде. Продолжительность действия составляет 5 минут.[48] 800 мкг сублингвального нитроглицерина полностью расслабляет частично вывернутую матку через 30 секунд. Для расслабления матки также применялись тербуталин и магнезия. Однако магнезия начинает действовать лишь через 10 минут после введения, что непозволительно долго. Более того, продолжительность их действия также очень длительная, что в дальнейшем необходимо избежать. Как только матка вправлена необходимо прекратить введение релаксантов и назначить утеротонические препараты.
Заключение
Послеродовое кровотечение является основной причиной материнской заболеваемости и смертности. На самом деле, в развивающихся странах ПРК основная причина материнской смертности. Для лечения разработаны несколько вариантов лечения. Хотя раньше основным методом лечения кровотечения была гистерэктомия, тем самым наступала потеря фертильности, сегодня применяются консервативные методы лечения для ее сохранения. Консервативные методы лечения доказали свою пользу, особенно при неудачных попытках гемостаза. Однако гистерэктомию нельзя откладывать в случае ограничения количества лекарственных препаратов и инфузионных растворов. Четкий мониторинг, слаженная работа в команде и вовремя принятые решения являются основополагающими в лечении послеродового кровотечения.
ЛИТЕРАТУРА
- Thomas T. Maternal Mortality. In Birnbach DJ, Gatt SR Datta s, editors. Textbook of оbstetric anesthesia 2000
- Prasertcharoensuk W, Swadpanich U, Lumbiganon P. Accuracy of the blood loss estimation in the third stage of labor. Int J Gynecol Obstet 2000;71:69-70
- Crochetiere C. Obstetric emergencies. Anesthesiology Clin N Am. 2003;21:111-125
- Sica-Blanco Y, Sala NG. Uterine contractility at the beginning and at the end of an oxytocin infusion. In: Caldeyro-Barcia R, Heller H, eds. Oxytocin. Oxford, United Kingdom: Pergamon Press, 1961:127-36
- Barrigon S, Tejerina T, Delgado C, Tamargo J. Effects of chlorbutol on 45Ca movements and contractile responses of rat aorta and its relevance to the actions of Syntocinon. J Pharm Pharmacol 1984; 36: 521-6
- Hendricks CH & Brenner WE. Cardiovascular effects of oxytocic drugs used postpartum. American Journal of Obstetric and Gynecology 1970; 108:751-760.
- Tsui BC, Stewart B, Fitzmaurice A, Williams R. Cardiac arrest and myocardial infarction induced by postpartum intravenous ergonovine administration. Anesthesiology 2001 ;94:363-4
- McDonald SJ, Prendiville WJ & Blair E. Randomised controlled trial of oxytocin alone versus oxytocin and ergometrine in active management of third stage of labour. British Medical Journal 1993; 307: 1167-1171
- Hogerzeil HV, Walker GJA. Instability of (methyl)ergometrine in tropical climates: An overview. Eur J Obstet Gynecol Reprod Biol 1996;69:25-9
- Sharma S., EI-Refaey H. Prostaglandins in the prevention and management of postpartum hemorrhage. Best Practice and Research Clinical Obstetrics and Gynaecology, 2003;17:811-823
- Walley R.L., Wilson J.B., Crane J.M., Matthews K., Sawyer E. and Hutchens D. (A double-blind placebo controlled randomised trial of misoprostol and oxytocin in the management of the third stage of labour. British Journal of Obstetrics and Gynaecology, 2001 ;107:1111-5
- Lokugamage AD, Sullivan KR, Niculescu I et al. A randomized study comparing rectally administered misoprostol versus Syntometrine combined with an oxytocin infusion for the cessation of primary post partum hemorrhage. Acta Obstet Gynecol Scand 2001; 80: 835-9
- Bigrigg A, Chui D, Chissell S: Use of intramyometrial 15-methylprostaglandin F2 to control atonic postpartum haemorrhage following vaginal delivery and failure of conventional therapy. Br J Obstet Gynaecol 1991;98:734-736
- O’Leary AM. Severe bronchospasm and hypotension after 15-methyl prostaglandin F2-alpha in atonic postpartum hemorrhage. International Journal of Obstetric Anesthesia 1994; 3:42-4
- Lynch C.B., Coker A, Laval A.M., Abu J, Cowen M.J. The B-Lynch surgical technique for control of massive postpartum haemorrhage: an alternative to hysterectomy? Five cases reported. Br J Obstet Gynaecol 1997;104: 372-78
- Tamizian O. and Arulkumaran S. The surgical management of postpartum haemorrhage. Current Opinion in Obstetrics and Gynecology 2001 ;13: 127-31.
- Burchell RC. Physiology of internal iliac artery ligation. J Obstet Gynaecol of British Commonwealth 1968;75: 642-51
- Chattopadhyay SK, Deb Roy B, Edrees YB. Surgical control of obstetric hemorrhage: hypogastric artery ligation or hysterectomy? Int J Gynaecol Obstet. 1990;32:345-51
- Bakri YN, Linjawi T. Angiographic embolization for control of pelvic genital tract hemorrhage. Acta Obstet Gynecol Scand 1992;71:17-21
- 20. Condous GS, Arulkumaran S, Symonds I, Chapman R, Sinha A, Razvi K. The «Tamponade Test» in the management of massive postpartum hemorrhage. Obstet Gynecol 2003;101: 767-72
- Johanson R, Kumar M, Obhrai M, Young P. Management of massive portpartum haemorrhage: use of a hydrostatic balloon catheter to avoid laparotomy. Br J Obstet Gynaecol 2001 ;108: 420-22
- Frenzel D, Condous GS, Papageorghiou AT, McWhinney NA. The use of the «tamponade test» to stop massive obstetric hemorrhage in placenta accreta. Br J Obstet Gynaecol 2005;112: 676-7
- Wee L, Barron J, Toye R. Management of severe postpartum hemorrhage by uterine artery embolization. Br J Anaesthesia 2004;93:591-4
- Vedantham S, Goodwin SC, McLucas B, Mohr G. Uterine artery embolization: an underused method of controlling pelvic hemorrhage. Am J Obstet Gynecol 1997;176: 938-48
- BadawySZA, Etman A, Singh M, Murphy K, MayelliT, Philadelphia M. Uterine artery embolization. The role in obstetrics and Gynecology. J Clin Imaging 2001; 25: 288-95
- Bloom Al, Versandig A, Gielchinsky Y, Nadjari M, Elchalal U. Arterial Embolisation for perisistent primary postpartum haemorrhage: before or after hysterectomy? Br J Obstet Gynecol 2004;111: 880-4
- Selo-Ojeme DO. Primary Postpartum Hemorrhage. J Ostet Gynecol 2002;22: 463-9
- Hedner U, Erhardsten E. Potential role for FVIIa in transfusion medicine. Transfusion 2002;42:114-124
- Gate H. Bauer KA, Levi M, Edgington TS, Sublett RD, Barzegar S, et al. The activation of factor X and prothrombin by recombinant factor Vila in vivo is mediated by tissue factor. J Clinical Invest 1993;92:1207-12
- Price G, Kaplan J, Skowronski G. Use of recombinant factor Vlla to treat life-threatening non-surgical bleeding in a post-partum patient. Br J Anaesthesia 2004;93:298-300
- Bouwmeester FW, Jonkhoff AR, Verheijen RHM, van Geijn HP. Successful treatment of life-threatening postpartum hemorrhage with recombinant activated factor VII. Obstet Gynecol 2003;101:1174-6
- Hollnberger H, Gruber E, Seelbach-Goebel B. Major post-partum hemorrhage and treatment with recombinant factor Vlla. Anesthesia & Analgesia 2005;101: 1886-7
- Branch DW, Rodgers GM. Recombinant Activated Factor Vlla: A new weapon in the fight against hemorrhage. Obstet Gynecol 2003;101:1155-6
- Levi M, Peters M, Buller HR. Efficacy and safety of recombinant factor Vlla for treatment of severe bleeding: A systematic review. Critical Care Medicine 2005;33:883-90
- Butwick AJ, Riley ET, Ahonen J, Jokela R. Recombinant factor Vlla for life-threatening post-partum haemorrhage. Br J Anaesthesia 2005;95:558
- Lockwood CJ, Bach R, Guha A, Zhou XD, Miller WA, Nemerson Y. Amniotic fluid contains tissue factor, a potent initiator of coagulation. Am J Obstet Gynecol 1991;165:1335-41
- Waters JH, BiscottiC, Potter PS, PhillipsonE. Amniotic fluid removal during cell salvage in the cesarean section patient. Anaesthesiology 2000;92:1531-36
- Souza A, Permezel M, Anderson M, Ross A, McMillan J, Walker S. Antenatal erythropoietin and intra-operative cell salvage in a Jehovah’s Witness with placenta praevia. Br J Obstet Gynaecol 2003;110:524-52
- Terui K. Antepartum Hemorrhage. In Birnbach DJ, Datta S, ed. Textbook of Obstetric Anesthesia 2000
- AGOG Committee Opinion. Placenta accrete. No. 266, January 2002. American College of Obstetricians and Gynecologists. Int J Gynaecol Obstet 2002;99:169-70
- Chou MM, Ho ESC, Lee YH. Prenatal diagnosis of placenta previa accrete by transabdominal color Doppler ultrasound. Ultrasound Obstet Gynecol 2000;15: 28-35
- Kitchin JD III, Thiagarajah S, May HV Jr, Thornton WN Jr. Puerperal inversion of the uterus. Am J Obstet Gynecol 1975;123:51-8
- Platt LD, Druzin ML. Acute puerperal inversion of the uterus. Am J Obstet Gynecol 1981 ;141:187-90
- Watson P, Besch N, Bowes WA Jr. Management of acute and subacute puerperal inversion of the uterus. Obstet Gynecol 1980;55:12-6
- Vinatier D, Dufour P, Berard J:Utilization of intravenous nitroglycerine for obstetrical emergencies. Int J of Gynaecol & Obstet, 1996;55: 129-34
- Caponas G:Glyceryl trinitrate and acute uterine relaxation: a literature review. Anaesth Intensive Care, 2001; 29:163-77
- Axemo P, Fu X, Lindberg B et al: Intravenous nitroglycerin for rapid uterine relaxation. Acta Obstet Gynecol Scand, 1998;77:50-3
- Dawson NJ, Gabbott DA. Use of sublingual glyceryl trinitrate as a supplement to volatile inhalational anaesthesia in case of uterine inversion. International Journal of Obstetric Anesthesia, 1997;6:135-37