Насколько распространена неалкогольная жировая болезнь печени? Формы заболевания
Содержание статьи
Неалкогольная жировая болезнь печени, известная как НАЖБП, является наиболее распространенным заболеванием этого органа. Тем не менее знания о нем, даже среди врачей, все еще недостаточны.
Неалкогольная жировая болезнь печени
По оценочным данным, НАЖБП встречается очень часто. Например, среди людей с избыточным весом и ожирением процент больных с подобной патологией достигает 50%. Эти значения близки или превышают количество людей с гипертонией или диабетом 2 типа.
Между тем у 5% больных заболевание принимает запущенную форму, называемую НАСГ, неалкогольным стеатогепатитом, а у 0,5% переходит в смертельный цирроз печени. Последние проценты кажутся небольшими, но в пересчете на общее количество заболевших они огромны.
Следовательно, НАЖБП включает: «простой» стеатоз и более опасный неалкогольный стеатогепатит. При появлении последней формы может возникнуть очень серьезное осложнение – цирроз печени.
Неалкогольный стеатогепатит: от патогенеза к терапии
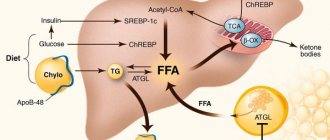
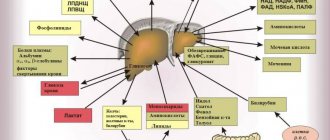
Неалкогольный стеатогепатит (НАСГ) представляет собой воспалительную инфильтрацию паренхимы и стромы печени с наличием очаговых некрозов. НАСГ является промежуточным звеном между последовательными стадиями одного патологического процесса (неалкогольного стеатоза и неалкогольного стеатофиброза), формой самостоятельного метаболического заболевания – неалкогольной жировой болезни печени (НАЖБП). Поскольку в перечне заболеваний МКБ-10 отсутствует единый код, отражающий полноту диагноза НАЖБП, в настоящее время наиболее часто используют: К 76.0 – жировая дегенерация печени, не классифицированная в других рубриках. Термин НАСГ впервые сформулировали в 1980 г. J. Ludwig et al., изучая характер изменений в печени больных с ожирением и сахарным диабетом (СД) 2-го типа, у которых в анамнезе не было указаний на прием алкоголя в гепатотоксических дозах, однако при морфологическом исследовании ткани печени были выявлены признаки, характерные для алкогольной болезни печени (АБП) [1]. А термин НАЖБП (non alcoholic fatty liver disease), введенный в 2000 г., в настоящее время употребляется как общее название различных дисметаболических состояний печени, в основе которых лежит чрезмерное внутри- и внеклеточное накопление жира [2]. При этом необходимо исключить хроническую алкогольную интоксикацию (когда употребление алкогольсодержащей продукции в пересчете на чистый этанол составляет менее 20 г/сут), наследственный гемохроматоз, инфекции HCV, HBV и HDV, повышение уровней церулоплазмина и α1-антитрипсина, убедиться в отсутствии аутоиммунного гепатита. Эпидемиология Необходимо помнить о том, что есть определенное количество пациентов, не употребляющих алкоголь, но имеющих поражение печени, сходное по гистологической структуре с алкогольным. Исследования, проведенные в Японии и Италии, показали, что распространенность жирового гепатоза в общей популяции колеблется от 3 до 58% (в среднем 23%). Высокая вариативность данных вызвана, вероятно, социально-экономическими различиями изучаемых поселений [3, 4]. В США НАСГ является самой обычной болезнью. Процент тучных людей в общей популяции увеличился с 10 до 25% за период только с 1961 по 1997 г. В европейских странах НАСГ диагностируют приблизительно у 11% пациентов, которым проводят биопсию печени в связи с повышенным уровнем трансаминаз сыворотки крови. У тучных людей распространенность НАСГ выше, составляет 19% и только в 2,7% случаев НАСГ диагностируется при нормальном весе [5, 6]. В действительности распространенность НАСГ может быть еще выше среди больных без клинической симптоматики, не употребляющих алкоголь в значительных количествах, если при этом отсутствуют серологические маркеры вирусных гепатитов. Так, многие больные с повышенной активностью печеночных ферментов в крови и отрицательными результатами неинвазивных исследований могут иметь НАСГ. Есть сообщения о случаях НАСГ, выявляемых в возрасте 10–20 лет [3, 7, 8]. Патогенез В основе патогенеза НАСГ лежит периферическая инсулинорезистентность [10–12]. Посредством тирозинкиназы происходит внутриклеточное нарушение передачи сигнала после активации инсулинового рецептора [11]. Точный механизм нарушения данного пути обмена веществ до конца не ясен. Решающим, по-видимому, становится выделение жировой тканью, особенно жировой тканью брыжейки, фактора некроза опухоли-α (ФНО-α), а также лептина и ряда других белковых медиаторов. ФНО–α снижает регуляцию сигнала инсулинового рецептора-субстрата и тем самым уменьшает транслокацию на клеточной мембране транспортирующего глюкозу белка GLUT-4. Как следствие, уменьшается количество утилизируемой клеткой глюкозы. Периферическая инсулинорезистентность ведет к гиперинсулинизму, что обусловливает блокирование митохондриального β-окисления. Гормон жировой ткани лептин также имеет важное значение. Резистентность к лептину или его дефицит приводят к усиленному накоплению жиров и нарушению β-окисления жирных кислот в печени. Также при НАЖБП снижается уровень гормона жировой ткани адипонектина, в связи с чем нарушаются внутриклеточные сигналы, такие как активация МАП-киназы и пероксисомального пролиферативного ядерного рецептора, что усиливает накопление жира в печени. Свободные жирные кислоты (СЖК) оказывают гепатотоксическое действие. В норме СЖК подвергаются нейтрализации следующими путями: митохондриальное β-окисление, продукция и секреция липопротеинов очень низкой плотности (ЛПОНП), синтез связывающего жирные кислоты белка, синтез триглицеридов. При НАЖБП различные механизмы нейтрализации СЖК ограничены. Жировая печень за счет второго патофизиологического механизма может стать основой для прогрессирования патологии печени в НАСГ с фиброзом [13]. В этой связи важен тот факт, что СЖК могут индуцировать цитохром Р 450 2 Е1 с последующей продукцией реактивных форм кислорода, которые путем усиления перикисного окисления липидов приводят к активации фибронеогенеза. Другой механизм представлен увеличенным поступлением эндотоксинов из кишечника в печень. Так же как и при алкогольном поражении печени, происходит выделение цитокинов звездчатыми клетками Купфера. Цитокины, в первую очередь ФНО-α, вносят вклад, с одной стороны, в патогенез гепатита, с другой стороны, в развитие периферической инсулинорезистентности [14, 15]. Среди причин, приводящих к НАСГ, рассматривают врожденные и приобретенные метаболические нарушения: болезнь Вильсона–Коновалова, метаболический синдром, тотальное парентеральное питание, выраженную потерю массы тела, а также редкие патологии: абеталипопротеинемию, гипобеталипропротеинемию, тирозинемию, патологию пероксисом, митохондриопатии. Имеют значение поликистоз яичников, целиакия, контакт с растворителями. Известно, что такие перенесенные хирургические вмешательства, как бандажирование желудка, обширная тонкокишечная резекция, наложение билиопанкреатического или подвздошно-тонкокишечного анастомоза также способствуют развитию НАСГ [14]. Ряд лекарственных препаратов из различных фармакологических групп (хлорохин, дилтиазем, нифедипин, амиодарон, глюкокортикоиды, тамоксифен, эстрогены, изониазид, метотрексат, аналоги нуклеозидов) вызывают НАСГ. Клиника и диагностика НАСГ Актуальность своевременной диагностики и лечения НАСГ связана, с одной стороны, с тем, что НАЖБП наряду с ожирением, СД 2-го типа, артериальной гипертензией и дислипидемией представляет собой компонент метаболического синдрома и является независимым фактором риска сердечно-сосудистых заболеваний. При этом, согласно наработанным данным, НАСГ составляет 20% всех случаев НАЖБП. С другой стороны, ранее считали, что НАСГ протекает доброкачественно и редко прогрессирует до декомпенсированного цирроза печени (ЦП). Но в настоящее время показано, что ЦП может развиться в 40% случаев НАСГ, и прогрессирование НАСГ до ЦП определяется выраженностью воспалительных изменений в гепатоцитах [16]. К тому же заболевание затрагивает все возрастные группы, в т.ч. и детей [16]. Истинные данные о распространенности НАСГ немногочисленны, что обусловлено его мало- и бессимптомным течением. Пациенты редко предъявляют жалобы, или они не специфичны даже на далеко зашедшей стадии болезни. Часто возможность развития НАСГ обсуждается при обнаружении повышения уровня трансаминаз, выявлении гепатомегалии во время осмотра или по данным визуализирующих методов [17]. Повышение эхогенности печени при ультразвуковом исследовании (УЗИ) выявлено у 14% из 2574 случайным образом отобранных жителей Японии. Поскольку УЗИ позволяет выявить только отложение жира, но не воспаление, то не все эти случаи можно считать НАСГ [16]. Также при избыточной массе тела возможно несовпадение заключений УЗИ, проводимых разными специалистами, ввиду увеличения толщины подкожного жирового слоя, что влечет за собой технические трудности при выполнении исследования и затрудняет оценку эхогенности печени [2]. Окончательный диагноз НАСГ можно поставить только по результатам биопсии печени. По данным аутопсий, НАСГ встречается в 18,5% случаев ожирения и у 2,7% здоровых лиц. В США у 20% клинически здоровых доноров печени выявлена жировая инфильтрация, у 7,5% – НАСГ. В Японии жировая инфильтрация выявлена у 9,2% доноров печени [16]. Гистологически жировая дистрофия печени проявляется в виде макровезикулярных жировых отложений в гепатоцитах и инфильтрации печеночной ткани нейтрофилами и мононуклеарными клетками, в отдельных далеко зашедших случаях могут присутствовать признаки фиброза или цирроза. Среди лабораторных показателей, чаще всего изменяющихся при НАСГ, наиболее часто встречается увеличение в 2–3 раза активности аланинаминотрансферазы (АЛТ) и аспарагиновой трансаминазы (АСТ). По отношению АСТ/АЛТ в большинстве случаев можно дифференцировать НАСГ (<1) и алкогольное поражение печени (<2). Уровень билирубина обычно нормальный, в 12–17% случаев его уровень повышается. В 39–59% случаев умеренно повышается активность щелочной фосфатазы, реже снижается содержание альбумина и протромбина в крови. Возможен гемосидероз с повышением содержания железа в крови. При первичном НАСГ часто развиваются изменения иммунологических показателей, сходные с таковыми при аутоиммунном гепатите. Например, в 13–30% случаев выявляют гипергаммаглобулинемию. Хотя антител к гладким мышцам не выявляют, в 40% случаев появляются ANA в титре 1:40 – 1:320. Почти в 20% случаев развивается гиперлипидемия (за счет триглицеридов и холестерина (ХС)). Нарушения обмена липопротеинов (особенно гиперлипидемия IV типа) нередко (в 54% случаев) наблюдаются при избыточной массе тела (на 50–200% выше нормы); обычно эти нарушения сочетаются с НАСГ при менее выраженном фиброзе. В 58% случаев нарушаются показатели обмена железа (повышение уровня ферритина и насыщения трансферрина в плазме). Даже при повышении содержания ферритина в плазме в 5 раз гистологические признаки гемохроматоза не развиваются. Поскольку обычные показатели функции печени неспецифичны, их определение не имеет значения при диагностике НАСГ и его дифференциации с невоспалительной жировой инфильтрацией печени [16]. Лечение Лечение НАСГ эмпирическое, общепринятых методов нет. Общими рекомендациями признаются соблюдение гипокалорийной диеты, борьба с гиподинамией. Лабораторные и гистологические нарушения, а также размеры печени при постепенном снижении массы тела могут уменьшаться. Однако улучшение возможно даже на фоне сохраняющегося ожирения. Также было замечено, что быстрое снижение массы тела сопровождается прогрессированием НАСГ. К тому же отдаленное положительное влияние снижения массы тела оценить трудно, поскольку для этого необходимо поддерживать сниженную массу тела, а больным НАСГ и ожирением это удается редко. При декомпенсированном ЦП в рамках НАСГ эффективна трансплантация печени, но НАСГ в трансплантате может рецидивировать, особенно на фоне увеличения массы тела и дислипидемии. Данные динамического наблюдения после трансплантации печени при НАСГ немногочисленны, но его рецидивирование описано уже через 6–10 нед. [16]. Для лекарственной терапии применяют препараты различных фармакологических групп. Учитывая роль инсулинорезистентности в патогенезе НАСГ, актуально использование бигуанидов и тиазолидиндионов, эффекты которых обусловлены уменьшением глюконеогенеза и синтеза липидов в печени, повышением чувствительности к инсулину,что способствует тем самым уменьшению ожирения. Используются препараты, содержащие эссенциальные фосфолипиды, которые являются основными элементами в структуре оболочки клеточных органелл печени и оказывают нормализующее действие на метаболизм липидов, белков [18]. В небольших и непродолжительных исследованиях было показано, что прием α–токоферола (витамина Е), сочетания лецитина, витамина С и низких доз витамина Е, β-каротина, селена, витаминов группы В несколько улучшает показатели функции печени [16]. За последнее время наибольшая лечебная эффективность при НАСГ выявлена у препаратов урсодезоксихолевой кислоты (УДХК). В пилотных исследованиях применение УДХК (в дозе 13–15 мг/кг/сут) в течение 12 мес. сопровождалось значительным улучшением показателей печеночных тестов, липидного обмена, уменьшением явлений стеатоза печени без существенного снижения массы тела [19, 20]. УДХК является эпимером хенодеоксихолевой кислоты, образующейся под действием бактериальных ферментов, и представляет собой гидрофильную, не обладающую цитотоксичностью желчную кислоту. Она является наименее агрессивной желчной кислотой – естественным компонентом желчи человека и содержится в количестве 1–5% от общего количества желчных кислот. Многочисленные экспериментальные, а также проводимые клинические исследования позволяют выделить многообразные свойства и эффекты УДХК. Гепатопротективный эффект развивается за счет того, что УДХК способна встраиваться в фосфолипидный слой клеточной мембраны, что способствует ее стабильности и повышению устойчивости к повреждающим факторам. Антихолестатический эффект определяется вытеснением пула токсичных гидрофобных желчных кислот за счет конкурентного захвата рецепторами в подвздошной кишке из энтерогепатической циркуляции; стимуляцией в гепатоцитах экзоцитоза, что приводит к уменьшению концентрации гидрофобных желчных кислот; индукцией бикарбонатного холереза, что усиливает выведение гидрофобных желчных кислот в кишечник. Описываются также иммуномодулирующие свойства (за счет уменьшения экспрессии молекул HLA I класса на гепатоцитах и HLA II класса на холангиоцитах и снижения продукции провоспалительных цитокинов), литолитический (за счет снижения литогенности желчи вследствие формирования жидких кристаллов с молекулами ХС) и гипохолестеринемический (ухудшает процессы всасывания ХС в кишечнике, его синтеза в печени и экскреции в желчь) эффекты [21–23]. Положительное влияние УДХК на биохимические показатели цитолиза и холестаза при НАСГ описаны во многих исследованиях [24, 25], а многообразные эффекты УДХК определяют применение препарата при широком спектре заболеваний печени [23, 26]. В настоящее время на российском рынке появился новый препарат УДХК Холудексан (World Medicine, Великобритания), каждая капсула которого содержит 300 мг УДХК. Нарастающий интерес к препаратам УДХК, в частности к Холудексану, не случаен, поскольку его фармакотерапевтический эффект многообразен. Особенную ценность приобретают свойства Холудексана у коморбидных сосудистых больных, число которых год от года растет. Так, эффективность применения УДХК при НАСГ у больных ишемической болезнью сердца (ИБС) была отмечена в нескольких исследованиях [27, 29]. В исследовании, проведенном в 2006 г. на Украине, изучали функциональное состояние печени больных ИБС в сочетании с НСАГ, получавших гиполипидемическую терапию статинами и УДХК (Холудексан 300 мг) в течение 3-х мес. Было отмечено снижение уровня общего ХС на 23–24%, триглицеридов – на 40–41%, липопротеинов низкой плотности – на 35–36%, ЛПОНП – на 25%, индекса атерогенности – на 13–14%, повышение уровня липопротеинов высокой плотности – на 42%. Значительное снижение активности АЛТ (на 56%) наблюдали у больных, получавших статины и УДХК [28]. Полученные результаты исследования эффективности УДХК (Холудексан 300 мг) и статинов при НАСГ и ИБС указывают на обоснованность применения препаратов с целью достижения гиполипидемического и цитопротективного эффекта, а также отсутствие нежелательных реакций при их сочетании. Кроме этого, несмотря на относительно доброкачественное течение НАСГ, в половине случаев отмечают прогрессирование патологического процесса и изредка формирование ЦП, назначение УДХК у больных ИБС и гиперлипидемией является обоснованным [30]. Итак, УДХК (Холудексан 300 мг) в сочетании со статинами, вероятно, оказывает потенцирующее гиполипидемическое действие, приводящее к нормализации липидного спектра у больных ИБС и НСАГ. Вместе с тем на фоне сочетания препаратов не происходит ухудшения метаболической функции печени, обусловливающего отмену лечения статинами. Холудексан назначают внутрь 1 р./сут перед сном или 2 р./сут. Капсулу проглатывают целиком, не разжевывая, запивая достаточным количеством жидкости. При лечении хронических заболеваний печени в дозе 10–15 мг/кг/сут продолжительность лечения составляет от нескольких месяцев до 2 лет. Необходимо отметить, что, в отличие от других препаратов УДХК, Холудексан имеет более удобную дозировку – 300 мг. Как написал в своей статье Л. Васильев (2008): «Посмотрим правде в глаза: в производстве любого лекарства стоит рассчитывать не на добросовестного, а на ленивого пациента, и чем меньшее число капсул в сутки ему будет нужно принимать, тем больше шансов, что он пройдет курс лечения до конца» [31]. Можно добавить, что преимущество дозировки в 300 мг заключается и в удобстве расчета дозы препарата на 1 кг веса больного в зависимости от диагноза (при НАСГ Холудексан применяют из расчета 13–15 мг/кг/сут от 6 мес. до нескольких лет). Таким образом, спектр фармакотерапевтических эффектов Холудексана широк и, естественно, не ограничен НАСГ. Показаниями к назначению Холудексана помимо НАСГ являются: неосложненная желчнокаменная болезнь (билиарный сладж; растворение холестериновых желчных камней в желчном пузыре при невозможности их удаления хирургическим или эндоскопическим методами; профилактика рецидивов камнеобразования после холецистэктомии); хронический активный гепатит; токсические (в т.ч. лекарственные) поражения печени; АБП; первичный билиарный ЦП; первичный склерозирующий холангит; муковисцидоз; атрезия внутрипеченочных желчных путей, врожденная атрезия желчного протока; дискинезии желчевыводящих путей с доказанной эффективностью УДХК при всех этих заболеваниях. Литература 1. Ludwig J., Viggiano T.R. Non–alcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease // Mayo Clin Proc. 1980. Vol. 55. Р. 434–438. 2. Буторова Л.И. Неалкогольная жировая болезнь печени как проявление метаболического синдрома: эпидемиология, патогенез, особенности клинического проявления, принципы диагностики, современный возможности лечения. М., 2012. 3. Карнейро де Мур М. Неалкогольный стеатогепатит // Клинические перспективы в гастроэнтерологии, гепатологии. 2001. № 2. С. 12–15. 4. Фадеенко Г.Д. Жировая печень: этиопатогенез, диагностика, лечение // Сучасна гастроентерологія. 2003. № 3(13). С. 9–17. 5. Северов М. Неалкогольная жировая болезнь печени // Врач. 2002. № 10. С. 23–26, 1212. 6. Bellentani S., Tinbelli C. Epidemiology and risk factors for fatty liver. In: Leuschner U. James OFW, Dancygier H (eds.). Steatohepatitis (NASH and ASH), Kluwer Academic Publishers, Dordrecht, 2001, 3–10. 7. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей (пер. с англ.). М., 1999. С. 486–497. 8. Яковенко Э.П., Григорьев П.Я., Агафонов Н.А., Яковенко А.В. и др. Метаболические заболевания печени: проблемы терапии // Фарматека. 2003. № 10. С. 47–52. 9. Bellentani S., Saccoccio G., Masutti F. et al. Prevalence of and risk factors for hepatic steatosis in northern Italy // Ann Intern Med. 2000. Vol. 132. Р. 112–117. 10. Chitturi S., Abeygunaskera S., Farrell G.C et al. NASH and insulin resistance: insulin hepersecretion and specific association with the insulin resistance Syndrom // Hepatology. 2002. N 35. P. 373–379. 11. Neuschwander-Tetri B.A., Caldwell S.H. Nonalcoholic steatohepatitis: summary of an AASLD Single topic Conference // Hepatology. 2003. N 37. P. 1202–1219. 12. Sanyal A.J., Campbell-Sargent C., Mirshahi F., Rizzo W.B. et al. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnor-malities // Gastroenterology. 2001. N 20. P. 1183–1192. 13. Oneta C.M., Dufour J.F. Non-alcoholic fatty liver disease: treatment options based on pathogenic considerations // Swiss Med.Wkly. 2002. N 132. P. 493–505. 14. Буеверов А.О. Гепатиты. Рациональная диагностика. М.: ГЭОТАР-Медиа, 2010. 15. Tilg H., Diehl A.M. Cytokines in alcoholic and nonalcoholic steatohepatitis // N. Engl. J. Med. 2000. N 343. P. 1467–1476. 16. МакНелли П.Р. Секреты гастроэнтерологии (изд-е 2-е). М.: Бином, 2005. 17. Павлов Ч., Бакулин И. Неалкогольный стеатогепатит: клинические особенности и принципы лечения // Врач. 2007. № 10. С. 24–28. 18. Степанов Ю.М., Филиппова А.Ю. Стеатоз печени и неалкогольный стеатогепатит: современный взгляд на патогенез, диагностику и лечение // Здоровье Украины. 2004. № С. 19. Ceriani R., Brunati S., Morini L. et al. Effect of ursodeoxycholic acid plus diet in patients with nonalcoholic steatohepatitis (Abstract) // Hepatology. 1998. Vol. 28. No. 894. Р. 386. 20. Guma C., Viola L., Thome M. et al. Ursodeoxycholic acid in the treatment of nonalcoholic steatohepatitis: Results of a prospective clinical controlled trial (Abstract) // Hepatology. 1997. Vol. 26. No. 1036. Р. 387. 21. Бакулин И.Г., Сандлер Ю.Г. Возможности применения гепатопротекторов в практике врача-терапевта // Consilium medicum. 2010. Т. 12. № 8. 22. Рациональная фармакотерапия заболеваний органов пищеварения / под общей ред. В.Т. Ивашкина. М.: Литтерра, 2007. 23. Буеверов А.О. Возможности клинического применения урсодезоксихолевой кислоты // Consilium medicum. 2005. № 7 (6). 24. Holoman J., Glasa J., Kasar J. et al. Serum markers of liver fibrosis in patients with non-alcocholic steatohepatitis (NASH). Correlation to morphology and effect of therapy // J Hepatol. 2000. Vol. 32. Р. 210. 25. Надинская М.Ю. Исследование применения урсодезоксихолевой кислоты в гепатологии с позиции медицины, основанной на научных доказательствах // Consilium medicum. 2003. № 6. С. 318–322. 26. Lazaridis K.N., Gores G.J., Lindor K.D. Ursodeoxycholic acid mechanisms of action and clinical use in hepatobiliary disorders // J Hepatol. 2001. Vol. 35. Р. 134–146. 27. Федоров И.Г., Байкова И.Е., Никитин И.Г., Сторожаков Г.И. Неалкогольный стеатогепатит: клиника, патогенез, диагностика, лечение // РМЖ. 2004. № 2. С. 46–49. 28. Долженко М.Н. Пациент с ишемической болезнью сердца и хроническим стеатогепатитом: как проводить гиполидемическую коррекцию? // Украинский медицинский журнал. 2007. № 1 (57). 29. Шипулин В.П., Долженко М.Н. Хронический стеатогепатоз: проспективное исследование функционального состояния сердечно-сосудистой системы // Крымский медицинский журнал.2006. № 3. С. 12–16. 30. Рациональная фармакотерапия заболеваний органов пищеварения / под ред. В.Т. Ивашкина, Т.Л. Лапиной. М.: Литерра, 2006. 552 с. 31. Васильев Л. Здоров как …медведь // Аптекарь. 2008. № 1.
Почему болезнь называют коварной? Нет ни признаков, ни симптомов
Заболевание очень долгое время (а иногда и вовсе) не проявляется никакими симптомами. И теми, что испытывает сам пациент, и которыми врач мог бы обнаружить во время осмотра больного (признаки).
При простом стеатозе, если появляются симптомы, они очень неспецифичны, то есть они также могут возникать при ряде других заболеваний, помимо НАЖБП. Специалисты обычно сообщают о двух таких симптомах:
- утомляемость;
- слабая, обычно тупая боль в правом верхнем углу живота.
Состояние похоже на другие «прогрессирующие» заболевания: гипертонию и диабет типа 2. Но в отличие от неалкогольной жировой болезни печени, эти заболевания обычно не дают осложнений, прежде чем их можно будет диагностировать.
В случае НАСГ, т.е. более опасной формы НАЖБП, при которой возникают дегенерация и фиброз печени), симптомы могут быть более характерными. Чаще, чем при простом стеатозе появляются:
- тупая или ноющая боль в правом верхнем отделе живота;
- более интенсивное чувство усталости, иногда это может быть сильная усталость;
- необъяснимая потеря веса;
- слабость.
Осложнение НАСГ – цирроз печени, также сопровождается рядом симптомов:
- желтухой, т.е. пожелтением кожи и белков глаз;
- кожным зудом;
- отеком всей ноги или ограниченным отеком вокруг лодыжек или ступней;
- тошнотой, потерей аппетита и / или потерей веса;
- увеличением живота из-за скопления жидкости (асцит);
- спутанностью сознания.
Асцит
Но повторим еще раз – эти симптомы появляются поздно и касаются не самого распространенного «простого» жирового стеатоза, а более опасной формы – НАСГ и цирроза печени.
Как диагностируется НАЖБП?
Возникает вопрос, как вообще обнаружить это заболевание, так как в большинстве случаев оно протекает бессимптомно.
НАЖБП диагностируется в основном на основании УЗИ брюшной полости, в том числе печени. Интересно, что ожирение печени в большинстве случаев обнаруживается именно случайно, когда УЗИ проводится по другим причинам, например, для выявления камней в желчном пузыре или при диагностике боли в животе.
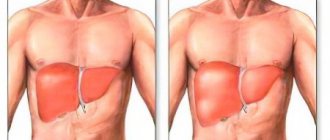
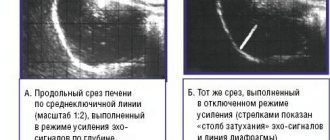
Жирная печень очень характерна на ультразвуковом изображении. Рентгенологи говорят, что печень «светится» на экране, она гиперэхогенная (ее эхо больше, чем у окружающих тканей).
Важно понимать, что ожирение печени также может возникать при других состояниях или заболеваниях, например, при злоупотреблении алкоголем, приеме определенных лекарств или гепатите С.
Раннее обнаружение жировой ткани с помощью ультразвука очень важно. Ранняя диагностика НАЖБП помогает не допустить обострения заболевания – НАСГ, а также предотвратить развитие осложнений, важнейшим из которых является цирроз печени. Поэтому гастроэнтерологи рекомендуют регулярно проходить УЗИ печени (брюшной полости), даже если нет симптомов. Особенно это касается пациентов из групп риска.
УЗИ печени (брюшной полости)
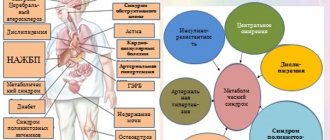
Группа или фактор риска – это статистическое понятие, ограничивающее группу людей с определенным состоянием или заболеванием, где вероятность возникновения определенного заболевания (в нашем случае НАЖБП) выше, чем в общей популяции. Следовательно, если риск развития неалкогольной жировой болезни печени у всего населения составляет 20-25%, то при сахарном диабете 2 типа этот показатель достигает 75%. Следовательно, диабет 2 типа является фактором риска развития НАЖБП.
Согласно европейским рекомендациям, ультразвуковое исследование брюшной полости следует обязательно проводить людям с:
- ожирением;
- факторами риска нарушения метаболизма – увеличение окружности талии, гипергликемия [повышение уровня сахара в крови], гипетриглицеридемия [повышение уровня триглицеридов в крови], снижение холестерина ЛПВП, гипертония;
- стойкое повышение аланинаминотрансферазы (АЛТ).
1.Общие сведения
Стеатоз, или жировая инфильтрация – скопление липидных соединений в гепатоцитах (паренхиматозных, функционально специализированных клетках печени). Гепатит – воспалительный процесс в печени. Соответственно, стеатогепатит – заболевание, сочетающие признаки и закономерности обоих патологических процессов. Уточнение «неалкогольный» (син. «псевдоалкогольный», «диабетический» и пр.) необходимо потому, что гистологическая картина неалкогольного стеатогепатита (НАСГ) идентична жировому перерождению клеток печени у алкоголиков, однако развивается у лиц, в отношении которых достоверно известно отсутствие злоупотреблений такого рода.
Данная нозологическая единица была выделена сравнительно недавно (1980) и активно исследуется гепатологами по всему миру, поскольку по сей день не прояснены многие вопросы. Накоплен, однако, достаточно обширный статистический материал. В частности, известна выраженная эндемичность (региональная зависимость) заболеваемости НАСГ: если в Японии его распространенность в общей популяции чуть более 1%, то в странах Запада, по разным оценкам, частота встречаемости колеблется от 7% до 11%. Достоверно установлено также, что вероятность «запуска» стеатогепатитного процесса зависит от возраста (в категорию риска попадают лица 45-55 лет) и от пола (женщины болеют втрое чаще).
Следует понимать, что приведенные данные являются сугубо статистическими тенденциями, хотя и достаточно сильными; в реальной клинической практике НАСГ обнаруживается у пациентов любого пола и возраста.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
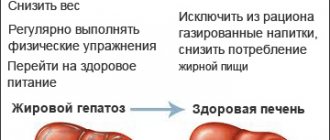
Как лечить НАЖБП?
Чудодейственного лекарства от этой болезни не существует. Чтобы жировая ткань регрессировала, необходимо соблюдать соответствующую низкокалорийную диету и регулярно заниматься физической активностью не менее 5 дней в неделю по 30 минут в день.
Регулярные занятия физической активностью
Очень важно постоянно наблюдаться у гастроэнтеролога, чтобы не пропустить осложнения.
4.Лечение
Общепризнанный и универсально-эффективный протокол лечения НАСГ на сегодняшний день не выработан. Однако в данном случае этиопатогенетической терапией (нацеленной на устранение первопричин заболевания) чаще всего оказывается устранение приведенных выше факторов риска.
Так, назначается индивидуально разрабатываемая диета и принимаются другие меры по постепенной нормализации массы тела. Отменяется прием или, при необходимости, подбирается альтернатива потенциально опасным для печени медикаментов, которые объективно показаны пациенту. Назначаются гепатопротекторы, по показаниям – антибиотики, статины и др. препараты.
Важные правила диеты при неалкогольной жировой болезни печени
Чего следует избегать в диете:
- Исключите насыщенные жиры и красное мясо, жирные молочные продукты.
- Важен отказ от транс- и гидрогенизированных (затвердевших) жиров, сахара, алкоголя.
- Исключите все продукты из переработанного зерна (то есть не используйте в своем рационе белую муку или белый рис).
Обязателен контроль содержания натрия в рационе – не превышайте 1500 мг поваренной соли в день.
Контроль содержания натрия в рационе
Будьте осторожны с добавками и лекарствами, многие имеют противопоказания при заболеваниях печени. Перед их приемом нужно обязательно проконсультироваться с гастроэнтерологом.
Полезные продукты для пациентов, больных неалкогольной ЖБП:
- Оливковое масло первого холодного отжима – для жарки и по три столовые ложки в день внутрь.
- Фрукты и овощи (но следите за содержанием соли!).
- Продукты с высоким содержанием клетчатки, такие как цельнозерновой хлеб и коричневый рис.
- Жирная рыба несколько раз в неделю.
- Курица без кожи и только нежирная свинина.
- Белок растительный (бобовые) без ограничений.
- Кофе – не более 3 чашек фильтрованного кофе в день.
Источники
- Хартлеб М., Вунш Э. и др.: Ведение пациентов с неалкогольной жировой болезнью печени.
- Gundermann KJ et al. Активность незаменимых фосфолипидов (EPL) сои при заболеваниях печени.
ОНЛАЙН-ЗАПИСЬ в клинику ДИАНА
Вы можете записаться по бесплатному номеру телефона 8-800-707-15-60 или заполнить контактную форму. В этом случае мы свяжемся с вами сами.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter