Кандидоз кишечника. Причины
Считается общепризнанным, что желудочно-кишечный тракт является основным эндогенным резервуаром Candida, откуда происходит последующее распространение инфекции по организму. Candida albicans относится к условно-патогенной флоре и является компонентом нормальной микрофлоры кишечника. Определение в бактериологическом анализе кала наличия Candida albicans в 10х4 степени по официальным требованиям не является показанием для выставления диагноза «кишечный кандидоз» и тем более для противогрибковой терапии. На практике клиницисту приходится сталкиваться с кандидоносительством, которое наблюдается в кишечнике до 80 % и лучше, чтобы Candida находилась ниже уровня определения в анализе (0).
Факторы риска развития кандидозной инфекции разнообразны, они обусловлены и различными заболеваниями органов и систем организма, при которых развиваются признаки нарушенной микрофлоры кишечника, в частности при сахарном диабете, онкопатологии, воспалительных заболеваниях кишечника (болезнь Крона и неспецифический язвенный колит), синдроме раздраженной кишки, анемии, СПИДе, снижении иммунной защиты, стрессах. Проводимая терапия по поводу основных заболеваний также может способствовать развитию нарушений микробиоценоза кишечника и избыточному росту кандид – это применение в лечении цитостатиков, иммуносупрессоров, лучевой терапии, антибиотиков, хирургических вмешательств.
Имеют значение в возникновении избыточного роста грибов рода кандид и физиологические периоды жизни человека, период новорожденности, беременности, менопаузы, старческий возраст, и ухудшение экологических условий, которые снижают антиинфекционную резистентность человека, что приводит к нарушению баланса между нормальной флорой и иммунным ответом организма. (Бурова С.А.,Курбатова И.В.,2006). Все причины, которые были описаны выше, при которых развивается нарушение микробиоценоза желудочно-кишечного тракта, могут привести к кандидозу. Следует выделить наиболее значимые состояния – это операции на желудке, нарушения секреторной и моторных функций желудка и кишечника, дивертикулез тостой кишки, цирроз печени.
Важным представляется для развития дисбиоза желудочно-кишечного тракта нерациональное питание и, в частности, содержащиеся в пище и добавках стероиды, пищевая непереносимость.
Отчего возникает болезнь
В небольшом количестве дрожжеподобные грибки рода Кандида присутствуют в организме любого человека. Однако при возникновении иммунодефицита начинается их активный рост, защитные силы организмы не справляются, и возникает болезнь.
Привести к снижению иммунитета могут различные причины. Однако самым главным виновников является неправильный или нецелесообразный прием антибиотиков. Они уничтожают «хорошие» микроорганизмы в кишечнике, которые стоят на страже здоровья человека. Без них защита слабеет, и инфекция берет вверх.
Также существуют негативные факторы, которые способны спровоцировать заболевание. Их разделяют на 2 большие группы:
- Внешние.
Благодаря им, инфекция проникает в организм через поврежденную кожу (ожоги, порезы, трещины). Например, поражение слизистой оболочки рта может возникнуть из-за плохой гигиены, пародонтита, неправильно подобранных протезов.
- Внутренние (эндогенные).
К ним относятся заболевания, которые приводят к снижению иммунитета, а также врожденное состояние иммунодефицита. Это авитаминоз, гормональные сбои, нарушения обмена веществ, анемия, хронические патологии ЖКТ, сахарный диабет.
Признаки кандидоза могут появиться из-за частого воздействия на кожу или слизистые оболочки химических веществ. Привести к болезни также могут прием гормональных контрацептивов, злоупотребление алкоголем, курение, неблагоприятная экология в месте проживания и частые стрессы.
Кандидоз кишечника. Показания к обследованию
Показаниями к проведению обследования желудочно-кишечного тракта для исключения грибковой инфекции должны быть следующие:
- наличие 2 факторов риска возможного возникновения кандидоза,
- двойная поверхностная колонизация кандид,
- наличие причин, которые могут привести к нарушению микрофлоры желудочно-кишечного тракта с избыточным ростом грибов рода Candida.
- лихорадочные состояния неясного генеза, резистентные к антибиотикотерапии,
- кожные и аллергические заболевания, т.к. кандиды являются триггером для аллергических заболеваний и фактором, благоприятствующим их развитию.
Алгоритм диагностики нарушений микрофлоры кишечника с избыточным ростом Candida flbicans:
- Анализ анамнеза, выявление факторов риска ,
- анализ клинических данных,
- микробиологический и газохроматографический методы исследования нарушений микрофлоры кишечного тракта (различных биологических сред),
- мазки- отпечатки со слизистых оболочек рта и пищевода,
- при подозрении на системный кандидоз необходимо провести посевы крови и биологических жидкостей и тканей на наличие грибковой инфекции,
- серологическая диагностика и оценка эффективности лечения по уровням антител к кандидам,
- маркеры воспаления (лизоцим, а-антитрипсин, эластаза),
- секреторный иммуноглобулин А, позволяющий оценить степень активности ассоциированной с кишечником иммунной системы,
- иммунологический статус (скрининговый) 1 уровня.
Все лабораторные данные должны оцениваться и анализироваться в совокупности с клинической текущей ситуацией пациента.
Как диагностируют заболевание
Визуальные методы диагностики кандидоза. При осмотре выявляются воспаление участков кожи, ограниченное бордюром отслаивающегося, мацерированного эпидермиса, белесоватый налет на слизистых оболочках.
Лабораторная диагностика. Вопреки распространенному мнению, главным методом диагностики кандидоза до сих пор является микроскопия мазка с пораженных участков слизистой. ПЦР (ДНК — диагностика), популярная в последнее время, как правило, плохо подходит для диагностики кандидоза.
Лабораторная диагностика заболевания включает в себя:
- микроскопию мазка выделений
- культуральную диагностику (посев)
- иммуно-ферментный анализ (ИФА)
- полимеразная цепная реакция (ПЦР).
Кандидоз кишечника. Симптомы
Нарушения микробиоценоза кишечника с избыточным ростом грибов рода кандид или кандидозный дисбактериоз клинически проявляется бродильной диспепсией, болями в животе, больше в области сигмы, метеоризмом, отмечается частый обильный пенистый жидкий стул со слизью до 6-10 раз в сутки, сопровождается нарушениями витаминного обмена, субфебрильной температурой, выраженной слабостью, головной болью. Нередко наблюдаются симптомы поражения слизистых оболочек в виде стоматита, глоссита, вульвовагинальной молочницы. Грибковая инфекция резко снижает иммунитет, что приводить к более глубокому процессу развития висцерального кандидомикоза с поражением верхних дыхательных путей, легких, мочеполовой и пищеварительной систем. В крови – умеренный лейкоцитоз, ускоренное СОЭ, при сигмоскопии – катаральный геморрагический проктосигмоидит.
Показания к терапии при условии клинического, микробиологического, серологического или гистологического подтверждения кандидозной инфекции, обнаружение кандид с клиническими проявлениями с двух и более поверхностей колонизации грибов.
Как выглядит «молочница» во рту – ее симптомы у взрослых
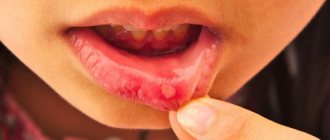
После того, как Кандиды прикрепляются к слизистой оболочке, они размножаются и «прорастают» вглубь нее2, вызывают воспаление, отек и покраснение. Возникают ощущение «ошпаренного рта» и дискомфорт при приеме пищи и глотании. Возможны изменение вкуса и появление металлического, кислого, соленого или горького привкуса1.
Размножение грибка приводит к появлению на деснах, языке, внутренней поверхности щек и небе мелких белых пятен, напоминающих створоженное молоко или крупинки манной каши. Увеличиваясь в размерах, «крупинки» превращаются в бляшки, которые, в свою очередь, сливаются, образуя сплошные белые пленки.
Если бляшки и пленки снять шпателем или ватной палочкой (для этого не требуются дополнительные усилия), то под ними обнаруживается ярко-красная воспаленная эрозированная слизистая оболочка.
Оральный микоз может распространяться на красную кайму губ, вызывая ее покраснение, сухость и шелушение. В уголках рта появляются заеды: кожа воспаляется, покрывается серовато-белыми чешуйками и растрескивается5.
Если не лечить кандидоз на этом этапе, грибы «перебрасываются» на язык и глоточные миндалины.
При поражении языка развивается глоссит — язык отекает, его сосочки сглаживаются, характерный белый налет появляется на его спинке и боковых поверхностях1, — а при поражении глоточных миндалин возникает ангина.
Вызванная грибковой микрофлорой ангина сильно отличается от обычной. При явном воспалении миндалин и наличии на них белых пленок и пробок, температура и боль при глотании отсутствуют, а подчелюстные лимфоузлы остаются обычных размеров1.
Кандидоз способен распространяться и дальше — поражать дыхательные пути, вызывать воспаление легких и заражение крови, поэтому важно остановить процесс в самом начале.
Наверх к содержанию
Локализация Candida
Следует отметить, что кандиды поражают прежде всего многослойный плоский эпителий полости рта и пищевода и реже однослойный цилиндрический эпителий кишечника. Вследствие этого грибы рода Candida вызывают инвазивное поражение в верхних отделах желудочно-кишечного тракта и колонизацию (адгезию) в отделах, расположенных ниже желудка. В то же время, в кишечнике даже на стадии адгезии могут появляться клинические симптомы, рассмотренные выше как признаки неинвазивного кандидоза. (Бурова С.А.,2006). Следовательно, среди всех локализаций кандидоза пищеварительного тракта на первом месте стоит орофарингеальный кандидоз, далее кандидозный эзофагит, кандидоз желудка (часто его можно заподозрить при неэффективной хеликобактерной терапии и длительном заживлении язвенного дефекта), кандидоз кишечника, который надо отдифференцировать от псевдомембранозного колита, вызываемого Clostridium difficile и острого процесса в кишечнике, вызванного ротовирусами и Escherichia coli.
Факторы риска по кандидозу слизистых оболочек
Дефекты в кратко описанной выше системе антифунгальной резистентности являются факторами, способствующими возникновению кандидоза, или т. н. факторами риска. Группы риска по развитию кандидоза пищеварительного тракта представлены ниже: • физиологические иммунодефициты (ранний детский период, старческий возраст, беременность); • генетически детерминированные иммунодефициты (например, селективный дефицит IgA); • ятрогенные иммунодефициты – (например, последствия лечения глюкокортикостероидами, иммунодепрессантами, антицитокиновая, лучевая и полихимиотерапия); • заболевания эндокринной системы (например, сахарный диабет, аутоиммунный полиэндокринный синдром, гипотиреоз); • дисбиоз слизистых оболочек после антибиотикотерапии; • СПИД; • хронические “истощающие” заболевания (например, цирроз печени); • нарушения нутритивного статуса (например, голодание и авитаминозы).
В указанных группах кандидоз выявляют чаще обычного. Отметим, что иногда явную причину нарушения антифунгальной резистентности определить не удается.
Кандидоз кишечника. Терапия
Терапевтические подходы к лечению дисбиоза желудочно-кишечного тракта с избыточным ростом грибов рода Candida включают в себя следующие моменты:
- Рациональное питание с исключением сахара, и употребления сложных углеводов, продуктов, обладающих пребиотическими свойствами, продукты–пробиотики.
- Противогрибковые препараты.
2.1.Полиеновые антибиотики (нистатин, натамицин, леворин).
- Нистатин наиболее целесообразно применять при наличии кандид в пищеводе, желудке и практически не эффективен при локализации кандид в кишечнике, что делает его также не эффективным при профилактическом назначении препарата одновременно с лечением антибиотиками.
- Пимафуцин (натамицин) — наиболее эффективный препарат при избыточном росте Candida в кишечнике. Препарат обладает противогрибковым (фунгицидным) действием. Взаимодействует со стеролами клеточных мембран грибов, нарушая их структуру и функцию и вызывают их гибель. Активен в отношении многих патогенных дрожжевых грибов, особенно Candida albicans. Резистентности к натамицину не отмечается. При кандидозе кишечника назначается по 1 табл. 4 раза в день после еды 7-10 дней .
2.2. Производные триазола (флюканазол, Дифлазон, Дифлюкан, Микосист, Флюкостат, румикоз, интраконазол, тербизил и др.), производные каспофунгина – Кансидас (для введения препарата), Ноксафил (позаконазол) суспензия для приема внутрь.
2.3. МПХ (медьпроизводное хлорофилла) – растительный антисептик из бурых водорослей, природный иммуномодулятор за счет стимуляции фагоцитоза и активности катионов меди, усиленных влиянием спирта, обладает бактерицидным действием в отношении стафилококков, стрептококков, пневмококков, грибов, гнилостных бактерий и кишечной палочки и противовирусным действием. МПХ защищает и стимулирует кроветворение, противовоспалительное действие обусловлено превосходным комплексом микроэлементов. Назначается врачом внутрь по 1 капле на 5 кг массы тела ежедневно в небольшом количестве воды. Курс лечения 30 дней,
2.4. Цитросепт — растительное противомикробное средство из экстракта семян грейпфрукта, обладающее бактерициднм действием в т.ч. и против грибов рода кандид и хеликобактериоза желудка, способствует усвоению витамина С, содержит биофлавоноиды, укрепляющие сосудистую стенку капилляров и предотвращая тромбообразование и холестериновых бляшек, стимулирует естественную сопротивляемость организма. Назначается каплями, разведенными в воде или соке разными схемами приема в зависимости от заболевания.
2.5. Самоэлиминирующиеся бациллярные препараты (В subtilis, L.bulgaricus) — Флонивин-ИС, Бактисубтил, Споробактерин, биоспорин, Бактиспорин, Гастрофарм и др.
2.6. Saccharomyces boulardi — Энтерол, 1капсула содержит 250 мг Saccaromyces boulardi , подавляет рост условно-патогенной флоры и грибов Candida Krusei, Candida pseudotropical
2.7. Пробиотики – лактосодержащие препараты (Лактобактерин, Гастрофарм, Примадофиллюс, Ацидофиллюс, Нарине и др.)
- Энтеросорбенты.
- Гепатопротекторы (Гептрал, Хофитол, Карсил, препараты расторопши, Флоравит и др.)
- Иммуномодулирующие препараты (Кипферон, Полиоксидоний, Дополан, Мариспан и др.)
КАНДИДОЗ ПИЩЕВОДА
Кандидоз — инфекционное заболевание слизистых оболочек, кожи и внутренних органов, вызванное дрожжеподобными грибами рода Candida. Кандидоз пищевода (КП), являющийся проявлением висцерального кандидоза, занимает видное место среди инфекционных поражений пищевода. В последние годы прослеживается тенденция нарастания частоты КП, особенно у пациентов с нарушением иммунитета. Рост кандидозной инфекции в значительной степени обусловлен увеличением количества больных с ВИЧ-инфекцией, успехами в трансплантологии и иммуносупрессивной терапии, бесконтрольным использованием антибиотиков. КП встречается у 0,7-1,5% больных гастроэнтерологического профиля [5, 6].
Проблема тяжелых грибковых инфекций, вызываемых оппортунистическими патогенами, состоит в том, что они трудно поддаются лечению и могут приводить к летальному исходу. Было обнаружено, что смертность при инвазивных кандидозных инфекциях составляет 34% [16].
Этиопатогенез. Различные виды Candida представляют собой наиболее часто встречающийся пищеводный патоген, прежде всего это касается Candida albicans, иногда встречаются C. tropicalis, C. parapsilosis, C. glabrata, C. lusitania и C. krusei. Эти микроорганизмы являются нормальными компонентами оральной флоры, и их рост сдерживается бактериальными комменсалами. Заражение грибами типа Candida, которые широко распространены в окружающей среде, происходит эндогенным или экзогенным путем. Эндогенное заражение связано с активированием грибов-сапрофитов; экзогенное инфицирование может произойти при прямом контакте с носителями инфекции или из окружающей среды. Если организм хозяина не ослаблен, многие грибы не проявляют своих патогенных свойств. Исследования последних лет показали, что источником диссеминации грибов служит кишечник, а кандидоз полости рта, гениталий, пищевода является проявлением системного кандидоза. Вероятность развития системного поражения зависит как от свойств самого микроорганизма (их количества, вирулентности, генетической и видовой неоднородности популяции), так и от состояния макроорганизма, особенно его иммунной системы, алиментарного статуса и абдоминального кровотока [3, 17].
Благоприятные условия для развития инфекционного процесса создают различные нарушения физиологических, анатомических и иммунологических механизмов защиты организма. В качестве факторов, провоцирующих возникновение эзофагеального кандидоза, можно назвать использование антибиотиков, ингаляционных или инъекционных кортикостероидов, антацидную терапию или гипохлоргидрическое состояние, сахарный диабет, алкоголизм, последствия интоксикации, недоедание, пожилой возраст, нарушение моторики пищевода или пищеводную обструкцию, трансплантацию органов и костного мозга, энтеральное и особенно парентеральное питание и др. Ослабление иммунной системы может привести к возникновению кандидозной инфекции. При сахарном диабете повышенный уровень глюкозы в крови способствует росту грибов, так как гипергликемия ослабляет функцию гранулоцитов. Гипофункция паращитовидных желез и надпочечников приводит к нарушению кальциево-фосфорного обмена, что вызывает скрытую спазмофилию пищевода, тем самым снижая его местные защитные возможности [9]. Нарушения нутритивного статуса из-за недостатка белка в организме и низкой калорийности пищи влияют на состояние иммунной системы и создают предпосылки для развития кандидоза [3]. К факторам риска заболевания кандидозом относится снижение кислотности желудочного сока (рН 7,4 является оптимальной для роста грибов Candida, а при сдвиге рН до 4,5 рост грибов полностью угнетается) [3, 4, 7].
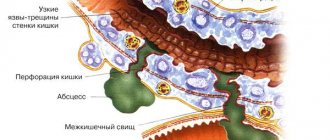
Патологические проявления КП разнообразны. Сначала пораженные участки пищевода имеют вид отдельных беловатых или желтоватых очажков, приподнятых над слизистой оболочкой. Позднее эти очажки могут сливаться, образуя плотные налеты с внедрением гриба в подслизистую оболочку или псевдомембранозные наложения с проникновением гриба в мышечную оболочку и сосуды [9]. Пленки, образующиеся на слизистой пищевода в особенно тяжелых случаях, могут почти полностью закрывать просвет пищевода. Налет состоит из слущенных эпителиальных клеток, которые смешиваются с грибками, клетками воспаления и бактериями. Микроскопическое исследование позволяет выявить равномерно окрашенные дрожжеподобные клетки и нити мицелия грибов Candida [9]. Истинное язвообразование наблюдается нечасто и в большинстве случаев отмечается у иммуносупрессированных больных с гранулоцитопенией [29]. Иногда возникает некроз стенки пищевода и развивается флегмонозное воспаление пищевода и средостения, что может стать одной из причин смерти больного [1].
Существует морфологическая классификация, согласно которой все случаи КП подразделяются на три группы в зависимости от степени тяжести процесса, то есть в зависимости от глубины поражения его стенки: 1-я группа — отдельные беловатые налеты с внедрением псевдомицелия гриба между эпителиальными клетками; 2-я группа — пленчатые налеты, сливающиеся между собой и образующие обширные поля, при этом нити псевдомицелия прорастают не только слизистую, но и подслизистую оболочку; 3-я группа — псевдомембранозные наложения, сочетающиеся с глубокими изменениями, при которых нити гриба глубоко проникают в толщу мышечной ткани [10].
Клинические проявления и осложнения. Симптомы заболевания практически отсутствуют у 25-30% пациентов, страдающих КП, особенно у иммунокомпетентных лиц. Тем не менее большинство пациентов предъявляют жалобы, связанные с поражением желудочно-кишечного тракта. Наиболее типичные клинические проявления КП — дисфагия и несколько реже одинофагия. Степень выраженности пищеводных симптомов колеблется от умеренного затруднения при глотании до резко выраженной боли, результатом чего являются неспособность принимать пищу и развитие вторичной дегидратации. При тяжелой одинофагии возможно наличие других причин или коинфекции, особенно у больных со СПИДом. Гораздо реже больные могут жаловаться на загрудинные боли, не связанные с глотанием, изжогу, тошноту, иногда рвоту с выделением пленок (псевдомембран), снижение аппетита и веса, появление жидкого стула со слизью (см. рисунок) [4, 9, 29].
| Симптомы кандиозного эзофагита (R. S. Orlando, 1996) |
При КП может быть полезно физикальное исследование. Приблизительно две трети пациентов со
СПИДом и пищеводным кандидозом имеют кандидозный стоматит. КП наблюдается у больных с хроническим слизисто-кожным кандидозом, который относится к тяжелым формам кандидозной инфекции и чаще наблюдается при дисфункции надпочечников и околощитовидных желез [29].
Осложнения пищеводного кандидоза наблюдаются редко. Эзофагеальное кровотечение может наблюдаться при тяжелом течении болезни, сопровождающемся образованием эрозий, язв, и ассоциироваться с коагулопатией; возможно развитие перфорации. Описана вторичная обструкция просвета мицетомой. Редко возникает некроз с развитием флегмонозного воспаления пищевода и средостения [1]. В тяжелых случаях специфический эзофагит может осложниться развитием кандидамикозного сепсиса [6].
Диагностика. Подозрение на пищеводный кандидоз должно возникнуть у любого больного при наличии факторов риска развития пищеводной инфекции и жалоб на дисфагию и одинофагию. Наличие кандидозного стоматита подтверждает этот диагноз, но при его отсутствии поражение пищевода также не исключается.
Рентгенография пищевода с использованием бария обычно применяется для начальной оценки перед проведением эндоскопии. Однако на ранних стадиях кандидозного эзофагита рентгенологическое исследование пищевода не имеет большого диагностического значения, так как оно отражает лишь неспецифические изменения, общие для всех эзофагитов [2]. Классическими рентгенологическими признаками острого эзофагита, вызванного Candida spp., являются линейные или неправильной формы дефекты наполнения с четкими краями. При тяжелом течении кандидозного эзофагита происходит слияние повреждений, из-за чего большие дефекты наполнения иногда образуют скопления в виде гроздьев винограда [2]. Пищевод при этом приобретает «косматый» («ворсистый») вид, симулируя ульцерацию [25]. Наличие больших, хорошо очерченных язв не является признаком кандидозного эзофагита. Могут наблюдаться нарушение моторики и сужение просвета пищевода за счет псевдомембран. Следует помнить о том, что нормальная рентгенограмма пищевода с использованием бария не исключает пищеводного кандидоза. Из-за тяжелой одинофагии больной не сможет выпить барий, что затрудняет рентгеногрфию пищевода [29].
Более информативным для диагностики кандидозного эзофагита считается рентгенологический метод двойного контрастирования, эффективность которого достигает 70% [26].
Цитологическая щетка и баллонный катетер используются для быстрой диагностики пищеводных инфекций без эндоскопии. Эти инструменты могут быть легко введены через носовые ходы или рот сквозь защитный зонд, который предотвращает контаминацию. Материал, полученный на защищенной щетке или баллонном катетере после того, как они будут изъяты из пищевода, оценивается цитологически и культурально. Методика с использованием защищенных щеток имеет чувствительность 88% и специфичность почти 100% [26].
Цитологический метод предполагает окраску мазков-отпечатков или осадка смыва с цитологической щетки в поисках активных форм Candida — почкующихся дрожжевых клеток, псевдомицелия и мицелия. Культуральный метод предполагает помещение исследуемого материала на обогащенную глюкозой среду Сабуро или другие среды, чтобы затем по характеру образующихся колоний судить об этиологии инфекционного процесса в пищеводе.
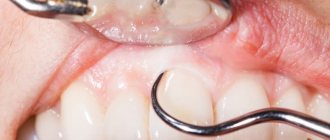
Эндоскопическое исследование пищевода — наиболее чувствительный и специфический метод диагностики пищеводного кандидоза. Эндоскопическая картина КП характеризуется чаще всего наличием легко снимающихся фибринозных рыхлых наложений белого или желтого цвета, под которыми обнаруживается легкоранимая и/или отечная слизистая. Реже наблюдаются катаральный и эрозивно-язвенный эзофагит [19]. Candida spp. редко вызывает истинное язвообразование. Наличие язвы при кандидозном эзофагите нередко служит признаком дополнительного патологического процесса в пищеводе [29]. Существуют различные эндоскопические классификации пищеводного кандидоза (табл. 1 и 2).
В ходе эндоскопии пораженные участки слизистой могут быть подвергнуты щеточной биопсии для цитологического исследования или биопсии для гистологической диагностики. Когда эндоскопически идентифицируются язвы, многократное проведение биопсии помогает исключить наличие сосуществующих патологических процессов. Цитологическое исследование материала, полученного с помощью браш-биопсии, имеет более высокую ступень чувствительности, чем гистологическое исследование образцов биопсии при умеренном поверхностном кандидозе, потому что микроорганизмы могут быть вымыты с поверхности ткани при обработке биопсийного материала [19]. В редких случаях позитивная цитология при наличии отрицательной гистологии указывает на то, что речь идет скорее о колонизации, чем об инфекции. При более тяжелом кандидозном поражении пищевода наибольшее диагностическое значение имеет гистологическое исследование биоптатов слизистой с использованием специальной окраски на нейтральные мукополисахариды по Шиффу PAS (ШИК-реакция) или по Gomori гексаметилентетрамином серебра. Только гистологическое исследование демонстрирует инвазию мицелия или псевдомицелия гриба в глубь ткани пищевода.
Кожное тестирование и серологические тесты малоинформативны для диагностики пищеводного кандидоза.
Лечение. Существует множество пероральных и внутривенных медикаментов, которые используются для лечения кандидозного эзофагита. Несмотря на относительно широкий выбор препаратов, лечение КП является актуальной проблемой, так как некоторые лекарственные средства недостаточно эффективны, другие имеют серьезные побочные эффекты; кроме того, в настоящее время отмечается рост резистентности к антигрибковым препаратам.
При лечении КП первоначально должна быть назначена пероральная терапия, внутривенное введение используется лишь в случае рефрактерного течения заболевания или если имеются противопоказания к пероральному использованию медикаментов. Больным с умеренной степенью тяжести заболевания и минимальным нарушением иммунитета необходим сокращенный курс терапии с использованием системных абсорбируемых лекарственных препаратов типа орального азола. Иммунокомпрометированных больных после трансплантации и больных СПИДом с КП лучше лечить более длинными курсами азола. У пациентов с гранулоцитопенией, когда имеется существенный риск диссеминации Candida инфекции, оправданно использование внутривенных препаратов системного действия (азолов, амфотерицина B) [29].
Арсенал современных противогрибковых средств достаточно широк. Для лечения пищеводного кандидоза используют антигрибковые препараты нескольких групп. Наиболее эффективны препараты из группы азола. Перорально используют невсасывающиеся азолы (клотримазол, миконазол); однако более эффективны препараты системного действия из этой группы (кетоконазол, флуконазол и итраконазол). Эти препараты, подобно другим из группы азола, изменяют проницаемость клеточной мембраны грибов посредством цитохром P450 (CYP)-зависимого вмешательства в биосинтез эргостерола, что приводит к повреждению грибной клетки и ее смерти. Новые триазолы (итраконазол и флуконазол) имеют большее аффинное подобие, чем имидазолы (миконазол и кетоконазол) для грибных CYP-энзимов [14]. Хотя другие средства, такие, как миконазол, клотримазол и нистатин, могут быть использованы для лечения кандидозного стоматита, а также для профилактики пищеводного поражения, эти лекарственные средства менее эффективны в качестве основной группы препаратов для терапии КП [24].
Клотримазол и миконазол — препараты имидазолового ряда. В настоящее время выпускаются клотримазол в таблетках и миконазол для перорального применения. Однако они не всасываются в желудочно-кишечном тракте. Эти препараты могут использоваться при легком кандидозном поражении пищевода у лиц без иммунодефицита.
Кетоконазол (низорал, ороназол) является производным имидазола и при ежедневном приеме в дозе от 200 до 400 мг дает хороший эффект в лечении пищеводного кандидоза. У больных СПИДом, которым обычно требуются более высокие дозы кетоконазола, дневная доза может быть увеличена, если не возникает тошноты, до максимальной (800 мг). Кетоконазол хорошо проникает в различные органы и ткани, но плохо — через гематоэнцефалический барьер. Препарат хорошо всасывается в желудочно-кишечном тракте, но для оптимального всасывания требуется кислая среда. При желудочной гипохлоргидрии и использовании антацидных средств его биодоступность уменьшается. Для улучшения всасывания кетоконазол следует принимать за 2 часа до приема противоязвенных препаратов. Приблизительно у 10-25% больных СПИДом наблюдается снижение желудочной кислотной секреции. Кетоконазол же может вызвать временную блокаду синтеза тестостерона и кортизола [6, 8, 29].
Итраконазол (споранокс) относится к группе триазолов, подобно кетоконазолу, назначается в дозе 200 мг в день. Дальнейшее увеличение дозы удлиняет период полураспада препарата и повышает его эффективность. Всасывание интраконазола уменьшается при снижении pH желудочного сока [23]. Кетоконазол и итраконазол метаболизируются в печени и выделяются с желчью. Период полураспада этих двух препаратов составляет от 7 до 10 часов и от 24 до 42 часов соответственно [14]. Коррекции дозы у больных с почечной недостаточностью не требуется.
Флуконазол (дифлюкан, дифлазон, форкан, флюкостат — отечественный флуконазол) представляет собой водорастворимый триазол и назначается в дозе 100 мг в день. Флуконазол — это препарат, всасывание которого не зависит от pH желудочного сока и который значительно более эффективен при лечении пищеводного кандидоза при СПИДе, чем кетоконазол (200 мг ежедневно) [21]. Флуконазол доступен для перорального и внутривенного применения. Он минимально метаболизируется и выделяется неизмененным с мочой. Флуконазол отличается высоким тканевым тропизмом и не влияет на синтез андрогенов, хорошо проникает через гематоэнцефалический барьер. В отличие от кетоконазола и интраконазола он хорошо растворим в воде и минимально связывается белком. Препарат обладает длительным периодом полураспада (приблизительно 30 часов, если не нарушена функция почек, а наличие пищи или гипохлоргидрия не изменяют всасывание), что позволяет принимать его один раз в сутки. Показано, что введение флуконазола улучшает иммунные показатели по Т- и В-системам [18]. И флуконазол, и итраконазол можно принимать перорально в виде растворов. Эти формы могут быть более эффективны, чем таблетки, потому как усиливают локальный эффект и улучшают всасывание.
Неблагоприятные воздействия кетоконазола, флуконазола и итраконазола прежде всего зависят от дозировки и проявляются в виде тошноты, гепатотоксичности, замедления продукции стероидов и метаболизма циклоспорина [14]. В редких случаях кетоконазол может вызывать фатальный гепатит [12]. Незначительное увеличение аминотрансфераз — общий побочный эффект для всех трех препаратов, однако это не должно служить оправданием для их отмены. Влияние на стероидогенез наиболее выражено у кетоконазола. Обратимое замедление гонадального и надпочечного синтеза стероидов под воздействием кетоконазола может наблюдаться, когда доза превышает 400 мг в сутки [27]. В рекомендуемых дозах флуконазол и итраконазол не влияют на стероидогенез. В результате воздействия на печеночные микросомальные ферменты все три азола ингибируют метаболизм циклоспорина, что приводит к увеличению уровня циклоспорина в крови; этот эффект наиболее ярко выражен у кетоконазола [14].
Другая основная группа противогрибковых средств — антибиотики полиены, представленные амфотерицином и нистатином. Эти препараты необратимо связываются со стеролами в грибковых клеточных мембранах, тем самым изменяя свойства проницаемости мембраны, нарушая ее барьерную функцию и вызывая клеточную смерть. Нистатин (антикандин, микостатин, фунгицидин) практически не всасывается в желудочно-кишечном тракте. Он используется для лечения кандидозного стоматита, но менее эффективен при поражении пищевода. Кроме того, эффективность, безопасность и легкость применения производных азола позволяют рассматривать нистатин в качестве средства терапии второго ряда. Амфотерицин В (амфостат, фунгизон) — единственный полиеновый антибиотик для парентерального введения. Он не всасывается в желудочно-кишечном тракте, применяется внутривенно капельно, хорошо проникает в различные органы и ткани, выделяется из организма почками. Период полувыведения составляет 24-48 часов, однако при систематическом применении может возрастать до 15 дней вследствие кумуляции в тканях [8]. Хотя амфотерицин B является наиболее эффективным препаратом, использующимся для лечения системных микозов, но из-за серьезных побочных эффектов его применение в лечении КП ограничено. Среди побочных эффектов амфотерицина можно выделить нейротоксичность, гематоксичность, нефротоксичность, местно-раздражающее действие (флебиты), аллергические реакции, диспептические расстройства, лихорадку и др. [8]. Наиболее неблагоприятным побочным эффектом, возникающим вследствие длительного использования амфотерицина, является нефротоксичность, которая обычно обратима. Этот препарат теперь доступен в виде раствора для перорального применения и пастилок. У больных с КП, которые резистентны к лечению флуконазолом или другими азолами, эффективными могут быть низкие дозы амфотерицина B, вводимого внутривенно (от 10 до 20 мг в день). Общая доза препарата для лечения пищеводного кандидоза составляет от 100 до 200 мг [29].
Флуцитозин — препарат с узким спектром противогрибковой активности, который действует благодаря вмешательству в трансляцию РНК. Он включается в клетки гриба, где превращается в 5-фторурацил и ингибирует тимидилат-синтетазу. Этот пероральный препарат, который назначается в дозе от 50 до 150 мг/кг в день каждые 6 часов, может быть использован в комбинации с амфотерицином B, но он не должен применяться в качестве монотерапии, потому что грибы быстро становятся к нему резистентными. Кроме того, монотерапия флуцитозином оказывается лишь умеренно эффективной [12].
Новейшим классом противогрибковых препаратов являются кандины, вмешивающиеся в синтез грибковой стенки. Они эффективны в отношении большинства видов Candida, в том числе C. krusei. Первые исследования показали, что капсофунгин, представляющий эту группу препаратов, оказался столь же эффективен при КП, как и амфотерицин В [16].
При лечении больных КП следует учитывать наличие резистентности, которая из-за широкого применения азолов в настоящее время значительно возросла. При развитии резистентности часто бывает полезно увеличить дозу азола. Если этого оказывается недостаточно, переходят на другой препарат из этой группы или используют пероральный раствор итраконазола [13], который нужно назначать в более высоких дозах из-за часто наблюдающейся перекрестной резистентности. Когда высокой дозы (то есть 400 мг ежедневно) флуконазола недостаточно, переходят на внутривенное введение амфотерицина B, при этом результат достигается в 90% случаев. Резистентность к амфотерицину наблюдается редко [29].
В табл. 3 представлено лечение кандидозного эзофагита в зависимости от функции лимфоцитов и гранулоцитов.
При лечении кандидозного эзофагита у больных СПИДом препаратами первого ряда являются кетоконазол и флюконазол, причем предпочтение следует отдавать флюконазолу. Из-за лучшей переносимости он прежде всего показан пациентам, находящимся на поздней стадии болезни, которые имеют много сопутствующих заболеваний. При нарушении глотания могут применяться парентеральные формы флуконазола. При неэффективности препаратов первого ряда используют лекарственные средства из группы резерва (амфотерицин В, итраконазол), которые более токсичные и/или более дорогие. Этиотропная терапия кандидоза пищевода, кроме основного курса лечения, требует проведения поддерживающего лечения, которое может быть пожизненным (табл. 4) [4].
Лечение кандидоза на фоне тяжелого иммунодефицита и лейкопении — задача сложная. Наряду с антигрибковой терапией актуально восстановление пула нейтрофильных лейкоцитов и их функциональной активности, так как нейтрофильные лейкоциты являются одним из основных звеньев механизма защиты от Candida spp. Предлагается в качестве дополнительного средства при лечении кандидозной инфекции на фоне нейтропении использовать гранулоцитарный колониестимулирующий фактор, который сокращает дефицит миелопероксидазы в нейтрофильных лейкоцитах и усиливает их кислородозависимую антикандидозную активность [7]. Получен хороший эффект от эндоскопического введения больным КП концентрата гранулоцитов и высокоинтенсивного импульсного лазерного излучения, что улучшает иммунные функции [5].
Таким образом, для достижения успеха у больных с тяжелыми грибковыми инфекциями, в том числе с кандидозом, целесообразен комплексный подход к диагностике и лечению. Повышению выживаемости будет способствовать оперативная диагностика с последующими подбором эффективной специфической противогрибковой терапии и проведением лечебных мероприятий, направленных на повышение числа гранулоцитов и стимуляцию фагоцитоза [16].
По вопросам литературы обращайтесь в редакцию
Кандидоз кишечника. Пролонгированное лечение
Продолжительность лечения не менее 6 недель, а затем пролонгированная пульс-терапия короткими курсами в индивидуальным подбором препаратов в течение 6 месяцев., но соблюдением принципов пролонгированного лечения дисбиоза желудочно-кишечного тракта с избыточным ростом грибов рода Candida.
- Рациональное питание продолжается в основном с ограничением сахаросодержащих продуктов и блюд.
- Повторные курсы цитросепта .
- Лактосодержащие пробиотики по 10 дней каждого месяца.
- Иммуномодулирующие препараты (повторные курсы через 3 месяца)
- Гепатопротекторы – 2 курса за 6 месяцев.
Оценка эффекта лечения по клиническим и лабораторным данным, о которых говорилось выше, в ходе лечения и через 6 месяцев.
Виды заболевания
Клиническая картина кандидоза полости рта классифицируется:
- На клинико-морфологическую.
- По течению.
- По локализации.
Клинико-морфологическая делится на:
- Гиперпластическую.
- Эрозивно-язвенную.
- Псевдомембранозную.
- Атрофическую.
Клиническая картина, классифицируемая по течению, делится на:
- Хроничекую.
- Острую.
По локализации:
- Хейлит.
- Гингивит.
- Глоссит.
- Стоматит.
- Тонзиллит и др.
Исходя из клинической картины, кандидоз полости рта бывает нескольких видов:
- Хронический гиперпластический.
- Кандидозная заеда.
- Хронический атрофический.
- Острый псевдомембранозный.
- Хронический псевдомембранозный.
- Острый атрофический.
Симптомы
Поражение слизистой полости рта грибком Candida может принимать различные формы, каждая из которых имеет собственные особенности симптоматики. Наиболее распространены такие формы болезни, как кандидозный ангулит, глоссит, хейлит, стоматит. Встречается как острая, так и хроническая формы заболевания.
- Псевдомембранозный острый кандидоз является самой распространенной формой и чаще всего встречается у младенцев и пожилых людей. Для этой формы характерно появление выраженного отека, гиперемии (покраснения) слизистых оболочек. Кроме того, на поверхности губ, неба, спинке языка и внутренней стороны щек образуется характерный беловатый налет. Если налет соскрести, поверхность слизистой под ним будет мацерированной (размягченной) или изъязвленной, кровоточащей. При этом у пациентов возникают жалобы на болезненность, жжение или зуд во рту; прием пищи в значительной степени затрудняется. Очень часто процесс распространяется на пищевод, глотку.
- Острый атрофический кандидоз слизистой оболочки полости рта обычно развивается из-за отсутствия адекватного лечения. Верхняя часть слизистых (эпителий) при этом слущивается, слизистая становится тонкой, красной или напротив — отечной. Яркий красный цвет приобретает и язык пациента, уголки губ; сосочки на языке атрофируются, сглаживаются. Налет при этом отсутствует или обнаруживается лишь в труднодоступных местах.
- Гиперпластический хронический кандидоз характеризуется образованием большого числа папул и бляшек неправильной или округлой формы. Они располагаются близко друг к другу на слизистой языка и щек и нередко спаиваются, срастаются. Вокруг каждого такого образования имеется тонкий ободок покрасневшей, воспаленной ткани. Соскоблить или удалить иным образом такую бляшку затруднительно. Полость рта при этом становится сухой и шероховатой; при жевании, говорении и даже в покое у пациентов обнаруживается значительный дискомфорт и болезненность. Следует отметить, что это заболевание чаще всего поражает мужчин старше 30 лет.
Главной причиной хронического атрофического типа является постоянное травмирование слизистых оболочек, например — из-за ношения протеза. Симптомы заболевания локализуются в области поражения. Возникает покраснение слизистой (часто — по контуру поражения), образуется налет, возникают боль и жжение, оболочки становятся сухими.