Тестостерон — андроген (стероидный мужской половой гормон), который в небольших количествах вырабатывается в организме женщины. Он принимает участие в регуляции обмена веществ, влияет на репродуктивную функцию.
Физиологическое изменение концентрации тестостерона наблюдается при половом созревании, беременности и в менопаузе. Патологическими причинами гормонального дисбаланса являются тяжелые поражения органов и систем, болезни эндокринных желез, опухолевые образования.
Одной из самых распространенных среди женских гормональных проблем является повышение уровня тестостерона в организме. Официальное название заболевания – гиперандрогения.
Уровень гормона тестостерона играет важную роль для здоровья женщины. Отклонение от нормы данного показателя должно стать сигналом к незамедлительному принятию мер.
Оптимальный уровень гормона тестостерона
Существует два вида данного вещества – свободный и общий.
- Свободный гормон тестостерон – это концентрация вещества, не связанного с половыми гормонами и белками.
- Общий тестостерон – это суммарный показатель концентрации свободного и привязанного к гормонам и белкам вещества.
Нормальный уровень общего гормона тестостерона – от 0,26 до 1, 3 нг/мл. Концентрация свободного вида компонента зависит от возраста женщины:
- До 39 лет уровень должен составлять от 0,13 до 3,09 нг/л.
- У женщин старше 40 до 59 лет – от 0,13 до 2,6 нг/л.
- У женщин старше 60 лет от 0,13 до 1,8 нг/л.
Выработка вещества может меняться в зависимости от времени суток и фазы менструального цикла.
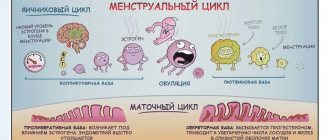
Что такое эстроген?
Эстроген – это целый класс родственных гормонов, который включает эстриол, эстрадиол и эстрон.
Эстриол производится из плаценты во время беременности. Это основной половой гормон беременных женщин. Он образуется из развивающихся фолликулов яичников.
Эстрадиол отвечает за женские характеристики и сексуальное функционирование. Кроме того, эстрадиол важен для здоровья костей у женщин. Изменения уровня эстрадиола способствуют развитию большинства гинекологических проблем, включая эндометриоз, миому и даже женские онкологические заболевания.
Эстрон широко распространен по всему телу. Это основной эстроген, присутствующий после менопаузы.
Пониженный уровень тестостерона
Низкая концентрация гормона может быть причиной слабого сексуального влечения, уменьшения мышечной ткани и увеличения жировой, сухости кожи, а также апатии и депрессии.
Если одновременно снижается выработка тестостерона и эстрогена, прекращает вырабатываться смазка во время полового акта, в связи с этим у женщины возникают сильные болезненные ощущения.
Основная причина низкой концентрации гормона тестостерона у женщин – нарушения менструального цикла. Это может привести к серьезным последствиям, поэтому нельзя игнорировать данное состояние.
Спровоцировать недостаточную выработку тестостерона могут также заболевания эндокринной системы, недостаточная физическая активность, слабый иммунитет, авитаминоз.
Для профилактики гормональных нарушений специалисты рекомендуют вести полноценную сексуальную жизнь, сбалансированно питаться, избегать стрессов и эмоциональных нагрузок. В случае низкого уровня тестостерона обязательно нужно обратиться к врачу, который назначит корректирующее лечение.
Роль тестостерона в организме женщины
Многие считают, что тестостерон вырабатывается только в мужском организме. На самом деле это вовсе не так и гормон находится в определенном количестве в норме и в организме женщин, выполняя целый ряд функций. Для чего он нужен и какая роль тестостерона в организме женщины?
Среди основных функций и гормона в женском организме выделяют:
- способствует поддержанию нормального развития мышечной массы
- способствует укреплению костной ткани
- способствует укреплению зубов
- поддерживает половую активность и направлен на воспроизведение потомства
- принимает участие в развитии волосяных фолликулов, контролирует рост волос на теле
- контролирует работу нервной системы
- регулирует продукцию жировой ткани и поддерживает ее уровень в организме
- участвует в процессе обмена веществ
- регулирует водно-солевой обмен
- предотвращает развитие заболеваний кровеносной системы
- способствует организму противостоять стрессу.
Высокая концентрация тестостерона
Спровоцировать чрезмерную выработку гормона тестостерона у женщин может неправильное питание, слишком интенсивная деятельность надпочечников либо наследственная предрасположенность.
О повышенном уровне гормона могут свидетельствовать такие симптомы: оволосение по мужскому типу, изменение фигуры и голоса, сухость кожи, выпадение волос, раздражительность, агрессивность.
В дальнейшем высокий уровень гормона может стать причиной развития гиперандрогении, нарушения менструального цикла, образования опухоли яичников и бесплодия. Поэтому при наличии симптомов, которые свидетельствуют о чрезмерной выработке тестостерона, обязательно нужно обратиться к врачу. Диагностика и оперативное лечение помогут стабилизировать гормональный фон и уберечься от возможных усложнений.
В начало раздела:: » Женские гормоны
Гиперандрогения — состояние, связанное с избыточной секрецией андрогенов и/или их усиленным воздействием на организм, которое у женщин чаще всего проявляется вирилизацией (появление мужских черт).
У женщин циркулирующие в крови андрогены (группа стероидных гормонов) в норме синтезируются в яичниках и надпочечниках, а также путем периферической конверсии андростендиона (АНД) и дегидроэпиандростерона (ДГЭА) в тестостерон (Т). В клинической практике большое значение имеют следующие андрогены и их предшественники: тестостерон, дигидротестостерон (ДГТ), 17-ОН-прогестерон (17-оксипрогестерон), АНД, дегидроэпиандростерон-сульфат (ДГЭАС).
Среди всех эндокринных заболеваний в гинекологической практике чаще всего встречаются патология щитовидной железы и рассматриваемая нами гиперандрогения. Для понимания данной проблемы необходимо обратиться к схеме синтеза андрогенов, как можно более упростив ее. Весь процесс в основном контролируется гормонами гипофиза — АКТГ (аденокортикотропным гормоном) и ЛГ (лютеинизирующим гормоном). Синтез всех стероидных гормонов начинается с превращения холестерина в прегненолон. Важно понимать следующее: этот этап происходит во всех стероидпродуцирующих тканях! Остальные процессы также в той или иной степени происходят во всех органах, имеющих отношение к стероидогенезу, однако в результате разными органами продуцируются как одинаковые, так и разные стероидные гормоны.
Кроме того, необходимо добавить, что продукция стероидных гормонов может происходить не только в эндокринных органах, но также и на периферии. В частности, для женщины важную роль в продукции стероидов играет подкожная жировая клетчатка.
Большинство врачей не считают необходимой оценку уровней андрогенов у женщин в постменопаузе при наличии клинических симптомов или биохимически подтвержденного их повышения из-за отсутствия взаимосвязи их уровней с различными изменениями в организме, возникающими в период естественного процесса старения. Однако при наличии клинических симптомов гиперандрогении следует обязательно проводить дифференциальную диагностику заболеваний, которые приводят к избытку андрогенов у женщин в постменопаузе. Рассмотрение возможных ключевых моментов в анамнезе, при физикальном обследовании и соответствующей лабораторной и рентгенологической оценке приведет к подбору оптимальных стратегий лечения выявленных причин гиперандрогении.
Ведущие признаки и симптомы
Большинство женщин с гиперандрогенией в период постменопаузы жалуются на гирсутизм в области лица и/или туловища вместе с потерей волос на голове. Подробный анамнез имеет решающее значение в разграничении прогрессирующего гирсутизма от истинной вирилизации. Гирсутизм — это избыточный рост терминальных волос, особенно на подбородке, верхней губе и в области белой линии живота [13]. Степень гирсутизма можно оценить по шкале Ферримана-Галлвея (1961), которая описывает степень роста волос в баллах от 0 до 4 в 9 областях тела. Считается, что у женщин в период пременопаузы степень гирсутизма равна 8 баллам и более, хотя в постменопаузе общий балл не обладает такой достоверностью. Вирилизация — комбинация выраженного гирсутизма вместе с облысением по мужскому типу, анаболическим (андроидным) типом ожирения, снижением тембра голоса и клиторомегалией (≥1,5×2,5 см) [13]. Наличие симптомов вирилизации предполагает выраженную гиперандрогению и необходимость проведения обследования для обнаружения опухоли (см. таблицу).
Синдром поликистозных яичников (СПКЯ)
СПКЯ (синдром Штейна-Левенталя) — сочетание олигоменореи или аменореи и двусторонних множественных кист яичников. При этом заболевании чаще всего встречаются нарушение менструального цикла, бесплодие, гирсутизм и ожирение [4]. Диагноз ставится при наличии гиперандрогении и хронической ановуляции [2]. При СПКЯ повышен риск развития инсулинорезистентности и гиперинсулинемии; сахарный диабет наблюдается у 20% больных.
Женщины с СПКЯ составляют особую группу, так как данное заболевание сохраняется вплоть до периода менопаузального перехода. В виду того что синтез Т яичниками снижается при естественной менопаузе постепенно [6], симптомы гиперандрогении, связанные с СПКЯ, могут сохраняться. Тщательно собранный анамнез, подтверждающий регулярность менструального цикла, время проявления симптомов гиперандрогении и прибавки массы тела помогут определить точный диагноз [20]. Поскольку женщины с СПКЯ имеют повышенный риск развития метаболического синдрома, сахарного диабета 2-го типа и гиперпластических процессов в эндометрии [15], должны быть определены методы раннего их выявления и проведено соответствующее лечение.
Гиперандрогения, вызванная ожирением
Известно, что не все женщины с избыточной массой тела имеют СПКЯ. В клинической практике широко распространено сочетание ожирения и симптомов, схожих с СПКЯ, но они сильно отличаются от симптомов классического СПКЯ, в связи с чем была выделена отдельная группа женщин с «гиперандрогенией, вызванной ожирением» [19]. Для таких женщин обычно характерно своевременное наступление менархе и регулярный менструальный цикл, но часто есть связь прибавки массы тела в анамнезе с беременностью без ее снижения до исходного уровня в течение последующих лет. На этом фоне менструальный цикл у женщин с наступлением периода пременопаузы становится нерегулярным. Позже развиваются признаки гиперандрогении, часто с образованием кист в яичниках, но без повышенного соотношения ЛГ/ФСГ, характерного для СПКЯ. Предполагают, что избыток ароматазы и 5α-редуктазы в жировой ткани вызывает местное повышение уровня эстрогенов и андрогенов, что приводит к нерегулярному циклу, гирсутизму и акне соответственно. Схожий сценарий наблюдается при достижении критической пороговой массы тела в период постменопаузы. В этом случае анамнез и время прибавки массы тела также помогут разграничить гиперандрогению при СПКЯ или вызванную ожирением. Стигмы, характерные для СПКЯ, помогают поставить диагноз, но они не исчезают при снижении массы тела. Как показывает клиническая практика, фенотипические симптомы гиперандрогении, вызванные ожирением, при снижении массы тела исчезают.
Дифференциальная диагностика СПКЯ и гиперандрогении, вызванной ожирением, у женщин в постменопаузе достаточно сложна. В то время как уровни Т резко падают при хирургической менопаузе, естественная менопауза приводит к более постепенному снижению уровня Т с возрастом (H. Judd и соавт., 1974). S. Winters и соавт. [26] доказали, что уровни Т всегда выше у женщин с СПКЯ по сравнению с женщинами контрольных групп соответствующего возраста. Однако недостатком данного исследования является то, что самая старшая возрастная группа включала женщин только от 47 до 57 лет и не была разделена по статусу относительно возраста наступления менопаузы. Не было также данных по изучению детального изменения уровней андрогенов у женщин с СПКЯ после менопаузы по сравнению с такими данными у женщин с ожирением с таким же индексом массы тела (ИМТ), не имевших СПКЯ.
Синдром Кушинга
Синдром Кушинга — состояние, характеризующееся избытком продукции глюкокортикоидов надпочечниками. У большинства больных отмечается увеличение массы тела с отложением жира на лице (лунообразное лицо), шее, туловище. Характерными клиническими проявлениями являются гирсутизм, нарушение менструальной функции, бесплодие, атрофия мышц конечностей, остеопороз, снижение иммунорезистентности, нарушение толерантности к глюкозе, депрессия и психозы. Существуют следующие варианты синдрома:
А. АКТГ-зависимый синдром гипофизарный — чаще всего опухолевое поражение гипофиза — и эктопический — секреция АКТГ (или кортиколиберина) опухолью любой локализации.
Б. АКТГ-независимый синдром надпочечниковый — рак, аденома или гиперплазия коры надпочечников — и экзогенный — самолечение препаратами глюкокортикоидов или вынужденный прием данных препаратов при другой патологии.
Гипертекоз (синдром Френкеля)
Гипертекоз яичников — двустороннее разрастание стромы яичников за счет пролиферации и лютеинизации. Клинически проявляется высокой вирилизацией женского организма вследствие выработки стромальными клетками яичника ДГЭА, андростендиона и Т. В плазме значительно повышено содержание эстрона (Э1). Соотношение ЛГ и ФСГ в норме или снижено. Кломифеновая проба отрицательная.
Еще в 1942 г. J. Gains отметил связь между клиническими проявлениями вирилизации и наличием островков лютеинизированных клеток в строме яичников. Впоследствии это явление стали называть стромальным гипертекозом. По мнению Е.Г. Иванова, гипертекоз — это наличие группы лютеинизированных клеток, которые расположены участками или диффузно в строме, захватывают область химуса. В отличие от СПКЯ, при гипертекозе кистозно атрезирующиеся фолликулы имеются в небольшом количестве либо отсутствуют, а белочная оболочка чаще всего не утолщена.
Гипертекоз является тяжелой формой СПКЯ, приводит к чрезмерной продукции андрогенов стромальными клетками яичников (S. Braithwaite и соавт., 1978). Это заболевание может проявиться у женщин как в пре-, так и в постменопаузе. Хотя основная этиология заболевания неясна, но считается, что причина гипертекоза яичников связана с повышенным уровнем гонадотропинов, в основном, ЛГ [12]. Яичники могут иметь нормальные размеры для пременопаузы, но не для постменопаузы; поэтому при интерпретации результатов УЗИ необходимо учитывать возраст женщины и период климактерия [3]. При гипертекозе наряду с гиперсекрецией андрогенов также повышена продукция эстрогенов на периферии, и эти женщины часто относятся к группе риска развития гиперплазии эндометрия и карциномы яичников [12]. Наличие симптомов СПКЯ в анамнезе может помочь при проведении дифференциальной диагностики. Женщины с гипертекозом имеют риск развития метаболических осложнений — гиперлипидемии и сахарного диабета 2-го типа [12, 16], хотя крупных исследований, в которых бы изучались их частота, клинические проявления и отдаленные последствия у таких пациенток в постменораузе, не проводилось.
Таким образом, гипертекоз — это неопухолевая патология яичников, при которой в их строме появляются пролиферирующие островки лютеинизированных клеток. При гипертекозе продукция Т, АНТ и ДГЭА возрастает в большей степени, чем при СПКЯ. Уровни ЛГ и ФСГ могут быть нормальными или сниженными, а степень инсулинорезистентности и гиперинсулинемии превышает таковую при СПКЯ.
Опухоли яичников или надпочечников
У женщин с опухолями яичников или надпочечников имеются быстро прогрессирующие признаки вирилизации, обусловленные высоким уровнем андрогенов.
Андробластома — односторонняя опухоль яичника, встречается в любом возрасте. Оказывает на организм женщины двухфазное воздействие: дефеминизацию, а затем маскулинизацию. Характерна гипоменорея, затем аменорея, выраженный гирсутизм, гипертрофия клитора, гипоплазия матки и молочных желез; в менопаузе — облысение, изменение тембра голоса.
Гистологическая картина ткани опухолей яичников у больных с гиперандрогенией представлена опухолевыми клетками Лейдига, Сертоли и стероидными клетками яичника (L. Morgan, 1990). Число случаев этих опухолей составляет 10% среди всех опухолей яичников. В источниках литературы описаны менее 150 случаев опухолей, состоящих только из опухолевых клеток Лейдига [11]. Данный тип опухоли продуцирует T и/или другие фракции андрогенов наряду с эстрогенами или без последних.
Опухоли надпочечников секретируют прогормоны андрогенов: ДГЭА, ДГЭАС и реже T, глюкокортикоиды и/или эстрогены [14, 23]. Истинную болезнь Кушинга следует дифференцировать от негипофизарного синдрома Кушинга, при котором избыточность эндогенного кортизола служит проявлением так называемого эктопического или паранеопластического АКТГ-синдрома (АКТГ-зависимый избыток глюкокортикоидов), аденомы или карциномы коры надпочечников или же экзогенного поступления глюкокортикоидов (АКТГ-независимый избыток глюкокортикоидов). При гормональном обследовании у больных с синдромом Кушинга определяются очень высокий уровень кортизола (гиперкортизолизм), высокий уровень T, но, как правило, несколько сниженный уровень ДГЭАС [28]. В противоположность этому при карциноме надпочечников наблюдаются высокие уровни ДГЭАС, хотя опухоль растет медленно и диагностируется при размерах больше 8-10 см. Однако описаны случаи опухолей надпочечников, секретирующих не только ДГЭАС, но и T [5].
Врожденная гиперплазия коры надпочечников
Врожденная гиперплазия коры надпочечников (ВГКН) — наследственное генетическое заболевание, связанное с наследственным дефицитом 11β- или 21-гидроксилазы.
В зависимости от этнической принадлежности пациентки различают 2 формы ВГКН: врожденная гиперплазия коры надпочечников, классическая (редко) или неклассическая (чаще), может быть причиной гиперандрогении в постменопаузе [22]. Семейный анамнез раннего пубархе, низкорослость и этническая принадлежность (повышенный риск у эскимосов, ашкенази, испанцев, итальянцев) позволяют предположить ВГКН, для подтверждения которой необходимо проведение лабораторной и инструментальной оценки. При этом повышается синтез кортикостероидов, что приводит к стимуляции выделения гипофизом АКТГ, а это в свою очередь ведет к усиленной секреции андрогенов корой надпочечников с последующей ее гиперплазией. Наряду с вирилизацией у больных развиваются слабость, мышечные боли, снижение артериального давления, пигментация кожных покровов. Уровень 17-ОКС в моче снижен, но при увеличении общего уровня 17-КС увеличивается уровень ДГЭА. Рентгенологически тень надпочечников более интенсивна при гиперплазии, чем при опухоли.
Лечение [19] ингибиторами ароматазы при раке молочной железы может спровоцировать гиперандрогению у женщин в постменопаузе с ранее неизвестной ВГКН.
Ятрогенная гиперандрогения
Применение лекарственных препаратов и/или пищевых добавок, а также гель с Т, используемый партнером, может привести к гирсутизму у женщин в постменопаузе [13]. Для лечения менопаузальных симптомов некоторые женщины используют комбинацию эстрогенов с Т или ДГЭА, которые в фармакологических дозах вызывают гирсутизм и другие симптомы гиперандрогении. Тщательный анализ лекарственных препаратов, пищевых добавок и гормональной терапии партнера поможет выявить эти обратимые причины.
Лабораторные исследования
Изучение анамнеза и физикальный осмотр проводят перед лабораторным и инструментальным исследованиями. Наиболее важным лабораторным исследованием для выявления гиперандрогении является определение уровней тестостерона и ДГЭАС [13]. Определение ДГЭА малоинформативно, так как этот гормон имеет неустойчивый ритм в течение суток и меняется при стрессе. Большинство коммерческих тестов были разработаны для определения общего Т у мужчин, поскольку порог чувствительности уровня Т у женщин очень низкий [17]; тем не менее уровни Т, значительно превышающие пределы нормального диапазона, могут быть использованы для диагностики гиперандрогении и контроля за ее динамикой во время лечения [17, 22]. Учитывая, что секреция андрогенов в яичниках и надпочечниках снижается с возрастом [6], следует критически относиться к достоверности оценки уровня андрогенов при гиперандрогении в пожилом возрасте. Относительно недавно разработаны тест-системы для определения уровня Т методом масс-спектрометрии, которые более чувствительны к низким уровням Т, чем радиоиммунный метод. С появлением этого метода появилась возможность определения нормального или повышенного уровня андрогенов в течение всей жизни женщины [18]. Имеются данные, свидетельствующие о том, что гиперпролактинемия может быть причиной гирсутизма; в связи с этим необходимы определение и контроль уровня пролактина у женщин различных возрастных групп [13]. Основным диагностическим тестом синдрома Кушинга является определение уровня свободного кортизола в суточной моче или слюне после пробы с 1 мг дексаметазона [14, 23]. Больные с аденомой надпочечников в большинстве случаев имеют нормальные показатели свободного кортизола. В связи с этим проба с дексаметазоном является идеальным тестом для выявления пациенток с субклиническими формами синдрома Кушинга [28]. После некоторых сомнений и споров в прессе по поводу того, имеются ли пороговые уровни Т и ДГЭАС, определяющие наличие опухолей яичников или надпочечников, было установлено, что при повышенных уровнях T >200 нг/дл (6,94 нмоль/л) или ДГЭАС >800 нг/мл (2171 нмоль/л) можно предполагать наличие опухолей яичников или надпочечников. Однако результаты проведенного обследования 478 женщин (в пре- и постменопаузе) с признаками и симптомами гиперандрогении противоречивы. В 11 (2-3%) случаях был выявлен высокий уровень T >250 нг/дл (8,68 нмоль/л) и только у 1 из 11 выявлена опухоль яичника. Из 10 женщин с уровнем ДГЭАС >600 нг/мл (1628 нмоль/л) у 9 была установлена опухоль надпочечника [24]. В другом исследовании, в котором принимали участие 60 женщин с диагностированной андрогенпродуцирующей опухолью яичников, у большинства из их числа уровень T колебался от 100 до 200 нг/дл (3,47-6,94 нмоль/л) [1]. Результаты данного исследования свидетельствуют о том, что андрогенпродуцирующие опухоли яичников встречаются и при уровне T ≤200 нг/дл. С целью проведения дифференциальной диагностики между опухолями яичников и надпочечников некоторые исследователи предлагают проводить 2-5-дневные тесты с минимальными дозами дексаметазона [9]. Снижение изначально повышенных уровней Т, АНД или ДГЭАС позволяет установить яичниковый генез гиперандрогении. Исследования у женщин с гиперандрогенизмом в постменопаузе весьма ограничены, в связи с этим данная проблема требует дальнейшего изучения.
Подходы к лечению постменопаузальной гиперандрогении
Методы лечения зависят от этиологии гиперандрогении. Медикаментозное и/или хирургическое лечение первичного заболевания (опухоли яичников или надпочечников, гипертекоза, ятрогенных причин, ВГКН или опухоли гипофиза) оказывает положительный эффект, проявляющийся снижением гиперандрогении. Аналоги ГнРГ могут быть использованы как в диагностических, так и в лечебных целях. Если уровни андрогенов снижаются в ответ на введение аналогов ГнРГ, опухоль считается гонадотропинзависимой; однако это не было подтверждено контролируемыми исследованиями.
Лечение гирсутизма рассмотрено в последних рекомендациях Общества эндокринологов и включает применение таких препаратов, как спиронолактон или флутамид, оказывающих антиандрогенный эффект [13]. Хотя ципротерона ацетат — прогестаген мощного антиандрогенного действия не используется для лечения гиперандрогении в США, он широко распространен в Европе [13]. Было установлено, что сенситайзеры инсулина подавляют андрогены у женщин в пременопаузе с СПКЯ [10], хотя данных об их влиянии на женщин в постменопаузе не существует.
Кардиометаболические последствия гиперандрогении. Надо ли лечить?
Данные относительно частоты и степени избытка андрогенов в период менопаузы ограничены. Нет доступной информации об отдаленных эффектах влияния избыточной продукции андрогенов на органном и системном уровне. Однако известно, что высокие уровни андрогенов нарушают липидный состав крови (повышают содержание ЛПНП, снижают уровень ЛПВП и повышают уровень триглицеридов) [25]. Недавно появились сообщения о связи конечных продуктов гликирования с уровнем Т у женщин в постменопаузе, независимо от наличия или отсутствия инсулинорезистентности [7]. Имеются также данные о повышении гематокрита у женщин с опухолями, с последующим падением его после удаления опухоли [27]. Высокий коэффициент Т/Э сопровождается усугублением инсулинорезистентности и может спровоцировать артериальную гипертензию и задержку жидкости. Исследования последних лет [8] показали, что высокие уровни Т у женщин коррелируют с повышенным риском развития рака молочной железы и заболеваниями сердца. Согласно данным L. Shaw и соавт. [21], в группе из 390 женщин, находящихся в постменопаузе с клиническими признаками ишемии, у 104 женщин с нерегулярным менструальным циклом в анамнезе и гиперандрогенией, по данным ангиограммы, чаще выявлялась ишемическая болезнь сердца, а также ожирение, метаболический синдром и сахарный диабет. Женщинам в постменопаузе с симптомами гиперандрогении необходимо проводить тщательное обследование и адекватно подобранное лечение. Тщательно собранный анамнез, физикальное обследование, лабораторные (тандемная масс-спектрометрия) и рентгенологические методы исследования позволят установить диагноз, что приведет к подбору соответствующего медикаментозного или хирургического лечения женщин с гиперандрогенией в постменопаузе.
Почему падает уровень эстрогена?
Почему падает уровень эстрогена?
Есть много причин, по которым уровень эстрогена падает, в том числе:
- гипогонадизм;
- гипопитуитаризм;
- нарушение развития беременности (эстриол);
- перименопауза и менопауза (эстрадиол);
- синдром поликистозных яичников (СПКЯ);
- нервная анорексия (расстройство пищевого поведения);
- экстремальные упражнения или тренировки;
- лекарства, блокирующие эстроген, например, кломифен.
Кроме того, женщины испытывают низкий уровень эстрогена сразу после родов, а также во время кормления грудью .
Как узнать,нормальный ли уровень гормонову вас?
Гинеколог-эндокринолог может оценить ваше состояние здоровья и симптомы уже на этапе физического осмотра. В этот момент он делает вывод, нужны ли дальнейшие лабораторные анализы для проверки уровня гормонов. Эти тесты могут быть важны, если есть подозрение на СПКЯ или если у пациентки прекратились менструации из-за чрезмерных спортивных тренировок или нервной анорексии.
Если анализы показывают аномальный уровень гормонов, врач обязательно назначает лечение.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter