Сексуальность и привлекательность – это факторы, которые очень важны для представительниц прекрасной половины человечества. Многие тратят огромное количество времени и средств на достижение таких результатов и получение подобных качеств. При этом мало кто знает, что отвечает за это мужской гормон тестостерон.
Это полезный элемент для женского организма, который необходим не только для красоты, но также для здоровья. Если его показатели снижаются, это автоматически отражается на здоровье и на красоте. Потому так важно знать, как повысить тестостерон у женщин
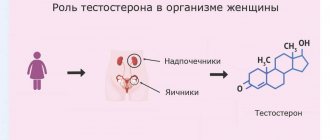
Краткая информация о тестостероне
Гормон очень важен для женского организма. Среди преимуществ, которые он обеспечивает женщине можно отметить следующие:
- Обеспечивает положительный психологический настрой;
- Оказывает положительное влияние на обычное половое влечение;
- Дает возможность долгие годы сохранять молодость и женскую привлекательность;
- Формирует строительную мышечную ткань;
- Помогает сжечь жир;
- Эффективно контролирует функционирование сальных желез;
- Положительно влияет на функционирование костного мозга;
- Полностью нормализует естественный липидный обмен;
- Способствует выработке белка;
- Снижает количество глюкозы в общем составе крови.
Недостаточное количество данного гормона достаточно опасно для любой женщины. Потому так важно знать, как правильно повышать тестостерон.
Выработка данного элемента осуществляется в надпочечниках и в яичниках. Что касается основного строительного материала, необходимого образования для тестостерона, то это обычный холестерин.
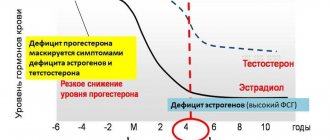
Самый высокий уровень важного тестостерона отмечается у молодых девушек, которые только перешагнули пород естественного полового созревания и при беременности у взрослых женщин. Далее с возрастом его количество начинает постепенно уменьшаться. Самое минимальное количество гормона наблюдается в период женского климакса.
Роль андрогенов у женщин: что мы знаем?
До последнего времени андрогены у женщин рассматривались лишь как причина различных метаболических и функциональных нарушений, однако их роль в женском организме по-прежнему до конца не изучена. На примере синдрома поликистозных яичников (СПКЯ) хорошо известно, что повышенный уровень андрогенов часто коррелирует с ановуляцией, бесплодием, а также нарушениями жирового и углеводного обмена [1]. В то же время антиандрогенная терапия не решила этих проблем [2–4]. Андрогены большинством клиницистов воспринимаются как «мужские» половые гормоны, но так ли это? В последнее десятилетие активно стали изучаться андрогендефицитные состояния у женщин, которые могут приводить к ухудшению качества жизни и сексуальным расстройствам [5–7]. В настоящий момент доказано влияние андрогенов на либидо и ощущение благополучия у женщин [7–10], однако их роль в генезе метаболических нарушений по-прежнему до конца не известна. Также остаются нерешенными вопросы влияния андрогенов на костную, мышечную ткани и кроветворение в женском организме.
Продукция и транспорт андрогенов в женском организме
Гипофиз регулирует секрецию андрогенов у женщин посредством выработки лютеинизирующего гормона (ЛГ) и адренокортикотропного гормона (АКТГ). Главными андрогенами в сыворотке у женщин с нормальным менструальным циклом являются тестостерон и дигидротестостерон. Дегидроэпиандростерон-сульфат (ДГЭА-С), дегидроэпиандростерон (ДГЭА) и андростендион считаются прогормонами, поскольку лишь конверсия в тестостерон полностью проявляет их андрогенные свойства. ДГЭА производится главным образом в сетчатой зоне надпочечников, а также в тека-клетках яичников [11]. Тестостерон синтезируется следующим образом: 25% синтезируется в яичниках, 25% в надпочечниках, оставшиеся 50% производятся в результате периферической конверсии преимущественно в жировой ткани из предшественников андрогенов, которые вырабатываются обеими железами [12]. У здоровых женщин репродуктивного периода ежедневно производится 300 мкг тестостерона, что составляет приблизительно 5% от ежедневной продукции у мужчин [13]. В отличие от довольно резкого снижения выработки эстрогенов, что ассоциируется с менопаузой, уровни предшественников андрогенов и тестостерон уменьшаются с возрастом постепенно. Снижение уровня ДГЭА-С происходит в результате снижения функции надпочечников. Концентрации ДГЭА-С, который не связывается ни с каким белком и не изменяется в течение менструального цикла, составляют приблизительно 50% у женщин в возрасте 40–50 лет по сравнению с концентрацией, отмеченный у 20-летних женщин [14–16]. Аналогичная динамика также отмечена и в секреции тестостерона [17].
Известно, что андрогены являются предшественниками эстрогенов, которые образуются из тестостерона путем ароматизации в гранулезных и тека-клетках яичников, а также в периферических тканях.
В плазме тестостерон находится преимущественно в связанном состоянии, причем 66% связано с глобулином, связывающим половые гормоны (ГСПГ), 33% связано с альбумином и лишь 1% находится в несвязанном состоянии [17]. Некоторые заболевания (тиреотоксикоз, цирроз печени), а также прием эстрогенов в составе комбинированной оральной контрацепции (КОК) и заместительной гормональной терапии (ЗГТ) могут приводить к существенному увеличению ГСПГ и уменьшению свободной фракции тестостерона [18]. Следовательно, патология гипофиза, яичников, надпочечников, а также заболевания, сопровождающиеся дефицитом жировой ткани или увеличением ГСПГ, могут приводить к развитию андрогендефицитных состояний у женщин.
Конечными метаболитами тестостерона являются 5-альфа-дегидротестостерон и эстрадиол, количество которых в несколько раз меньше, чем тестостерона, из чего можно сделать вывод, что концентрация андрогенов у женщин в несколько раз превышает концентрацию эстрогенов. Таким образом, изучение роли андрогенов, а также заместительная терапия андрогендефицитных состояний у женщин, в том числе получающих ЗГТ эстрогенами и прогестинами с недостаточным эффектом, имеет под собой убедительное биологическое обоснование.
Влияние андрогенов на жировой и углеводный обмен
Одним из обсуждаемых побочных эффектов тестостерона является негативное влияние на липидный обмен, заключающееся в снижении липопротеидов высокой плотности (ЛПВП). Во многих исследованиях отмечено, что более высокие уровни общего тестостерона и индекс свободных андрогенов были прямо пропорционально связаны с общим холестерином, липопротеидами низкой плотности (ЛПНП) и триглицеридами, с одной стороны, и более низким уровнем ЛПВП — с другой [19–21]. Эта взаимосвязь наиболее четко прослеживалась у женщин с СПКЯ [22]. Исследования с пероральным применением метилтестостерона также показали значительное снижение ЛПВП при нормальном или пониженном уровне ЛПНП [23]. На протяжении многих лет этот факт являлся основным доводом противников применения андрогенов у женщин.
В то же время при применении парентеральных форм тестостерона (импланты, внутримышечные инъекции и трансдермальные препараты) не было отмечено снижения ЛПВП [24], а у женщин, получающих заместительную терапию эстрогенами, при добавлении тестостерона ундеканоата ежедневно и даже при достижении супрафизиологических концентраций тестостерона было отмечено значительное снижение общего холестерина и липопротеинов низкой плотности [25].
Bell R. и соавт. обследовали 587 женщин в возрасте от 18 до 75 лет, не предъявлявших никаких жалоб. Не было выявлено статистически значимой взаимосвязи между концентрацией эндогенного тестостерона, его надпочечниковых предшественников и уровнем ЛПВП, в то время как уровни ГСПГ были обратно пропорциональны уровням ЛПНП и триглицеридов [26].
Популяционное исследование, проведенное в Швеции, выявило, что женщины с низким уровнем андрогенов имели более высокую сердечно-сосудистую заболеваемость, в том числе и получавшие ЗГТ, даже если они и контролировали уровни липидов. При этом анализ, проведенный методом логистической регрессии, показал, что концентрация общего тестостерона была прямо пропорциональна ЛПВП и ЛПНП у всех женщин, в то время как уровень андростендиона положительно ассоциировался с ЛПВП и отрицательно с триглицеридами [27].
Интересно, что уровни ДГЭА-С, общего и свободного тестостерона и индекс свободных андрогенов обратно пропорционально коррелируют не только с индексом массы тела, но и с соотношением окружности талии к окружности бедер как у мужчин, так и у женщин [28, 29], однако в женской популяции эта закономерность была менее выражена [28].
В течение многих лет находили ассоциацию между гиперандрогенией и инсулинорезистентностью на примере женщин с СПКЯ [1], однако данные исследований показали, что терапия флутамидом и агонистами гонадотропного релизинг-гормона не улучшали чувствительность к инсулину у таких пациенток [5–7]. Противоречивые данные, которые были получены у женщин без СПКЯ в некоторых исследованиях, не подтвердили взаимосвязи тестостерона с инсулинорезистентностью [30, 31]. Удаление андрогенпродуцирующей опухоли у больной с выраженной гиперандрогенией через 9 месяцев привело к выраженному ухудшению периферической чувствительности к инсулину [32].
Андрогены и сердечно-сосудистая заболеваемость у женщин
Наиболее часто влияние андрогенов на кардиоваскулярный риск у исследователей ассоциируется с клинической моделью гиперандрогении при СПКЯ. У женщин с СПКЯ отмечено повышение уровня эндотелина-1, маркера вазопатии, свободного тестостерона, и инсулина. Назначение метформина, повышающего чувствительность периферических тканей к инсулину, в течение 6 месяцев способствовало значительному снижению уровней эндотелина-1, уменьшению гиперандрогении и гиперинсулинемии, а также улучшению утилизации глюкозы [33]. Метаанализ рандомизированых клинических исследований также показал, что терапия метформином у пациенток с СПКЯ приводила к снижению уровня андрогенов [34], что свидетельствует о первичной роли гиперинсулинемии в увеличении секреции андрогенов у женщин.
Толщина intima-media сонных артерий, определяемая с помощью ультрасонографии, — один из наиболее популярных маркеров, используемых исследователями для определения выраженности атеросклероза [35]. Большое число публикаций, сфокусированных на измерении толщины intima-media и определении уровней андрогенов, лишний раз это подтверждает. Bernini и соавт. обследовали 44 пациентки с физиологической менопаузой. Исследовались уровни общего и свободного тестостерона, андростендиона, измерялась толщина intima-media сонных артерий. Была отмечена обратная корреляция между уровнем андрогенов и толщиной intima-media — признаком, наиболее отражающим атеросклеротические изменения сосудов: у женщин с наименьшей толщиной intima-media уровни андрогенов находились в верхней трети нормального диапазона, а с наибольшей — в нижней четверти. На основании проведенного исследования авторы пришли к выводу, что андрогены могут оказывать благоприятное воздействие на стенку сонных артерий у женщин в постменопаузе [36]. К аналогичному выводу в своих исследованиях пришли и другие авторы [37–39].
Hak и соавт. исследовали соотношения уровней общего и биодоступного тестостерона и толщины intima-media брюшного отдела аорты у мужчин и женщин. Если у мужчин прослеживалась четкая обратная корреляция между уровнями общего и свободного тестостерона, то у женщин уровни этих андрогенов положительно коррелировали с аортальным атеросклерозом, но эта корреляция становилась статистически незначимой после учета других факторов сердечно-сосудистого риска [40].
Важным фактором в развитии серьезных сердечно-сосудистых осложнений является ангиоспазм. Worboys S. и соавт. исследовали эффекты парентеральной терапии тестостероном у женщин, получающих ЗГТ эстрогенами и прогестинами. Было обследовано 33 женщины в постменопаузе, получающие ЗГТ, имплантами с тестостероном (50 мг) длительностью более 6 мес. Контрольную группу составили 15 женщин, не получающих никакой терапии. При помощи УЗИ исследовались диаметр плечевой артерии, реактивная гиперемия (эндотелий-зависимая вазодилятация) и действие нитроглицерина (эндотелийнезависимая вазодилятация). В основной группе отмечалось повышение уровней тестостерона, что ассоциировалось с увеличением на 42% эндотелийзависимой вазодилятации. В контрольной группе не было отмечено никаких изменений. Похожие данные были получены в отношении эндотелийнезависимой вазодилятации. Авторы пришли к выводу, что парентеральная терапия тестостероном у женщин в постменопаузе, длительно получающих ЗГТ, улучшает как эндотелийзависимую, так и эндотелийнезависимую вазодилятацию плечевой артерии [42].
Влияние андрогенов на костно-мышечную систему у женщин
В ряде исследований было показано положительное влияние эндогенных андрогенов на минеральную плотность костной ткани (МПКТ) у женщин в постменопаузе. E. C. Tok et al. обследовали 178 женщин в постменопаузе, никогда не получавших ЗГТ [43]. Исследовались уровни андрогенов (ДГЭАС, андростендиона и свободного тестостерона) и их корреляция с МПКТ, измеренной методом двухэнергетической рентгеновской абсорбциометрии. Было отмечено, что уровни ДГЭАС и свободного тестостерона были положительно связаны с МПКТ поясничного отдела позвоночника и шейки бедра. При этом анализ данных методом линейной регрессии показал различный эффект андрогенов на костную ткань. Так, свободный тестостерон был независимо связан с минеральной плотностью поясничного отдела позвоночника (трабекулярная костная ткань), в то время как ДГЭАС — с минеральной плотностью шейки бедра (кортикальная костная ткань). По мнению авторов, различные андрогены по-разному влияют на различные типы костной ткани. S. R. Davis et al. в своем исследовании показали, что среди двух групп женщин в постменопаузе, получавших ЗГТ эстрогенами и эстрогенами в сочетании с тестостероном, МПКТ была достоверно выше во 2-й группе [44].
У женщин с андрогенным дефицитом, ассоциированным с ВИЧ-инфекцией, чаще, чем в общей популяции, развивается остеопороз и повышается риск переломов. В исследовании S. Dolan et al. было отмечено, что риск остеопении и остеопороза у таких пациенток ассоциировался с низким уровнем свободного тестостерона [45].
Влияние андрогенов на кроветворение
Эффекты тестостерона на эритропоэтин были отмечены еще в 60-е годы 20 века [46]. L. Ferrucci at al. при обследовании 905 пациентов старше 65 лет (критериями исключения являлись онкозаболевания, хроническая почечная недостаточность и прием препаратов, влияющих на концентрацию гемоглобина) выявили, что уровень гемоглобина коррелировал с уровнем свободного тестостерона как у мужчин, так и у женщин, кроме того, было отмечено, что при низком уровне тестостерона трехлетний риск развития анемии был выше, чем при нормальном уровне (у женщин в 4,1, а у мужчин в 7,8 раза) [47]. Другое исследование у женщин с анемией, ассоциированной с ВИЧ-инфекцией, показало аналогичную закономерность [48]. У женщин с СПКЯ, получающих антиандрогенную терапию, также была выявлена четкая позитивная ассоциация между концентрацией свободного тестостерона и уровнями гемоглобина и гематокрита [49].
Причины развития андрогендефицитных состояний у женщин
Дефицит андрогенов у женщин характеризуется снижением либидо, ощущения благополучия, депрессией, снижением мышечной массы и длительной беспричинной усталостью в сочетании с низким уровнем общего и свободного тестостерона при нормальном уровне эстрогенов [50]. Среди причин дефицита андрогенов выделяют яичниковые, эндокринные, хронические заболевания и медикаментозные [18, 50] (.).
Лабораторным критерием андрогенного дефицита у женщин является концентрация общего тестостерона в нижней квартили или ниже нижней границы нормального диапазона [50].
Эффекты андрогензаместительной терапии
Терапия тестостероном у женщин впервые была использована в 1936 г. с целью облегчения вазомоторных симптомов [51]. В настоящее время тестостерон при различных заболеваниях и состояниях у женщин применяется как off-label терапия во многих странах. Новая эра началась с 2006 г., когда применение пластыря, содержащего 300 мкг тестостерона, было официально одобрено Европейским медицинским агентством для лечения сексуальной дисфункции у женщин после овариоэктомии [52]. Тестостерон может применяться как в виде добавления к традиционной ЗГТ [27, 53], так и в виде монотерапии [54]. В рандомизированных плацебо-контролируемых исследованиях было показано, что трансдермальная монотерапия тестостероном в физиологической дозе 300 мкг дважды в неделю в течение 18 месяцев у женщин с андрогенным дефицитом, вызванным как гипопитуитаризмом, так и ВИЧ-инфекцией, приводила к достоверному увеличению МПКТ, мышечной массы и силы, а также улучшала показатели индексов депрессии и сексуальной функции у таких пациенток. При этом показатели жировой массы не изменялись, а побочные эффекты были минимальны [55–57]. Также было отмечено, что трансдермальная терапия тестостероном у женщин с андрогенным дефицитом, вызванным ВИЧ-ассоциированным синдромом потери массы тела, не нарушала чувствительность к инсулину, общую массу жировой ткани, регионарное распределение подкожно-жировой клетчатки и не влияла на маркеры воспаления и тромболизиса [58]. Кроме того, гель с тестостероном, наносимый на переднюю брюшную стенку, приводил к уменьшению абдоминальной подкожно-жировой клетчатки и уменьшению общей массы тела у женщин в постменопаузе [59]. Mестное применение крема с андрогенами было эффективно в отношении атрофического вагинита и диспареунии у пациенток в постменопаузе [60, 61].
Сочетание тестостерона с традиционной ЗГТ
Одним из наиболее часто применяющихся у женщин в США эстроген-андрогенным препаратом является Estratest, содержащий конъюгированные эквинные эстрогены и метилтестостерон. Как показали данные WHI, конъюгированные эстрогены не являются препаратом выбора для ЗГТ ввиду относительного увеличения риска рака молочной железы и сердечно-сосудистых осложнений у женщин старшей возрастной группы. Следовательно, оптимальный препарат для заместительной эстроген-гестагенной терапии должен соответствовать критериям безопасности в отношении молочных желез, эндометрия, не иметь негативного влияния на липидный и углеводный обмен, не повышать риск сердечно-сосудистых осложнений и положительно влиять на метаболизм костной ткани.
Из лекарственных средств, содержащих нативные половые гормоны, препаратом выбора является Фемостон, используемый для заместительной гормональной терапии в пери- и постменопаузе и единственный на современном рынке, выпускающийся в трех дозировках: 1/5, 1/10 и 2/10. Фемостон представляет собой комбинированный препарат, в состав которого входят 17-бета-эстрадиол — натуральный эстроген — и дидрогестерон — чистый аналог природного прогестерона, не теряющий своей активности при пероральном введении.
Применение дидрогестерона в сочетании с 17-бета-эстрадиолом усиливает защитный эффект эстрогенов на костную ткань. Если эстрогены действуют в направлении снижения костной резорбции, то исследования, проведенные in vitro, позволяют предположить, что дидрогестерон может способствовать костеобразованию [62]. Кроме того, дидрогестерон не обладает побочными гормональными эффектами и не оказывает отрицательного влияния на свертывающую систему крови, углеводный и липидный обмен [63]. Результаты проведенных клинических исследований Фемостона показали его высокую эффективность для лечения климактерических расстройств у женщин в перименопаузе, безопасность и хорошую переносимость, приемлемость и удобство в применении. Препарат способствует снижению атерогенного потенциала крови, в связи с чем может оказывать реальное профилактическое действие на частоту развития сердечно-сосудистых заболеваний. Комбинация 17-бета-эстрадиола с дидрогестероном лучше влияет на липидный профиль, чем некоторые другие схемы ЗГТ. В двойном слепом исследовании проводилось сравнительное изучение влияния двух вариантов ЗГТ: Фемостон 1/5 и конъюгированные конские эстрогены внутрь (0,625 мг) + норгестрел (0,15 мг). Оба варианта одинаково положительно влияли на уровень ЛПНП (снижение на 7% за 6 мес), но по влиянию на уровень ЛПВП Фемостон 1/5 оказался значительно эффективнее (увеличение на 8,6% и снижение на 3,5% соответственно; p < 0,001) [64]. Все это существенно снижает риск сердечно-сосудистых заболеваний у женщин в постменопаузе. Таким образом, совместное применение Фемостона с андрогенами может иметь потенциальные преимущества у женщин с психоэмоциональными и сексуальными расстройствами, вызванными андрогенным дефицитом и не купирующимися традиционной ЗГТ.
Заключение
В настоящее время в мировой практике имеется огромный опыт применения эстрогенной и эстроген-гестагенной заместительной терапии, однако накопилось все больше данных о том, что у ряда пациенток без коррекции возрастного андрогенного дефицита не удается повысить качество жизни. Андрогензаместительная терапия ввиду отсутствия знаний о роли андрогенов, а также из-за большого количества предрассудков об андрогенах как «мужских» половых гормонах по-прежнему не находит широкого применения. В настоящее время отсутствуют алгоритмы применения андрогенов у женщин, неизвестны дозировки, при которых была бы достигнута наибольшая эффективность с наименьшими побочными эффектами, а также недостаточно изучены вопросы безопасности длительного применения андрогенов.
Литература
- Azziz R., Nestler J. E., Dewailly D. Androgen excess disorders in women. Second Edition. Humana Press, 2007.
- Diamanti-Kandarakis E., Mitrakou A., Hennes M. M., Platanissiotis D., Kaklas N., Spina G., Georgiadou E., Hoffmann R. G., Kissebah A. H., Raptis S. Insulin sensitivity and antiandrogenic therapy in women with polycystic ovary syndrome // Metabolism, 1995, vol. 44, p. 525–531.
- Dunaif A., Green G., Futtermeit W., Dobrjansky A. Suppression of hyperandrogenism does not improve of peripheral or hepatic insulin resistance in the polycystic ovary syndrome // J Clin Endocrinol Metab, 1990, vol. 70, p. 699–704.
- Lasco A., Cucinotta D., Gigante A., Denucco G., Pedulla M., trifiletti A., Fristina N. No changes of peripheral insulin resistance in polycystic ovary syndrome after long-term reduction of endogenous androgens with leuprolide // Eur J Endocrinol, 1995, vol. 133, p. 718–722.
- Sherwin B. B. Use of combined estrogen-androgen preparations in the postmenopause: evidence from clinical studies // Int J Fertil Womens Med, 1998, vol. 43, p. 98–103.
- Guay A. T. Decreased testosterone in regularly menstruating women with decreased libido: a clinical observation // J Sex Marital Ther, 2001, vol. 27, p. 513–519.
- Braunstein G. D., Sundwall D. A., Kate M., Shifren J. L., Buster J. E., Simon J. A, Bachman G., Aguirre O. A., Lucas J. D., Rodenberg C., Buch A., Watts N. B. Safety and efficacy of a testosterone patch for the treatment of hypoactive sexual desire disorder in surgically menopausal women: randomized placebo-controlled trial // Arch Intern Med, 2005, vol. 165, p. 1582–1589.
- Buster J. E., Kingsberg S. A., Aguirre О., Brown C., Breaux J. G., Buch A., Rodenberg C. A., Wekselman K., Casson P. Testosterone patch for low sexual desire in surgically menopausal women: A randomized trial // Obstet Gynecol, 2005, vol. 105, p. 944–952.
- Davis S. R., Bouchard C., Kroll R., Moufarege A., Von Schoultz B. The effect of a testosterone transdermal system on hypoactive sexual desire disorder in postmenopausal women not receiving systemic estrogen therapy, the aphrodite study. 82 nd Annual Meeting of the Endocrine Society; Boston USA, 2006.
- Nathorst-Boos J., Floter A., Jarcander-Rollf M. Treatment with percutaneous testosterone gel in postmenopausal women with decreased libido-effects on sexuality and psychological well-being // Maturitas, 2006, vol. 53, p. 11–18.
- Burger H. G. Androgen production in women // Fertil Steril, 2002, vol. 77 (Suppl 4), p. 3–5.
- Balthazart J. Steroid control and sexual differentiation of brain aromatase // J Steroid Biochem Mol Biol, 1997, vol. 61, p. 323–339.
- Southren A. L., Gordon G. G., Tochimoto S. Further study of factors affecting the metabolic clearance rate of testosterone in man // J Clin Endocrinol Metab, 1968, vol. 28, p. 1105–1112.
- Guay A., Munarriz R., Jacobson J., Talakoub L., Traish A., Quirk F., Goldstein I., Spark R. Serum androgen levels in healthy premenopausal women with and without sexual dysfunction: Part A. Serum androgen levels in women aged 20–49 years with no complaints of sexual dysfunction // J Impot Res, 2004, vol. 16, p. 112–120.
- Labrie F., Belanger A., Cusan L., Gomez J. L., Candas B. Marked decline in serum concentrations of adrenal C19 sex steroid precursors and conjugated androgen metabolites during aging // J Clin Endocrinol Metab, 1997, vol. 82, p. 2396–2402.
- Orentreich N., Brind J. L., Riser R. L., Vogelraan J. H. Age changes and sex differences in serum dehydroepiandrosterone sulfate concentrations through out adulthood // J Clin Endocrinol Metab, 1984, vol. 59, p. 551–555.
- Pancer C., Guay A. Testosterone replacement therapy in naturally and surgically menopausal women // J Sex Med, 2009, vol. 6, p. 8–18.
- Riverra-Woll L. M., Papalia M., Davis S. R., Burger H. G. Androgen insufficiency in women: diagnostic and therapeutic implications // Human Reproduction Update, 2004, vol. 10, № 5, p. 421–432.
- Mudali S., Dobs A. S., Ding J., Cauley J. A., Szklo M., Golden S. H. Endogenous postmenopausal hormones and serum lipids: the Atherosclerosis Risk in Communities Study // J Clin Endocrinol Metab, 2005, vol. 90, p. 1202–1209.
- Lambrinoudaki I., Chrisotdoulakos G., Rizos D., Economou E., Argeitis J., Vlachou S., Creatsa M., Kouskouni E., Botsis D. Endogenous sex hormones and risk factors for atherosclerosis in healthy Greek postmenopausal women // Eur J Endocrinol, 2006, vol. 154, p. 907–916.
- Debing E., Peeters E., Duquet W., Poppe K. Velkieners B., Brande P. Van de. Endogenous sex hormone levels in postmenopausal women undergoing carotid artery endarterectomy // Eur J Endocrinol, 2007, vol. 156, p. 687–693.
- Vrionidou A., Papatheodorou A., Tavridou A., Terzi Th., Loi V., Vatalas I.-A., Batakis N., Рhenekos C., Dyonissou-Asteriou A. Association of hyperandrogenemic and metabolic phenotype with carotid intima-media thickness in young women with polycystic ovary syndrome // Obst gyn Surv, 2006, vol. 61, № 2, р. 104–106.
- Hickok L. R., Toomey C., Speroff L. A comparison of esterified estrogens with and without methyltestosterone: effects on endometrial histology and serum lipoproteins in postmenopausal women // Obstet Gynecol, 1993, vol. 82, p. 919–924.
- Shifren J. L., Davis S., Moreau M., Waldbaum A., Bouchard C., DeRogatis L., Derzhko C., Baernson P., Kakos N., O’Neill S., Levine S., Wekselman K., Buch A., Rodenberg C., Kroll L. Testosterone patch for the treatment of hypoactive sexual desire disorder in naturally menopausal women: results from the INTIMATE NM 1 study // Menopause, 2006, vol. 13, p. 770–779.
- Floter A., Nathorst-Boos J., Carlstrom K., von Schoulz B. Serum lipids in oophorectomized women during estrogen and testosterone replacement therapy // Matutritas, 2004, vol. 47, № 2, p. 123–129.
- Bell R. G., Davison S. L., Papalia M.-A., McKenzie D., Davis S. Endogenous androgen levels and cardiovascular risk profile in women across the adult life span // Menopause, 2007, vol. 14, № 4, p. 630–638.
- Khatibi A., Agardh C.-D., Shakir Y. A., Nerbrand C., Nyberg P., Lidfeldt J., Samsioe G. Could androgen protect middle aged women from cardiovascular events. A population-based study of Swedish women. The Women’s Healh in the Lund Area (WHILA) study // Climacteric, 2007, vol. 10, № 5, p. 386–392.
- Manolakou P., Angelopoulou R., Bakoyiannis C., Bastounis E. The effects of endogenous and exogenous androgens on cardiovascular disease risk factors and progression // Reprod Biol Endocr, 2009, vol. 7, p. 44.
- Bernini G. P., Moretti A., Sgro M., Argenio G. F., Barlascini C. O., Cristofani R., Salvetti A. Influence of endogenous androgens on carotid wall in postmenopausal women // Menopause, 2001, vol. 8, p. 43–50.
- Evans D. J., Hoffman R. G., Kalkhoff R. K., Kissebach A. H. Relationship of androgenic activity to body fat topography, fat cell morphology, and and metabolic aberrations in premenopausal women // J Clin Endocr Metab, 1983, vol. 57, p. 304–310.
- Peiris A. N., Mueller R. A., Struve M. F., Smith G. A., Kissebah A. H. Relationship of androgenic activity to splanchnic insulin metabolism and peripheral glucose utilization in premenopausal women // J Clin Endocr Metab, 1987, vol. 64, 162–169.
- Volpi E., Lieberman S. A., Ferrer D. M., Gilkison Ch. R., Rassmussen B. B., Nagamani M., Urban R. G. The relationship between testosterone body composition, and insulin resistance. A lesson from a case of extreme hyperandrogenism // Diabetes Care, 2005, vol. 28, № 2, p. 429–432.
- Diamanti-Kandarakis E., Spina G., Kouli Ch., Migdalis I. Increased endothelin levels in women with polycystic ovary syndrome and the beneficial effect of metformin therapy // Journ Clin Endocr Met, 2001, vol. 86., № 10, p. 4666–4673.
- Barba M., Schunemann H., Sperati F., Akl E., Mussico F., Guyatt G., Muti P. The effects of metformin on endogenous androgens and SHBG in women: a systematic review and meta-analisis // Clin Endocr, 2009, vol. 70, № 5, p. 661–670.
- Manolakou P., Angelopoulou R., Bakoyiannis Ch., Bastounis E. The effects of endogenous and exogenous androgens on cardiovascular disease risk factors and progression // Reprod Biol Endocrinol, 2009, vol. 7, p. 44–52.
- Bernini G. P., Sgro M., Moretti A., Argenio G. F., Barlascini C. O., Cristofani R., Salvetti A. Endogenous androgens and carotid intimal-medial thickness in women // J Clin Endocrinol Metab, 1999, vol. 84, p. 2008–2012.
- Golden S. H., Maguire A., Ding J., Crouse J. R., Cauley J. A., Zacur H., Szklo M. Endogenous postmenopausal hormones and carotid atherosclerosis: a case-control study of the Atherosclerosis Risk in Communities Cohort // Am J Epidemiol, 2002, vol. 155, p. 437–445.
- Montalcini T., Gorgone G., Gazzaruso C., Sesti G., Perticone F., Pujia A. Role of endogenous androgens on carotid atherosclerosis in non-obese postmenopausal women // Nutr Metab Cardiovasc Dis., 2007, vol. 17, p. 705–711.
- Debing E., Peeters E., Duquet W., Poppe K., Velkieners B., Brande P. Van de. Endogenous sex hormone levels in postmenopausal women undergoing carotid artery endarterectomy // Eur J Endocrinol, 2007, vol. 156, p. 687–693.
- Hak A. E., Witteman J. C. M., de Jong F. H., Geerlings M. I., Hofman A., Pols H. A. Low levels of endogenous androgens increase the risk of atherosclerosis in elderly men: the Rotterdam Study // J Clin Endocrinol Metab, 2002, vol. 87, p. 3632–3639.
- Worboys S., Kostopoulos D., Teede H., McGrath B., Davis S. Evidence that parenteral testosterone therapy may improve endothelium-dependend and endothelium-independend vasodilatation in postmenopausal women already receiving estrogen // Journ Clin Endocr Met, 2001, vol. 86, № 1, p. 158–161.
- Tok E. C., Ertunc D., Oz U., Camdeviren H., Ozdemir G., Dilek S. The effect of circulating androgens on bone mineral dencity in postmenopausal women // Maturitas, 2004, vol. 48, № 3, p. 235–242.
- Davis S. R., McCloud P., Strauss B. J., Burger H. Testosterone enhances estradiols effects on postmenopausal bone density and sexuality // Maturitas, 2008, vol. 61, p. 17–26.
- Dolan S. E., Carpenter S., Grinspoon S. Effects of weight, body composition, and testosterone on bone mineral density in HIV-infected women // Journ of AIDS, 2007, vol. 45, № 2, p. 161–167.
- Rishpon-Meyerstein N., Kilbridge T., Simone J., Fried W. The effect of testosterone on erythropoietin levels in anemic patients // Blood, 1968, vol. 31, № 4, p. 453–460.
- Ferucci L., Maggio M., Bandinelly S., Basaria S., Lauretani F., Ble A., Valenti G., Ershler W. B., Guralinik J. M., Longo D. L. Low testosterone levels and the risk of anemia in older men and women // Arch Intern Med, 2006, vol. 166, № 13, p. 1380–1388.
- Behler C. M., Shade S. B., Gregory K., Abrams D. I., Volberding P. A. Anemia and HIV in the antiretroviral era: potential significance of testosterone // Blood, 2004, p. 104, abstract 3722.
- Berria R., Gastaldelli A., Lucidi S., Belfort R., De Filippis E., Easton C., Britzki R., Cusi C., Jovanovic L., DeFronzo R. Reduction in hematocrit level after pioglitasone treatment is correlated with decreased plasma free testosterone level, not hemodilution, in women with polycystic ovary syndrome // Clin Pharm Ther, 2006, vol. 80, p. 105–114.
- Bachmann G. A., Bancroft J., Braunstein G., Burger H., Davis S., Dennerstein L., Goldstein I., Guay A., Leiblum S., Lobo R. et al. Female androgen insufficiency: the Princeton consensus statement on definition, classification and assessment // Fertil Steril, 2002, vol. 77, p. 660–665.
- Bachmann G. A. Androgen cotherapy in menopause: evolving benefits and challenges // Am J Obstet Gynecol, 1999, vol. 180, p. 308–311.
- Radestad A. F. Testosterone treatment in women — an overviev // Cur Wom Heal Rev, 2009, vol. 5, № 1, p. 29–43.
- Flooter A., Nathorst-Boos J., Carlstrom K., Ohlsson C., Ringertz H., von Schoultz B. Effects of combined estrogen/testosterone therapy on bone and body composition in oophorectomized women // Gynec Endocr, 2005, vol. 20, № 3, p. 155–160.
- Arlt W. Androgen therapy in women // Eur Journ Endocr, 2006, vol. 154, p. 1–11.
- Miller K. K., Biller B. M. K., Beauregard C., Lipman J. G., Jones J., Schoenfeld D., Sherman J. C., Swearigen B., Loeffler J, Klibanski A. Effects of testosterone replacement in androgen-deficient women with hypopituitarism: a randomized, double-blind, placebo-controlled study // J Clin Endocrinol and Metabol, 2006, vol. 91, № 5, p. 1683–1690.
- Dolan S., Wilkie S., Aliabadi N., Sullivan M. P., Basgoz N., Davis B., Grispoon S. Effects of testosterone administration in human immunodeficiency virus-infected women with low weight. A randomized placebo-controlled study // Arch Intern Med, 2004, vol. 164, p. 897–904.
- Dolan S., Collins M., Lee H., Grispoon S. Effects of long-term testosterone administration in HIV-infected women: a randomized placebo-controlled trial // AIDS, 2009, vol. 23, p. 951–959.
- Herbst K. L., Calof O. M., Hsia S. H., Sinha-Hikim I., Woodhouse L. J., Buchanan T. A., Bhasin S. Effects of transdermal testosterone administration on insulin sensitivity, fat mass and distribution, and markers of inflammation and thrombolysis in human immunodeficiency virus-infected women with mild to moderate weight loss // Fertil Steril, 2006, vol. 85, № 6, p. 1794–1802.
- Gruber D. M., Sator M. O., Kirhengast S., Joura E. A., Huber G. C. Effect of percutaneous androgen replacement therapy on body composition and body weight in postmenopausal women // Maturitas, 1998, vol. 29, № 3, p. 253–259.
- Witherby S. Efficacy and safety of topical testosterone for atrophic vaginitis in breast cancer patients on aromatase inhibitors: a pilot study // Breast Canser Res Treat, 2007, 106: abstract 6086.
- Labrie F., Archer D., Bouchard C., Fortier M., Cusan L., Gomez G. L., Girard G., Baron M., Ayotte N., Moreau M., Dube R., Cote I., Labrie C., Lavole L., Berger L., Gillbert L., Martel C., Balser J. Intravaginal dehydroepiandrosterone (Prasterone), a physiological and highly efficient treatment of vaginal atrophy // Menopause, 2009, vol. 16, № 5, p. 907–722.
- Verhaar H. J. L, Damen C. A., Duursma Scheven B. A. A. A comparison of action of pro-gestins and estrogen on the growth and differentiation of normal adult human osteoblasl-like cells in vitro // 11 Bone, 1994, v. 15, p. 307–311.
- Voetberg G. A., Netelenbos J. C., Kcnemans P. et al. Estrogen replacement therapy con-tinuosly combined with four different dosages of dydrogesteronc; effect on calcium and lipid metabolism // J Clin Endocrin Metab, 1994, v. 79, p. 1465–1469.
- Siddle N., Jesinger D., Whitehead M. // Br J Obst Gynaecol, 1990, vol. 97, p. 1093–1100.
С. Ю. Калинченко, доктор медицинских наук, профессор С. С. Апетов, кандидат медицинских наук
РУДН, Москва
Контактная информация об авторах для переписки
Снижение тестостерона – чем опасно?
О том, что у женщины снижается количество тестостерона, свидетельствуют определенные изменения во внешности. Развиваются они при отсутствии должной терапии и достаточно медленно, потому заметить их практически невозможно. К основным признакам снижения гормона можно отнести:
- Появление жировых отложений.
- Образование дряблости кожи и мышц.
- Повышение хрупкости костной ткани.
- Снижение качества кожи, волос, а также ногтевых пластин. Кожные покровы становятся сухими, ногти часто ломаются.
Частое появление депрессии и снижение настроения. Вместо того, чтобы круглосуточно радоваться каждому дню, женщина начинает впадать в депрессивное состояние и ощущает усталость. Одновременно с этим снижение тестостерона негативно сказывается на памяти и на концентрации. Женщины начинают все хуже воспринимать информацию и перестают полноценно запоминать ее.
Все это достаточно неприятные явления, которые не порадуют ни одну женщину. Именно по этой причине так важно знать, как эффективно повысить уровень тестостерона. Сделать это можно разными способами – кушать специальные продукты, использовать народные методики и современные медикаменты.
Норма тестостерона для женщин
У разных клинических лабораторий нормальный показатель концентрации может существенно отличаться. Это связано как с особенностями используемого оборудования, так и собственно метода определения.
Однако большинство лабораторий в качестве физиологической нормы указывают пределы от одиннадцати до тридцати трех нано моль на литр для мужчин и от ноль целых двадцать четыре сотых до трех целых восьми десятых для женщин.
Продукты для повышения тестостерона
Если в организме женщины отсутствуют те или иные патологические состояния, возникающие по причине нехватки тестостерона, его можно повысить естественным способом.
Чтобы повысить тестостерон естественным методом, первое на что нужно обратить свое внимание, это на качество своего ежедневного питания.
В свой стандартный рацион очень важно включить продукты, в которых содержатся вещества, оказывающие прямое воздействие на выработку столь важного тестостерона. Среди основных таких продуктов можно отметить:
- Все виды мяса специальных нежирных сортов;
- Яйца;
- Все виды молочных продуктов;
- Рыба и все возможные морские дары;
- Орешки и разные сорта семечек;
- Все виды и категории овощей и фруктов;
- Каши из круп.
Как уже отмечалось выше, гормон секретируется из полезной формы холестерина. Именно по этой причине в рацион нужно включить максимальное количество продуктов и жиров животного происхождения и иные специальные продукты питания, которые влияют на строительную основу для тестостерона – холестерин.
Вот несколько самых основных продуктов, которые повышают общее количество хорошего холестерина:
- Нужно употреблять как можно больше мяса. Это идеальный источник важного для организма белка и холестерина. Белок эффективно строит мышечные волокна, а чем их больше, тем большее количество тестостерона вырабатывается.
- Орехи – это природные бомбочки с полезным жиром. Они дают организму нужный холестерин. Оптимальным вариантом является употребление специального бразильского ореха.
- Оливки всех сортов и авокадо – один из основных источников полезного жира.
- Зеленая брокколи – это отличный источник индола. Это вещество, которое способствует снижению вредного холестерина и выработке хорошего.
- Оливковое масло – очень хорошая заправка для всех свежих салатов. Оно помогает организму эффективнее всасывать полезный холестерин.
- Заправка в виде бальзамического уксуса – поддерживает уровень инсулина в нужном положении.
Определенные компоненты нельзя отнести к доступным, но тем не менее можно все равно свободно модифицировать их, сочетать друг с другом и заменять отсутствующие компоненты на те, что есть в распоряжении.
Существует очень важный химический элемент, в котором присутствует большое количество тестостерона. Это цинк! Получить его в большом количестве можно из рыбы и морепродуктов.
Если каждый день кушать большое количество овощей, можно насытить свой организм полезными макро- и микроэлементами, способными усилить восприимчивость рецепторных клеток к гормону. Никакого особого различия между овощами нет, кушать можно все и много, отдавая предпочтение тем продуктам, которые вызревают не в земле, но над ее поверхностью.
Не менее важно употреблять фрукты. Предпочтение стоит отдать таким продуктам, как:
- Все виды цитрусовых;
- Абрикос;
- Хурма;
- Дыня;
- Виноград;
- Ананас;
- Груша.
Стоит каждый день кушать множество разных круп. Это продукты, имеющие в составе клетчатку. Она в свою очередь оказывает положительное воздействие на кровообращение и существенно улучшает функционирование эндокринной системы.
По каким симптомам можно заподозрить
Симптомы дефицита мужского гормона в женском организме достаточно неспецифичны, и схожи с проявлениями многих других патологических состояний, негативно сказывающихся на работе эндокринной системы.
Среди проявлений можно выделить:
- Ничем не спровоцированные перепады настроения или его стойкое снижение. Иногда не стоит спешить с началом лечения депрессии. Иногда крайне похожие проявления могут наблюдаться и при нехватке тестостерона.
- Стабильное ощущение усталости, которое не проходит даже после девяти-десяти часового сна, что также может быть проблемой, так как низкая концентрация тестостерона приводит к расстройствам сна.
- Негативно влияет дефицит мужских половых гормонов и на половую жизнь. Характерно резкое снижение полового влечения, сухость влагалища, а также проблемы с достижением оргазма.
- Волосы могут становиться ломкими и выпадать. При этом это касается как волос на голове, так и растущих на других частях тела.
- Проблемы с концентрацией внимания. Задачи, которые ранее не вызывали совершенно никаких затруднений, могут при низком тестостероне потребовать достаточно много времени и сил.
- Характерна также и тревожность. При этом выраженность этого проявления может варьироваться от незначительной до полноценных панических атак.
Народные средства для увеличения тестостерона
Чтобы эффективно повысить количество тестостерона, можно употреблять специальные лечебные настои, травяные натуральные отвары и все возможные полезные настойки. Делать подобные напитки можно из таких компонентов, как:
- Плоды шиповника;
- Ягоды рябины;
- Мякоть алоэ;
- Корень женьшеня;
- Дамиан;
- Дикий ямс.
Подобные продукты позволяют не только увеличить общее количество тестостерона, но одновременно улучшают общее состояние организма. Если подобных средств окажется недостаточно, можно готовить специальные лечебные настои и смеси. Вот несколько самых действенных из них.
Цветочная пыльца
Чтобы приготовить лечебное средство данной категории, нужно подготовить следующие компоненты:
- 1⁄2 кг обычной купленной в аптеке пыльцы;
- Две банки сгущенки.
Ингредиенты следует поместить в небольшую емкость, тщательно перемешать все и убрать в холодильник. Смесь выдерживается на протяжении двух полных недель.
Средство нужно употреблять сначала по одной чайной ложке, за 4 дня доведя количество до употребления одной столовой ложки. Периодичность приема составляет один раз в день, и употреблять продукт нужно строго за 20 минут до еды.
Полезный салат
Очень полезно есть салат, который готовится из таких компонентов, как:
- Сельдерей;
- Красная и белая капуста;
- Яблоки.
Заправляется подобный салат обычным растительным маслом, в которое добавляется столовое вино и яблочный уксус. Это очень полезное блюдо, которое не только повысит количество тестостерона в крови, но улучшит общее самочувствие.
Отвар из рябины и шиповника
Чтобы приготовить лечебный настой потребуется взять три небольшие горсточки смеси плодов, положить в термос и залить литром горячей воды. Полученный настой нужно пить вместо чая, не добавляя в напиток сахар.
Полезная смесь из меда и орехов
Необходимо взять немного орешек, тщательно измельчить их и смешать с медом. Полученную смесь желательно употреблять каждый день в объеме 30 г три раза за сутки.
Имбирный чай
Для приготовления данного лечебного напитка нужно взять 20 грамм корня и залить их 300 мл кипятка. Чай требуется настаивать на протяжении 5 часов. По готовности напиток нужно пить четыре раза в день по 100-120 мл.
Отвар из шишек хмеля
Для приготовления лечебного средства нужно взять одну столовую ложку продукта и залить ее 300 мл горячей воды. Небольшая емкость с готовой смесью ставится на медленный огонь. Настой требуется отваривать примерно 10 минут. Готовый отвар требуется хорошо остудить и употреблять по 100 мл два раза в сутки.
Медикаментозное лечение
Если тестостерон значительно снижен, специалисты назначают женщинам консервативное лечение. В стандартную схему терапии входят препараты, в которых присутствует искусственный или природный тестостерон.
Современные медикаменты выпускаются в разных формах. Можно принимать обычные таблетки, проставлять инъекции, а также использовать специальные пластыри или гели. Среди самых популярных таблетированных препаратов можно отметить:
- Андриол – лекарственное средство, которое изготавливается на основе специального тестостерона ундеканоат;
- Метилтестостерон.
Большой популярностью пользуется препарат для проставления инъекций – Тестостерон Пропионат. Что касается трансдермального метода, то здесь можно отметить пластырь Андродерм. Он наклеивается прямо на поверхность кожи – на спину, на бедро или на область живота. Можно приобрести гель Андрогель и два-три раза в день наносить на живот или на плечи.
Гормонозаместительная терапия характеризуется наличием большого количества противопоказаний. По этой причине она должна осуществляться исключительно под контролем опытного квалифицированного врача и строго после тщательного обследования. Как только специалист убедиться в отсутствии хронических патологий, он назначит соответствующие медикаменты и будет контролировать их употребление.
Дополнительные методы увеличения тестостерона
Если отклонения тестостерона являются незначительными, полностью нормализовать их количество можно естественными способами. Вот несколько рекомендаций, соблюдение которых позволит эффективно повысить количество тестостерона в организме:
- Спать нужно не менее 8 ч;
- Важно избегать каких-либо стрессовых ситуаций;
- Ежедневно требуется нужно употреблять витамин С, причем в количестве не менее 1000 мг;
- В постоянном режиме требуется пить витамины категории А, В и Е;
- Важно регулярно заниматься физическими упражнениями и легкими силовыми нагрузками;
- Необходимо регулярно заниматься сексом;
- Желательно исключить из дневного рациона грейпфруты;
- Крайне важен отказ от спиртных напитков.
Если снижение тестостерона является незначительным, вполне достаточно перейти на данный режим. Так можно значительно улучшить не только свое здоровье, но также сексуальность и привлекательность.
Спорт и тестостерон
Умеренная физическая нагрузка также положительно влияет на выработку тестостерона. Подобное преимущество основано на том, что увеличивается рост мышечных тканей и снижается количество лишнего жира. Существует несколько несложных правил, которые нужно обязательно соблюдать в процессе организации тренировок:
- Стоит выбирать такие базовые упражнения, которые задействуют большие мышцы;
- Высоко интенсивные тренировки способствуют росту уровня тестостерона;
- Каждое упражнение нужно выполнять, максимум, два-три повторения. Работать до полного отказа не нужно;
- Отдых между подходами должен колебаться от одной до двух минут.
Время от времени свои тренировки можно дополнять высоко интенсивным интервальным тренингом. Суть данной методики заключается в чередовании коротких, достаточно интенсивных и более долговременных упражнений. Вариантов таких тренировок существует достаточно много, можно без проблем подобрать оптимальную схему.
Необходимо знать, что в процессе занятий спортом нужно избегать такого явления, как перетренированность, так как можно добиться прямо противоположного эффекта. Если заниматься спортом до появления таких признаков, как отсутствие физических сил, появление боли, вялость и перманентная усталость, можно получить такой неприятный эффект, как снижение количества тестостерона.
Заниматься спортом требуется исключительно в меру собственных возможностей и физических сил.
Физическая активность
Для активации кровообращения и повышения уровня тестостерона рекомендовано заниматься:
- спортивной ходьбой;
- бодибилдингом;
- легкой атлетикой;
- плаванием.
Нагрузки должны быть интенсивными и постоянными, не меньше 3 раз в 7 дней. Сеты (2-3) необходимо чередовать с кратковременным отдыхом (1-2 мин). При такой физической активности будут уходить лишний жир и расти мышцы.
Чтобы не снизить тестостерон, во время занятий спортом не должно быть:
- усталости;
- упадка сил;
- вялости;
- боли.
Полезные витамины и разные спортивные добавки
Выстроенное грамотно питание дает возможность организму эффективно синтезировать в организме тестостерон. А наличие же современных технологий позволяет делать это еще более эффективно. Говоря иными словами, правильное питание нужно обязательно дополнять специальными качественными добавками. Среди самых эффективных и доступных из них можно отметить:
- D3. Это не витаминная добавка, но гормон, получаемый нашим телом от обычного солнечного света. Если женщине не посчастливилось жить в солнечных теплых регионах, если работа осуществляется в офисе, добавка данного витамина будет оптимальным вариантом.
- Омега-3. Качественный рыбий жир, употребляемый каждый день, способствует эффективной выработке гормона.
- Специальный сывороточный протеин. Это добавка, оптимально подходящая не только для мужчин, но также для женщин. При помощи данной добавки можно получить положенную для здоровья норму белка. Это вещество позволяет восстанавливать, защищать и наращивать нужные для тела мышцы.
- Кофеин. Как показали проведенные многочисленные исследования, употребление 100 мг обычного кофеина перед походом в спортзал, способствует повышению выработки необходимого гормона.
Хорошее питание и оптимальная физическая нагрузка должны сопровождаться организацией полноценного сна.
Учеными доказано, что синтез тестостерона осуществляется исключительно тогда, когда человек спит. Если хронически недосыпать, если долгое время спать менее 5 часов в день, у организма просто не будет времени вырабатывать столь нужный гормон. Кроме выработки тестостерона, полноценный сон и отдых также снижает количество кортизола, который имеет свойство блокировать тестостерон.
Чтобы обеспечить себе полноценный ночной отдых, стоит оградить себя от смартфона, от принятия вечером особых бодрящих напитков. Все что нужно сделать, принять теплую расслабляющую ванну или душ.
Витамины
К повышающим тестостерон биологически активным добавкам и витаминам относят:
- Трибулус на основе сапонинов из стелющихся якорцев.
- Витамин С, который:
- удерживает андроген в норме;
- укрепляет кости;
- нейтрализует кортизол;
- восстанавливает организм;
- регенерирует ткани;
- избавляет от плохого холестерина.
- Витамин Д. Этот компонент:
- нормализует всасывание фосфора и кальция;
- поддерживает порядок в гормональной и иммунной системах;
- придает организму силы;
- удерживает в норме вес.
- Рыбий жир, выполняющий следующие функции:
- улучшение здоровья организма;
- активация биосинтеза тестостерона;
- усиление стрессоустойчивости;
- нормализацию настроения и давления.
- Витамин Е, он:
- восстанавливает репродукцию;
- очищает от токсинов;
- участвует в выработке тестостерона;
- замедляет старение;
- укрепляет сердце.
- Витамины группы В, которые также участвуют в:
- поддержке здоровья кожи;
- синтезе белка;
- нормализации пищеварения;
- регулировке функционирования нервной системы;
- защите печени;
- строительстве для нуклеиновых кислот.
Эффективное управление стрессом
Как известно, часто повторяющиеся стрессы вызывают образование большого количества кортизола. В небольших дозировках он относительно безвреден и необходим. Он эффективно запускает жизненно важную реакцию в теле женщины. Проблемы могут начаться тогда, когда стрессовая ситуация несколько затягивается по времени.
У женщины автоматически начинаются проблемы со здоровьем, соответственно не может быть и речи о том, чтобы осуществлялась выработка тестостерона. Чтобы эффективно справляться со стрессом, нужно регулярно делать медитации, простые дыхательные упражнения и прогулки.
Как повысить тестостерон: ключевые микроэлементы
В синтезе тестостерона принимают участие несколько различных питательных веществ. Среди них витамин Д3 и цинк, которые очень часто поступают в недостаточном количестве, приводя к дефициту.
Цинк — важный минерал, который в естественном виде содержится в некоторых продуктах. Дефицит цинка сопровождается широким спектром симптомов, так как он участвует во множестве важных для организма процессов 5,6.
Витамин Д и цинк — два ключевых микроэлемента необходимых для естественной выработки тестостерона
Витамин Д вырабатывается во время нахождения на солнце (в незащищенных участках кожи). В климате, где солнца мало, риск развития дефицита этого витамина очень велик.
Для того, чтобы обеспечить организм витамином Д нет нужды часами принимать солнечные ванны, но регулярное пребывание на солнце жизненно необходимы.
Стресс — натуральный убийца тестостерона. В состоянии стресса надпочечники выделяют гормон кортизол, который подавляет действие тестостерона. В этом случае даже если естественный уровень тестостерона у вас высок, его эффективность будет значительно снижаться. Избегайте стрессовых ситуаций 7!
При стрессе выделяется гормон кортизол, который подавляет действие тестостерона
Рекомендуем: Дефицит витаминов и минералов: как понять, каких витаминов не хватает?
Сохранение уровня тестостерона
Увеличить объем тестостерона в организме при помощи лекарств или народных средств лечения достаточно просто. Намного сложнее сохранить полученный результат. Чтобы поддерживать уровень гормона на высоком уровне долгое время, стоит придерживаться следующих рекомендаций:
- Важно полностью отказаться от вредных привычек – курение и алкоголь;
- Необходимо вести активный образ жизни, заниматься спортом;
- Требуется постоянно следить за своим весом – категорически запрещено допускать увеличение массы тела;
- Лекарственные препараты нужно принимать исключительно по рекомендации врачей;
- Необходимо избегать каких-либо стрессовых ситуаций и разных нервных перегрузок;
- Каждый год желательно проходить медицинское обследование.
Женский организм – это достаточно сложная система. Для ее идеального и полноценного функционирования баланс гормонов очень важен. Следует вести здоровый образ жизни, правильно питаться. Только так можно избежать отклонений в количестве тестостерона.
Состояния, сопровождающиеся похожими клиническими проявлениями
Симптомы пониженного уровня тестостерона у женщин достаточно неспецифичны, и могут напоминать клинические проявления многих других патологических состояний. Самостоятельно разобраться в причине появления беспокоящих проявлений не представляется возможным, так как может понадобиться консультация не одного специалиста для постановки точного диагноза.
Среди заболеваний, клинические проявления которых могут быть похожими на дефицит тестостерона можно выделить нехватку гормонов щитовидной железы. Ухудшение состояния волос и кожи, изменения настроения и снижение трудоспособности не позволяют клинически дифференцировать эти два заболевания, необходимы дополнительные лабораторные исследования, которые и укажут причину подобных симптомов.
Большое депрессивное расстройство, для которого характерны снижение умственной трудоспособности, подавленное настроение, проблемы со сном, снижение полового влечения, потеря, или же наоборот, набор массы тела без явного изменения пищевых привычек.
Однако в случае с подобными расстройствами стоит сначала исключить возможную соматическую природу подобных состояний – похожие проявления характерны как для патологии щитовидной железы, так и собственно для нехватки тестостерона.