Фармакологические свойства препарата Омарон
Фармакодинамика. Комбинированное лекарственное средство, оказывающее выраженное антигипоксическое, ноотропное и сосудорасширяющее действие. Пирацетам активирует метаболические процессы в головном мозгу путем усиления энергетического и белкового обмена, повышения утилизации глюкозы клетками и их устойчивости к гипоксии, улучшает процессы межнейрональной передачи в ЦНС, регионарный кровоток в ишемизированной зоне. Циннаризин — селективный блокатор медленных кальциевых каналов, предотвращает поступление ионов кальция в клетки и уменьшает их содержание в депо плазмолеммы, снижает тонус гладких мышц артериол, уменьшает их реакцию на биогенные сосудосуживающие вещества (эпинефрин, норэпинефрин, дофамин, ангиотензин, вазопрессин). Оказывает сосудорасширяющий эффект (особенно сосудов головного мозга, усиливая антигипоксическое действие пирацетама), не влияя существенно на АД. Проявляет умеренную антигистаминную активность, уменьшает возбудимость вестибулярного аппарата, снижает тонус симпатической нервной системы. Повышает эластичность мембран эритроцитов, их способность к деформации, снижает вязкость крови. Фармакокинетика. Пирацетам: быстро и полностью всасывается в ЖКТ. Максимальная концентрация пирацетама в плазме крови достигается через 2–6 ч. Максимальная концентрация в ликворе — через 2–8 ч. Биодоступность составляет 100%. С белками плазмы крови не связывается. Проникает во все органы и ткани, проходит через плацентарный барьер. Выборочно накапливается в коре головного мозга, в основном в лобных, теменных и затылочных долях, мозжечке и базальных ганглиях. Не подвергается метаболизму. Через 30 ч более 95% выводится почками. Циннаризин: максимальная концентрация циннаризина в плазме крови определяется через 1–4 ч. С белками плазмы крови связывается на 91%. Активно и полностью метаболизируется. Период полувыведения составляет 4 ч. 1/3 м етаболитов выводится с мочой, 2/3 — с калом.
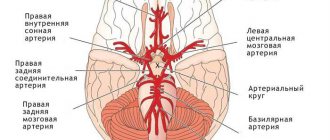
Острые нарушения мозгового кровообращения представляют собой одно из наиболее распространенных патологических состояний в клинической практике. По данным Всемирной федерации неврологических обществ, ежегодно в мире регистрируется не менее 15 млн инсультов. При этом есть основания считать, что эти данные явно занижены, так как в развивающихся странах многие случаи инсульта не регистрируются или вовсе остаются без внимания врачей по причине недоступности медицинской помощи. В России заболеваемость инсультом составляет 3,4 на 1000 человек в год. В абсолютных цифрах это составляет более 450 000 новых инсультов в год [6]. Последствия инсульта ложатся тяжелым бременем на общество, существенно снижая уровень семейной, социальной и трудовой адаптации пациентов.
Стремительный рост заболеваемости острыми нарушениями мозгового кровообращения, их «омоложение» формируют одну из актуальнейших проблем современной медицины — проблему реабилитации. Как правило, при благоприятном течении ишемического инсульта вслед за острым возникновением неврологической симптоматики наступает ее стабилизация и постепенный регресс. Предполагается, что в основе уменьшения выраженности неврологической симптоматики лежит процесс «переобучения» нейронов, в результате которого интактные отделы головного мозга берут на себя функции пострадавших. На клеточном уровне данный процесс обусловлен образованием новых дендритов и синапсов между нейронами, изменением электрофизиологических свойств нейрональных мембран. Есть данные [1, 2] о том, что активная двигательная, речевая и когнитивная реабилитация в восстановительном периоде ишемического инсульта благоприятно влияет на процесс «переобучения» нейронов и улучшает исход ишемического инсульта. Принято считать, что реабилитационные мероприятия следует начинать как можно раньше и систематически проводить в течение первых 6-12 мес после ишемического инсульта. В эти сроки темп восстановления утраченных функций максимален.
При проведении лечения и реабилитационных мероприятий следует принимать во внимание, что основная масса пациентов имеет, как правило, сопутствующую соматическую патологию. Это могут быть мерцательная аритмия, атеросклероз, дислипидемия, гипертоническая болезнь, сахарный диабет и т.д. Наличие сопутствующей патологии предполагает сочетанное применение до 5-10 и более препаратов с различными механизмами действия, что в конечном итоге приводит к проблеме полипрагмазии и связанными с нею негативными явлениями (потенцирование побочных эффектов, риск развития лекарственных поражений почек, печени и т.д.). Сложность для врача возникает и при подборе адекватного дозового режима для каждого препарата, а для пациента — его соблюдения, что приводит к ухудшению комплаенса или даже к отказу от лечения.
Результатом многочисленных попыток оптимизации фармакотерапии неврологических заболеваний стало создание комбинированных лекарственных средств, содержащих 2 и более компонента с различными механизмами действия, по разному влияющих на патогенез и клинические проявления конкретных форм патологии. Особую популярность приобрели комбинированные препараты, способствующие нормализации центральных регуляторных механизмов, улучшающие мозговой метаболизм и гемодинамику, стабилизирующие корково-подкорковые взаимодействия, содержащих активные ингредиенты как ноотропного, так и вазотропного действия. Очевидно, что объединение нескольких активных компонентов в одну таблетку делает прием лекарственных средств более простым и удобным. Но преимущества комбинированных препаратов этим далеко не ограничиваются. В современной фармакологии активно используется явление синергизма действия 2 и более различных активных веществ. Положительные эффекты, которые наблюдаются при одновременном поступлении в организм компонентов комбинированных препаратов, могут иметь принципиальное значение для усиления их терапевтического действия и улучшения переносимости больными.
Хорошим примером указанного синергизма является сочетание пирацетама и циннаризина, широко применяющееся в настоящее время для лечения сосудистой патологии мозга [4]. Первый из них действует на многие нейрохимические процессы. Не менее значимо и действие пирацетама на сосудистую систему: препарат влияет на степень адгезии тромбоцитов к поверхности эпителия сосудистой стенки, уменьшает агрегацию тромбоцитов и, таким образом, улучшает регионарный кровоток в ишемизированной зоне. Циннаризин — селективный блокатор кальциевых каналов сосудов головного мозга — улучшает мозговое кровообращение, оказывает клинически значимое влияние на микроциркуляцию. Ингибируя поступление в гладкомышечные клетки сосудов ионов кальция, он снижает тонус артериол, уменьшает их чувствительность к сосудосуживающим веществам (эпинефрин, норэпинефрин, дофамин, ангиотензин, вазопрессин) и предупреждает патологическую вазоконстрикцию. При этом циннаризин характеризуется высоким аффинитетом именно к сосудам головного мозга, увеличивает суммарный и регионарный мозговой кровоток, оказывая избирательное действие на спазмированные сосуды, не вызывая синдрома «обкрадывания», чем обеспечивает реализацию протекторного противоишемического действия. Важным преимуществом циннаризина следует считать его способность уменьшать возбудимость вестибулярного аппарата, что расширяет показания к его применению при вестибулярных дисфункциях.
В настоящее время в качестве комбинированного лекарственного средства, содержащего пирацетам и циннаризин, широко используется отечественный препарат омарон, содержащий в одной таблетке 0,4 г пирацетама и 0,025 г циннаризина. Активирующий эффект пирацетама, уменьшая седативное действие циннаризина, позволяет омарону оказывать нормотимическое действие, обеспечивая хорошую переносимость препарата при длительном применении. В свою очередь, седативные свойства циннаризина оптимально нивелируют явления повышенной активации ЦНС и связанные с ними симптомы возбуждения, нарушения сна, отмечающиеся в ряде случаев при терапии монопрепаратами пирацетама [3]. Омарон улучшает метаболизм мозга за счет нейропротекторного действия и оптимизации мозгового кровотока [5].
Целью настоящего исследования было изучение эффективности и безопасности применения препарата омарон в раннем восстановительном периоде ишемического инсульта для коррекции когнитивных, двигательных и речевых расстройств у пациентов.
Материал и методы
Исследование было проведено на базе отделения восстановительного лечения городской поликлиники №7 Воронежа.
В него были включены 120 пациентов, проходивших курс реабилитации после перенесенного ишемического инсульта. Из них инфаркт в бассейне правой средней мозговой артерии перенесли 50 (41,7%) человек, левой средней мозговой артерии — 54 (45%), в вертебрально-базилярном бассейне — 16 (13,3%). Время, прошедшее после перенесенного инсульта, колебалось от 28 до 262 дней, составляя в среднем 118,5±4,6 дня; преобладали пациенты (57,5%), которые перенесли острое нарушение мозгового кровообращения за 90-180 дней до исследования. Перенесенный инфаркт головного мозга был верифицирован с помощью КТ или МРТ головного мозга у 77 (64,2%) обследованных.
Критериями исключения больных из исследования служили повторный инсульт; наличие тяжелого двигательного, речевого, когнитивного дефицита, а также декомпенсация соматических заболеваний.
Клиническое состояние пациентов оценивали по результатам исследования неврологического статуса и данным дополнительных методов исследования.
Омарон назначался по 1-2 таблетки 3 раза в день в течение 1-3 мес в зависимости от тяжести заболевания, детям — по 1-2 таблетки 1-2 раза в день.
Для оценки эффективности проводимой терапии использовали следующие методы: 1) оценка выраженности неврологических симптомов в баллах; 2) краткая шкала оценки высших психических функций — MMSE (Mini-Mental State Examination); 3) оценка активности пациента в повседневной жизни (по индексу Бартель); 4) шкала общего клинического впечатления — CGI; 5) оценка переносимости и эффективности препарата (0-5 баллов).
Обследование больных проводили до начала терапии (1-й визит), через 2 нед лечения омароном (2-й визит) и после окончания лечебного курса (3-й визит).
Результаты и обсуждение
При неврологическом осмотре у большинства больных выявлялись координаторные (84,17%), чувствительные (95,8%) и двигательные (75,8%) нарушения в виде умеренного правостороннего гемипареза — у 43 (35,8%) пациентов, левостороннего гемипареза у 42 (35%). Реже встречались речевые расстройства: элементы моторной афазии — у 19 пациентов, сенсорной — у 3, смешанная афазия — у 5 человек.
Когнитивные изменения были отмечены у 69 (68%) больных со средним баллом по шкале MMSE 23,6±0,5. Индекс Бартел составил в среднем 72,7±1,6 балла, что соответствует умеренной зависимости больного от окружающих. В целом тяжесть инсульта у пациентов, включенных в исследование, при балльной оценке от 0 (нет изменений) до 7 (очень грубый дефицит) расценивалась как умеренно выраженный дефицит — 4,05±0,06 балла.
При оценке неврологического статуса у 120 больных по окончании курса лечения омароном отмечался постепенный регресс двигательных, чувствительных расстройств и координаторных нарушений, однако степень выраженности изменений не являлась статистически достоверной (табл. 1).
Статистически достоверное улучшение прослеживалось при оценке психических функций по шкале MMSE (р
<0,001); достоверно уменьшилась тяжесть инсульта к моменту окончания исследования (
р
<0,001) и повысилась активность больных в сфере повседневной жизнедеятельности — индекс Бартель (
р
<0,05) во всех группах пациентов (см. табл. 1).
Было выявлено достоверное влияние омарона на показатели сна — практически у всех больных улучшался процесс засыпания. Одновременно омарон достоверно (р
<0,001) уменьшал выраженность соматовегетативных проявлений — головной боли, головокружения (табл. 2).
Выявлено достоверное комплексное действие омарона на вегетативную дисфункцию, астенический синдром, снижение памяти, тревожность и пониженный фон настроения.
К моменту завершения исследования терапевтический эффект разной степени выраженности наблюдали у всех пациентов, в том числе очень хороший терапевтический эффект — у 11 (9,13%), хороший — у 80 (66,7%) и удовлетворительный — у 29 (24,17%) больных.
Таким образом, анализ литературных данных [1] и собственный клинический опыт позволяют констатировать, что омарон, как комбинированный препарат, позволяет повысить эффективность и расширить сферу применения входящих в него ингредиентов — пирацетама и циннаризина, обеспечивая одновременно этим повышением безопасность их применения.
Преимущества использования омарона в клинической практике выражаются в возможности применения доказанных стандартных эффективных сочетаний активных веществ в рамках одной лекарственной формы (упрощение процедуры выбора лечебного средства для практического врача); сокращении вынужденной полипрагмазии при сохранении или повышении эффективности лечения; улучшении комплаенса (удобство применения для больного и врача); повышении экономической доступности лечения.
Если учитывать низкие доходы пациентов, что требует разумного подбора лекарственных препаратов, обеспечивающих эффективность и соответствие стандартам лечения, то можно отметить, что отечественный препарат омарон удовлетворяет данным требованиям и может быть рекомендован для реабилитации перенесших инсульт пациентов на амбулаторном этапе их лечения.
Показания к применению препарата Омарон
Недостаточность мозгового кровообращения (атеросклероз сосудов головного мозга, восстановительный период ишемического и геморрагического инсульта, черепно-мозговой травмы, энцефалопатии различного генеза, интоксикации; другие заболевания ЦНС, сопровождающиеся снижением интеллектуально-мнестических функций (нарушение памяти, внимания, настроения), психоорганический синдром с преобладанием признаков астении и адинамии, астенический синдром; лабиринтопатия, синдром Меньера; отставание интеллектуального развития у детей; профилактика мигрени и кинетозов.
Эффективность Омарона у пациентов с дисциркуляторной энцефалопатией
Клиническое разнообразие ДЭ условно сводится к эмоционально–волевому, мнестическому, пирамидному, стволово–мозжечковому, паркинсоническому и другим синдромам [Шмидт Е.В., 1985, Бурцев Е.М. 1998, Яхно Н.Н., 2000]. Ведущую роль в формировании когнитивных нарушений при ДЭ играет разобщение лобных долей и подкорковых образований, что приводит к возникновению вторичной дисфункции лобных долей головного мозга. Согласно теории А.Р. Лурия, лобные доли отвечают за регуляцию произвольной деятельности: формирование мотивации, выбор цели деятельности, построение программы и контроль за ее достижением [5]. При этом дорзолатеральная лобная доля коры и ее связи со стриарным комплексом обеспечивают переключаемость внимания, что необходимо для смены алгоритма деятельности. Орбитофронтальные отделы участвуют в подавлении нерелевантных цели побуждений, обеспечивая таким образом устойчивость внимания и адекватность поведенческих реакций. Кроме того, орбитофронтальная лобная кора находится в тесной взаимосвязи с гиппокампом, обеспечивая устойчивость внимания в мнестической деятельности [7,9]. Поэтому лечение ДЭ должно быть направлено на основное сосудистое заболевание (этиотропная терапия), основные патогенетические механизмы и клиническую симптоматику, которая приводит к ухудшению качества жизни пациентов и их ближайших родственников. С патогенетической точки зрения оправдано назначение препаратов, улучшающих церебральную микроциркуляцию, но не вызывающих эффект «обкрадывания». С этой целью в настоящее время в повседневной клинической практике широко применяются такие препараты различных фармакологических групп, как ингибиторы фосфодиэстеразы (экстракт гинкго билоба, пентоксифиллин), блокаторы кальциевых каналов (циннаризин, нимодипин), антагонисты пресинаптических α–адренорецепторов (ницерголин, пирибедил). Для обеспечения нейрометаболической защиты нейронов используются препараты, повышающие выживаемость нейронов в условиях хронической гипоксии. Наиболее распространенным и хорошо изученным препаратом, улучшающим память, внимание, умственную деятельность, а также повышающим устойчивость мозга к гипоксии, является пирацетам, который уже хорошо известен широкому кругу клиницистов. Однако в последние годы интерес к пирацетаму вырос благодаря появлению комбинированных препаратов, например Омарону, одна таблетка которого содержит пирацетам (0,4 г) и циннаризин (0,025 г). Данная комбинация позволяет к свойствам «идеального» ноотропа добавить свойства циннаризина, обладающего влиянием на сосуды головного мозга. Омарон – комбинированное лекарственное средство с выраженным антигипоксическим, ноотропным и сосудорасширяющим эффектом [6]. Пирацетам уменьшает потребность тканей в кислороде и повышает устойчивость организма в условиях гипоксии, что делает его применение у больных с ДЭ I и II стадий патогенетически обоснованным. Циннаризин – селективный блокатор медленных кальциевых каналов, ингибирует поступление в клетки ионов кальция и уменьшает их содержание в депо плазмолеммы, снижает тонус гладкой мускулатуры артериол, уменьшает их реакцию на биогенные сосудосуживающие вещества (эпинефрин, норэпинефрин, дофамин, ангиотензин, вазопрессин). Обладает сосудорасширяющим эффектом (особенно в отношении сосудов головного мозга, усиливая антигипоксическое действие пирацетама), не оказывая существенного влияния на артериальное давление. Проявляет умеренную антигистаминную активность, уменьшает возбудимость вестибулярного аппарата, понижает тонус симпатической нервной системы. Повышает эластичность мембран эритроцитов, их способность к деформации, снижает вязкость крови. Оба компонента Омарона усиливают действие друг друга, одновременно уменьшая количество побочных эффектов. В связи с этим было проведено клиническое исследование по применению Омарона у пациентов с ДЭ. Цель исследования – оценка эффективности и переносимости препарата Омарон у пациентов с ДЭ. Материалы и методы В открытое исследование было включено 203 пациента от 40 до 75 лет (средний возраст 61,7 года) обоих полов с документированным диагнозом «ДЭ II стадии». Все пациенты подписывали информированное согласие участвовать в исследовании с возможностью находиться под наблюдением в течение 45 дней. Диагноз ДЭ, устанавливался в соответствии с общепринятыми критериями [4] и проявлялся когнитивными нарушениями, обычно достигающими умеренной степени. Синдромальная диагностика умеренных когнитивных нарушений проводилась в соответствии с диагностическими критериями Touchon J., Petersen R. 2004 [8]: когнитивные нарушения по словам пациента или родственников; нейропсихологическое подтверждение когнитивных нарушений; ухудшение когнитивных способностей по сравнению с недавним прошлым; отсутствие выраженных нарушений повседневной активности; отсутствие деменции. Критерии исключения из исследования: паркинсонический синдром, невозможность пациентом выполнить предлагаемые тесты, уровень депрессии больше 17 баллов по шкале Бека, возраст старше 75 лет. Все пациенты, включенные в исследование, методом простой рандомизации были разбиты на основную и контрольную группы. Между группами не было статистически значимых различий по полу, возрасту и наличию фоновой патологии. Пациенты обеих групп получали соматопротективные препараты (гипотензивные, вазодилататоры и т.д.), которые не имели ноотропного и седативного действия и не обладали прямым синергизмом с Омароном. Терапия Омароном по 2 капсулы 3 раза/сут. в течение 45 дней проводилась у 117 пациентов, 86 пациентов составили контрольную группу. Обе группы были разделены на подгруппы: 55 лет и моложе, вторая – старше 55 лет. В ходе исследования все пациенты были дважды осмотрены неврологом и офтальмологом – в 1–й день заболевания и на 45–й день. При каждом осмотре пациенты проходили полное клиническое неврологическое исследование, нейропсихологическое тестирование, нейроофтальмологическое исследование (острота зрения, осмотр глазного дна, измерение полей зрения по стандартной методике), измерялось среднесуточное артериальное давление, пульс, оценивалась переносимость препарата, побочные действия, исследовался уровень холестерина плазмы крови. Тестированием оценивалось качество сна, личностная и ситуационная тревожность. Исследование включало в себя оценку субъективных жалоб пациентов, оценку неврологического статуса, измерение артериального давления и пульса с целью установить, влияет ли Омарон на основные гемодинамические показатели и результаты нейропсихологического тестирования. Формализованная оценка выраженности субъективных симптомов проводилась по 5–балльным рейтинговым шкалам со стандартизированными критериями оценки выраженности каждого субъективного симптома (от 0 – нет нарушений до 4 – грубые нарушения, аналогично субъективным проявлениям). Оценивались следующие субъективные симптомы: головная боль, головокружение, шум в голове, нарушение памяти и сна, утомляемость, общая слабость, затруднение при ходьбе, снижение зрения, нарушение речи, недержание мочи, чувство внутреннего напряжения, раздражительность, страхи, онемение в конечностях. Нейропсихологическое обследование включало в себя: минитест оценки психического состояния (Mini–mental scale examination – MMSE); для оценки кратковременной зрительной памяти пациентам предъявлялись 16 картинок с экспозицией 30–60 с (регистрировалось количество запомнившихся картинок); для исследования кратковременной слуховой памяти использовалось 10 слов (регистрировалось количество запомнившихся слов после одного повторения) [3]. Для исследования уровня внимания были использованы черно–белые таблицы Шульте (регистрировалось время, за которое пациент находил цифры от 1 до 25 в квадратах). В корректурной пробе Бурдона регистрировалось время выполнения первой и второй половины таблицы, продуктивность внимания – количество просмотренных знаков за 5 мин., точность выполнения – количество правильно и ошибочно вычеркнутых цифр за 5 мин.). Последние два метода исследования позволяют анализировать не только уровень внимания, но и истощаемость в процессе работы. Для субъективной оценки качества жизни использовался первый раздел (General Health (GH) – общее состояние здоровья) опросника качества жизни «SF–36 HEALTH STATUS SURVEY» – оценка больным своего состояния здоровья в настоящий момент и перспектив лечения (высокая оценка указывает на лучшее качество жизни) [10]. Для субъективной характеристики пациентом качества ночного сна использовалась 5–балльная оценка следующих показателей сна: скорость засыпания, продолжительность и глубина сна, самочувствие после пробуждения, где 1 балл – плохо, а 5 баллов – отлично. Все показатели суммировались в общую оценку сна. Уровень личностной и реактивной тревожности оценивался по шкале Спилбергера [3]. Врачом и больным независимо друг от друга выставлялась общая оценка эффекта и побочных действий лечения, использовалась шкала общего клинического впечатления (Clinical Global Impression’Scale — CGI), а именно субшкала индекса эффективности, который рассчитывается по совокупности одной из четырех степеней терапевтического эффекта (заметный, умеренный, минимальный, без изменений) и степени выраженности побочного эффекта препарата (отсутствует, незначительный, значительный, нивелирующий терапевтический эффект). При проведении офтальмологического исследования фиксировались острота зрения, состояние сосудов сетчатки, значения полей зрения на оба глаза у пациентов. Сумма всех меридианов в норме составляет 535 градусов, что было нами принято за 100%. Исследование проводилось на периметре Ферстера, белая метка 2 мм. При ограничении полей зрения, зафиксированном по отдельным меридианам, сумма всех меридианов уменьшается, что фиксировалось офтальмологом. Для статистического анализа подсчитывались средние значения и стандартное отклонение. Сравнение проводили с использованием параметрического t–критерия Стьюдента и непараметрического U–критерия Манна – Уитни, при оценке эффективности лечения использовался критерий Уилкоксона. Различия считались достоверными при p<0,05. Статистическая обработка материала проводилась с помощью компьютерной программы Statistica 6.0. Результаты исследования Основными причинами развития ДЭ у обследованных 203 больных явилась гипертоническая болезнь – у 185 (91,1%) человек, нарушения сердечного ритма – у 51 (25,1%), сахарный диабет – у 43 (22,6%), гиперхолестеринемия – 25 (12,3%). Транзиторные ишемические атаки имели 11 (5,4%) пациентов. У обследованных выявлялись следующие жалобы: головная боль у 64 (31,5%) человек, головокружение – у 46 (22,6%), нарушение памяти – у 50 (24,6%), шум в голове – 85 (41,8%), нарушение сна – у 144 (70,9)%, повышенная утомляемость 164 (80,8%), общая слабость – у 91 (44,8%), затруднение при ходьбе – у 34 (16,7%), снижение зрения – у 103 (50,7%), нарушение речи – у 6 (3%), недержание мочи – у 1 (0,5%), чувство внутреннего напряжения 28(13,8%), раздражительность – у 10 (4,9%), страхи – у 4 (2%), онемение и слабость в верхних и нижних конечностях у 24 (11,8%). При неврологическом осмотре выявлялись такие симптомы, как легкая пирамидная недостаточность в виде повышения сухожильных рефлексов или анизорефлексии 105 (51,7%), рефлексы орального автоматизма у 34 (16,7%), незначительная атаксия в конечностях у 45 (22,1%), цереброастенические проявления – 78 (38,4%), дизартрия у 11 (5,4%), дисфония – 9 (4,4%), рассеянная микроочаговая неврологическая симптоматика у 53 (26,1%). Как в основной, так и в контрольной группе после проведенного курса лечения существенных изменений в неврологическом статусе не наблюдалось. При анализе результатов показателей краткой шкалы оценки психического статуса (MMSE) оценка колебалась от 16 до 30 баллов, средний балл 25, на 45–й день в обеих группах не было значимой разницы. Динамика субъективных жалоб пациентов отмечена на рисунке 1. При статистической обработке данных получены различия между основной и контрольной группами на 45–й день обследования (рис. 1): улучшения в основной группе по сравнению с контролем зарегистрированы по следующим признакам: головная боль (р<0,01), головокружение (р<0,01), нарушение памяти (р<0,05), снижение зрения (р<0,01), онемение и слабость в верхних и нижних конечностях (р<0,05). В первый день исследования количество правильно названных картинок было обратно пропорционально возрасту пациента. В основной группе объем зрительной памяти после 45–дневного курса лечения статистически значимо (р<0,01) возрос в обеих возрастных подгруппах (младшая, старшая) пациентов с 10,3 (картинок) до 12,0 и с 8,1 до 9,8 соответственно, а также по сравнению с контрольной группой, в которой отмечалось улучшение зрительной памяти лишь с 9,1 до 10,4 и с 8,7 до 9,1. Состояние функций вербальной памяти у пациентов до начала исследования соответствовало по всем оцениваемым параметрам нижним границам нормы. В ходе приема препарата в основной группе наблюдались отчетливые позитивные изменения практически по всем оцениваемым показателям. Статистически значимых различий между возрастными подгруппами не наблюдалось. К 45–му дню приема Омарона наблюдалось увеличение объема долговременной памяти в основной группе и отсутствие динамики у пациентов контрольной группы. Увеличение произвольной слуховой памяти в результате лечения представлено на рисунке 2. Исследование показателей произвольного внимания выявило достоверное их улучшение в основной группе: улучшились такие показатели, как объемы произвольного внимания, функции концентрации, распределения и переключения. Оптимизация функций внимания выражалась в уменьшении времени просмотра таблиц, возрос также общий показатель эффективности работы. Улучшение показателей произвольного внимания в основной группе выразилось в уменьшении времени, необходимого для нахождения цифр по таблицам Шульте (рис. 3). Среднее время обработки всех квадратов не изменилось в контрольной группе и достоверно уменьшилось в основной: статистически значимые различия (р=0,01) получены по первой, второй таблице и среднему времени всех таблиц. Эффект «врабатываемости» в виде уменьшения времени работы с пятым квадратом присутствует в основной группе. Т.е. в основной группе отмечается нарастание психического темпа и скорости ориентировочно–поисковых движений взора при выполнении задания. Необходимо отметить, что статистически достоверное улучшение достигнуто в основной группе только за счет пациентов старшей возрастной подгруппы, в молодой подгруппе изменений не наблюдалось, т.к. временные показатели в ней соответствовали возрастной норме 48 и 50 с. Анализ уровня умственной работоспособности в ходе терапии Омароном показал, что у пациентов на фоне его приема увеличивались объемы обработанной информации и параллельно улучшалось качество умственной деятельности в виде уменьшения числа ошибок. Динамика умственной работоспособности, точности выполнения заданий оценивалась в корректурной пробе Бурдона (табл. 1). Отмечено, что пациенты, получавшие Омарон, после лечения показывали несравнимо лучшие результаты по скорости и точности выполнения теста. Статистически значимые результаты в основной группе по сравнению с контролем получены по общему времени выполнения задания (р<0,01) и первой половины задания (р<0,01), количеству просмотренных знаков (р<0,05) и правильно вычеркнутых знаков (р<0,05), количество ошибок уменьшилось статистически незначимо. Ошибки чаще совершали пациенты моложе 55 лет. При предъявлении первого раздела (General Health (GH) – общее состояние здоровья) опросника качества жизни «SF–36 HEALTH STATUS SURVEY» пациенты всех возрастов и групп давали хорошую оценку своему здоровью и не отмечали ухудшения в нем в динамике. Цифры всех оценок колебались в следующих пределах: 3,4–3,7. Была оценена эффективность лечения врачом и больным, независимо друг от друга, по шкале общего клинического впечатления (максимальная оценка – 3). Пациенты, получавшие Омарон, дали следующие оценки: моложе 55 лет – 2,5, старшая группа оценила лечение в 1,6 балла. При этом объективных изменений в когнитивных функциях произошло больше у старшей группы пациентов. Врачи дали оценки 2,4 и 2,2 соответственно младшей и старшей подгруппам. Динамика тревожности пациентов представлена в таблице 2. Личностная тревожность не претерпела существенной динамики в обеих группах: для лиц моложе 55 лет значение тревожности было умеренным: 43,1–45,3, у пациентов старшей возрастной группы личностная тревожность была выше: 47,6–50,1. При первичном опросе выявлен высокий уровень реактивной тревожности в старших подгруппах, причем в основной группе в результате лечения достоверно снизился до умеренного (р<0,01), в контрольной группе он даже несколько увеличился. В младших возрастных группах не произошло статистически значимых изменений. Учитывая результаты обработки полученных при опросе пациентов данных о значительном улучшении зрения при приеме Омарона, нами была предпринята попытка объективизировать эти изменения в зрительном анализаторе. Также была проведена стандартная методика исследований полей зрения у 203 пациентов (406 глаз). При первичном обследовании в основной группе были получены результаты (в % от нормы): изменение от 79 до 97% у младшей возрастной подгруппы и от 45 до 90% в старшей. Абсолютный прирост полей зрения через 45 дней приема Омарона составил от 0 до 11% в младшей возрастной подгруппе и от 0 до 28% в старшей подгруппе. Поля зрения в контрольной группе не изменились через 45 дней. Статистически достоверным (р<0,01) оказалось улучшение полей зрения в группе пациентов старше 55 лет, принимавших Омарон – прирост полей зрения у них составил в среднем 10,3% (рис. 4). Все пациенты, включенные в исследование, получили полный курс лечения. Побочные явления при приеме Омарона отмечала одна пациентка в виде головной боли, при дообследовании у нее выявлены подъемы артериального давления, при его нормализации головные боли исчезли. Выводы Таким образом, применение Омарона – комбинированного препарата с выраженным антигипоксическим, ноотропным и сосудорасширяющим эффектом в суточной дозе 6 таблеток – безопасно и эффективно для коррекции когнитивных нарушений при ДЭ. Основные эффекты применения Омарона выражаются в достоверном улучшении по сравнению с контрольной группой по выраженности головной боли, головокружения, нарушений памяти, снижения зрения, онемения и слабости в верхних и нижних конечностях. К 45–му дню приема Омарона отмечено увеличение объема долговременной памяти в основной группе и отсутствие динамики у пациентов контрольной группы. Оценка показателей произвольного внимания выявила достоверное их улучшение в основной группе: улучшились такие показатели, как объемы произвольного внимания, функции концентрации, распределения и переключения. Анализ уровня умственной работоспособности в ходе терапии Омароном показал, что у пациентов на фоне его приема увеличивались объемы обработанной информации и параллельно улучшалось качество умственной деятельности в виде уменьшения числа ошибок. Доказано статистически достоверное увеличение полей зрения у пациентов с ДЭ старше 55 лет с исходными нарушениями. Таким образом, применение Омарона позволяет улучшать состояние пациентов с ДЭ, уменьшая выраженность основных симптомов заболевания, а также улучшая основные интеллектуально–мнестические показатели. Лечение хорошо переносится пациентами, не вызывает серьезных побочных явлений.
Литература 1. Дамулин И.В. Болезнь Альцгеймера и сосудистая деменция / Под ред. Н.Н. Яхно. М., 2002. 85 с. 2. Дамулин И.В., Парфенов В.А., Скоромец А.А., Яхно Н.Н. Нарушения кровообращения в головном и спинном мозге // Болезни нервной системы. Руководство для врачей / Под ред. Н.Н. Яхно, Д.Р. Штульман. М., 2003. С. 231–302. 3. Белова А.Н. Шкалы и опросники в неврологии и нейрохирургии. М., 2004. 4. Захаров В .В. Клиника, диагностика и лечение дисциркуляторной энцефалопатии // Русский медицинский журнал. 2009. Т. 17. № 2. С. 140–144 5. Лурия А.Р. Высшие корковые функции человека. М.: Изд–во МГУ, 1969. 6. Парфенов В.А., Беланина Г.Р., Вахнина Н.В. и др. Применение Омарона у больных с умеренными постинсультными когнитивными нарушениями // Журнал неврологии и психиатрии им. С.С. Корсакова. 2009. № 6. С. 47–51. 7. Пилипонич А.А., Захаров В.В., Дамулин И.В. Лобная дисфункция при сосудистой деменции // Клиническая геронтология. 2001. Т. 5. № 6. С. 35–41. 8. Petersen R.S., Touchon J. Consensus on mild cognitive impairment. Research and practice in Alzheimer’s disease. // EADS–ADCS jont meeting. 2005. № 10. P. 24–32 9. Roman G.V. Vascular dementia: NINDS AIREN diagnostic criteria // New concepts in vascular dementia / A. Culebras, J. Matias Guiu, G. Roman (eds). Barcelona: Prous Science Publishers, 1993. P.19. 10. Ware J.E., Snow K.K., Kosinski M. Et al. SF–36 Health Survey. Manuel and Interpretation Guide. Lincoln, RI: Quality Metric Inc. 2000. 150 р.
Особые указания по применению препарата Омарон
Следует с осторожностью назначать лицам с заболеваниями печени и/или почек. При легкой и умеренной почечной недостаточности (особенно при клиренсе креатинина ≤60 мл/мин) следует снизить терапевтическую дозу или увеличить интервал между приемами. У лиц с нарушением функции печени необходимо контролировать уровень печеночных ферментов. Следует избегать употребления алкоголя во время лечения. С осторожностью назначают препарат при повышенном внутриглазном давлении, а также болезни Паркинсона. Во время лечения следует придерживаться осторожности при управлении транспортными средствами и работе с механизмами.
Омарон
Омарон (пирацетам+циннаризин) — комбинированный ноотропный препарат. Используется при нарушениях кровообращения в церебральных сосудах (при наличии в их просвете атеросклеротических бляшек, во время реабилитационного периода после перенесенного ишемического или геморрагического мозгового кровоизлияния, ЧМТ), заболеваниях ЦНС, проявлениями которых является угнетение когнитивных функций, органических дефектах с астеническими и адинамическими проявлениями, болезни Меньера, замедленном интеллектуальном развитии в детском возрасте, с целью профилактики синдрома укачивания и мигрени. Пирацетам стимулирует обменные процессы в мозговых клетках посредством интенсификации метаболизма белков и энергетического обмена, повышения способности клеток усваивать глюкозу и переносить нехватку кислорода. Пирацетам способствует также более продуктивной передаче нервных импульсов в ЦНС, улучшает регионарное кровообращение в ишемизированных участках. Циннаризин – избирательно блокирует кальциевые каналы L-типа (т.н. «медленные кальциевые каналы), препятствует поступлению кальций-ионов внутрь клеток и их аккумуляции в плазмолемме, вызывает расслабление гладкомышечного «кокона» мелких артерий, снижает их чувствительность к воздействию эндогенных вазосупрессоров. Проявляет вазодилатирующие свойства (главным образом – в отношении церебральных сосудов, потенцируя антигипоксический эффект своего «партнера» – пирацетама), не вызывая при этом существенного снижения артериального давления. Выступает в роли антагониста гистамина, десенсибилизирует вестибулярный аппарат, снижает симпатический тонус. Делает эритроцитарные мембраны более эластичными и устойчивыми к деформациям, улучшает реологические характеристики крови. Пирацетам быстро и практически в полном объеме абсорбируется из гастроинтестинального тракта.
Биодоступность (показатель, отражающий способность препарата усваиваться в организме) приближается к 100%. Аккумулируется в коре больших полушарий. Метаболическим трансформациям не подвергается, в отличие от циннаризина, который метаболизируется в полном объеме. Пирацетам выводится главным образом вместе с мочой, циннаризин – с калом. Омарон противопоказан лицам с повышенной чувствительностью к пирацетаму, циннаризину или вспомогательным компонентам препарата, тяжелыми поражениями печени и почек, болезнью Паркинсона, беременным и кормящим женщинам. В педиатрии препарат используется, начиная с 5-летнего возраста. Разовая доза для детей и взрослых – 1-2 таблетки. Кратность применения – трижды в день (взрослые), 1-2 раза в день (дети). Продолжительность медикаментозного курса – 30-90 дней. Возможные нежелательные побочные эффекты: диспепсические явления, головная боль, расстройства сна, аллергические реакции (в редких случаях). При применении Омарона с лекарственными средствами, подавляющими активность ЦНС, алкоголем, антигипертензивными средствами возможно потенцирование седативного эффекта. Вазодилататоры потенцируют эффект Омарона. У лиц с заболеваниями печени и почек препарат следует применять с особой осторожностью. Во время лечения рекомендуется воздерживаться от алкоголя. При продолжительном медикаментозном курсе (2,5-3 месяца) следует контролировать основные функциональные показатели печени и почек. Во время медикаментозного курса рекомендуется воздерживаться от активностей, требующих повышенного внимания и концентрации (в т.ч. вождения автомобиля и работы с потенциально опасными механизмами).