Фармакодинамика
Ноопепт® обладает ноотропными и нейропротективными свойствами. Улучшает способность к обучению и память, действуя на все фазы процессинга: начальную обработку информации, консолидацию, извлечение. Препятствует развитию амнезии, вызванной электрошоком, блокадой центральных холинергических структур, глутаматергических рецепторных систем, лишением пародоксальной фазы сна.
Нейропротективное (защитное) действие препарата Ноопепт® проявляется в повышении устойчивости мозговой ткани к повреждающим воздействиям (травма, гипоксия, электросудорожное, токсическое) и ослаблении степени повреждения нейронов мозга. Препарат уменьшает объем очага на тромботической модели инсульта и предупреждает гибель нейронов в культуре ткани коры головного мозга и мозжечка, подвергнутых действию нейротоксических концентраций глутамата, свободно-радикального кислорода.
Ноопепт® оказывает антиоксидантное действие, блокирует потенциалзависимые кальциевые каналы нейронов, ослабляя нейротоксическое действие избыточного кальция, улучшает реологические свойства крови, обладая антиагрегационным, фибринолитическим, антикоагулянтным свойствами.
Ноотропный эффект препарата связан с образованием циклопролилглицина, аналогичного по структуре эндогенному циклическому дипептиду, обладающему антиамнестической активностью, а также с наличием холинопозитивного действия.
Ноопепт® увеличивает амплитуду транскаллозального ответа, облегчая ассоциативные связи между полушариями головного мозга на уровне кортикальных структур. Способствует восстановлению памяти и других когнитивных функций, нарушенных в результате повреждающих воздействий, — травма мозга, локальная и глобальная ишемия, пренатальные повреждения (алкоголь, гипоксия).
Терапевтическое действие препарата у больных с органическими расстройствами ЦНС проявляется, начиная с 5–7 дней лечения. Вначале реализуются имеющиеся в спектре активности препарата Ноопепт® анксиолитический и легкий стимулирующий эффекты, проявляющиеся в уменьшении или исчезновении тревоги, повышенной раздражительности, аффективной лабильности, нарушений сна. После 14–20 дней терапии выявляется позитивное влияние препарата на когнитивные функции, параметры внимания и памяти.
Ноопепт® обладает вегетонормализующим действием, способствует уменьшению головных болей, ортостатических нарушений, тахикардии.
При отмене препарата не наблюдается синдром отмены. Не оказывает повреждающее действие на внутренние органы; не приводит к изменению клеточного состава крови и биохимических показателей крови и мочи; не обладает иммунотоксическим, тератогенным действием, не проявляет мутагенные свойства.
Ноопепт в лечении дисциркуляторной энцефалопатии с умеренными когнитивными нарушениями
По данным эпидемиологических исследований, легкие и умеренные когнитивные нарушения, не достигающие степени деменции, в старших возрастных группах встречаются у 12–17% лиц старше 65 лет [10, 15, 18]. В значительной части случаев эти нарушения имеют сосудистый генез и приобретают прогрессирующий характер, со временем трансформируясь в сосудистую или смешанную (сосудистую и нейродегенеративную) деменцию.
Нарушение когнитивных функций наряду с другими нервно-психическими и двигательными расстройствами во многом определяет тяжесть цереброваскулярных нарушений при дисциркуляторной энцефалопатии (ДЭ). Особенностью когнитивного дефицита при ДЭ является преобладание нейродинамических и регуляторных когнитивных нарушений. Это проявляется замедленностью психической деятельности, ослаблением внимания, снижением речевой активности, нарушением планирования, организации и контроля деятельности. Нарушение памяти, как правило, бывает умеренным и носит вторичный характер (об этом свидетельствует дефицит свободного воспроизведения при относительно сохранном узнавании и эффективности опосредующих приемов) [16, 18].
При нейропсихологическом тестировании при легких когнитивных расстройствах выявляются преимущественно нейродинамические нарушения в виде замедленности, снижения работоспособности, истощаемости, колебаний внимания [7, 9, 10, 12, 19]. По мере прогрессирования ДЭ выраженность когнитивных нарушений нарастает. Наряду с нейродинамическими расстройствами выявляются регуляторные нарушения (дизрегуляторный или подкорково-лобный когнитивный синдром) [7, 9, 12, 21, 22]. Умеренные когнитивные расстройства, хотя и не приводят к существенному ограничению профессиональной, бытовой и социальной независимости пациентов, могут затруднять выполнение сложных (как правило, инструментальных) видов повседневной активности и способствовать снижению качества жизни больных [10, 12, 15, 16, 18, 26, 27]. Дальнейшее прогрессирование сосудистого поражения головного мозга приводит к тяжелым когнитивным нарушениям, достигающим уровня деменции, нарушающим профессиональную, бытовую и социальную адаптацию [6, 10, 12, 15–18, 26].
Ведущая роль лобной дисфункции в структуре нейропсихологических нарушений проявляется также в нередком сочетании когнитивных и эмоционально-личностных нарушений [8, 10, 12, 18, 23]. Последние на более ранних стадиях ДЭ представлены преимущественно аффективными расстройствами (раздражительность, эмоциональная лабильность, тревожность, депрессия), на более позднем этапе к ним могут присоединяться выраженные личностные и поведенческие расстройства в виде апатико-абулических нарушений, расторможенности, эксплозивности, а также психотических расстройств.
Для лечения когнитивных нарушений при ДЭ широко используются ноотропные средства — соединения, которые действуют на центральную нервную систему, усиливая когнитивные возможности (улучшают память, внимание, ориентировку и т. д.). Основной характеристикой ноотропов является активирующее специфическое влияние на высшие интегративные функции мозга и восстановление нарушений высшей нервной деятельности. Основными механизмами терапевтического действия ноотропных препаратов служат: усиление синтеза аденозинтрифосфорной кислоты (АТФ), повышение усваивания глюкозы клетками головного мозга; усиление процессов синаптической передачи в ЦНС; нормализация нейротрансмиттерных нарушений (эффект ряда ноотропных средств опосредуется через нейромедиаторные системы головного мозга, среди которых наиважнейшие моноаминергическая, ацетилхолинергическая, глутаматергическая, ГАМКергическая); мембраностабилизирующее действие [4, 19]. Механизмы действия ноотропных средств интенсивно изучались на нейрофизиологическом уровне. Показано влияние ноотропов на поздние компоненты (400–800 мс) вызванных потенциалов у людей при решении ими задач, что рассматривается как непосредственное подтверждение действия ноотропов на когнитивные процессы [11].
Учитывая, что в клинической практике потребность в ноотропах велика, получение и внедрение в практику новых высокоэффективных ноотропных лекарственных препаратов является важной и актуальной задачей. Лекарственные средства пептидной природы интересны в качестве потенциальных ноотропов, поскольку в регуляции когнитивных функций основную роль играют нейропептиды и в большинстве случаев пептидные препараты более эффективны, чем препараты других химических групп [1, 2, 4, 5].
Ноопепт представляет собой этиловый эфир N-фенил-ацетил-L-пролилглицина — дипептид, обладающий ноотропными и нейропротективными свойствами [1, 13].
Нейропротективное (защитное) действие Ноопепта проявляется в повышении устойчивости мозговой ткани к повреждающим воздействиям (травма, гипоксия, электросудорожное и токсическое поражение). Препарат уменьшает объем очага на тромботической модели инсульта в эксперименте и предупреждает гибель нейронов в культуре ткани коры головного мозга и мозжечка, подвергнутых действию токсических концентраций глутамата и свободно-радикального кислорода [1, 13]. Ноопепт оказывает антиоксидантное действие, антагонистическое влияние на эффекты избыточного поступления кальция в клетки, улучшает реологические свойства крови. Ноотропный эффект препарата связан с образованием циклопролилглицина, аналогичного по структуре эндогенному циклическому дипептиду, обладающему антиамнестической активностью, а также характеризующемуся наличием ацетилхолинергического действия.
Наличие у Ноопепта широкого спектра ноотропной активности явилось основанием для проведения клинических исследований по его применению у взрослых с нарушениями памяти, внимания и других интеллектуально-мнестических функций после черепно-мозговой травмы и при хронической цереброваскулярной недостаточности. Терапевтическое действие препарата у больных с органическими расстройствами центральной нервной системы проявляется начиная с 5–7 дней лечения. Вначале реализуются имеющиеся в спектре активности Ноопепта анксиолитический и легкий стимулирующий эффекты, проявляющиеся в уменьшении или исчезновении тревоги, повышенной раздражительности, аффективной лабильности, нарушений сна. После 14–20 дней терапии выявляется позитивное влияние препарата на когнитивные функции, параметры внимания и памяти [1, 13]. Установлено, что в терапевтически эффективных суточных дозах препарат отличается хорошей переносимостью [13].
Проведенный анализ динамики спектра электроэнцефалограммы (ЭЭГ) показал, что Ноопепт вызывает повышение мощности альфа-ритма и ослабление дельта-ритма, подтверждающее наличие у препарата ноотропного действия [1, 11, 13]. Особый интерес вызывает оценка влияния Ноопепта на когнитивные нарушения, связанные с сосудистой мозговой недостаточностью.
Целью настоящего исследования явилась оценка клинической эффективности, безопасности и переносимости применения препарата Ноопепт при ДЭ с умеренными когнитивными нарушениями.
Пациенты и методы
Обследовано 360 пациентов в возрасте 50–80 лет (115 мужчин и 245 женщин), средний возраст 69,8 ± 8,3 года с ДЭ I и II стадии атеросклеротического и гипертонического генеза с умеренными когнитивными нарушениями. Диагноз ДЭ ставился в соответствии с общепринятыми критериями [8].
Исследование проводилось с участием специалистов из 12 лечебных учреждений России: кафедра нервных болезней Московской медицинской академии им. И. М. Сеченова (гл. исследователь акад. РАМН, проф. Н. Н. Яхно); кафедра неврологии и нейрохирургии Российского государственного медицинского университета; поликлиника восстановительного лечения № 7, г. Москва (гл. исследователь проф. А. Н. Бойко); Медицинский центр Управления делами президента, г. Москва, Центральная клиническая больница (гл. исследователь проф. В. И. Шмырев); кафедра неврологии Санкт-Петербургского государственного медицинского университета им. акад. И. П. Павлова (гл. исследователь акад. РАМН, проф. А. А. Скоромец); Областной неврологический центр ГУЗ РОКБ, г. Ростов-на-Дону (гл. исследователь проф. Ю. В. Тринитатский); кафедра неврологии и нейрохирургии Самарского государственного медицинского университета (гл. исследователь проф. И. Е. Повереннова); Клинический институт мозга, г. Екатеринбург (гл. исследователь проф. А. А. Белкин); кафедра неврологии Новосибирского государственного медицинского университета (гл. исследователь проф. Б. М. Доронин); кафедра неврологии и реабилитации Казанского государственного медицинского университета (гл. исследователь проф. Э. И. Богданов); кафедра неврологии и нейрохирургии Иркутского государственного института усовершенствования врачей, г. Иркутск (гл. исследователь проф. В. В. Шпрах); кафедра неврологии Новокузнецкого государственного института усовершенствования врачей (гл. исследователь к. м. н. М. Г. Жестикова).
Всем пациентам было проведено клиническое неврологическое обследование. Оценка изменения выраженности клинических проявлений ДЭ на фоне лечения Ноопептом проводилась с использованием Шкалы общего клинического впечатления об изменениях (ШОКВИ, CGI-I), оценка когнитивных функций — с использованием Краткой шкалы оценки психического статуса (КШОПС, MMSE) [20], теста рисования часов (ТРЧ) с оценкой по 10-балльной системе, литеральных и категориальных ассоциаций [24].
Все пациенты получали Ноопепт в дозе 10 мг два раза в день (20 мг/сут) в течение 2 месяцев.
Фиксировались все нежелательные явления, которые произошли с пациентом после приема первой дозы Ноопепта и до дня заключительного визита. Статистическая обработка полученных результатов проводилась с использованием статистического пакета SPSS 13.0 for Windows. Для оценки достоверности межгрупповых различий зависимых выборок использовался параметрический t-критерий Стьюдента. Уровень достоверности различий исследуемых параметров был установлен на уровне p < 0,05.
Результаты
В результате проведенного исследования у пациентов были выявлены умеренные когнитивные нарушения. При осмотре пациенты предъявляли жалобы астенического характера: быстрая утомляемость, раздражительность, рассеянность внимания, снижение памяти, головные боли при умственном и физическом напряжении. При проведении нейропсихологического исследования пациентам трудно было сосредоточиться на выполнении тестов, они быстро истощались при выполнении более сложного задания («счет» по КШОПС (MMSE), литеральные и категориальные ассоциации). Эти нарушения отражали нарушение регуляторного звена и проявлялись импульсивностью в принятии решения и возникновением характерных ошибок, нарушением произвольного внимания, снижением речевой активности, замедленностью выполнения нейродинамических тестов. Память страдала умеренно, ее нарушения носили модально-неспецифический характер по данным КШОПС (MMSE).
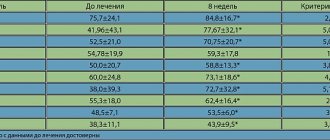
Проведенное исследование показало положительное влияние терапии Ноопептом на когнитивные функции обследованных пациентов: внимание, память, нейродинамические функции, что подтверждает достоверное улучшение общего балла по КШОПС (MMSE) на фоне лечения Ноопептом у пациентов с ДЭ и умеренными когнитивными расстройствами (рис. 1).
Достоверное улучшение показателя ТРЧ отражает улучшение конструктивного праксиса (рис. 2).
Выявлено улучшение нейродинамических функций и речевой продукции, что подтверждается достоверным улучшением показателей теста категориальных ассоциаций и положительной тенденцией, полученной при сравнении результатов теста литеральных ассоциаций (рис. 3).
Таким образом, при сравнении результатов нейропсихологического обследования у больных с ДЭ на фоне приема Ноопепта в течение 60 дней в указанной дозе было выявлено достоверное улучшение общего балла КШОПС (MMSE), конструктивного праксиса (ТРЧ), речевой продукции (категориальные ассоциации) (p < 0,05). Положительная тенденция отмечалась при исследовании литеральных ассоциаций (0,05 < p < 0,06) (
.).
В результате исследования выявлена хорошая переносимость Ноопепта. У 14 пациентов были отмечены нежелательные явления во время приема Ноопепта, проявляющиеся в четырех случаях в виде усиления нарушения засыпания, в четырех случаях в виде усиления головной боли, в двух случаях в виде усиления несистемного головокружения, в одном случае в виде ощущения «тяжести» в голове, в двух случаях в виде однократных подъемов артериального давления у пациентов с гипертонической болезнью, купированных приемом гипотензивных средств, и в одном случае в виде аллергической реакции по типу крапивницы. В 13 случаях выраженность нежелательных явлений была легкой и не потребовала отмены препарата. В одном случае при возникновении аллергической реакции прием Ноопепта был прекращен и назначены антигистаминные препараты, после чего аллергическая реакция регрессировала. Связь с приемом Ноопепта во всех случаях была вероятной.
Общая оценка клинической эффективности применения Ноопепта по показаниям Шкалы общего клинического впечатления об изменениях (CGI-I) соответствует умеренному улучшению.
Таким образом, на фоне лечения Ноопептом отмечено улучшение беглости речи, конструктивного праксиса, нейродинамических функций, памяти. Нарушения нейропсихологического профиля у обследованных пациентов с ДЭ были обусловлены, в основном, недостаточностью внимания и имеющимися модально-неспецифическими нарушениями памяти, носящими динамический характер. Отмеченное улучшение нейропсихологических функций на фоне лечения Ноопептом связано с его ноотропными свойствами. Препарат имеет высокий профиль безопасности, хорошо переносится, не вызывая значительных нежелательных побочных эффектов и может быть рекомендован для коррекции когнитивных нарушений у пациентов с ДЭ.
Литература
- Аведисова А. С., Ястребов Д. В. Сравнительная эффективность Ноопепта и пирацетама при терапии астенических расстройств и нарушений органического генеза // Русск. мед. Журн. 2007. № 5. С. 434–437.
- Арсеньева К. Е. Ноотропные препараты в лечении цереброваскулярных заболеваний // Русск. мед. журн. 2007. № 4. С. 225–228.
- Воронина Т. А. Гипоксия и память. Особенности эффектов и применения ноотропных препаратов // Вестник Российской АМН. 2000. № 9. С. 27–34.
- Воронина Т. А., Середенин С. Б. Ноотропные препараты, достижения и новые проблемы // Экспер. и клин. фармакол. 1998. Т. 61, № 4. С. 3–9.
- Гудашева Т. А., Островская Р. У., Трофимов С. С. и соавт. Пептидные аналоги пирацетама как лиганды предполагаемых ноотропных рецепторов // Хим. фармакол. журн. 1985. № 1. С. 1322–1329.
- Дамулин И. В. Сосудистая деменция // Неврол. журн. 1999. № 4. С. 4–11.
- Дамулин И. В., Захаров В. В., Яхно Н. Н. Когнитивные нарушения: дифференциальная диагностика и методы лечения. Метод. реком. М., 2000. 44 с.
- Дамулин И. В., Парфенов В. А., Скоромец А. А., Яхно Н. Н. Нарушения кровообращения в головном и спинном мозге / В кн.: Болезни нервной системы. Рук-во для врачей. Т. 1. Под ред. Н. Н. Яхно. 4-е изд., перераб. и доп. М.: Медицина, 2005. С. 232–303.
- Захаров В. В., Дамулин И. В. Диагностика и лечение нарушений памяти и других высших мозговых функций у пожилых. Метод. реком. Под ред. Н. Н. Яхно. М., ММА, 1997. 44 с.
- Захаров В. В., Яхно Н. Н. Синдром умеренных когнитивных расстройств в пожилом возрасте: диагностика и лечение // Русск. мед. журн. 2004. № 10. С. 573–576.
- Крапивин С. В. Нейрофизиологические механизмы действия ноотропных препаратов // Журн. невропатол. и психиатрии. 1993. Т. 93, № 4. С. 104–107.
- Левин О. С., Голубева Л. В. Гетерогенность умеренного когнитивного расстройства: диагностические и терапевтические аспекты // Consilium Medicum. 2006. № 12. С. 106–110.
- Незнамов Г. Г., Телешова Е. С. Результаты сравнительного изучения ноопепта и пирацетама при лечении больных с легкими когнитивными нарушениями при органических заболеваниях головного мозга сосудистого и травматического генеза // Журн. неврол. и психиатр. 2008. Т. 108, № 3. С. 33–42.
- Семина И. Г., Семина И. И., Азанчеев Н. М. и соавт. К вопросу о мембранных механизмах действия ноотропных препаратов // Биологические мембраны. 2001. Т. 18, № 5. С. 363–369.
- Яхно Н. Н. Когнитивные расстройства в неврологической клинике // Невролог. журн. 2006. Т. 11, приложение № 1. С. 4–12.
- Яхно Н. Н., Дамулин И. В. Дисциркуляторная (сосудистая) энцефалопатия // Росс. мед. журн. 1999. № 5. С. 3–7.
- Яхно Н. Н., Захаров В. В. Нарушения памяти в неврологической практике // Невролог. журн. 1997. № 4. С. 30–35.
- Яхно Н. Н., Захаров В. В., Локшина А. Б. и соавт. Танакан (EGb 761) в терапии умеренных когнитивных нарушений (мультицентровое исследование) // Ж. неврол. и психиатрии. 2006. № 12. С. 48–53.
- Bowler J. V., Hachinski V. The concept of vascular cognitive impairment / In: Vascular cognitive impairment. T. Erkinjuntti, S. Gauthier (eds.). N. Y.: Martin Dunitz, 2002. Р. 9–26.
- Folstein M. F., Folstein S. E., McHugh P. R. Mini-mental state exam: a practical method for grading the cognitive status of patients for the clinician // J. Psychiatr. Res. 1975. Vol. 12. P. 189–198.
- Galluzzi S., Sheu C.-F., Zanetti O. et al. Distinctive clinical features of mild cognitive impairment with subcortical cerebrovascular disease // Dement. Geriatr. Cogn. Disord. 2005. Vol. 19. Р. 196–203.
- Geroldi C., Ferrucci L., Bandinelli S. et al. Mild cognitive deterioration with subcortical features: Prevalence, clinical characteristics, and association with cardiovascular risk factors in community–dwelling older persons (The InCHIANTI Study) // J. Amer. Ger. Soc. 2003. Vol.51. P. 1064–1071.
- Monfort V., Pouthas V., Ragot R. Role of frontal cortex in memory for duration: an event-related potential study in humans // Neurosci. Lett. 2000. Vol. 286. Р. 91–94.
- Lezak M. Neuropsychological assessment. N.Y.: Oxford University Press, 1983. P. 768–170.
- Petersen R. S., Smith G. E., Waring S. C. et al Mild cognitive impairment: clinical characterization and outcome // Arch. Neurol. 1999. Vol. 56. P. 303–308.
- Rockwood K., Wentzel C., Hachinscki V. et al. Prevalence and outcomes of vascular cognitive impairment // Neurology 2000. Vol. 54. Р. 447–451.
- Roman G. C., Erkinjuntti T., Wallin A. et al. Subcortical ischemic vascular dementia // Lancet Neurology. 2002. Vol.1. Р. 426–436.
Н. Н. Яхно, доктор медицинских наук, профессор, академик РАМНИ. В. Дамулин, доктор медицинских наук, профессор Л. М. Антоненко, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва
Таблица.
Фармакокинетика
Этиловый эфир N-фенилацетил-L-пролилглицина, абсорбируясь в ЖКТ, в неизмененном виде поступает в системный кровоток, проникает через ГЭБ, определяется в мозге в бóльших концентрациях, чем в крови. Tmax в среднем составляет 15 мин. T1/2 из плазмы крови — 0,38 ч. Частично сохраняется в неизмененном виде, частично метаболизируется с образованием фенилуксусной кислоты, фенилацетилпролина и циклопролилглицина. Обладает высокой относительной биодоступностью (99,7%), не кумулирует в организме, не вызывает лекарственную зависимость.