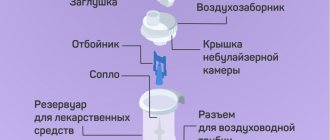
Заболевания, вызванные респираторными инфекциями, могут длиться неделями, если мокрота плохо отходит от стенок бронхов и из легких. А трахеиты превращаются в бесконечное раздражение горла, сопровождающееся дерущим стенки кашлем. Ацетилцистеин помогает мокроте отделяться от стенок системы дыхания, ускоряя процесс выздоровления.
Ацетилцистеин: что это
Ацетилцистеин – вещество, активно применяемое при заболеваниях системы дыхания. Его можно купить как в форме порошка для приготовления раствора, так и в таблетках. Таблетки могут быть растворимыми и шипучими, а можно найти форму для проглатывания, запивая водой. Ацетилцистеин встречается под разными торговыми названиями.
Употребление лекарства снижает вязкость слизи, вырабатываемой органами дыхания на фоне воспалительного процесса. Благодаря чему слизь становится жидкой и легко отходит от стенок бронхов и бронхиол. Кроме того, средство увеличивает мокроту в объеме. Если пациент лежачий или страдает нарушениями кашлевого рефлекса, в медицинской практике используют специальную систему отсоса, защищающую легкие от заполнения слизью.
Дополнительно Ацетилцистеин снижает выраженность воспалительного процесса за счет подавления реактивных метаболитов в легочной ткани, благодаря чему тормозится развитие острого течения болезни.
Прием внутрь обеспечивает полное и быстрое всасывание вещества в кровь, что способствует скорому наступлению первых симптомов облегчения состояния. Большая часть Ацетилцистеина выводится почками из организма. Малая часть выходит в неизменном виде во время дефекации. Максимальная концентрация достигается спустя 2,5 часа. Вывод может задержаться у пациентов с поражением печени, из-за чего препарат остается в организме до 8 часов.
АНТИОКСИДАНТНЫЕ И АНТИТОКСИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЦИСТЕИНА
АНТИОКСИДАНТНЫЕ СВОЙСТВА АЦЕТИЛЦИСТЕИНА
Существует ряд лекарственных средств, интерес к которым со временем не только не ослабевает, но и усиливается, открывая новые области и возможности их применения. К числу препаратов, потенциал которых до сих пор не исчерпан, относится, несомненно, и ацетилцистеин (N-ацетилцистеин, NAC, АЦЦ, ). Только за последние 2–3 года в мировой литературе опубликованы результаты сотен работ в разных областях медицины, посвященных новым направлениям применения ацетилцистеина или расширению уже существующих показаний. Ацетилцистеин является производным аминокислоты цистеина, оказывает муколитическое и отхаркивающее действие. Обычно препарат применяют для разжижения мокроты при заболеваниях органов дыхания, сопровождающихся образованием густого секрета.
Благодаря наличию в молекуле свободной сульфгидрильной группы, ацетилцистеин разрывает дисульфидные связи кислых мукополисахаридов мокроты, что снижает их полимеризацию и вязкость бронхиального секрета, ускоряет мукоцилиарный клиренс.
Кроме того, благодаря наличию свободной сульфгидрильной группы ацетилцистеин оказывает выраженное антиоксидантное, антитоксическое, иммуномодулирующее действие, нейтрализует свободные радикалы, образующиеся в организме даже при нормальной метаболической активности. Большинство исследователей считают, что свободные радикалы, оказывающие неблагоприятное влияние на клетку и ДНК, являются важнейшим фактором, участвующим в процессе биологического старения организма. Благодаря выраженным антиоксидантным и пневмопротекторным свойствам, ацетилцистеин обеспечивает защиту органов дыхания от токсического воздействия неблагоприятных факторов окружающей среды, например, табачного дыма.
Ацетилцистеин активирует синтез глутатиона — важного фактора химической детоксикации (Anderson M.E., Luo J.L., 1996).
Ацетилцистеин защищает клетки организма от влияния свободных радикалов как путем прямой реакции с ними, так и поставляя цистеин для синтеза глутатиона. Ряд исследователей считают, что именно второй механизм действия препарата наиболее важен (Shattuck К.Е. et al., 1998). Уровень содержания глутатиона в клетках организма во многом определяет устойчивость к окислительным воздействиям и имеет тенденцию к снижению с возрастом.
Кроме того, препарат можно использовать в качестве иммуномодулятора и антимутагенного средства (Остроумова М.Н. и соавт., 1994), а также как радиопротектор у лиц, подвергшихся воздействию ионизирующих излучений.
АЦЕТИЛЦИСТЕИН КАК АНТИОКСИДАНТ
В 1989 г. O.T. Aruoma и соавторы при изучении in vivo
и
in vitro
антиокислительных свойств ацетилцистеина обнаружили его
неспецифическую активность в нейтрализации различных свободнорадикальных групп.
Ацетилцистеин проявляет выраженный антиокислительный эффект даже в низких концентрациях.
Очевидно, это происходит не только на биохимическом, но и на биологическом уровне.
Ацетилцистеин защищает клетки, в частности олигодендроциты и фибробласты, от гибели вследствие влияния различных неблагоприятных факторов — программированной клеточной смерти (апоптоза), вызванной воздействием неадекватного количества фактора некроза опухолей (tumor necrosos factor, TNF). K такому выводу пришли М. Mayer и М. Noble (1994), исследуя in vitro
свойства ацетилцистеина как клеточного протектора.
Эти данные сопоставимы с результатами, приведенными коллективом авторов, относительно апоптоза клеток сосудистого эндотелия. Согласно одной из существующих патофизиологических моделей, воздействие мононуклеарных клеток периферической крови, активированных ионизирующими излучениями, или бактериальных эндотоксинов (липополисахаридов, LPS) блокирует восстановление поврежденного эндотелия сосудов и усиливает апоптоз. Этот механизм может лежать в основе различных клинических осложнений, вовлекающих в процесс внутреннюю сосудистую стенку.
В эксперименте установлено, что прием ацетилцистеина полностью предотвращал индуцированную программированную смерть клеток эндотелия сосудов.
Эти результаты открывают перспективы применения ацетилцистеина при патологических процеcсах, оказывающих неблагоприятное действие на внутреннюю стенку сосудов (например, токсемия любого генеза) (Lindner Н. et al., 1997).
Цитопротекторное действие ацетилцистеина тесно связано с его антиоксидантными свойствами и определяет области возможного использования препарата. Естественно, что у клиницистов всего мира вызывает интерес прежде всего потенциальный эффект применения ацетилцистеина при различных заболеваниях и патологических состояниях.
По данным К. Erkkila и соавторов (1998), антиоксидантная защита играет важную роль в регуляции программированной клеточной смерти, даже если эта смерть индуцирована неокислительными стимулами. Результаты данного исследования свидетельствуют о роли ацетилцистеина как фактора, подавляющего in vitro
программированную смерть клеток герминативного эпителия семенных канальцев.
Авторы рассматривают ацетилцистеин как потенциально эффективное средство при идиопатической олигоспермии.
В статье С. Fiorentini и соавторов (1999) приведены доказательства эффективности применения ацетилцистеина для профилактики псевдомембранозного колита, обусловленного применением антибиотиков.
Авторы указывают, что индуцирующим фактором развития этой патологии являются токсины А и В анаэробной бактерии Clostridium difficile.
На субклеточном уровне эти токсины оказывают повреждающее влияние на актиновый цитоскелет. Результаты исследования влияния нарушений окислительно-восстановительного баланса на токсиноиндуцированный цитопотический эффект свидетельствуют, что оба токсина провоцируют окислительный стресс, вследствие чего значительно уменьшается количество белковых SH-групп.
Представлено первое доказательство того, что поставщик тиоловых групп ацетилцистеин препятствует клеточному повреждению, действуя на целость цитоскелета.
В настоящее время основной областью применения ацетилцистеина является пульмонология.
Ещe несколько лет назад антиокислительные свойства ацетилцистеина были признаны важным фактором, оказывающим дополнительное влияние на течение патологического процесса в легких. Дело в том, что воспалительные заболевания легких характеризуются резким усилением окислительных процессов в легочной ткани. Это приводит к снижению содержания глутатиона, что в свою очередь сопровождается нарушением функции сурфактанта и усилением активности цитокининов — медиаторов воспаления. В норме внутриклеточный глутатион подавляет выработку медиаторов воспаления, препятствует прямому повреждению легочной ткани под влиянием свободнорадикальных реакций. Поставщик тиоловых групп ацетилцистеин способствует восстанавлению содержания внутриклеточного глутатиона, оказывает прямое антиоксидантное действие. Это создает дополнительные преимущества при использовании ацетилцистеина при воспалительных заболеваниях легких (
Morris P.E., Bernard G.R., 1994).
Eщe одно важное преимущество применения ацетилцистеина отмечено С.Н. Zheng и соавторами (1999). Исследовано влияние мукорегулирующих средств карбоксиметилцистеина и ацетилцистеина на адгезивные свойства бактерии Mоrахеllа
catarrhalis
по отношению к клеткам фарингеaльного эпителия. При применении этих препаратов адгезивные свойства
М. cafarrhalis
дозозависимо снижались — максимально на 57% от начальной. Эти результаты позволяют сделать заключение, что дополнительным фактором, влияющим на эффективность лечения ацетилцистеином пациентов с острыми и хроническими респираторными заболеваниями, является свойство препарата ингибировать адгезию бактерий на эпителии верхних дыхательных путей.
В 1995 г. были опубликованы результаты двойного слепого исследования эффективности ацетилцистеина у 24 больных, оперированных с применением аппарата искусственного кровообращения (АИК). Из них 12 пациентам ацетилцистеин вводили болюсом в дозе 100 мг/кг на фоне постоянного капельного введения ацетилцистеина в дозе 20 мг/кг в 1 ч (1-я группа); 12 — плацебо (2-я, контрольная, группа).
Кровь для определения окислительной реакции нейтрофильных гранулоцитов (НГ) брали несколько раз через разные промежутки времени. У больных 1-й группы окислительная реакция НГ была значительно менее выражена, чем у пациентов контрольной группы.
На основании этих данных авторы определяют роль ацетилцистеина как нейтрализатора свободных радикалов кислорода, эффективного при
проведении
операций с использованием АИК
(Andersen L.W. et al., 1995).
Недавно опубликованы результаты другого проспективного рандомизированного исследования (Porter J.M. et al., 1999). Установлена важная роль кислородных радикалов в этиологии синдрома полиорганной недостаточности и инфекционных осложнений посредством прямой клеточной токсичности и активации внутриклеточных медиаторных процессов.
Выявлено снижение активности антиоксидантной защиты у больных с травматическими повреждениями. Отмечено снижение содержания глутатиона, для которого ацетилцистеин является предшественником, и селена, являющегося кофактором для глутатиона.
Восемнадцать больных с различными травмами были распределены на две группы. Пациентам одной из них назначали ацетилцистеин, селен, витамины С и Е в течение 7 дней.
По сравнению с контрольной группой, в группе больных, получавших активную терапию, инфекционные осложнения (8 против 18) и органная дисфункция возникали реже (0 против 9). Эти данные подтверждают мнение о том, что применение антиокислительных средств, в частности ацетилцистеина, способствует снижению частоты инфекционных осложнений и органной дисфункции
у пациентов с серьезными травмами.
Дополнительные данные, подтверждающие эффективность ацетилцистеина при различных нарушениях функции внутренних органов (в данном случае — пригепаторенальном синдроме
), приведены S. Holt и соавторами (1999). Авторы отмечают, что применение ацетилцистеина
улучшает функцию
почек.
R.W. Hurd и соавторы (1996) у 4 больных с прогрессирующей миоклонической эпилепсией типа Unverricht-Lundborg (PME-UL)
обнаружили повышенную активность внеклеточного фермента супероксиддисмутазы. Это послужило основанием для включения в план лечения ацетилцистеина в суточной дозе4000
–
6000 мг. Под влиянием лечения отмечено значительное снижение миоклонуса и нормализация соматосенсорно-индуцированных потенциалов. Больных лечили ацетилцистеином в течение
30 мес
. Положительный эффект также отмечен в течение длительного времени после прекращения приема препарата. Авторы пришли к выводу, что ацетилцистеин может предупреждать ухудшение клинического состояния пациентов с PME-UL. Кроме того, приведенные результаты можно рассматривать как
доказательство безопасности ацетилцистеина
, поскольку его применение в дозах, многократно превышающих среднетерапевтические, и в течение времени, многократно превышающего среднюю продолжительность обычного курса лечения, не привело к развитию серьезных побочных явлений. Авторы предположили, что с помощью ацетилцистеина можно улучшить состояние пациентов и с другими нейродегенеративными процессами, при которых прогрессирование обусловлено избыточной продукцией свободных радикалов.
Подобную гипотезу высказали М. Маtinez и соавторы (1999). Они предложили использовать ацетилцистеин как средство лечения пациентов с болезнью Паркинсона.
Учитывая снижение активности митохондриального комплекса в клетках
substantia nigra
при болезни Паркинсона, что сопровождается снижением синтеза АТФ и накоплением активных кислородных радикалов, авторы предположили, что именно избыток активных радикалов ведет к гибели клеток
substantia nigra
и появлению клинических признаков болезни.
По мнению авторов, если гипотеза верна, то антиоксиданты, содержащие тиоловую группу как необходимый компонент окислительного фосфорилирования, смогут защитить клеточные структуры от оксидативного повреждения. Предполагается, что применение антиоксидантов, содержащих тиоловую группу, может стать новой стратегией в нейропротекторной терапии болезни Паркинсона.
В большинстве стран антиоксидантная терапия включена в стандартный протокол лечения пациентов с ожогами. В патогенезе повреждений такого рода важную роль играет снижение клеточного иммунитета.
О. Cetinkale и соавторы (1999) опубликовали результаты проведенного на крысах исследования с целью изучения влияния антиоксидантной терапии на состояние клеточного иммунитета после ожогового поражения. Использовали различные антиоксидантные препараты: аллопуринол (50 мг/кг в день), дефероксамин (15 мг/кг в день), РЕG-каталазу (PEG-CAT) (1200 ед/кг в день), аскорбиновую кислоту (0,5 мг/кг в день), ацетилцистеин (1 мг/кг в день). Все препараты назначали сразу после ожога и применяли в течение 7 дней. Полученные данные свидетельствуют о том, что предотвратить глубокую иммуносупрессию при тяжелых ожогах в значительной мере можно путем своевременного назначения антиоксидантной терапии, в частности, ацетилцистеина.
Кроме того, отмечена возможность восстановления клеточного иммунитета благодаря проведению такой терапии.
Впрочем, еще в 1993 г. в мировой медицинской литературе появились данные о комплексном влиянии ацетилцистеина на иммунитет у ВИЧ-инфицированных пациентов (Eylar Е. et al., 1993).
В статье приведены доказательства иммуностимулирующего действия ацетилцистеина на Т-лимфоциты, в частности на митогенез, продукцию интерлейкина-2 (IL-2) и на рост Т-лимфоцитов в культуре клеток. Ссылаясь на работы других авторов и данные собственных исследований in vitro,
свидетельствующих об ингибирующем влиянии ацетилцистеина на репликацию ВИЧ, авторы рекомендуют ацетилцистеин для лечения ВИЧ-инфицированных пациентов.
По данным M. Roederer и соавторов (1993), у пациентов со СПИДом установлена зависимость тяжести инфекционных осложнений от степени снижения уровня глутатиона. При низком уровне глутатиона клетки организма подвергаются дополнительной нагрузке в виде оксидативного стресса, что потенцирует развитие инфекционных осложнений.
Авторы рекомендуют ввести ацетилцистеин в схему лечения больных с ВИЧ-инфекцией как средство, ингибирующее развитие любых воспалительных процессов, в том числе непосредственно связанных с репликацией ВИЧ. Такого же мнения придерживается W. Droge (1993).
Результаты ряда клинических и лабораторных исследований позволяют предположить, что развитие СПИДа может быть в значительной степени обусловлено вызванным ВИЧ недостатком цистеина.
Снабжение клетки цистеином влияет на внутриклеточное содержание глутатиона, IL-2-зависимую пролиферацию Т-лимфоцитов и активацию фактора транскрипции NF-kappaB. Следовательно, дефицит цистеина у ВИЧ-инфицированных пациентов ответственен не только за клеточную дисфункцию, но также за целый ряд патогенетических факторов болезни.
Авторы пришли к выводу, что ацетилцистеин можно рассматривать как средство пополнения содержания цистеина и восстановления уровня глутатиона в оргaнизме у ВИЧ-инфицированных пациентов. Ожидаемый эффект связан с тем, что ацетилцистеин оказывает влияние на различные факторы патогенеза СПИДа и является хорошо исследованным и безопасным лекарственным средством. Однако действие ацетилцистеина при СПИДе и других заболеваниях связано не только с его ролью как поставщика цистеина для синтеза глутатиона.
R. Kinscherf и соавторы (1994) обнаружили на примере здоровых лиц, что при избыточном уровне внутриклеточного глутатиона, так же, как и при его недостатке, количество CD4+ Т-клеток меньше, чем при содержании глутатиона в пределах нормы. У пациентов со сниженным внутриклеточным уровнем глутатиона в течение 4 нед отмечено снижение количества CD4+ Т-клеток в среднем на 30%. В данной работе выявлено, что назначение
ацетилцистеина
предотвращало уменьшение количества CD4+ Т-клеток несмотря наизменения уровня внутриклеточного глутатиона.
Ацетилцистеин оказывает не только непосредственное, но и косвенное влияние на иммунитет. В одном из исследований, например, отмечено его индуцирующее влияние при лечении интерфероном больных вирусным гепатитом С (Beloqui О. et al., 1993). Альфа-интерферон — эффективное средство, используемое для лечения больных гепатитом С, однако при этом довольно часто развивается резистентность к препарату, механизм которой еще неизвестен. В данном исследовании при резистентности к альфа-интерферону, то есть при высоком уровне активности аланин-аминотрансферазы (АлАТ) крови в течение 4 мес терапии пациентам дополнительно назначали ацетилцистеин перорально в дозе 600 мг в сутки. У всех пациентов до применения ацетилцистеина отмечали также снижение содержания глутатиона в плазме крови и в мононуклеарных клетках. Оценку эффективности дальнейшего лечения проводили на основании уровня АлАТ в плазме крови. При использовании ацетилцистеина в сочетании с альфа-интерфероном активность АлАТ снижалась, у 41% больных через 5–6 мес соответствовала показателям в норме. Внутриклеточный уровень глутатиона также восстановился.
Последний факт отчасти служит объяснением эффективности комбинированной терапии гепатита С.
В исследовании 1998 г. на примере вируса кошачьего иммунодефицита обнаружено, что восстановление внутриклеточного уровня глутатиона оказывает прямое ингибирующее воздействие на репликацию вируса. В качестве средства, нормализующего уровень внутриклеточного глутатиона, также применяли ацетилцистеин (Mortola Е. et al., 1998).
При обострении перемежающейся порфирии в организме человека накапливается 5-аминолевулиновая кислота (5-АЛК), предшественник гемa. Эта кислота стимулирует продукцию свободных радикалов, что приводит к повреждению белков и ДНК.
Полученные in vitro
данные свидетельствуют о том, что ацетилцистеин предотвращает свободнорадикальное повреждение белков и ДНК, вызванное накоплением 5-АЛК (Yusof M. et al., 1999).
И еще одна потенциальная область применения ацетилцистеина. Данные последних экспериментальных исследований на мышах позволили предположить целесообразность применения ацетилцистеина при цитокинопосредованных заболеваниях, в частности артрите (
Tsuji F. et al., 1999).
АНТИТОКСИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЦИСТЕИНА
Ацетилцистеин обладает выраженной неспецифической антитоксической активностью
. Его применение одинаково эффективно и в «домашней терапии», например, для устранения похмельного синдрома вследствие избыточного употребления алкоголя, и в терапии серьезных, опасных для жизни отравлений. Ацетилцистеин сочетает в себе свойства одновременно и
неспецифического токсикотропного
противоядия (вступающего в физико-химические взаимодействия с токсичными веществами в организме человека), и
токсикокинетического
противоядия (оказывающего влияние на скорость процессов деградации токсичных молекул). Ацетилцистеин активизирует синтез
глутатиона
, который является важным фактором химической детоксикации (Anderson M.E., Luo J.L., 1996).
С момента начала клинического применения препарата постоянно накапливаются сведения о его эффективности при отравлениях самыми различными веществами.
Ацетилцистеин можно применять у пациентов с острыми отравлениями альдегидами, фенолами и другими химическими веществами.
Ацетилцистеин оказывал антитоксическое действие в отношении широкого спектра различных токсичных веществ, в частностиакролеина, содержащегося в сигаретном дыме, автомобильных выхлопах и в жареных блюдах, а также образующегося в организме при терапии пациентов с онкологическими заболеваниями циклофосфана.
Ацетилцистеин является антидотом при остром отравлении парацетамолом (ацетаминофеном).
Ацетилцистеин рассматривается в мировой медицинской литературе как одно из наиболее широко применяемых антитоксичных средств (Lheureux Р. et al., 1990).
Также в литературе описаны редкие клинические случаи отравлений с потенциально летальным исходом, при которых только применение ацетилцистеина смогло кардинально изменить ситуацию и спасти пациента.
В частности, в статье D. Mattin и соавторов (1990) описана история болезни пациента в возрасте 32 лет, который за 5,5 ч до поступления в отделение интенсивной терапии принял с суицидальной целью потенциально летальную дозу одной из солей мышьяка. Внутримышечное введение димеркапрола и дополнительные детоксикационные мероприятия оказались неэффективными. Состояние пациента ухудшалось. Через 27 ч внутривенно введен ацетилцистеин. В течение следующих 24 ч состояние пациента значительно улучшилось. Несколько дней спустя он был выписан в удовлетворительном состоянии.
В одном из докладов калифорнийского Центра по контролю заболеваемости описан случай излечения больного в возрасте 42 лет после отравления бледной поганкой. Ацетилцистеин в этом случае назначали перорально в высоких дозах. Через несколько дней пациент был выписан в удовлетворительном состоянии. Никаких отдаленных последствий отравления не наблюдали (Amanita phalloides Mushroom Poisoning, 1997).
Отечественными авторами получены данные об эффективном применении ацетилцистеина в комбинированной терапии больных с острым отравлением дихлорэтаном. Ацетилцистеин использовали после проведения экстракорпоральной детоксикации (гемосорбции) для предотвращения развития токсического поражения печени (Курашов О.В., Троцевич В.А., 1992).
В экспериментальной работе с использованием линии клеток LLC-PK1 in vitro
изучено влияние ацетилцистеина на цитотоксичность кадмия. Установлено, что ацетилцистеин эффективно защищает клетки от токсического воздействия кадмия, преимущественно за счет уменьшения его проникновения во внутриклеточное пространство (Wispriyono В. et al., 1998).
Исследовали влияние ацетилцистеина на хроническую кадмий-индуцированную нефротоксичность.
Хроническая кадмий-индуцированная нефротоксичность характеризуется необратимыми нарушениями в почках на поздних стадиях, и в настоящее время не существует методов ее устранения. Исследование проводили на крысах-самках линии Sprague–Dawley
, получавших 5 раз в неделю в течение 26 нед инъекцию кадмия хлорида в дозе 5 мкмоль на 1 кг массы тела c дополнительным применением на 13-й неделе ацетилцистеина. Явления нефротоксичности (появление белка и повышение содержания лактатдегидрогеназы в моче) отмечали на 10-й неделе.
Введение ацетилцистеина, начиная с 13-й недели, предупреждало дальнейшее развитие нефротоксичности. Продолжение введения ацетилцистеина после 26-й недели (то есть после прекращения введения кадмия) способствовало быстрому купированию симптомов даже при выраженной нефротоксичности (Shaikh Z.A. et al., 1999).
В эксперименте на крысах линии Sprague–Dawley
также установлено, что ацетилцистеин значительно снижает
нефротоксичность циклоспорина
, связанную с ухудшением кровоснабжения почек и накоплением в почечной ткани свободных радикалов кислорода (oxygen-derived free radicals, ODFR).
В течение 3 нед животные одной группы получали циклоспорин в дозе 25 и 50 мг/кг, другой группы — циклоспорин в сочетании с ацетилцистеином в различных дозах: 10, 20 и 40 мг/кг.
Эффект оценивали по изменению уровня мочевины и креатинина в плазме крови, а также по данным гистологического исследования биоптатов почек. Лечение ацетилцистеином весьма успешно защищало почечную ткань от повреждений вследствие применения циклоспорина. Также подтверждена роль оксидативного стресса в патогенезе циклоспорин-индуцированной нефротоксичности (Tiriq М. et al., 1999).
Насколько широко распространены отравления ртутью? Большое количество людей в мире озабочены повышением частоты отравлений ртутью вследствие применения ртутьсодержащих амальгам в стоматологии.
Такое отравление получило название «амальгамозависимое неаллергическое заболевание». Этот термин не получил статуса официального диагноза, однако широко используется в литературе при обсуждении вопроса о токсическом действии ртути.
О серьезности отношения к этой проблеме свидетельствует, например, тот факт, что в Швеции существует Ассоциация пациентов, в лечении которых применяли ртутные амальгамы. Ассоциация существует на протяжении 16 лет и насчитывает более 15 000 членов.
Конечно, в обычных условиях наличие в ротовой полости ртутной амальгамы не создает для человека проблем. Проблема перестанет казаться надуманной, если познакомиться с данными исследования Sallsten (1996). Автор установил, что у лиц, употребляющих никотинсодержащую жевательную резинку, содержание ртути в моче повышается в 5 раз и достигает уровня, образующегося при контакте со ртутью в условиях производства. Обычная жевательная резинка обладает подобным эффектом, хотя и в меньшей степени (Gay, 1979; Abraham, 1984; Aronsson, 1989; Berglund, 1990; Bjorkman, 1992).
Molin (1990) приводит данные о том, что при стоматологических манипуляциях на зубе с установленной ртутной амальгамой содержание ртути в плазме крови может повышаться на 300–400% по сравнению с таковым до проведения манипуляции.
В связи с этим особый интерес вызывает такое свойство ацетилцистеина, как снижение токсического действия ртути.
В исследовании, проведенном F. Livardjani и соавторами (1991), крыс подвергали воздействию паров ртути. При гистологическом исследовании выявляли изменения легочной ткани — альвеолярный отек, появление гиалиновых мембран и участков фиброза. Воздействие паров ртути в течение 2 ч приводило к гибели 50% животных на протяжении следующих 2 нед. Применение ацетилцистеина увеличивало длительность жизни и процент выживших животных, снижало содержание ртути в крови и легочной ткани, активность легочной супероксиддисмутазы (антиоксидантный эффект).
Также в одном из исследований выявлены протективные свойства ацетилцистеина при нефротоксичности, вызванной хлоридом ртути. Также отмечено, что применение ацетилцистеина значительно снижает содержание ртути в тканях печени и почек (Girardi G., Elias M.M., 1991).
Кроме того, обнаружены хелатные свойства ацетилцистеина при проведении гемодиализа у пациентов с отравлением ртутью. Его эффективность применительно к ртути была наиболее высокой по сравнению с другими десятью широко применяемыми для гемодиализа хелатными агентами. Через 90 мин после проведения гемодиализа содержание ртути в перфузате снижалось на 73% (Ferguson C.L., Cantilena L.R.Jr., 1992).
Недавно опубликованы данные, свидетельствующие о том, что применение ацетилцистеина снижает действие ареколина, канцерогенного вещества (Chatterjee A., Deb S., 1999).
«Экстази» — жаргонное название 3,4-метилендиокси-метамфетамина (МDМА); другие жаргонные названия этого соединения — «X», «Е», «ХТС», «Adam» и др. Это полусинтетическое наркотическое соединение, обычно в виде белых кристаллов солянокислой соли, вызывает психическую зависимость. Продается нелегально в капсулах, спрессованных из порошка, в таблетках или в виде белого порошка. Обычно его принимают внутрь, но иногда также интраназально, в виде ингаляций (курят), вводят подкожно, внутримышечно или внутривенно.
Некоторые исследователи предполагают, что влияния «Экстази» на серотониновую систему можно избежать или снизить его выраженность приемом антиоксидантов.
B. Leibovitz (1999) предлагает в качестве предупредительной меры использовать 5 мг бета-каротина, 2 г биофлавонидов, 100 мг коэнзима Q , 2–4 г аскорбиновой кислоты, 1 г L-кaрнитина, 2 г N-ацетилцистеина, 250 мкг селена, 1000 ME токоферола.
Эти данные представляют интерес, хотя они не получили должного подтверждения.
АЦЕТИЛЦИСТЕИН КАК АНТИДОТ ПРИ ОТРАВЛЕНИИ ПАРАЦЕТАМОЛОМ
Использование парацетамола, жаропонижающего и анальгетического средства, безопасно в рекомендуемых дозах. Этот препарат является одним из наиболее широко применяемых в мире. Однако в высоких дозах парацетамол может вызвать тяжелые поражения печени. Отравления парацетамолом заслуживают отдельного исследования прежде всего потому, что жертвами таких отравлений становятся в первую очередь дети. Только в Великобритании ежегодно регистрируют 150 смертей вследствие отравления парацетамолом. Парацетамол, по данным исследований разных авторов, проведенных в разное время, явился причиной 5–45% всех бытовых отравлений в США и Великобритании (Acute Exacerbations of COPD, 1998).
В литературе описаны случаи молниеносного течения поражения печени под влиянием препарата. Гепатотоксичность парацетамола связывают с накоплением его токсического метаболита N-ацетилимидохинона. Существует высокий риск развития некроза печени при использовании препарата в дозе 150 мг/кг у детей и 10 г у взрослых. Острые формы недостаточности печени возникают в 1–5% случаев передозировки парацетамола через 3–6 дней от начала приема (Olson K.R., 1994).
У больных с хроническим алкоголизмом гепатотоксичность может проявляться и на фоне лечения препаратом в более низких дозах. Эти тяжелые формы поражения печени возникают у каждого второго больного с алкоголизмом с выраженным нарушением функции печени при приеме парацетамола в терапевтических дозах.
В качестве основного антидота при передозировке парацетамола
в настоящее время используют
ацетилцистеин
внутривенно или перорально. Первоначально предполагали, что
ацетилцистеин
эффективен только при назначении не позднее 14 ч после приема парацетамола в высокой дозе. Однако опыт практического применения препарата свидетельствует, что исход может быть более благоприятным,
дажееслиантидот будет введен через 24 ч.
Тем не менее задержка более чем на 10 ч снижает эффективность применения ацетилцистеина (Olson K.R., 1994).
В США существует практика использования ацетилцистеина только перорально. При этом больному вначале назначают препарат в нагрузочной дозе из расчета 140 мг/кг, в дальнейшем — 17 доз из расчета 10 мг/кг каждые 4 ч. Это весьма эффективный методический подход, однако на практике его использование затруднено, так как отравление парацетамолом может сопровождаться рвотой, развивающейся слишком поздно, чтобы способствовать выведению парацетамола из организма. Если рвота следует непосредственно за приемом очередной дозы ацетилцистеина, то прием препарата в этой дозе немедленно повторяют (Olson K.R., 1994).
Существует другая методика, в соответствии с которой ацетилцистеин вводят внутривенно в течение 20 ч в общей дозе 300 мг/кг (Prescott L.F. et al., 1977).
Обычно при таком введении больные хорошо переносят препарат, но эффективность его снижается, если он введен через 10 ч и более после отравления.
ЗАКЛЮЧЕНИЕ
При наличии большого количества средств ацетилцистеин в настоящее время является препаратом выбора для осуществления неспецифической детоксикации и поддержания должного уровня противоокислительной защиты организма.
Ацетилцистеин эффективен при отравлениях различными органическими и неорганическими соединениями. Ацетилцистеин хорошо переносится и всасывается, устойчив к воздействию ферментов и обладает доказанной в многочисленных исследованиях активностью при пероральном приеме.
Когда применяют Ацетилцистеин
Главными показаниями к приему Ацетилцистеина являются бронхиты любой этиологии и воспаление легких, а также его назначают в случаях воспаления слизистой оболочки трахеи. Действие препарата направлено на разжижение мокроты, которая является результатом работы местного иммунитета организма.
Когда возбудитель попадает на слизистые оболочки и провоцирует воспалительный процесс, легочная ткань, а также эпителий, выстланный по внутренней поверхности бронхов и бронхиол, начинает активную выработку мокроты. Это нужно для того, чтобы как можно скорее вывести из просвета системы дыхания болезнетворные микроорганизмы. Кашель в такой ситуации является еще одним защитным механизмом, выводящим зараженную слизь.
Если мокрота густая и вязкая, ей трудно отделиться от стенок органов дыхания. Оседая в бронхах и легких, она становится постоянным раздражителем кашлевых рецепторов. В такой ситуации человека мучает сухой кашель, а заболевание прогрессирует.
Ацетилцистеин превращает мокроту в жидкую и не липкую субстанцию, которая за пару кашлевых толчков полностью выводится наружу. При пневмонии Ацетилцистеин помогает легким освобождаться от слизи, в которой болезнетворные бактерии быстро размножаются, провоцируя развитие осложнений. Освободив легкие от мокроты, или не позволив ей там скопиться, удастся избежать бактериальной пневмонии.
При синуситах и гайморитах нередко также назначают Ацетилцистеин, поскольку слизь в верхних отделах дыхательных путей может перейти в отит. Чем скорее слизь покинет носовые ходы и пазухи, тем быстрее наступит выздоровление.
Фармакологическое применение[править | править код]
Является муколитиком
, т.е. разжижает мокроту помогая выводить ее наружу. Используется при легочных заболеваниях, таких как хроническая обструктивная болезнь легких (ХОБЛ), бронхит и т.д.
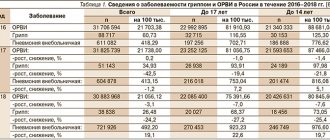
Используется при ОРВИ
. При вирусных инфекциях происходит активация фагоцитов, в результате чего повышается продукция свободных радикалов и нарушается иммунная противовирусная защита, что ведет к цитотоксическим эффектам, обусловливающим всю клиническую симптоматику острой респираторной вирусной инфекции (ОРВИ).
В 1997 г. S. De Flora и соавт. провели многоцентровое плацебо-контролируемое двойное слепое рандомизированное исследование, в котором показали превентивное действие Флуимуцила (ацетилцистеина) при развитии ОРВИ. Препарат не влиял на противовирусный иммунитет непосредственно, но в 3 раза снижал частоту манифестных форм ОРВИ, уменьшал выраженность как респираторных, так и общих симптомов заболевания (головная боль, миалгия, артралгия). Максимальная эффективность препарата наблюдалась в период наивысшей заболеваемости ОРВИ. На фоне приема ацетилцистеина заболевание протекало значительно легче, быстрее наступало выздоровление.
В исследованиях было показано, что ацетилцистеин усиливает действие антибиотиков.
Используется при отравлении парацетамолом, а также как антидот
. Обладает антитоксическим свойством, используется как антидот при отравлении парацетамолом, а также нитратами, автомобильными выхлопами, сигаретным дымом, тяжелыми металлами и т.д. Защищает от сигаретного дыма.
Гепатотоксичность парацетамола связывают с накоплением его токсичного метаболита N-ацетили-мидохинона, истощающего запасы глутатиона в печени. Ацетилцистеин, освобождая внутриклеточный L-цистеин, принимающий участие в синтезе глутатиона, восстанавливает запасы последнего и значительно улучшает прогноз при интоксикации парацетамолом.
Ацетилцистеин обладает широким спектром антитоксического действия, в т. ч. в отношении акролеина, содержащегося в сигаретном дыме, автомобильных выхлопах и жареных блюдах, а также образующегося в организме в период лечения циклофосфаном. Его применяют в качестве хелатного агента при отравлении металлами, включая ртуть, золото, серебро, кадмий и др. Будучи донатором свободных сульфгидрильных групп, ацетилцистеин оказывает протективный эффект в отношении поражений печени и почек, вызванных ртутью.
В экспериментальных исследованиях продемонстрирована способность ацетилцистеина оказывать протективный эффект в отношении цитотоксического действия сигаретного дыма. Профилактическое его применение угнетало индуцированные курением гиперплазию мукозных клеток и гипертрофию эпителия. Кроме того, ацетилцистеин способствовал улучшению микроциркуляции у курильщиков. Комплекс благоприятных свойств препарата позволяет рекомендовать его регулярный прием не только активным, но и пассивным курильщикам, постоянно подвергающимся воздействию сигаретного дыма.
Ограничения приема Ацетилцистеина
В связи с тем, что препарат направлен на увеличение объема продуцируемой мокроты и ее разжижение, средство не принимают на ночь. В противном случае ночные часы будут посвящены не сну, а продуктивному откашливанию. Что особенно актуально для детей, ночной кашель которых не даст спать всей семье.
Дополнительно следует отметить, что Ацетилцистеин не назначают детям до двух лет. Это связано с тем, что ребенок не имеет ярко выраженного кашлевого рефлекса или сила его толчков недостаточно сильная. Препарат может быть использован только в условиях стационара, когда медики с помощью специальной аппаратуры смогут отсосать мокроту из дыхательных путей ребенка.
Применение в качестве антиоксиданта[править | править код]
Ацетилцистеин является мощным антиоксидантом оказывающим как прямое, так и непрямое действие. Прямое действие обусловлено наличием тиоловой SH-группы способной нейтрализовать свободные радикалы, причем ацетилцистеин проявляет выраженный антиоксидантный эффект даже при низких концентрациях. Непрямое действие происходит за счет того, что ацетилцистеин является предшественником глутатиона. Глутатион – трипептид, который состоит из глутаминовой кислоты, цистеина и глицина. Глутатион служит основным фактором защиты от воздействия внутренних токсических и внешних агентов: окиси азота, окиси серы и других компонентов табачного дыма, а также веществ, загрязняющих воздух.
Возможные побочные реакции
Среди редких побочных реакций выделяют:
- головные боли;
- крапивницу;
- отек лицевых тканей;
- снижение давления;
- рвота;
- стоматит.
При первых признаках проявления негативных реакций следует немедленно прекратить прием препарата. Если средство было принято не более получаса назад, следует промыть желудок, вызвав рвоту.
Противопоказания[править | править код]
Побочные явления при употреблении ацетилцистеина крайне редки и как правило ограничиваются расстройствами желудочно-кишечного тракта. При передозировке возможны диарея, тошнота, рвота.
Тиоловая группа ацетилцистеина как правило взаимодействует с антибиотиками разрушая их, поэтому прием антибиотиков желательно проводить после 2-х часов после приема ацетилцистеина.
Тиоловая группа ацетилцистеина может вступать в реакцию с резиной и металлами, поэтому желательно пользоваться стеклянной или эмалированной посудой.
Опасное взаимодействие
В связи с тем, что механизм действия препарата направлен на увеличенние количества жидкой мокроты в органах дыхания, одновременный прием с препаратами обратного действия противопоказан.
Среди них:
- Синекод;
- Омнитус;
- Коделак Нео;
- Туссикод;
- Стоптуссин.
Все они имеют в качестве действующего вещества бутамират, который «выключает» кашлевой центр в мозге, останавливая кашель. В результате, мокрота будет вырабатываться в огромных количествах, заполняя бронхи и легкие, не имея возможности выйти наружу.
Кроме того, другие противокашлевые рецептурные препараты, такие как Коделак, на основе кодеина, также не следует принимать вместе с муколитиками.
Совместное применение[править | править код]
- При заболевании.
Как уже указывалось выше, ацетилцистеин усиливает действие антибиотиков, но только тех, которые не вступают в связь с тиоловой группой ацетилцистеина, например тиамфеникол. В этом случае действие ацетилцистеина и антибиотика повышается по сравнению с применением их по отдельности.
- Антиоксидант.
В работе белорусских ученых (Борисенок О.А.) рекомендуется совмещение мелатонина и ацетилцистеина. Мелатонин, также как и ацетилцистеин является сильным антиоксидантом.