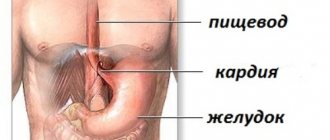
Общие сведения
Дуодено-гастральный рефлюкс (син. рефлюкс-гастрит, билиарный рефлюкс, щелочной гастрит, билиарный гастрит) представляет собой патологический процесс ретроградного поступления желчного содержимого дуоденальной кишки в желудок, который может сопровождаться клинической симптоматикой, гистологическими признаками и эндоскопическими изменениями реактивного (химического) гастрита. Термин «refluxus» означает «обратное течение». В физиологических условиях желчь из двенадцатиперстной кишки не должна попадать в анатомически вышележащие отделы пищеварительного канала, поэтому желчный рефлекс рассматривают как патологическое явление. ДГР возникает вследствие чрезмерного поступления желчи из ДП-кишки из-за недостаточности привратника, выполняющего роль барьера для ретроградного тока желчи или вследствие нарушения (снижения) антероградной перистальтики желудка и ДП-кишки.
Современные научные исследования свидетельствуют о росте числа заболеваний, обусловленных наличием у пациента патологического дуоденогастрального рефлюкса. При этом, высокая распространенность ДГР (в 46-52% случаев) и частое сочетание с хроническим гастритом, функциональной диспепсией, язвенной болезнью, ГЭРБ, раком желудка, пищеводом Барретта, дисфункцией сфинктера Одди, дуоденостазом, постхолецистэктомическим синдромом и др. усложняет их течение и терапию. ДГР достаточено часто встречается после хирургических вмешательств (в 16% случаев после холецистэктомии и почти в 55% случаев после операции по поводу дуоденальной язвы).
Кроме того, дуоденальный рефлюкс может быть причиной развития метаплазии эпителия пищевода, тяжелого эзофагита и плоскоклеточного рака пищевода на фоне метаплазии. Следует отметить, что гастродуоденальный рефлюкс в «чистом» виде, (позиционирующийся как изолированный диагноз) встречается относительно редко (10-15%) и преимущественно диагностируется на фоне других заболеваний. То есть, в большинстве случаев ДГР представляет собой синдром, сопровождающих целый ряд заболеваний верхних отделов ЖКТ.
ДГР возникает вследствие чрезмерного поступления желчи из ДП-кишки из-за недостаточности привратника, выполняющего роль барьера для ретроградного тока желчи или вследствие нарушения (снижения) антероградной перистальтики желудка и ДП-кишки.
Таким образом, дуоденальный патологический рефлюкс осложняет течение различных органических/функциональных заболеваний ЖКТ, что и обуславливает необходимость его своевременной диагностики, правильной клинической интерпретации и проведения адекватной медикаментозной коррекции.
Преимущества лечения дуодено-гастрального рефлюкса в Швейцарской Университетской клинике
- Наш Центр оснащен современным оборудованием производства ведущих европейских и американских компаний, что позволяет проводить сложнейшие диагностические и лечебные манипуляции с высокой точностью и эффективностью.
- В клинике принимают специалисты высшей и первой категории, имеющие огромный опыт, каждый из них в совершенстве владеет всеми методиками по своей специализации.
- Нашими специалистами проведено более 600 хирургических вмешательств, связанных с нарушением дуоденальной проходимости.
- Пациентам, имеющим сопутствующие заболевания брюшной полости и малого таза и нуждающимся в хирургическом лечении, в нашей клинике может быть проведена симультанная операция. В ходе одного вмешательства можно избавиться от 3-4 патологий (например, кисты почки, яичника, нефроптоза, миомы и целого ряда других заболеваний).
Патогенез
В основе патогенетических механизмов развития ДГР лежат:
- несостоятельность сфинктерного аппарата, что позволяет содержимому дуоденальной кишки свободно через пилорический/нижний пищеводный сфинктеры достигать желудка;
- антродуоденальная дисмоторика (расстройство координации между пилорическим/антральным отделами желудка и ДП-кишкой), что приводит к нарушению управления направлением тока содержимого двенадцатиперстной кишки;
- ликвидация антирефлюксного барьера после операционного вмешательства (частичная гастрэктомия).
При развитии патологического ДГР из-за дисфункции сфинктеров желчь ретроградно в составе рефлюксата попадает из ДПК в выше расположенный желудок. Компоненты дуоденального содержимого, представленные желчными кислотами, лизолецитином и трипсином, обладают агрессивным повреждающим действием на слизистую оболочку желудка. Наиболее выраженным действием обладают тауриновые конъюгированные желчные кислоты и лизолецитин, особенно при кислом рН, что и определяет их синергизм с соляной кислотой при развитии гастрита. Трипсин не конъюгированные желчные кислоты оказывают выраженное токсическое действие при слабощелочном и нейтральном рН, при этом, токсичность неконъюгированных желчных кислот обеспечивается преимущественно ионизированными формами, которые способны легко проникают через СОЖ.
Длительное воздействие на СОЖ желчных кислот, содержащихся в желчи, вызывает некробиотические и дистрофические изменения поверхностного эпителия и приводят к состоянию рефлюксгастрита (гастрит С).
При наличии Нelicobacter pylori повреждающее действие рефлюксанта на СОЖ усиливается. Формирование ДГР способствует нарушению моторики разных отделов ЖКТ и функции сфинктеров, что приводит к расстройству работы пищеварительного конвейера, оказывает негативное влияние на мембранное/полостное пищеварение и всасывание пищевых ингредиентов, изменяет водный баланс. Агрессивное влияние вначале проявляется в виде нарастающей атрофии, дисплазии и метаплазии СОЖ, формирующих риск развития гастроканцерогенеза. Постепенное агрессивное воздействие желчи с панкреатическим соком способствует тому, что поверхностный гастрит прогрессирует и эрозии слизистой трансформируются в эрозивно-язвенные поражения СОЖ.
Подходы к диагностике и терапии гастрита, ассоциированного с рефлюксом желчи
Широкое распространение в клинической практике рефлюкс-гастрита при отсутствии единого термина [2] (синонимы: гастрит типа С, щелочной гастрит, реактивная гастропатия), а также понимание механизмов формирования, стандартов диагностики и терапии делают актуальным анализ и освещение имеющихся представлений об этом варианте гастрита.
Гастрит, ассоциированный с билиарным рефлюксом (лат. refluo — течь назад), редко носит первичный характер [2, 3], преимущественно развиваясь вторично вследствие анатомических изменений, связанных с оперативным вмешательством: резекцией желудка, гастроэнтеростомией, энтеростомией, ваготомией, холецистэктомией. Несостоятельность сфинктерного аппарата, антродуоденальная дискоординация (нарушение координации между антральным, пилорическим отделами желудка и двенадцатиперстной кишкой), а также резекции части желудка, приводящая к ликвидации естественного антирефлюксного барьера, являются причиной формирования рецидивирующего заброса содержимого двенадцатиперстной кишки, содержащего желчь, в желудок с повреждением его слизистой оболочки.
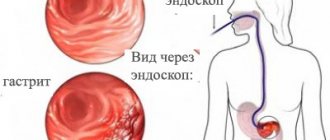
Любой диагностический процесс начинается с опроса и сбора анамнеза. При наличии симптомов диспепсии, которые не носят специфического характера и в ряде случаев рефлюкс-гастрита могут отсутствовать, а также при заболеваниях и состояниях, имеющих высокую степень риска билиарного рефлюкса (желчно-каменная болезнь, состояния после резекции желудка, ваготомии и др.), необходимо проведение эндоскопического исследования с биопсией слизистой оболочки желудка для выяснения наличия, степени и стадии гастрита, а также инфицирования Helicobacter pylori (НР).
Эндоскопическая картина при рефлюкс-гастрите характеризуется гиперемией и отеком слизистой оболочки, которые распространяются циркулярно от пилорического отдела в проксимальном направлении. При этом на ней часто обнаруживаются пятна желчи, отмечается видимый заброс желчи из двенадцатиперстной кишки в желудок или высокое содержание желчи в просвете желудка.
«Золотого стандарта» диагностики дуоденогастрального рефлюкса пока не существует. В качестве метода функциональной диагностики используют 24-часовую рН-метрию, рентгеноскопию и ультразвуковое исследование желудка. Основным методом диагностики билиарных забросов в настоящее время является рН-мониторирующая система Bilitec 2000, которая довольно качественно оценивает желчный рефлюкс и рН в желудке. Barrett M. W. с соавторами [4] показали высокую чувствительность данного устройства для мониторирования желчного рефлюкса in vivo, но несколько меньшую in vitro, с частотой ложноотрицательных результатов около 23%. В кислых условиях объем абсорбции билирубина, определяемый данным прибором, уменьшается, что может привести к росту ложноотрицательных результатов и, соответственно, уменьшению ложноположительных. Хотя этот метод не может быть отнесен к «золотым стандартам» дуоденогастрального рефлюкса, но он наиболее удобен и употребим для динамического мониторинга рефлюкса желчи [5].
Чем же опасен рефлюкс содержимого двенадцатиперстной кишки в желудок, какие структурные изменения происходят в слизистой оболочке желудка под воздействием дуоденального рефлюксата?
Известно, что желчные кислоты, обладающие детергентными свойствами, способствуют солюбилизации липидов мембран поверхностного эпителия, при этом их негативное влияние в отношении эпителия зависит от их концентрации, конъюгации и рН окружающей среды, а также от продолжительности времени, в течение которого слизистая оболочка подвергается действию желчи [6]. При низких значениях рН слизистую оболочку повреждают только тауриновые конъюгаты, а при высоких значениях рН (например, в культе желудка после операции) именно неконъюгированные желчные кислоты оказывают негативный эффект. Помимо собственно желчных кислот лизолецитин, образующийся под воздействием панкреатической фосфолипазы А из лецитина, обладает повреждающим действием, с увеличением обратной диффузии ионов водорода, а также усилением высвобождения гистамина и гастрина. В последние годы обсуждается и возможное взаимодействие желчных кислот с определенным подтипом мускариновых рецепторов, локализованных на главных клетках, вследствие чего в слизистой оболочке желудка развивается активное воспаление, атрофия желез, интестинальная метаплазия и очаговая гиперплазия [7].
Помимо этого, забросы желчи, меняя химический состав поверхности слизистой оболочки, могут потенцировать действие других патогенных факторов: инфекции НР и желудочного сока [8, 9]. Chen S. L. с соавторами [10], оценивая влияние билиарного рефлюкса на выраженность повреждений слизистой оболочки желудка у 49 пациентов с диспепсией и хроническим гастритом, не установили взаимосвязи между длительностью дуоденального рефлюкса и pH в полости желудка, что свидетельствует о наличии сложных механизмов обратной связи, включающих регулирование секреторной и эвакуаторной функции желудка. Вместе с тем степень изменений слизистой оболочки, как и колонизация инфекцией НР, коррелировали с длительностью билиарного рефлюкса. При этом полученные данные отчетливо демонстрировали взаимосвязь между билиарным рефлюксом и выраженностью повреждения слизистой оболочки желудка. Так, выраженный рефлюкс коррелировал с активным воспалением (r = 0,3949, P < 0,05), хроническим воспалением (r = 0,8938, P = 0,0001), атрофией слизистой (r = 0,4619, P < 0,005) и колонизацией НР в теле желудка (r = 0,8938, P = 0,0001). В данной работе, как и в некоторых других [11], был продемонстрирован суммирующийся патогенный эффект на слизистую оболочку желудка НР инфекции и билиарного рефлюкса. Можно предположить комплексный механизм этого воздействия. Так, абсорбция рефлюктанта желчи на поверхности слизистой оболочки желудка оказывает прямой повреждающий эффект, а также усиливает действие пепсина и соляной кислоты; повреждение слизистой оболочки, в свою очередь, способствует колонизации НР от антрального отдела до тела желудка. В отсутствии инфицирования НР вследствие забросов щелочного содержимого из двенадцатиперстной кишки и изменения рН возможна бактериальная контаминация микрофлорой нижележащих отделов пищеварительного тракта, что также приводит к более выраженному повреждению слизистой оболочки желудка.
К характерным морфологическим признакам этого варианта поражения желудка можно отнести феномен фовеолярной гиперплазии, пролиферации гладкомышечных клеток в собственной пластинке, а также изменение продукции мукоцитами муцинов, играющих важную роль в протекции слизистой оболочки [12] (рис.). Модификация секретируемых муцинов, выявляемая иммуногистохимически, приводит к реактивным/регенеративным изменениям, сходным с проявлениями гастропатии, вызванной нестероидными противовоспалительными препаратами (НПВП-гастропатии) [13]: нарушается экспрессия мембранного муцина (MUC1), который вовлечен в процессы адгезии и полярности, и секреторных муцинов (MUC5AC и MUC6). Обнаруженные изменения отличаются от НР-ассоциированного гастрита, при котором уменьшается экспрессия MUC5AC на поверхностном эпителии, а муцин MUC6 распространяется на поверхность мукоцитов [14].
В прогностическом плане крайне важен и еще один аспект изменений слизистой оболочки желудка, ассоциированный с билиарным рефлюксом. Персистенция воспаления с гиперпродукцией свободных радикалов, нарушением микроциркуляции и, как следствие, нарушением процессов клеточного обновления приводит к более частой встречаемости в сравнении с аналогичной возрастной популяцией атрофии и кишечной метаплазии слизистой оболочки желудка. Здесь уместно напомнить о более высоком риске развития рака кишечного типа в культе желудка, который был продемонстрирован как в экспериментальных, так и в эпидемиологических исследованиях [15, 16].
Безусловно, наличие и выраженность воспалительного инфильтрата, а также атрофии слизистой оболочки желудка не определяют наличия у больного клинических симптомов диспепсии, возникающих вследствие нарушений желудочной секреции, гастродуоденальной моторики, висцеральной чувствительности. Почему же тогда так важно клиницисту адекватно интерпретировать данные заключения патолога? Ответ кроется в целевых установках классификационной системы гастрита — оценить состояние слизистой оболочки, дать характеристику воспалительного процесса для прогноза и персонификации программы наблюдения больного, прежде всего с целью предупреждения прогрессирования воспалительных изменений и развития атрофии, кишечной метаплазии, дис/неоплазии.
Тщательный анализ синдрома диспепсии, данных эндоскопического, биопсийного и функциональных исследований, проведенный клиницистом, создает основу для формирования целей терапии больного:
- купировать проявления диспепсии (при их наличии) для повышения качества жизни пациента;
- редуцировать изменения слизистой оболочки для профилактики формирования атрофии с кишечной метаплазией, а при их наличии — остановить прогрессирование изменений слизистой оболочки для профилактики рака желудка.
Важной составляющей лечебной программы следует признать модификацию образа жизни и характера питания пациента. Своевременный прием пищи, отсутствие в рационе избытка животных жиров, сладких газированных напитков, прекращение курения и приема алкоголя способствуют позитивным изменениям в течении гастрита с синдромом диспепсии.
При наличии инфицирования НР следует запланировать проведение эрадикационной терапии для элиминации дополнительного фактора, повреждающего слизистую оболочку желудка и увеличивающего риск рецидивирования синдрома диспепсии.
Поскольку в формировании рефлюкс-гастрита ключевую позицию занимают моторные нарушения, целесообразно курсовое назначение прокинетиков (Ганатон, Тримедат) в качестве одного из средств патогенетической терапии. Однако лишь назначением препаратов этой группы нельзя достичь всех целей терапии рефлюкс-гастрита.
Следующей группой средств патогенетической терапии, рациональной для ряда пациентов с желчно-каменной болезнью, функциональными нарушениями билиарного тракта, сопутствующими хроническими диффузными заболеваниями печени, являются препараты урсодезоксихолевой кислоты (Урсосан, Урсофальк, Урдокса, Урсодекс), которые назначаются в суточной дозе 10–13 мкг/кг веса курсами по 6–8 недель, а при необходимости — и на более длительный период.
Классическим консервативным подходом к лечению гастрита, ассоциированного с билиарным рефлюксом, признано назначение антацидов и солей висмута. В одном из хорошо спланированных исследований применение сукральфата и рабепразола у больных с билиарным рефлюксом после холецистэктомии продемонстрировало свою эффективность как на клинические проявления, так и на выраженность макроскопических признаков воспаления, диагностируемых по результатам эндоскопического исследования [17].
Таким образом, назначение курсовой терапии прокинетиками, антисекреторными средствами и мукоцитопротекторами позволяет купировать симптомы диспепсии. Редуцировать изменения слизистой оболочки с целью профилактики развития атрофии с кишечной метаплазией, а при их наличии — остановить прогрессирование изменений слизистой оболочки для профилактики рака желудка возможно и в результате включения в терапию муко/цитопротекторов.
Группа муко/цитопротекторов включает несколько лекарственных средств (табл.), среди которых следует отдельно выделить терапевтические возможности солей висмута, в том числе Де-Нола. В многочисленных исследованиях показано, что препараты висмута образуют защитный слой на пораженных участках слизистой оболочки, предохраняя ее от воздействия агрессивных факторов, стимулируют секрецию слизи и гидрокарбоната, ингибируют активность пепсина, предохраняют эпителиальные факторы роста от распада, способствуя регенерации клеток эпителия, улучшают микроциркуляцию, стимулируют секрецию гастрозащитных простагландинов. Наряду с цитопротективными эффектами, перечисленными выше, два фактора следует упомянуть отдельно. Это — бактерицидный эффект Де-Нола в отношении хеликобактера и способность Де-Нола к связыванию желчных кислот [26]. Эрадикация хеликобактера с помощью четырехкомпонентной схемы, включающей Де-Нол, значительно уменьшает выраженность дуоденогастрального рефлюкса, что было убедительно показано в исследовании S. D. Ladas и соавт. [27]. Нейтрализация желчных кислот и их солей также чрезвычайно важна в плане устранения одного из ведущих патогенетических факторов рефлюкс-гастрита. Учитывая изложенное выше, применение Де-Нола при гастрите, обусловленном дуоденогастральным рефлюксом, является абсолютно обоснованным с патогенетической точки зрения.
В условиях контаминации слизистой оболочки желудка не-НР микроорганизмами [18], в том числе Helicobacter spp. [19], Proteus mirabilis, Citrobacter freundii, Klebsiella pneumoniae, Enterobacter cloacae, Staphylococcus aureus, с дополнительным стимулом к персистенции воспалительного инфильтрата, активизации процессов перекисного окисления липидов и выработкой бактериями нитрозаминов, несущих проканцерогенный потенциал [20], клиницисту также важно использовать эффекты солей висмута. Во-первых, не являясь антибиотиком, Де-Нол подавляет активность бактериальной флоры без риска формирования резистентности, что успешно применяется уже в течение многих лет в стандартной эрадикационной терапии. Во-вторых, в условиях персистенции воспаления становятся необходимыми свойства Де-Нола, влияющие на активность воспалительного процесса, а именно снижение содержания провоспалительных цитокинов и наличие антиоксидантного эффекта. Следует отметить, что эти свойства препарата успешно используются и при лечении других заболеваний, в т. ч. и кишечника. В-третьих, пациенты с рефлюкс-гастритом, особенно с атрофией, особенно нуждаются в мукоцитопротекторной терапии с повышением продукции слизи, простагландинов, улучшением микроциркуляции в слизистой оболочке желудка [25].
Наконец, предпринимаются попытки хирургическими методами скорректировать негативное влияние рефлюкса [21] (наложение энтеро-энтероанастомоза по Брауну, Roux-en-Y), особенно после резекции желудка в качестве «средства резерва», если все другие методы терапии оказались неэффективны.
Таким образом, гастрит, ассоциированный с рефлюксом желчи, несмотря на отсутствие стандартов диагностики и лечения, при использовании комплексного подхода может быть своевременно выявлен и для его терапии существуют достаточно надежные, безопасные и эффективные препараты.
Литература
- Kawiorski W., Herman R. M., Legutko J. Current diagnosis of gastroduodenal reflux and biliary gastritis // Przegl Lek. 2001; 58: 90–94.
- Hermans D., Sokal E. M., Collard J. M., Romagnoli R., Buts J. P. Primary duodenogastric reflux in children and adolescents // Eur J Pediatr. 2003, Sep; 162 (9): 598–602. Epub 2003, Jun 26.
- Lin J. K., Hu P. J., Li C. J., Zeng Z. R., Zhang X. G. A study of diagnosis of primary biliary reflux gastritis // Zhonghua Neike Zazhi. 2003; 42: 81–83.
- Barrett M. W., Myers J. C., Watson D. I., Jamieson G. G. Detection of bile reflux: in vivo validation of the Bilitec fibreoptic system // Dis Esophagus. 2000; 13: 44–45.
- Barrett M. W., Myers J. C., Watson D. I., Jamieson G. G. Dietary interference with the use of Bilitec to assess bile reflux // Dis Esophagus. 1999; 12: 60–64.
- Stathopoulos P., Zundt B., Spelsberg F. W., Kolligs L., Diebold J., Goke B., Jungst D. Relation of gallbladder function and Helicobacter pylori infection to gastric mucosa inflammation in patients with symptomatic cholecystolithiasis // Digestion. 2006; 73 (2–3): 69–74.
- Raufman J. P., Cheng K., Zimniak P. Activation of muscarinic receptor signaling by bile acids: physiological and medical implications // Dig Dis Sci. 2003; 48: 1431–1444.
- Chen S. L., Mo J. Z., Chen X. Y., Xiao S. D. The influence of bile reflux, gastric acid and Helicobacter pylori infection on gastric mucosal injury: Severity and localization // Weichang Bingxue. 2002; 7: 280–285x.
- Johannesson K. A., Hammar E., Stael von Holstein C. Mucosal changes in the gastric remnant: long-term effects of bile reflux diversion and Helicobacter pylori infection // Eur. J Gastroenterol Hepatol. 2003; 15: 35–40.
- Chen S. L., Mo J. Z., Cao Z. J., Chen X. Y., Xiao S. D. Effects of bile reflux on gastric mucosal lesions in patients with dyspepsia or chronic gastritis // World J Gastroenterol. 2005. May 14; 11 (18): 2834–2847.
- Abe H., Murakami K., Satoh S., Sato R., Kodama M., Arita T., Fujioka T. Influence of bile reflux and Helicobacter pylori infection on gastritis in the remnant gastric mucosa after distal gastrectomy // J Gastroenterol. 2005, Jun; 40 (6): 563–569.
- Mino-Kenudson M., Tomita S., Lauwers G. Y. Mucin expression in reactive gastropathy: an immunohistochemical analysis // Arch Pathol Lab Med. 2007, Jan; 131 (1): 86–90.
- Mino-Kenudson M., Tomita S., Lauwers G. Y. Mucin expression in reactive gastropathy: an immunohistochemical analysis // Arch Pathol Lab Med. 2007, Jan; 131 (1): 86–90.
- Corfield A. P., Myerscough N., Longman R., Sylvester P., Arul S., Pignatelli M. Mucins and mucosal protection in the gastrointestinal tract: new prospects for mucins in the pathology of gastrointestinal disease // Gut. 2000. 47: 589–594.
- Ma Z., Wang Z., Zhang J. Carcinogenicity of duodenogastric reflux juice in patients undergoing gastrectomy // Zhonghua Wai Ke Za Zhi. 2001, Oct; 39 (10): 764–766.
- Oba M., Miwa K., Fujimura T., Harada S., Sasaki S., Hattori T. Chemoprevention of glandular stomach carcinogenesis through duodenogastric reflux in rats by a COX-2 inhibitor // Int J Cancer. 2008, Oct 1; 123 (7): 1491–1498.
- Santarelli L., Gabrielli M., Candelli M., Cremonini F., Nista E. C., Cammarota G., Gasbarrini G., Gasbarrini A. Post-cholecystectomy alkaline reactive gastritis: a randomized trial comparing sucralfate versus rabeprazole or no treatment // Eur J Gastroenterol Hepatol. 2003, Sep; 15 (9): 975–979.
- Takako Osaki, Katsuhiro Mabe, Tomoko Hanawa, Shigeru Kamiya. Urease-positive bacteria in the stomach induce a false-positive reaction in a urea breath test for diagnosis of Helicobacter pylori infection // Journal of Medical Microbiology. 2008, 57, 814–819.
- Cinthia G. Goldman and Hazel M. Mitchell. Helicobacter spp. other than Helicobacter pylori 2010 Blackwell Publishing Ltd, Helicobacter 15 (Suppl. 1): 69–75.
- Correa P. A human model of gastric carcinogenesis // Cancer Res. 1988; 48: 3554–3560.
- Madura J. A. Primary bile reflux gastritis: diagnosis and surgical treatment // Am J Surg. 2003, Sep; 186 (3): 269–273.
- Slomiany В. L., Nishikawa H., BHski J., Slomiany A. Colloidal bismuth subcitrate inhibits peptic degradation of gastric mucosа_epidermal grown factor in vitro // Amer. J. Gastroenterol. 1990. V. 85. P. 390–393.
- Lambert J. R., McLean. Pharmacology of colloidal bismuth subcitrate (De-Nol) and use in non ulcer dyspepsia / Helicobacter pylori in peptic ulceration and gastritis; eds. B. J. Marshall, R. W. McCallum, R. L. Guerrant. Oxford, London, Edinburgh, Melbourne: Blackwell Scientific Publications, 1991. P. 201–209.
- Кононов А. В. Цитопротекция слизистой оболочки желудка: молекулярно-клеточные механизмы // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2006. № 3. С. 12–16.
- O’Connor A., Gisbert J. P., McNamara, O’Morain C. Treatment Of Helicobacter pylori Infection 2011 // Helicobacter. 2011. Sep. 16: 53–58.
- Wagstaff A. J., Benfield P., Monk J. P. Colloidal bismuth subcitrate. A review of its pharmacodynamic and pharmacokinetic properties, and its therapeutic use in peptic ulcer disease // Drugs. 1988; 36: 132–157.га
- Ladas S. D., Katsogridakis J., Malamou H. et al. Helicobacter pylori may induce bile reflux: link between H. pylori and bile induced injury to gastric epithelium // Gut. 1996; 38: 15–18.
М. Ф. Осипенко*, доктор медицинских наук, профессор М. А. Ливзан**, доктор медицинских наук
* ГОУ ВПО «Новосибирский государственный медицинский университет Минздравсоцразвития России», Новосибирск ** ГОУ ВПО «Омская государственная медицинская академия Минздравсоцразвития России», Омск
Контактная информация об авторах для переписки
Причины
К основным причина формирования ДГР относятся:
- Врожденная/приобретенная функциональная недостаточность (ослабление замыкательной функции) пилорического сфинктера.
- Гиперкинетический тип (с усиленной моторикой) перистальтики двенадцатиперстной кишки.
- Несогласованность (дискоординация) физиологических циклов расслабления/сокращения и желудка, и ДП-кишки (мигрирующий моторный комплекс).
- Дуоденальная гипертензия (повышение давления в просвете двенадцатиперстной кишки), обусловленное спланхноптозом (опущением внутренних органов), поясничным лордозом, грыжами/злокачественными новообразованиями.
- Длительно текущее воспаления ДП-кишки (хронический дуоденит, дуоденальная язва, гастродуоденит).
- Недостаток/отсутствие гормонов (гастрина).
- Глистная инвазия (лямблиоз).
- Аномалии развития ДП-кишки.
К факторам риска развития дуоденогастрального рефлюкса относятся:
- нерегулярный прием пищи и некачественное питание (переедание, питание всухомятку, жирная и острая пища, вызывающая гиперсекрецию желчи);
- курение и злоупотребление алкоголем;
- пожилой возраст (после 60 лет);
- длительное применение спазмолитических средств и НПВС;
- операции по резекции части желудка, холецистэктомия (удаление желчного пузыря), наложение анастомозов кишечника и желудка;
- дискинезия желчевыводящих путей, холецистит;
- панкреатит;
- сахарный диабет, ожирение.
Симптомы
Cимптомы дуодено-гастралього рефлюкса не являются специфическими. Как правило, заболевание манифестирует преобладанием диспептических симптомов – тошнотой, изжогой, отрыжкой воздухом/кислым, горечью во рту и рвотой желчью. Периодически появляющиеся боли в верхних отделах живота, усиливающиеся после приема пищи носят схваткообразный характер и могут провоцируются стрессовыми ситуациями, физической нагрузкой или появляться после хирургического вмешательства по поводу резекции желудка, холецистэктомии и при развившейся дуоденальной непроходимости. Поскольку ДГР в «чистом» виде встречается редко и диагностируется преимущественно на фоне других за болеваний ЖКТ, особенно гастродуоденальной патологии, на клиническую симптоматику рефлюкса накладывают отпечаток симптомы основного заболевания, которые в определенной степени маскирует симптомы ДГР.
Выводы
1. Результаты исследования показали следующее: ДГР приводит к воспалению, фовеолярной гиперплазии, интерстициальному отеку, фибропролиферации и ветвистости валиков.
2. H. рylori
приводит к увеличению воспаления, проявляющемуся в виде роста активности и выраженности воспаления, фовеолярной гиперплазии, числа лимфоидных фолликулов легкой и средней степеней тяжести.
3. ДГР у детей может иметь клинические проявления в виде болевого синдрома и безболевого течения. При болевом синдроме, как и при безболевом течении, отмечаются в равной степени изменения в морфологической картине, поэтому судить о тяжести морфологических изменений по выраженности болей некорректно.
4. ДГР приводит к развитию определенных морфологических проявлений, что не позволяет расценивать его как физиологический процесс.
Конфликт интересов отсутствует.
Анализы и диагностика
Диагноз устанавливается на основании клинических симптомов и инструментальных методов исследования, среди которых наиболее эффективны:
- Суточная рН-метрия — позволяет оценить высоту рефлюкса и профиль внутрижелудочной рН.
- Ультразвуковая диагностика (эхография с водной нагрузкой): при ДГР периодически на эхограммах регистрируется ретроградное движение пузырьков газа и жидкости (соответствует забросу дуоденального содержимого в желудок) от привратника к телу желудка.
- Трансиллюминационный гемомотородинамический мониторинг. В качестве параметра ДГР используют разницу амплитуды моторной волны в антральном отделе желудка и луковице ДПК.
- Фиброгастродуоденоскопия (отек СОЖ, очаговая гиперемия, зияние привратника).
- Рентгеноскопия желудка (отмечается регургитация бария из ДПК в желудок).
- Фиброоптическая спектрофотометрия.
При подозрении на желчный рефлюкс проводится дифференциальная диагностика с кислым гастроэзофагеальным рефлюксом, пептическими язвами желудка.
Диета
Диета при желчи в желудке
- Эффективность: лечебный эффект через 10 дней
- Сроки: постоянно
- Стоимость продуктов: 1400-1500 руб. в неделю
Коррекция питания является обязательным элементом комплексной терапии. Назначается диета при желчи в желудке. Диетическое питание направлено на нормализации моторики органов гастродуоденальной зоны. Основными требованиями к питанию больного являются: дробное частое питание, соблюдение режима приема пищи, исключение из рациона питания острой и соленой пищи, консервации, маринадов, жирных, копченых и жаренных продуктов и блюд, хлеба из муки грубого помола снижающих скорость опорожнения желудка. Ограничивается употребление различных овощей и бобовых, богатых клетчаткой (редис, бобовые, репа, редька, спаржа) и фруктов с грубой кожурой (крыжовник, виноград, финики, смородина), а также, грубых круп (перловая, ячневая, пшено, кукурузная). Ограничить употребление сахара, меда и варенья, шоколада. В основе рациона питания должны быть нежирные вареные легкоусвояемые продукты: легкие супы, каши, куриное мясо без грубой корки, отварная рыба и овощи/овощные пюре, фруктовые/овсяные кисели.
Пациенты с ДГР должны после еды избегать физической нагрузки, подъема тяжести наклонов, что способствует повышению внутрибрюшного давления. Не менее важно не допускать метеоризма/запоров. Однако, поскольку ДГР протекает преимущественно на фоне других за болеваний ЖКТ, может назначаться диета основного заболевания, например, Диета №5, Диета при язвенной болезни желудка, Диета при гастрите, Диета при гастродуодените и др.
Методы лечения ГЭРБ
Лечение ГЭРБ проводит врач-гастроэнтеролог. Лечение направлено на снятие воспаления слизистой пищевода, уменьшения частоты забросов содержимого желудка в пищевод, снижение поражающих свойств рефлюктата (той субстанции, что попадает в пищевод из желудка), повышение защитных свойств слизистой пищевода.
Большое значение имеет:
Медикаментозное лечение
Лечение медицинскими препаратами назначается врачом и должно учитывать индивидуальные особенности пациента.
Изменение образа жизни
Большое значение имеет нормализация образа жизни. Необходимо бросить курить, ограничить, а лучше исключить употребление алкоголя. Не стоит употреблять жирную, острую, кислую пищу, а также кофе, чай, шоколад, бобовые, капусту, горох, черный хлеб. Пищу лучше принимать более часто (4-6 раз в день), но небольшими порциями. Не стоит есть перед сном (последняя трапеза должна быть за 2-2,5 часа до сна). Спать надо с приподнятой верхней частью тела, чтобы уменьшить вероятность рефлюкса во время сна.
Записаться на прием Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Профилактика
Профилактика ДГР заключается в:
- Своевременном лечении лечение заболеваний ЖКТ (особенно гастродуоденальной патологии).
- Коррекции массы тела.
- Соблюдении правильного режима питания, позволяющего обеспечить физиологически нормальную моторику ЖКТ.
- Отказе от курения и злоупотребления алкоголем.
- Нормализации физической активности и психоэмоциональной сферы. Исключении факторов, провоцирующих рефлюкс (подъем тяжестей, упражнения с сильным напряжением брюшного пресса, избегание нахождения в горизонтальном положении после приема пищи, работа в наклоненном положении).
- Исключении/недопущении длительного приема лекарственных препаратов, ухудшающих реологию желчи и моторику желчного пузыря (антибиотики, отхаркивающие, седативные, НПВС, эстрогены, спазмолитики, β-адреноблокаторы, снотворные, блокаторы кальциевых каналов).
Классификация заболевания
Существует несколько классификаций гастродуоденитов в зависимости от конкретного параметра, а именно:
- По этиологическому фактору — экзогенные (внешние причины) и эндогенные (внутренние причины) гастродуодениты.
- По степени распространенности — локализованные или диффузные.
- По течению заболевания — латентный, монотонный и рецидивирующий.
- По происхождению — первичный или вторичный (возникает на фоне других заболеваний и состояний).
- По характеру желудочной секреции — с повышенной, нормальной или пониженной секрецией.
- По морфологическим показателям — поверхностный, гипертрофический, эрозивный, геморрагический, субатрофический и смешанный.
Список источников
- Звягинцева Т.Д., Чернобай А.И. Функциональные нарушения моторно-эвакуаторной функции пищеварительного тракта и их патогенетическая коррекция // Новости медицины и фармации. – 2009.– №294. С. 7–11.
- Звягинцева Т.Д., Чернобай А.И. Дуоденогастральный рефлюкс в практике врача-гастроэнтеролога: очевидные опасности и скрытая угроза// Медицинская газета «Здоровье Украины». 2012.—№1. С.11.
- Трухан Д.И., Филимонов С.Н. Дифференциальный диагноз основных гастроэнтерологических синдромов и симптомов. М.: Практическая медицина, 2021. 168 с.
- Трухан Д.И. Рациональная фармакотерапия в гастроэнтерологии // Справочник поликлинического врача. 2012. № 10. С. 18–24.
- Багненко Г.Ф., Назаров Е.В., Кабанов М.Ю. Методы фармакологической коррекции двигательно-эвакуаторных нарушений желудка и двенадцатиперстной кишки. // Рус. мед. журнал. Болезни органов пищеварения. –2004. – Т. 1. – С. 19-23.