Биологическая терапия заняла прочные позиции в лечении иммуновоспалительных заболеваний. В равной мере это относится и к воспалительным заболеваниям кишечника (ВЗК), в частности к язвенному колиту (ЯК). Среди обширного спектра биологических препаратов для лечения ЯК пока зарегистрирован лишь один – инфликсимаб (Ремикейд®). В России Ремикейд® используется при ЯК с 2006 г., и уже накоплен определенный опыт его применения, хотя не столь значительный, как за рубежом. В реальной клинической практике врачи часто боятся назначать инфликсимаб, не располагают такой возможностью или не знают показаний к его назначению. Поэтому мы сочли целесообразным рассмотреть в этой статье ряд основополагающих исследований по оценке эффективности инфликсимаба при ЯК и поделиться собственным опытом применения препарата.
Цели лечения ЯК: • купирование атаки и индукция ремиссии; • поддержание ремиссии без применения глюкокортикостероидов (ГКС); • профилактика осложнений и операций; • улучшение качества жизни.
Частота стероидрефрактерных и стероидзависимых форм ЯК во всем мире суммарно составляет 40–50 %; по России точные данные пока отсутствуют, по Московской области эта величина составляет около 40 %. Часть больных также не отвечают на лечение традиционными иммуносупрессорами (азатиоприном и циклоспорином). К важнейшим целям лечения ВЗК относятся преодоление резистентности к лечению и отказ от ГКС при стероидзависимых формах заболеваний, поддержание ремиссии без их использования. Именно на это направлено лечение инфликсимабом. Показаниями к назначению этого препарата, согласно Европейскому кон-сенсусу (ЕССО), являются резистентные ко всем видам базисной терапии формы ВЗК, включая стероидзависимость и стероидрезистентность [1]. На экспертном совете по разработке новых стандартов применения инфликсимаба в странах ЕС и США, состоявшемся в октябре 2005 г. (UC and CD: Treating to New Standards Expert Round Table), было предложено включить в показания к лечению не только стероидрефрактерные формы болезни Крона и ЯК, но и тяжелые формы этих заболеваний (в качестве препарата первой линии).
Эффективность инфликсимаба
Систематические обзоры по оценке инфликсимаба при среднетяжелом и тяжелом ЯК, рефрактерном к стероидам и иммуносупрессорам, свидетельствуют, что препарат эффективен с точки зрения достижения клинического ответа, индукции клинической ремиссии, ускоряет заживление слизистой оболочки толстой кишки (СОТК) и снижает частоту срочных колэктомий [2, 3]. В рандомизированных клинических исследованиях инфликсимаб, назначенных в виде трех инфузий (исходной, 2-я и 6-я недели), превосходил стандартную терапию по индукции клинической и эндоскопической ремиссии и клиническому ответу на 8-й неделе [4–7]. В двойном слепом плацебо-контролируемом исследовании G. Janerot и соавт., включившем 45 пациентов с тяжелым или среднетяжелым стероидорезистентным ЯК, частота колэктомий в течение трех месяцев после единичной инфузии инфликсимаба была в 2 раза ниже, чем в группе стандартной терапии [8].
Ключевыми в изучении эффективности и безопасности инфликсимаба при ЯК были два рандомизированных двойных слепых плацебоконтролируемых исследования: АСТ I и АСТ II. Они были сходными по дизайну, отличаясь лишь длительностью активного лечения и сроками наблюдения [4]. В исследование АСТ I были включены 364 пациента с тяжелым или среднетяжелым ЯК (6–12 баллов по индексу активности Мэйо), получавших ГКС и/или тиопурины, или рефрактерных к пероральному приему этих препаратов. В исследование АСТ II были также включены 364 пациента, рефрактерных хотя бы к одному из базисных препаратов – ГКС (в виде монотерапии или в комбинации), аминосалицилатам и тиопуринам. В обоих исследованиях пациенты получали инфузии инфликсимаба в дозе 5 или 10 мг/кг в виде индукционного курса (исходно, 2-я и 6-я недели) и затем регулярно каждые 8 недель или стандартную терапию: в АСТ I в течение одного года (последняя инфузия – на 46-й неделе), в АСТ II последняя инфузия проводилась на 22-й неделе. Результаты оценивали на 8-й, 30-й и 54-й неделях в АСТ I и на 8-й и 30-й неделях в АСТ II.
Критерии оценки: • частота достижения клинического ответа (снижение индекса Мэйо минимум на три пункта по сравнению с исходным и исчезновение или значительное уменьшение видимой крови в стуле); • частота достижения клинической ремиссии (индекс Мэйо не более двух баллов); • степень заживления СОТК (эндоскопический индекс 0–1 балла, что практически соответствует эндоскопической ремиссии); • возможность отказа от приема ГКС к 30-й и 54-й неделям при наличии ремиссии; • частота госпитализаций и доля госпитализированных больных.
Результаты показали достоверно более высокую частоту клинического и эндоскопического ответа (более 60 %), равно как и выхода в ремиссию, среди больных, получавших инфликсимаб, по сравнению с группой стандартной терапии. Как и при болезни Крона, оптимальной оказалась доза инфликсимаба 5 мг/кг/сут. В исследовании АСТ I клинический ответ на 8-й неделе был достигнут у 69,6, 61,5 и 37,2 % пациентов в группах, получавших 5, 10 мг/кг и стандартную терапию соответственно. Доли больных, достигших в тот же срок клинической ремиссии, составили в соответствующих группах 38,8; 32,0 и 14,9 %, а заживление СОТК тмечено у 62,0; 59,0 и 33,9 % больных. Почти идентичные результаты в указанный срок были получены в АСТ II (табл. 1). Аналогичная тенденция достижения клинического ответа отмечена на 30-й неделе: 52,1; 50,8 и 29,8 % больных в указанных группах в АСТ I, 47,1; 60,0 и 26,0 % – в АСТ II.
. Эффективность инфликсимаба (% больных) при ЯК (АСТ I и II).
В исследованиях АСТ I и АСТ II были получены впечатляющие результаты в отношении достижения эндоскопической ремиссии, существенно превы сившие эффект в группе стандартной терапии. Наиболее значимая разница (в 2 и более раз) в обоих исследованиях отмечена на 8-й неделе, несколько меньшая, но также достоверная – на 30-й неделе (табл. 1). Все три показателя (клинический ответ, клиническая ремиссия и заживление СОТК) в группах, получавших Ремикейд®, сохранили позитивную динамику на 54-й неделе, более чем в 2 раза превзойдя показатели в группе стандартной терапии.
Доли больных, отметивших нежелательные явления, были сходными во всех трех группах в АСТ I и АСТ II. У больных в группе стандартной терапии чаще отмечали нарастание тяжести ЯК и анемию.
На основании приведенных исследований можно сделать следующие выводы: • инфликсимаб эффективен в лечении ЯК и характеризуется высоким коэффициентом польза/риск; • инфликсимаб способен индуцировать и поддерживать при ЯК полную (клиническую и эндоскопическую) ремиссию; • на фоне стойкой ремиссии инфликсимаб позволяет отказаться от приема ГКС у значительного числа пациентов.
Одна из последних работ также подтвердила возможность поддержания ремиссии и полного отказа от ГКС у 17 больных стероидзависимым ЯК при двухлетнем лечении инфликсимабом [9].
Действие инфликсимаба развивается быстро: уже через одну неделю можно наблюдать начало клинического эффекта. Через 8–12 недель концентрация препарата в сыворотке снижается, поэтому у больных с наиболее упорной формой заболевания рекомендуются повторные инфузии каждые 8 недель для поддержания клинического ответа.
Инфликсимаб (Ремикейд) в лечении рефрактерных форм болезни Крона
Воспалительный процесс при БК локализуется преимущественно в кишечнике, хотя могут поражаться все отделы желудочно–кишечного тракта, включая пищевод, желудок, ротовую полость, язык. Гистологическая картина БК харктеризуется неспецифическим иммунным воспалением с вовлечением в процесс всех слоев кишечной стенки. Воспаление имеет регионарный характер, при котором зоны воспалительной инфильтрации чередуются с относительно не измененными участками кишки. В зоне инфильтрации образуются глубокие язвы–трещины, также проникающие через все слои кишечной стенки. Патогномоничным гистологическим признаком является наличие эпителиоидных гранулем, состоящих из гигантских многоядерных клеток типа Пирогова–Ланганса [1]. В клинической картине заболевания доминируют диарея, постоянные локализованные боли в животе, соответствующие месту поражения, лихорадка, прогрессирующая анемия [2]. Характер гистологических изменений и глубина поражения кишечной стенки определяют спектр осложнений БК: стриктуры с последующим развитием кишечной непроходимости, абдоминальные инфильтраты, межорганные и наружные (кишечно–кожные) свищи и абсцессы. При поражении аноректальной области формируются парапроктиты, свищи, стриктуры прямой кишки и глубокие анальные трещины. Даже при адекватном лечении у большинства больных заболевание имеет прогрессирующий характер с развитием осложнений или формированием непрерывных форм заболевания. Патогенез гранулематозного воспаления при БК опосредован двумя основными факторами: во–первых, нарушением клеточного иммунитета и дисбалансом Т–хелперов 1 и 2 типов с преимущественной активацией Т–хелперов 1 типа; во–вторых, с нарушением баланса цитокинов в слизистой оболочке кишки с преобладанием провоспалительных медиаторов преимущественно макрофагального происхождения и дефицитом противовоспалительных регуляторных цитокинов [4,5,23,34]. В нормальной слизистой оболочке содержание клеточных субпопуляций, а соответственно, и соотношение провоспалительных и противовоспалительных цитокинов сбалансировано, что обеспечивает адекватный иммунный ответ на антигенное раздражение [19,34]. Группу цитокинов с провоспалительным действием составляют интелейкины (ИЛ): ИЛ–1, ИЛ–2, ИЛ–6, ИЛ–8 и др., фактор некроза опухоли–альфа (ФНО–a), интерферон– гамма (ИФ–g). К противовоспалительным и регуляторным цитокинам относятся ИЛ–10, ИЛ–11, эндогенные антагонисты рецепторов ИЛ–1 (ИЛ–1рa), трансформирующий ростовой фактор–b (ТРФ–b) [21]. Патогенетические механизмы воспалительных и аутоиммунных заболеваний разделяют по доминирующему субклассу активированных Т–лимфоцитов в очаге поражения и, соответственно, по профилю вырабатываемых ими цитокинов [4]. Так, ревматоидный артрит и БК ассоциированы с Т–хелперным иммунным ответом 1–типа, при котором основными медиаторами являются ИЛ–2 и ИФ–g [23]. Общность нарушений иммунных механизмов при этих заболеваниях определяют общие подходы к их лечению. Среди цитокинов с воспалительным действием одним из наиболее активных является ФНО–a. Его считают ключевым в процессе воспаления при ревматоидном артрите, других аутоиммунных заболеваниях и БК. Этот цитокин существует в двух видах: в трансмембранной форме и в форме растворимого тримера (рис. 1) [4,36]. ФНО–a синтезируется разными типами клеток: макрофагами, Т–хелперами 1 типа, клетками эндотелия, но моноциты/макрофаги, безусловно, являются его основным источником. В нормальных физиологических условиях ФНО функционирует как иммунорегуляторный медиатор и обеспечивает рост, пролиферацию и дифференцировку разных типов клеток, активирует нейтрофилы, Т и В–лимфоциты, лизирует опухолевые и инфицированные бактериями и вирусами клетки, участвует в регуляции апоптоза. В патологических условиях ФНО–a ведет себя как активный провоспалительный агент. Биологические реакции, связанные с его избыточной продукцией и патологическим действием включают [4,34,36]: • активацию нейтрофилов, Т и В–лимфоцитов, в том числе, Тх1 и синтез соответствующих провоспалительных медиаторов– ИЛ–2, ИФ–g; • активацию макрофагов и индукцию синтеза ИЛ–1 и ИЛ–6; • стимуляцию воспалительных реакций и симптомов эндотоксемии – лихорадки, похудания, лейкоцитоза, сепсиса; • образование острофазных воспалительных белков печенью (С–реактивного белка, серомукоида, a–1–антитрипсина); • индукцию синтеза свободных кислородных радикалов; • увеличение экспрессии молекул адгезии на лейкоцитах и клетках эндотелия; • увеличение сосудистой проницаемости и миграции лейкоцитов из сосудистого русла в очаг воспаления; • торможение апоптоза воспалительных клеток; • индукцию экспрессии HLA II класса на нейтрофилах; • стимуляция остеопороза и остеомаляции. В формировании гранулем при БК ФНО–a играет главенствующую роль [36]. Гранулема состоит из эпителиоидных и гигантских многоядерных клеток, которые формируются из Т–клеток (CD4+) и моноцитов/макрофагов. Взаимодействие между ними регулируется цитокинами: ФНО–a и ИФ–g и ИЛ–1b. Присутствие ФНО–a обязательное условие образования гранулемы. Базисная патогенетическая терапия БК включает три группы лекарственных препаратов: кортикостероидные гормоны, препараты 5–аминосалициловой кислоты (5–АСК) и иммуносупрессоры [2]. 5–АСК (сульфасалазин, месалазин) применяет для лечения БК с легким течением, но даже в этих случаях терапия не всегда бывает достаточной. Кортикостероидные гормоны (преднизолон и его метилированные аналоги, гидрокортизон, будесонид) были и остаются наиболее широко применяемыми средствами для лечения БК с тяжелым и среднетяжелым течением заболевания. Механизм действия кортикостероидов и аминосалицилатов заключается в ингибировании синтеза воспалительных медиаторов, включая метаболиты арахидоновой кислоты (лейкотриены, фактор активации тромбоцитов) и подавляющее большинство цитокинов макрофагального происхождения [30,36]. Несмотря на широкий спектр противоспалительных и иммуносупрессивных влияний стероидные гормоны часто не дают позитивных результатов, а длительный прием препаратов чреват развитием серьезных побочных эффектов. При отсутствии ответа на лечение гормонами назначают препараты резерва – иммуносупрессоры (азатиоприн, метотрексат) [26,27,33]. Применение иммуносупрессоров, к сожалению, не решает полностью проблему лечения рефрактерных форм БК. Частота достижения клинического эффекта и выхода в ремиссию как для азатиоприна, так и для метотрексата колеблется в интервале 40–70% [12,14,26,27]. Кроме того, применение иммуносупрессоров в определенной мере ограничено широким спектром побочных эффектов, свойственных цитостатикам (тошнота, рвота, диарея, лейкопения, агранулоцитоз, тромбоцитопения, анемия, гепатотоксическое действие и др.). Побочные эффекты развиваются с частотой 6–20%. Действие азатиоприна и метотрексата развивается медленно, улучшение может быть заметно не ранее, чем через 3–4 недели, для получения максимального эффекта азатиоприна необходим срок 3–4 мес. (для метотрексата несколько меньше), из–за чего иммуносупрессоры не могут применяться в острых ситуациях, они используются для лечения хронических вялотекущих активных форм БК. Таким образом, лечение иммуносупрессорами лимитировано побочными эффектами, медленно развивающимся действием и недостаточной эффективностью. Практически, альтернативным методом лечения пациентов с резистентным течением БК является оперативное лечение. Развитие рефрактерности к лечению наблюдается в популяции больных БК в среднем в 35% и приводит к тяжелым осложнениям, оперативным вмешательствам и выходу на инвалидность лиц молодого трудоспособного возраста [2]. В исследованиях В. Moun с соавторами показано, что риск рецидива в течение первого года после установления диагноза составляет при БК 47% [16]. Среди пациентов с БК, леченых глюкокортикостероидами, лишь у 44% наблюдается стойкая ремиссия в течение первого года, в то время, как у 36% формируется стероидозависимость и у 20% стероидорезистентность [10,17]. Анализ естественного течения БК показывает, что, у большинства пациентов отмечается рецидивирующее течение с разной длительностью ремиссий, а у 10–15% больных на фоне лечения заболевание имеет непрерывный характер с постоянной более или менее выраженной активностью [18]. Независимо от характера течения БК примерно у 60% больных в связи с развитием осложнений возникает необходимость в оперативном лечении, особенно в случаях поражения толстой и подвздошной кишки [15]. Отсутствие эффекта от кортикостероидной и иммуносупрессивной терапии даже без осложнений также является показанием к операции – резекции пораженного участка. Нет, однако, никакой гарантии, что после операции не возникнет рецидив в зоне анастомоза или в любом другом месте ЖКТ, т.к. естественное течение БК не прерывается после операции. Частота послеоперационных рецидивов составляет 20–40% в течение 5 лет после резекции и, как минимум, 1/3 больных нуждается в повторной операции [25]. Несовершенство существующих методов лечения и необходимость снижения числа операций выдвигают на первый план поиски новых подходов к терапии. Все новые возможности учитывают современные представления о патогенезе БК и участии цитокинов в этом процессе и направлены на оптимизацию лечения рефрактерных форм ВЗК, на преодоление стероидорезистентности. Прогресс в лечении БК заключается в выработке принципиально новой «биологической» лечебной стратегии. Эта стратегия основана на концепции о ведущей роли воспалительных цитокинов (ФНО–a, ИЛ–1 и др.) в патогенезе кишечного воспаления и о возможной блокаде их биологических эффектов специфическими ингибиторами или противовоспалительными цитокинами [23,31,36]. Теоретически, любые звенья воспалительного каскада являются селективными мишенями и точками приложения лекарственных препаратов биологического действия. Биологических методов на сегодняшний день достаточно много, но лишь некоторые из них уже вошли в клиническую практику. В рамках биологической стратегии наиболее перспективной на сегодняшний день представляется стратегия ингибирования фактора некроза опухоли, поскольку именно это цитокин является если не основным, то одним из ведущих в развитии гранулематозного воспаления при БК [34,36]. Применение антител к ФНО–a – это реальный путь ограничения гранулематозного воспаления путем связывания растворимых тримеров ФНО и, опосредовано, ингибирования активации CD4+. В настоящее время в клиническую практику вошел рекомбинантный препарат инфликсимаб (Ремикейд), представляющий собой химерные моноклональные мышиные антитела к ФНО–a, соединенные с человеческим иммуноглобулином G1 (25% мышиного белка и 75% человеческого иммуноглобулина). Инфликсимаб специфически связывает человеческий ФНО–a, причем обладает очень высокой аффинностью к растворимому ФНО–тримеру, но блокирует и мембрансвязанный ФНО (рис. 1). Препарат вызывает лизис клеток воспалительного инфильтрата, усиливает апоптоз активированных Т–лимфоцитов [11,23,34]. Ремикейд зарегистрирован в России в 2001 г. по двум основным показаниям – ревматоидный артрит и БК, сходных по механизмам развития воспаления. При БК инфликсимаб используется в случаях заболевания, устойчивого к действию стероидных гормонов и иммуносупрессоров, активен как при среднетяжелых, так и при тяжелых формах БК [26,27,28]. Препарат обладает пролонгированным действием. При не осложненном течении БК достаточно однократного внутривенного введения для достижения ремиссии. При наличии свищей рекомендуется 3 инфузии с интервалом в 2 недели [20]. Оптимальная доза, по данным контролируемых исследований, составляет 5 мг/кг массы тела, увеличение дозы до 10 мг/кг не приводит к повышению частоты клинического ответа [23]. Действие инфликсимаба развивается быстро, уже через 2 недели можно наблюдать начало клинического эффекта. Продолжительность его действия до 30 недель после однократной инфузии, однако через 8–12 недель концентрация препарата в сыворотке снижается, поэтому для поддержания клинического ответа и ремиссии рекомендуются повторные инфузии каждые 8 недель [23]. В контролируемых мультицентровых испытаниях частота ответа на инфликсимаб при стероидорезистентных формах БК колеблется в интервале 50–82%, частота достижения клинической ремиссии составляет 25–48% (рис. 2) [13,20,35]. В самом крупном клиническом исследовании (ACCENT I) показано, что при БК Частота поддержания ремиссии в результате терапии Ремикейдом в течение 30 недель после однократного введения составляет 39–44% и не зависит от начальной дозы препарата – 5 или 10 мг/кг. По сравнению с плацебо в группах, получавших Ремикейд, в 3 раза больше пациентов, у которых на 54 неделе продолжалась ремиссия БК (рис. 3). Кроме того, исследование ACCENT I показало, что терапия инфликсимабом безопасна, хорошо переносится и позволяет отказаться от кортикостероидов (рис. 4) [13]. К 22 неделе у всех пациентов, получавших инфликсимаб, стероиды были отменены и поддерживающая терапия Ремикейдом в 2,2 раза увеличивает возможность ремиссии на 30 и 54 неделях и позволяет отменить ГКС. Инфликсимаб значительно снижает индекс гистологической активности у больных БК в виде илеоколита, при этом исчезает патологическая экспрессия HLA DR и уменьшается содержание ФНО и молекул адгезии в колонобиоптатах [7,8]. В одном из исследований показано, что под влиянием инфликсимаба снижение эндоскопической активности коррелирует с индексом клинической активности (индексом Беста) и гистологическим уменьшением воспалительного инфильтрата [9]. Cнижение гистологической активности показано также в исследованиях с меченым технецием по количеству лейкоцитов, мигрирующих в зону воспаления [32]. Длительное лечение инфликсимабом в течение 44 недель оказалось эффективным и хорошо переносимым методом купирования симптомов БК и достижения ремиссии у пациентов, не ответивших на традиционное лечение [33]. Опыт лечения 500 больных рефрактерной БК в клинике Мэйо также продемонстрировал высокую клиническую эффективность и хорошую переносимость инфликсимаба [21]. Успешные результаты получены у больных БК с развитием воспаления в области илеоанального резервуара и при перианальной локализации БК [22,24]. Побочных эффекты инфликсимаба изучены по данным нескольких плацебо–контролируемых исследований, в которые был включен 771 пациент с ревматоидным артритом и БК [29]. Реакции, связанные с непосредственным введением препарата и наблюдаемые в течение первых 2 часов после инъекции (лихорадка, головная боль, уртикарная сыпь, одышка, гипо– или гипертензия) отмечались в 17% случаев против 7% при применении плацебо. В течение 27 недель наблюдения после последней инъекции у 26% пациентов, получавших инфликсимаб против 16%, получавших плацебо, зафиксированы различные инфекции (чаще всего респираторные) и гнойно–воспалительные процессы, которые, в большинстве случаев, не носили серьезного характера. Менее, чем у 2% больных потребовалась отмена препарата в связи с развитием побочных реакций. По данным S. Hanauer с соавторами, различные инфекции, требовавшие дополнительного лечения, развивались у 29% больных, у 12% отмечены посттрансфузионные реакции [13]. Наибольшую опасность представляет реактивация старых очагов туберкулеза под влиянием инфликсимаба. Больные (особенно, имевшие туберкулез в анамнезе) перед началом лечения должны быть тщательно обследованы рентгенологически и с помощью туберкулиновых проб, и при необходимости консультированы фтизиатром. Примерно у 13% пациентов, получавших инфликсимаб, отмечено появление антител к нему (НАСА – Human antihimeric antibodies), однако наличие этих антител не снижало эффективности препарата [23]. Закончились многоцентровые рандомизированные плацебо–контролируемые исследования ACT I и ACT II, в которых оценивалась эффективность и безопасность Ремикейда при активном язвенному колите (ЯК). В них было включено 364 пациента со средне–тяжелым и тяжелым течением ЯК, не отвечавших на по крайней мере один препарат стандартной базисной терапии. Ремикедй вводили в дозировке 5 или 10 мг, результаты оценивали на 22 и 46 неделе лечения. К 8 неделе ремиссии достигли от 30 до 40% пациентов, получавших Ремикейд, и более 60% достигли эндоскопического заживления, достигнутое улучшение сохранялось до конца исследований. В настоящий момент данное показание находится в процессе регистрации в странах Европейского Союза. Российский опыт применения Ремикейда при БК основан на результатах клинических испытаний IV фазы, проведенных в трех исследовательских центрах (ГНЦ колопрктологии, МОНИКИ, Областная больница г. Липецка) [6]. В исследование было включено 23 пациента БК, не ответивших на лечение кортикостероидами, с локализацией процесса в подвздошной и толстой кишке (21 больной) и с сочетанным поражением толстой кишки и верхних отделов ЖКТ (2 больных). У 1 пациента заболевание осложнилось формирование ректовагинального свища. Индекс Беста у всех больных соответствовал тяжелому или среднетяжелому течению (220–450 баллов). Результаты проведенного исследования показали, что Ремикейд хорошо купирует рефрактерные обострения БК, клинический эффект был достигнут у 12 больных (52%). Двое больных были оперированы, у остальных эффект был умеренный. В течение последующего года после однократной инфузии ремиссия сохранялась у 35% пациентов. В целом, полученные результаты соотвествуют данным международных контролируемых исследований. Побочные эфекты были зафиксированы в одном случае. Наш собственный опыт примения Ремикейда также свидетельствует о его эффективности при рефрактерных формах БК [3]. Мы наблюдали 8 пациентов БК (колитом или илеоколитом), резистентных к стероидам с индексом активности 220–400. Через 4 недели после введения ремикейда положительная динамика отмечена у 5 из 8 больных (62,5%) – уменьшение или исчезновение болевого синдрома, уменьшение частоты стула. Через 8 недель боль в животе сохранялась у 3 больных, стул 2–3 раза в сутки у 4 больных. Индекс активности снизился к концу 8 недели на 50–86 пунктов у 5 больных, менее чем на 50 пунктов у 2 больных, 1 больной был оперирован в связи с неэффективностью лечения. Таким образом, у подавляющего большинства больных в течение 8 недель была достигнута положительная динамика. Через 16 и 24 недели у 5 больных индекс активности снизился до 150 и менее, у них же в течение года отмечается ремиссия, поддерживаемая 5–АСК. Побочных эффектов не было отмечено ни в одном случае. В настоящее время разрабатывается большое количество «биологических» методов лечения, основанных на влиянии на различные цитокины. Все новые направления в лечении БК, по–видимому, перспективны, но пока обоснованы только теоретически и не получили практического развития. Единственным достаточно эффективным и безопасным методом при рефрактерном течении БК и уже имеющим клиническое подтверждение является инфликсимаб.
Литература 1. Аруин Л.О., Капуллер Л.Л., Исаков В.И. Морфологическая диагностика болезней желудка и кишечника. М., Триада–Х.– 1998, 496 с. 2. Белоусова Е.А. Язвенный колит и болезнь Крона// М.,Триада, 130 с. 3. Морозова Н.А., Белоусова Е.А., Никитина Н.В., Златкина А.Р. Опыт применения ремикейда (инфликсимаба) у больных болезнью Крона. // Гастроэнтнрология Санкт–Петербурга, 2004, № 9, материалы 6–ого Международного Славянско–Бантийского научного форума. 4. Насонов Е.Л. Нарушения иммунитета при аутоиммунных заболеваниях // Российский журнал гастроэнтерологии, гепатологии, колопроктологии,1999,т.IX, № 4, прилож.7, с.43–48 5. Насонов Е.Л. Фактор некроза опухолей–a новая мишень для противовоспалительной терапии ревматоидного артрита // РМЖ, 2000, т.8, № 17, с.718–722. 6. Халиф И.Л. Ремикейд: лечение болезни в третьем тысячелетии (Устное сообщение, Российская гастроэнтерологическая неделя, 2004) 7. Baert F.J., D’Haens G., Peeters M., Hiele M.I. et all. Tumor necrosis factor–a antibody (infliximab) therapy profoundly down–regulates the inflammation of Crohn’s ileocolitis.// Gastroenterology.– 1999.– v. 116.– p. 22–28 8. Chey W.Y., Hussain A., Ryan C., Potter G.D. et all. Infliximab for refractory ulcerative colitis // Am. J. Gastroenterol.–2001.– v. 96.– p.1860–1866 9. D’Haens G., van Deventer S.J.H., van Hogezand R., Chalmers D. et all. Endoscopic and histological healing with Infliximab anti–tumor necrosis factor antibodies in Crohn’s disease: a European multictnter trial. // Gastroenterology.– 1999.– v. 116.– p. 1029–1034 10. Faubion W.A., Loftus E.V., Harmsen W.S., Zinsmeister A.R. et all. The natural history of corticosteroid therapy for inflammatory bowel disease: a population based study // Gastroenterology. –2001.– v. 121.– p. 255–260 11. Feagan B.G. Infliximab in the treatment of Crohn’s disease.// Scand. J. Gastroenterol. 2000.– v.14.–suppl. C.–6B 12. Feagan B.G., Fedorak R.N., Irvine E.J., Wild G. et all. A comparison of methotrexate with placebo for the maintenance of remission in Crohn’s disease // N. Engl. J. Med.– 2000.– v.342.– p. 1627–1632 13. Hanauer S.B., Lichtenstein G.R., Colombel J.F. et all. Maintenance infliximab (Remicade) is safe, effective and steroid–sparing in Crohn’s disease: preliminary results from the Accent I trial // Gastroenterolgy.–2001.–v.120.–Suppl.1.–p.99 14. Lemann M., Zenjari T., Cosnes J., Mesnard B. Methotrexate in Crohn’s disease: long–term efficacy and toxity.– m. J. Gastroenterol. 2000.– v. 95.– p.1730–1734 15. Mechjian H.S., Switz D.M., Watts H.D., Deren J.J. et all. National Cooperative Crohn’s disease Study. Factors determining recurrence of Crohn’s disease after surgery.//Gastroenterology.– 1979.–v.77.–(4 Part 2).– p.907–913 16. Moum B., Ecbom A., Vatn M.H. et all. Clinical course during the 1st year after diagnosis of ulcerative colitis and Crohn’s disease. Results of a large prospective population–based study in southeastern. Norway 1990–93 // Scand. J. Gastroenterol..– 1997.– v. 32.– p. 105–112 17. Munkholm P., Langholz E., Davidsen M., Binder V. Frequency of glucocorticoid resistence and dependency in Crohn’s disease //Gut.–1994.– v.35.– p. 360–362 18. Munkholm P., Langholz E., Davidsen M., Binder V. Disease activity courses in a regional cogort of Crohn’s disease patients.// Scand.J.Gasrtroenterol. –1995.– v.30.–p.699–706 19. Papadakis K.A., Targan S.R. Role of cytokines in the pathogenesis of inflammatory bowel disease // Ann. Rev. Med.–2000.– v.51.– p.289–298 20. Present D.H., Rutgeerts P., Targan S., Hanauer S.B. et all. Infliximab for the treatment of fistulas in patiens with Crohn’s disease.– N. Engl. J. Med.– 1999.– v. 340.– 1398–1405 21. Ricart E., Panaccione R., Loftus E., Tremain W. Infliximab for Crohn’s disease in clinical practice at the Mayo Clinic: the first 100 patients.// Am. J. Gastroenterol.– 2001.– v.96.– p. 722–729 22. Ricart E., Panaccione R., Loftus E., Tremain W. Successful management of Crohn’s disease of the ileoanal pouch with infliximab // Gastroenterology.– 1999.– v. 117.– p. 429–432 23. Rutgeerts P. A critical assessment of new therapies in inflammatory bowel diseases.// J. Gastroenterol Hepatol.–2002.– v.17. suppl. – S177 QR 24. Rutgeerts P. Management of perianal Crohn’s disease // Scand. J. Gastroenterol.– 2000.– v. 14, (Suppl. C).– 7C. 25. Rutgeerts P., Geboes K., Vantrappen G., Beyls J. et all. Predictability of postoperative course of Crohn’s disease // Gastroenterology. 1990.– v. 99. – p. 956–963 26. Sanborn W.J. Steroid–dependent Crohn’s disease. // Scand. J. Gastroenterol..– 2000.– v. 14.– (Suppl. C).– 17C. 27. Sands B.E Medical therapy of steroid–resistant Crohn’s disease. // Scand. J. Gastroenterol.– 2000.– v. 14.– (Suppl. C).– 33C. 28. Sands B.E., Tremaine W.J., Sanborn W.J., Rutgeerts P. et all. Infliximab in the treatment of severe steroid–refractory ulcerative colitis: a pilot study // IBD.– 2001.–v.7.– p.83–88 29. Schaible T.F. Long–tern safety of infliximab // Scand. J. Gastroenterol.– 2000.– v. 14.– (Suppl. C).– 29 C. 30. Schreiber S. Aspects of the immunology of inflammatory bowel diseases. // Recent Advances in the Pathophysiology of Gastrointestinal and Liver Diseases. –Nantes.– July 1997.– p.133–171. 31. Schreiber S.,Campieri M., Colombel J.F., van Deventer S.J.H. et all. Use of anti–tumor necrosis factor agents in inflammatory bowel diseases. European guidelines for 2001–2003. //Int. J. Colorectal Dis.–2001.– v.16.– № 1.– p. 1–11 32. Schluter U., Ledeboer M., Arndt J., Griffioen G. et all. Very rapid anti–inflammatory effect of infliximab (Remicade) in Crohn’s disease as assessed by 99M TC–WBC–scintigraphy // 8–th UEGW, Brussels, Nov. 2000. 33. Steinhart H. Steroid resistant and steroid dependent Crohn’s disease. // IBD, salicylates and other relevant therapies–Proceeding of the International IBD Symposium.– London.– 1999.– p.83–90 34. Targan S.R. Biology of inflammation in Crohn’s disease: mechanism of action of anti– TNF–a therapy. // Scand. J. Gastroenterol.– 2000.– v. 14.– (Suppl. C).– 13C. 35. Targan S.R., Van Deventer S.J.H., et all. A short–term study of chimeric monoclonal antibody cA2 to tumor necrosis factor a for Crohn’s disease.// N.Engl.J.Med. –1997.–v.337.–p.1029–1035 36. Van Deventer S.J.H Tumor necrosis factor and Crohn’s disease.– Gut. –1997. – 40 (4) . – p.443–448
Клинико-экономические аспекты
Раннее начало болезни, госпитализации и операции определяют экономические затраты при ЯК. Целью исследования R.D. Cohen соавт. (2010) был систематический обзор литературы по стоимости ведения больных ЯК в западных странах. Ежегодные медицинские расходы на одного пациента с ЯК составляют 6200–11 500 долл. в США и 8900–10 400 евро в Европе, причем стоимость госпитализаций составляет 40–55 % всех прямых медицинских затрат. Непрямые затраты составляют 30 % всех расходов в США и 54–68 % в Европе [10].
В исследованиях АСТ I и АСТ II был проведен анализ частоты госпитализаций больных ЯК. Всего в двух исследованиях участвовали 728 человек, из которых 484 пациента получали Ремикейд® в разных дозах (5 и 10 мг/кг/сут). Общая частота госпитализаций в течение 30 недель, в т. ч. повторных, была вдвое ниже в группе, получавшей Ремикейд®, по сравнению с группой стандартной терапии (9 против 18 %). Доля госпитализированных пациентов составила соответственно 8 и 14 % [11]. Поскольку стационарное лечение является наиболее затратной частью ведения больных ЯК; можно сделать вывод, что применение Ремикейда обеспечивает существенный экономический эффект для национальных систем здравоохранения.
Результаты
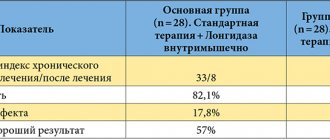
- В анализ включили 100 пациентов, которые были рандомизированы в группу инфликсимаба и стандартной терапии в отношении 1:1.
- Показано, что на 10 неделе большее число пациентов из группы инфликсимаба, по сравнению со стандартной терапией достигли клинической ремиссии (59% vs. 34%, соответственно, p=0,021) и эндоскопической ремиссии (59% vs. 17%, соответственно, p=0,001).
- На 52 неделе не было выявлено достоверных различий между группами по показателю клинической ремиссии (p=0,421). При этом 41% пациентов на фоне инфликсимаба имели клиническую ремиссию на монотерапии азитромицином без необходимости усиления терапии, в сравнении с 15% из группы стандартной терапии (p=0,004).
Собственный опыт применения Ремикейда при ЯК
В отделении гастроэнтерологии МОНИКИ имеется опыт применения Ремикейда у больных ВЗК: 20 пациентов с болезнью Крона, 40 – с ЯК, из них 3 пациента после субтотальной резекции толстой кишки с активностью в культе сигмовидной и прямой кишки.
Задачи настоящего исследования: • оценка эффективности индукционного курса терапии инфликсимабом у больных ЯК, рефрактерных к другим методам лечения; • оценка возможности достижения и поддержания клинико-эндоскопической ремиссии ЯК при терапии инфликсимабом; • поддержание ремиссии ЯК без ГКС на фоне терапии инфликсимабом.
Задачи исследования были сформулированы с целью сравнения эффективности биологической терапии инфликсимабом в России (на примере популяции больных Московской области), Европе и в других странах.
Материал и методы
В открытое проспективное исследование были включены 37 неоперированных больных ЯК, наблюдавшихся с января 2008-го по декабрь 2010 г. Диагноз ЯК был подтвержден эндоскопически и гистологически. Все больные проходили обследование на наличие скрытых форм туберкулеза.
Клиническая характеристика больных представлена в табл. 2. Стероидрезистентность развилась у 5 пациентов с острой формой (первой атакой) заболевания, у остальных 32 больных сформировалась стероидзависимость. Исходную тяжесть атаки ЯК оценивали по индексу активности критериев Truelove и Witts [12–14]. Мониторинг эффективности терапии проведен по индексу Мэйо. До начала терапии инфликсимабом ГКС в виде монотерапии (преднизолон или метилпреднизолон) применяли у 29 пациентов. Из них 5 человек с острой тяжелой формой заболевания впервые получали 250–500 мг метилпреднизолона внутривенно с последующим снижением дозы и переходом на пероральный прием преднизолона из расчета 1 мг/кг массы тела в сутки; 24 пациента с очередной атакой рецидивирующей формы ЯК получали преднизолон перорально в той же дозе – 1 мг/кг массы тела.
Комбинацию пероральных ГКС в дозе 30–40 мг и азатиоприна в дозе 100–150 мг (не менее 2 мг/кг ) использовали 4 больных со стероидзависимой непрерывной формой ЯК. Комбинацию азатиоприна в той же дозе и 5-аминосалициловой кислоты получали 4 пациента со стероидзависимой формой ЯК и выраженными побочными эффектами ГКС. Таким образом, до назначения Ремикейда ГКС получали в общей сложности 33 больных, азатиоприн АЗА – 8 пациентов.
Больным назначали инфликсимаб (Ремикейд®) по программе ДЛО Московской области из расчета 5 мг/кг массы тела в сутки в виде индукционного курса (3 инфузии на исходной, 2-й и 6-й неделях) и затем каждые 8 недель. Мониторинг эффективности лечения проведен по индексу Мэйо. Индукционный курс (не менее 3 инфузий) получили 35 из 37 пациентов. Его эффективность оценена по аналогии с исследованиями АСТ I и II на 8-й неделе после начала лечения (через 2 недели после 3-й инфузии). В табл. 3 приведено количество инфузий Ремикейда у наблюдаемых нами больных ЯК включительно по декабрь 2010 г.
Количество инфузий инфликсимаба у больных ЯК.