- Принцип действия
- Ингибиторы АПФ
- Польза препаратов ингибиторов
- Классификация и формы
- Применение
- Противопоказания для лечения ингибиторами
К группе ингибиторов относятся вещества, которые замедляют или полностью блокируют химические (в особенности, ферментативные) и физиологические процессы. Название происходит от латинского слова inhibere, что в переводе означает “захватывать”. Одна из групп – ингибиторы АПФ – используются для лечения патологий сердечно-сосудистой системы.
В числе известных АПФ ингибиторов можно выделить препарат Эналаприл, применяемый при сердечной недостаточности, эссенциальной и реноваскулярной гипертензии, а также для профилактики развития патологий.
Ингибиторы АПФ
В лечении болезней сердечно-сосудистой системы более 30 лет применяются ингибиторы АПФ — ангиотензинпревращающего фермента.
Ангиотензинпревращающий фермент является одним из ключевых элементов системы регуляции давления. Под их воздействием неактивный гормон ангиотензин I превращается в ангиотензин II, который обладает сосудосуживающим эффектом. При использовании ингибиторов АПФ его действие подавляется, благодаря чему препараты группы способны понижать давление и эффективны в лечении гипертензии.
Кроме того, за счет выброса окиси азота и простагландина I2 препараты данной группы тормозят распад вазодилататора (вещества, сильно расширяющего сосуды) брадикинина.
Для лечения сердечной недостаточности ингибиторы обычно назначаются в дозах, не снижающих АД.
Препараты также назначают для лечения почечной недостаточности.
Польза препаратов ингибиторов
Ингибиторы АПФ:
- обладают противовоспалительным эффектом;
- способствуют выведению мочи;
- повышают чувствительность периферических тканей к инсулину;
- обладают нефропротективным действием, то есть способствуют сохранению функции почек;
- укрепляют сосуды: улучшают функцию эндотелия, повышают эластичность стенок, являются профилактическим средством против повреждения атеросклеротической бляшки;
- предотвращают увеличение размеров левого желудочка сердца;
- способствуют выравниванию сердечного ритма;
- улучшают циркуляцию крови в жизненно важных системах (отделах ЦНС, почках, сердце);
Классификация и формы
Ингибиторы АПФ выпускаются в двух видах:
- лекарственные в активной форме;
- пролекарства – вещества, которые становятся активными после трансформации в ЖКТ и почках.
Вещества данной группы — липофильные, то есть выводятся посредством почечной экскреции (через мочевую систему). По этой причине людям с почечной недостаточностью рекомендуют начинать терапию с пониженной дозировки ингибиторов. Среди ингибиторов есть и гидрофильные препараты, которые выводятся с желчью и калом.
Наиболее безопасными для длительного применения считаются ингибиторы АПФ, которые выводятся из организма через печень. Препараты гидрофильной группы не метаболизируются в организме и выводятся в первоначальном виде, липофильные ингибиторы подвергаются частичной метаболизации, образуют органические вещества, часть из которых биологически активна.
По продолжительности действия ингибиторы бывают:
- короткого действия, регулярность приема – 2-3 раза в сутки;
- длительного действия, регулярность приема – 1-2 раза в сутки.
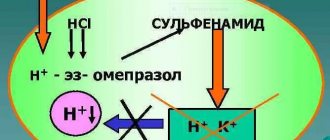
Механизм действия
После попадания в просвет желудка, ингибиторы протонного насоса проникают в полость тонкого кишечника, после чего растворяются, всасываются в системный кровоток и с током крови переносятся в печень. Далее, активные компоненты препаратов взаимодействуют с париетальными (секреторными) клетками слизистой оболочки желудка.
При комплексной эрадикации Хеликобактер Пилори, перед началом терапии, важно иметь показатели рН-метрии. При гастрите с нулевой кислотностью (ахлоргидрии), эта группа лекарственных средств не используется, так как наблюдается полная атрофия слизистой оболочки желудка, и клетки органа не вырабатывают соляную кислоту.
Применение
Широкое распространение ингибиторы АПФ получили в кардиологии. Препараты группы применяются для лечения:
- систолической дисфункции левого желудочка независимо от наличия хронической сердечной недостаточности;
- гипертрофии левого желудочка;
- артериальной гипертензии, в том числе, симптоматической;
- атеросклероза сонных артерий;
- метаболического синдрома.
В профилактических целях ингибиторы назначаются пациентам, перенесшим инфаркт миокарда.
Ингибиторы АПФ назначаются всем пациентам с хронической сердечной недостаточностью, независимо от стадии и этиологии заболевания. Первоначально врачи прописывают минимальные дозы препаратов, постепенно увеличивая их до целевых.
При гипертонии (артериальной гипертензии) ингибиторы используются в качестве самостоятельного терапевтического средства и в сочетании с другими препаратами.
По статистике, при лечении ингибиторами АПФ сахарный диабет развивается реже, чем при терапии диуретическими препаратами и β-блокаторами.
В неврологии препараты группы используются для первичной и вторичной профилактики инсульта головного мозга. Показанием для назначения ингибиторов также является транзиторная ишемическая атака и перенесенный инсульт. При этом пол, возраст пациента и исходные показатели артериального давления значения не имеют. Лечение ингибиторами АПФ приводит к снижению риска повторного приступа, общего риска осложнений на сердечно-сосудистую систему.
Препараты группы эффективны для лечения эндокринологических заболеваний: диабетической нефропатии, сахарного диабета. Ингибиторы показаны пациентам с ожирением и резистентностью к инсулину, поскольку они повышают чувствительность к данному гормону. Кроме того, препараты замедляют развитие почечной недостаточности на фоне диабета I и II типа, снижают частоту осложнений на сердечно-сосудистую систему.
Низкомолекулярные «взломщики»
Необратимые ковалентные ингибиторы — это относительно малоактивные молекулы, которые трансформируются ферментом-мишенью в высокоактивную форму, способную необратимо ингибировать (то есть «выключить») фермент [1]. Представим себе идеальную ситуацию: мы разработали ингибитор, который не обладает совершенно никакой активностью вне нашей мишени, но, попав в последнюю, узнает ее и выключает, обрекая на смерть. Но как же заставить ингибитор работать только в нужном нам белке? Ответ лежит на поверхности: использовать собственный механизм действия молекулярной мишени против самой себя. Фермент должен сперва принять ингибитор за привычную природную молекулу. Затем начать реакцию, за счет которой лекарство необратимо свяжется с мишенью [2]. То есть, приходя в качестве безобидного субстрата, этот «диверсант» намертво хватает ничего не подозревающий фермент, лишая его способности к функционированию и обрекая на верную гибель [3]! Эти вещества как бы «взламывают» нормальные ферментативные реакции для выключения белка. Правильно спроектированный необратимый ингибитор специфичен к определенному ферменту и не опасен для других молекул. Поэтому лекарства, основанные на этом подходе, могут иметь важное преимущество в виде малого количества нежелательных эффектов [1].
«В чем же секрет столь сильного связывания этих ваших необратимых ингибиторов?» — спросите вы. В ковалентной связи. Существует несколько механизмов связывания лекарств с их молекулярными мишенями. Обычно связывание происходит при помощи слабых взаимодействий [4]. Ковалентная же связь является сильнейшим из возможных взаимодействий и превосходит любые другие в десятки, а то и сотни раз (табл.1) [5]!
Таблица 1. Типы взаимодействий между ингибитором и рецептором.[5]
| Тип связи | Энергия, ккал/моль |
| Ковалентная | 50–150 |
| Электростатическая | 5–10 |
| Водородная | 2–5 |
| Гидрофобная | 0,5–1 |
Механизм образования ковалентной связи строится на том, что пара электронов одного из атомов молекулярной мишени (нуклеофила) распределяется между ним и одним из атомов ингибитора (электрофилом) (рис. 1). Из-за высокой прочности связи ингибитор оказывается необратимо присоединен к ферменту и приводит к разрушению последнего. Восстановление функции фермента наступает только после синтеза его новых копий [5].
Рисунок 1. Общий механизм действия необратимых ингибиторов.
[5]
Как же выглядят эти электрофильные группы, которые используются для создания ковалентных необратимых ингибиторов? Найти ответ вы сможете, посмотрев на рисунок 2. Наличие одного из этих фрагментов в структуре лекарства может говорить о том, что оно действует по уже известному вам механизму [6].
Рисунок 2. Примеры электрофильных групп, встречающихся в необратимых ингибиторах.
[6]
Несмотря на то, что связывание необратимых ингибиторов приводит к гибели фермента, не следует думать, что одна доза такого лекарства может полностью уничтожить фермент в организме. Наличие и работа генов позволит создать его новые копии, пусть на это и понадобится от нескольких часов до пары дней [2].
Как и все в мире, ковалентные необратимые ингибиторы имеют свои преимущества и недостатки, которые мы представили в формате таблицы 2 [6].
Таблица 2. Преимущества и недостатки ковалентных необратимых ингибиторов.[6]
| Преимущества | Недостатки |
| Высокие эффективность и избирательность позволяют использовать меньшие дозы и уменьшить риск побочных эффектов | Высокая активность некоторых представителей может приводить к некрозу печени, мутациям и даже раку! |
| Связывание с важными остатками фермента предотвращает развитие устойчивости микробов, что важно при лечении инфекций | Потенциальная иммуногенность, так как полученный продукт реакции может вызывать аллергический ответ |
| Длительное действие, так как активность фермента вновь появляется только при синтезе его новых копий |
Противопоказания для лечения ингибиторами
Несмотря на общее положительное действие на организм, у ингибиторов есть ряд противопоказаний, при которых лечение этой группой препаратов недопустимо. Это:
- двусторонние стенозы почечных артерий;
- тяжелая почечная недостаточность;
- перенесенная пересадка почки;
- выраженный аортальный стеноз;
- легочно-сердечная недостаточность;
- детский возраст;
- индивидуальная непереносимость;
- заболевания крови;
- цирроз печени, гепатит.
Также препараты не подходят для беременных и кормящих женщин.
Прием ингибиторов должен осуществляться строго по назначению лечащего специалиста. Бесконтрольное применение препаратов и самолечение приводят к осложнениям и развитию опасных для жизни патологий.
Тернистые пути разработки эффективных лекарств
Если вы думаете, что разработка необратимых ковалентных ингибиторов — легкое дело, то вы глубоко заблуждаетесь. Даже если закрыть глаза на то, что разработка любого лекарства является крайне трудоемким и времязатратным процессом [7], задача не сильно упростится — ведь необратимые ингибиторы требуют особого подхода к своей персоне. Сегодня не так много одобренных препаратов действуют именно таким образом. А механизм действия многих из них открыли только спустя годы после разработки! Ученые на этом пути сталкиваются с большим количеством порой неразрешимых проблем.
Одна из них — участие одного фермента сразу в нескольких метаболических каскадах. Обсуждаемые лекарства необратимо связываются с ферментом-мишенью, уничтожая его на то время, которое требуется на синтез новых копий фермента. Этот процесс может занимать до нескольких суток! В том случае, если фермент-мишень выполнял несколько функций, это чревато серьезными побочными эффектами. Чтобы обойти проблему, необратимо связывающиеся ингибиторы чаще всего применяют для блокирования одного из ферментов потенциально опасных для человека вирусов, бактерий и т. д. [3].
Вторая проблема заключается в том, что при низкой избирательности необратимые ингибиторы могут связываться с нежелательными мишенями, похожими на выбранную нами для ингибирования. Это тоже может приводить к серьезным побочным эффектам. Поэтому важная задача при оптимизации структуры ингибиторов — повышение избирательности к своей мишени [3].
Опасения в отношении побочных эффектов необратимых ингибиторов не лишены оснований. Бум гонений на эту группу препаратов вызвали исследования 1970-х годов. Тогда выяснили, что два из наиболее широко известных представителей этой группы — парацетамол и фуросемид — обладают высокой токсичностью в связи с тем, что, метаболизируясь в печени, они образовывают активные производные, формирующие ковалентные связи с ее белками [2], [8]. Как выяснилось позже, эти единичные случаи не имеют отношения ко многим препаратам из группы необратимых ингибиторов, а парацетамол и фуросемид до сих пор активно используются в клинической практике.
Другим распространенным примером нежелательного необратимого ингибирования является цитохром P450. Цитохромы — группа ферментов в нашем организме, главной задачей которых является обезвреживание потенциально опасных веществ. Первыми необратимыми ингибиторами цитохрома стали алкены и алкины. В результате ингибирования этого фермента процессы детоксикации становятся невозможными. Неполный список препаратов, способных вступать в подобную реакцию, включает 17α-алкенил-стероиды, левомицетин, циклофосфамид, спиронолактон, фурокумарины, никотин, изониазид и барбитураты. Звучит опасно, не правда ли? Не многим опаснее, чем пить грейпфрутовый сок! Его компоненты способны необратимо связываться с цитохромом кишечника и лишать этот фермент активности на 24 часа! К чему это может привести? К тому, что принимаемые в это время лекарства будут более эффективно поступать в наш организм, а рост их концентрации повышает риск развития нежелательных эффектов [5]. Именно поэтому врачи рекомендуют запивать таблетки только водой.
Но всегда ли можно считать необратимые ингибиторы безопасными лекарствами? Конечно же, нет. Поиск необратимых ингибиторов, и правда, не всегда оборачивается успехом для исследователей. В частности, полным провалом завершились исследования мышьяк-содержащих органических соединений для лечения трипаносомоза [9]. Эти соединения необратимо ингибировали жизненно необходимые ферменты трипаносомы за счет образования связей между атомом мышьяка в составе исследуемых веществ и серосодержащими остатками фермента. Но они оказались токсичными не только для трипаносомы, но и для организма человека [5].
К счастью, несмотря на все перипетии судьбы, ученые вновь сфокусировали свои пристальные взгляды на необратимых ковалентных ингибиторах. Лучшее понимание реально существующих рисков и знание механизма химических преобразований открыли множество возможностей для разработки более эффективных лекарств и привели к резкому росту встречаемости необратимых ингибиторов в различных исследованиях [10].