Рак молочной железы — самое частое онкологическое заболевание у женщин в России. Опухоль возникает у 11% женщин в течение жизни, при этом заболеваемость продолжает расти, увеличиваясь ежегодно на 1,2%. Приблизительно 1 из 2000 беременных или кормящих женщин также заболевают раком груди. Рак молочной железы встречается и у мужчин, но довольно редко -менее 1 из каждых 180 случаев заболевания.
Эта форма рака стоит на третьем месте среди всех причин смерти женского населения России после болезней системы кровообращения и несчастных случаев во всех возрастных группах.
Регулярный осмотр у маммолога поможет выявить болезни груди на ранних стадиях, оказать своевременную помощь и сохранить здоровье.
- Опухоли молочной железы при УЗИ могут быть представлены отграниченным образованием или зоной с нарушением нормальной эхоструктуры .
- Принадлежность объемного образования МЖ к злокачественному или доброкачественному процессу определяют , исходя из следующих эхопризнаков :
- • характер контуров (ровные, неровные, четкие , нечеткие, волнистые, фестончатые, звездчатые).
- • взаимосвязь с окружающими тканями;
- • тип внутренней структуры;
- • эхогенность ;
- • акустические эффекты наблюдаемые за опухолью;
- • характер кровоснабжения.
Характер контуров опухоли является одним из основных дифференциальных критериев типа роста опухоли в МЖ- раздвигающего или инфильтрирующего.
Доброкачественная опухоль не разрушает окружающие ткани, а только раздвигает их. Поэтому для доброкачественных опухолей характерны четкие контуры и отграниченный ( раздвигающий) тип роста.
Злокачественные опухоли МЖ в основной своей массе представлены раками. Рак молочной железы имеет гетерогенное патогистологическое строение. Большинство РМЖ ( до 70-80%) являются инвазивными , протоковыми .
Для инвазивных форм РМЖ характерен инфильтрирующий тип роста , что эхографически проявляется размытостью, нечеткостью контуров. При инфильтрирующем типе опухолевого роста бывает трудно провести границу между краем опухоли и окружающими тканями.
Эхографические признаки инфильтрирующего типа роста никогда не встречаются при доброкачественных опухолях. В то же время, УЗ признаки отграниченного типа роста могут быть обнаружены как при доброкачественных , так и при злокачественных опухолях.
И доброкачественные и злокачественные опухоли могут иметь собственную анатомическую капсулу , либо псевдокапсулу , образованную сдавленными или фиброзированными окружающими тканями.
Эхогенность опухоли может быть различной , однако для злокачественных образований более характерна низкая эхогенность и неоднородность внутренней структуры.
Акустические эффекты при опухолях молочной железы разнообразны: от небольшого усиления или ослабления УЗ волн до возникновения акустических теней позади образования. Акустическая тень рассматривается как один из ведущих ультразвуковых признаков злокачественности. Однако данные статистики свидетельствуют , что этот эхографический признак определяется только позади 30-65 % злокачественных опухолей. Следует заметить , что при РМЖ частота встречаемости дорсальной акустической тени ( критерий ультразвуковой маммографии ) примерно соответсвует частоте нахождения сгруппированных микрокальцинатов ( критерий рентгеновской маммографии).
Характеристика доброкачественных и злокачественных опухолей
Существуют чёткие критерии:
- Отграничение опухоли от сопредельных тканей.
- Скорость роста.
- Способность к метастазированию.
- Гистологический портрет клеток.
- Выживаемость больного.
Доброкачественные опухоли чётко отграничены от здоровых тканей, часто имеют капсулу. Рак прорастает окружающие ткани, внедряется в сосуды, его контуры более аморфны.
Большинство доброкачественных опухолей могут расти годами, не проявляя симптомов. Карциномы растут быстро, нарушая функции органов и отравляя организм. Рост сопровождается утомляемостью, слабостью, потерей веса, болью.
Доброкачественные образования “сидят” на одном месте, постепенно растут и раздвигают здоровые ткани, подвижны при прощупывании. Раковые клетки слабо скреплены друг с другом, легко отделяются и разносятся лимфой и кровью по организму. Они оседают в лимфоузлах, костях, внутренних органах, образуя новые опухолевые очаги — метастазы. При пальпации узел спаян с тканями и не сдвигается.
Много информации даёт биопсия. Исследование показывает, что доброкачественные клетки похожи на здоровые, их структура более чёткая. Структура злокачественных клеток сильно изменена из-за выраженных мутаций. Чем меньше клетки напоминают ткань, из которой выросли, тем хуже прогноз для лечения и жизни.
Доброкачественную опухоль, такую как аденома простаты, можно удалить и добиться полного излечения. Если возникнет рецидив, он будет на том же месте, где нашли первичный очаг. Злокачественные образования трудно удалить полностью. Даже одна оставшаяся клетка даст новую опухоль либо на старом месте, либо там, куда она попала по сосудам. Выживаемость больных существенно ниже.
3.Диагностика рака
Чем раньше будет диагностирован рак, тем выше шансы на его успешное лечение. Некоторые виды рака, такие как рак кожи, рак молочной железы, рак полости рта, рак яичек, рак предстательной железы и рак прямой кишки могут быть обнаружены самостоятельно, при самообследовании или просто при внимательном наблюдении за ощущениями в организме. В общем, еще до того, как симптомы станут очень тяжелыми.
Большинство же видов рака, к сожалению, диагностируется только тогда, когда симптомы рака становятся уже слишком серьезными, а опухоль явной. Иногда рак диагностируется случайно, в ходе обследования, связанного с выявлением других заболеваний, или их лечения.
Диагностика рака начинается с тщательного медицинского обследования у онколога. Лабораторные исследования крови, мочи и кала могут обнаружить аномалии, дающие основания для подозрения на наличие рака. При подозрении на опухоль может проводиться рентген, компьютерная томография, магнитно-резонансная томография (МРТ), ультразвуковое и эндоскопическое исследование. Все эти способы диагностика рака позволят врачу определить наличие опухоли, ее размер и местоположение, а также наличие метастаз. Для подтверждения диагноза рак выполняется биопсия – взятие образца ткани из предполагаемой опухоли и исследование его на наличие раковых клеток.
После диагностики рака разрабатывается индивидуальная программа лечения рака. Лечение рака может включать в себя химиотерапию, облучение и хирургическое вмешательство и сопровождаться иммунотерапией.
О нашей клинике м. Чистые пруды Страница Мединтерком!
Виды опухолей
Доброкачественные:
- кисты;
- невусы или родинки;
- узелки, название которых имеет суффикс ома: фиброма, миома, аденома, папиллома — в зависимости от конкретной ткани.
Злокачественные:
- образования, к названию которых присоединяется слово карцинома, саркома, бластома, бластоз (фиброобластома, миосаркома, аденокарцинома);
- онкозаболевания крови — лимфогранулёматоз, лейкоз и другие;
- рак кожи — меланома, базалиома.
Различия не всегда очевидны. Нужна тщательная диагностика для поиска атипичных клеток.
Особенности кистозно-солидных образований
- Солидное образование (рак) – это самое опасное состояние, при котором шансы излечиться от недуга минимальны; оно имеет твердую оболочку и заполнено тканью.
- В отличие от него, кистозное новообразование легко поддается лечению, оно мягкое, может расти и уменьшаться.
- Кистозно-солидное образование является промежуточным звеном между ними. Оно может появиться в любом органе, меняться в размерах или оставаться неизменным, а также содержать в себе как ткань, так и жидкую субстанцию.
Авторская методика при удалении опухоли забрюшинного пространства
Ответственными этапами операции является выделение опухоли, установление ее связи с окружающими органами и жизненно важными структурами, ревизия и мобилизация опухоли. Я всегда отдаю предпочтение лапароскопическому доступу — малотравматичному и эффективному.
Особенностью моей техники проведения лапароскопии является разработанный мной метод установки троакаров, что позволяет размещать хирургические инструменты под оптимальным манипуляционным углом. Иссечение патологических образований в этой сложной зоне, таким образом, происходит быстро и безопасно.
Я также использую в ходе оперативного вмешательства современные ультразвуковые ножницы и аппарат дозированного электротермического лигирования тканей «LigaSure» (США), что исключает необходимость применения хирургических нитей и клипс. Отсутствие кровотечения в зоне операции обеспечивает безопасность вмешательства и максимальную точность при манипуляциях с мельчайшими структурами. В случае первичной забрюшинной опухоли и наличия поражения соседних структур радикальная операция проводится единым блоком. Удаленные ткани отправляются на гистологическое исследование, что важно для дальнейшего лечения и прогноза.
Лапароскопические вмешательства я провожу с 1997 года, мною проведено более 200 операций по удалению опухолей забрюшинного пространства с использованием лапароскопического доступа. Любой пациент, обратившийся ко мне, может рассчитывать на мои знания и опыт. На основании результатов обследования я подбираю тактику лечения таким образом, чтобы добиться максимально эффективного результата.
Причины
На данный момент причины развития опухолей забрюшинного пространства окончательно не установлены. Однако существует ряд факторов, способствующих их появлению:
- генетические отклонения;
- воздействие вредного излучения или химических веществ (например, гербицидов или пестицидов);
- подавление иммунитета при токсическом влиянии химических препаратов.
Существует версия, что болезнь развивается у пациентов, прошедших облучение в ходе лечения при онкологическом процессе.
Для определения вида кисты забрюшинного пространства, ее локализации к основным структурам органа и показаний к операции, а также выбора правильной тактики хирургического лечения необходимо прислать мне на личный электронный адрес полное описание УЗИ брюшной полости, данные МСКТ забрюшинного пространства с контрастом, указать возраст и основные жалобы. Тогда я смогу дать более точный ответ по вашей ситуации.
Анапластический рак щитовидной железы – симптомы
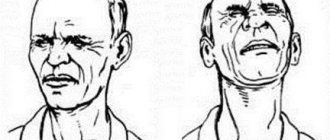
Симптомы анапластического рака весьма специфичны, и заподозрить его может и сам пациент, и врач практически любой специальности. Самый важный симптом – появление быстро растущей опухоли на передней поверхности шеи. Рост опухоли происходит настолько быстро, что он заметен на глаз – утром опухоль выглядит больше, чем вечером. Обычно анапластический рак щитовидной железы является плотным при ощупывании. Опухоль быстро теряет подвижность за счет врастания в окружающие органы. Поражение опухолью возвратных нервов приводит к потере подвижности голосовых складок и, как следствие, к ухудшению голоса (осиплость, хрипота, слабость голоса). При врастании опухоли в трахею появляется удушье. Часто при ощупывании выявляются уплотненные увеличенные лимфоузлы на боковых поверхностях шеи. Врастание опухоли в пищевод приводит к появлению затруднения при проглатывании пищи и воды.
Общее состояние пациента ухудшается – может появляться повышенная температура, слабость, утомляемость. В анализе крови нередко выявляется лейкоцитоз (повышение уровня лейкоцитов крови). Следует отметить, что сам анапластический рак щитовидной железы гормоны не вырабатывает, поэтому уровни ТТГ, Т4 св., Т3 св., кальцитонина крови будут находиться в пределах нормы.
Лечение солидного онкологического заболевания
Солидное образование – это рак, крайне серьезный недуг, требующий основательного подхода и высочайшего уровня квалификации. Только действительно опытные специалисты в состоянии осуществить точную диагностику и подобрать наиболее подходящее лечение, которое зависит от локализации, размеров и иных особенностей конкретной опухоли.
Специалисты онкологического – это врачи, на протяжении многих лет занимающиеся выявлением и лечением рака на разных стадиях. Если у вас возникли подозрения относительно своего здоровья, записывайтесь на консультацию. Помните, что на начальном этапе преодолеть болезнь проще, быстрее и безболезненней.
Выделенные в самостоятельную нозологическую единицу гастроинтестинальные стромальные опухоли (англ. Gastrointestinal stromal tumors — GIST) уже не являются большой редкостью для онкологов. GIST — это стромальные опухоли желудочно-кишечного тракта (ЖКТ), которые имеют общее происхождение из одной клетки-предшественницы с интерстициальными клетками Кахаля. Последние расположены между циркулярными и продольными мышечными волокнами стенки органов ЖКТ и являются пейсмейкерами, регулирующими автономную перистальтическую активность. GIST являются наиболее распространенными новообразованиями в группе мезенхимальных опухолей ЖКТ.
GIST могут поражать любой отдел ЖКТ, но чаще всего локализуются в желудке (40—60%) и тонкой кишке (30—35%). Реже поражаются ободочная и прямая кишка (5—16%), крайне редко пищевод. Встречаются первичные GIST, локализующиеся вне полых органов, например, в сальнике или забрюшинном пространстве. Чаще GIST диагностируют у лиц среднего и пожилого возраста. Пик заболеваемости приходит на 5-й и 7-й десяток. Распределение по полу одинаковое, с незначительным преобладанием мужчин.
Алгоритм обследования больных с подозрением на GIST включает в себя эндоскопические и лучевые методы диагностики. Основным подтверждением диагноза является иммуногистохимическое исследование с определением специфических маркеров.
До недавнего времени единственным способом лечения GIST было оперативное вмешательство. Однако даже выполнение операции в объеме полной циторедукции не позволяло добиться 5-летней выживаемости выше 50—65%. В качестве адъювантного лечения пытались использовать системную химиотерапию, особенно у больных с диссеминированным процессом или у которых во время операции произошло нарушение целостности образования. Но реального улучшения выживаемости больных отмечено не было. Лучевая терапия применялась еще реже из-за малой эффективности, возможности лучевого повреждения кишечника и ограниченного применения только у больных с GIST желудка и прямой кишки. Медиана выживаемости больных с диссеминированным процессом составляла 10 мес.
Ситуация резко изменилась с 2001 г., когда группа финских онкологов под руководством Heikki Joensuu [1] сообщила о первом опыте применения ингибитора тирозинкиназного рецептора у больной с GIST. Они использовали препарат STI 571, который в настоящее время известен как гливек (иматиниб). Неэффективность традиционных схем химиотерапии и значительная противоопухолевая активность иматиниба послужили поводом для самой быстрой в современной истории регистрации препарата.
С этого момента началась новая эра в лечении больных с GIST. Тем не менее, несмотря на явное улучшение статистических показателей, нерешенных вопросов меньше не становится.
Таким образом, диагностика и лечение больных с GIST является актуальной проблемой современной онкологии.
Диагностика GIST
Эзофагогастродуоденоскопия в большинстве случаев позволяет предположить у больного наличие стромальной опухоли и, что немаловажно, выполнить биопсию образования. Эндоскопическая картина довольно разнообразна, размеры неэпителиальных образований варьируют от 1—2 см до 20—30 см. При небольшом размере опухоли и выполнении эндоскопического ультразвукового исследования (УЗИ) можно определить, что опухоль исходит из мышечного слоя [2]. Вместе с тем иногда при эндоскопической диагностике GIST возникают затруднения, которые связаны с особенностями роста опухоли. При небольшом размере опухолевого узла эндоскопическая картина может соответствовать, в зависимости от характера роста, неизменному органу (при экстраорганной форме), сдавлению извне (при смешанной форме) или подслизистому образованию — при эндоорганной форме. При первых двух формах редко удается точно оценить истинный размер опухолевого узла, даже с использованием эндосонографии. Слизистая оболочка на начальных этапах заболевания обычно не изменена, что сильно затрудняет щипцовую биопсию. Даже применение углубленной ступенчатой биопсии не всегда позволяет получить материал, пригодный для гистологического исследования [3, 4].
В такой ситуации простым и весьма эффективным методом является трансабдоминальное УЗИ с прицельной биопсией опухоли. Эхографическая картина GIST в типичном случае представляет собой единичные или множественные узловые образования, связанные со стенкой желудка или кишки. В наших наблюдениях в основном отмечалась внеорганная форма роста GIST. Контур образований на начальной стадии заболевания при размере узлов до 4 см ровный и четкий. На более поздних стадиях, в местах прорастания опухоли в прилежащие органы и брюшину, контур становится неровным и нечетким, что и является эхографическим признаком инвазивного роста. Структура опухолевых узлов солидная, средней эхогенности, с выраженной сосудистой сетью. Характерным для GIST является наличие в структуре опухоли жидкостных включений с ровной стенкой, с однородным анэхогенным содержимым. Полости могут быть различными, от единичных мелких до многосантиметровых, занимающих до 90% объема опухоли.
Для выполнения пункционной биопсии оптимальным является использование биопсийного пистолета, который оснащен одноразовыми съемными иглами. Наиболее подходящими по размеру являются иглы длиной 20 см и калибром 16—18G. При срабатывании биопсийного устройства происходит последовательный выброс с коротким (менее 0,1 с) интервалом внутренней, а затем внешней части иглы. При этом в пазе иглы задерживается фрагмент ткани в виде «столбика», длиной около 2 см и толщиной 1—1,5 мм. Данного количества материала, как правило, достаточно для проведения гистологического и иммуногистохимического исследования. Методика пункционной биопсии проводится следующим образом. После антисептической обработки кожи по предполагаемой трассе пункции раствором анестетика выполняется послойная инфильтрационная анестезия. Остроконечным скальпелем производится насечка на коже. Затем под постоянным экранным контролем биопсийная игла подводится к границе опухолевого образования и приводится в действие механизм биопсийного пистолета (см. рисунок).
Рисунок 1. Эхограммы. Чрескожная биопсия GIST желудка (стрелками указана биопсийная игла). Подведение биопсийной иглы (а); забор материала (б).
Таким образом, трансабдоминальное УЗИ с учетом ультразвуковой семиотики позволяет предположить GIST у обследуемого пациента, а также с высокой точностью оценить местную распространенность процесса. Прицельная пункция узлового образования в стенке полого органа с соблюдением описанных условий безопасна и позволяет получить материал для гистологического подтверждения диагноза на дооперационном этапе лечения.
Особое внимание в диагностическом алгоритме GIST уделяют компьютерной томографии (КТ), которая используется в качестве уточняющей диагностики, так как дает более четкое представление о размере, характере роста опухоли, инвазии соседних органов и структур, а также наличии метастазов. Не меньшее значение имеет использование КТ при проведении контрольного обследования больных после и в процессе лечения. На компьютерной томограмме GIST выглядят в виде одиночных или множественных объемных образований с неоднородной внутренней структурой и четкими контурами. Участки пониженной плотности в центральных отделах новообразований могут быть обусловлены внутриопухолевым некрозом, кровоизлиянием или кистозной дегенерацией. При внутривенном контрастировании отмечается выраженное неравномерное «усиление» опухолевых масс в ранние фазы исследования. В отличие от аденокарцином при гастроинтестинальных сторомальных опухолях не наблюдается концентрического сужения просвета пораженной кишки. Инвазии магистральных сосудов и венозного тромбоза, как правило, не отмечается. Несмотря на то что первичная опухоль гиперваскулярна, большинство внутрипеченочных метастазов выглядят как очаги пониженной плотности с признаками слабо выраженного контрастирования их периферических отделов в артериальную фазу. Однако у одного и того же пациента могут встречаться как гипо-, так и гиперваскулярные очаги. В наиболее крупных метастазах могут встречаться участки некроза, иногда зоны кровоизлияния и кальцинаты (последние, как правило, после химиотерапевтического лечения) [5].
С 1983 г., когда M. Mazur и H. Clark [6] впервые выделили особую подгруппу гастроинтестинальных неэпителиальных опухолей, отличающихся по своим иммуногистохимическим и ультраструктурным характеристикам от опухолей с истинной нейрогенной и гладкомышечной дифференцировкой и назвали их GIST, механизм возникновения этих опухолей долгое время оставался не ясен. Открытие S. Hirota и соавт. в 1998 г. [8] молекулярных механизмов, ответственных за появление GIST, позволило сделать значительный прорыв в понимании патогенеза данного заболевания. Было обнаружено, что для данного типа сарком характерны аномальная активация и гиперэкспрессия гена KIT (4q12), белковый продукт которого с-Kit (CD117, KIT) принадлежит к III типу семейства плазматических трансмембранных рецепторов тирозиновой киназы. Мутации в гене KIT встречаются в гастроинтестинальных опухолях у 56—92% больных [9]. Как правило, они локализованы в 9, 11, 13, 14 и 17-м экзонах гена.
В 3—8% наблюдений обнаруживают мутацию в гене PDGFRA (экзоны 12, 14 и 18), кодирующего α-рецептор тромбоцитарного фактора. Крайне редко мутации локализованы в гене BRAF (менее 1%). Приблизительно в 12—15% GIST выявить мутацию вышеуказанных генов не удается. В этом случае говорят о диком типе мутации [3, 5, 8, 10].
Маркер CD117 экспрессируется до 95% всех GIST. Другими маркерами, которые помогают иммунофенотипировать и дифференцировать GIST от других опухолей ЖКТ мезенхимального происхождения, являются: DOG1 (от англ. «discovered on GIST 1»), который определяется в 87% случаев, CD34 (рецептор кроветворных стволовых клеток и эндотелиоцитов) обнаруживают в 60—70% опухолей, гладкомышечный актин — в 30—40%. Некоторые опухоли экспрессируют S100 (5%), десмин (1—2%), общий кератин (1—2%) [3, 7, 10]. Необходимо отметить значение маркера пролиферативной активности Ki-67, уровень экспрессии которого достоверно повышается с ростом «риска агрессивности» GIST, что используют для оценки степени злокачественности и прогноза [11].
Согласно рекомендациям ведущих онкологических сообществ (ESMO, NCCN, Canadian Advisory Committee on GISTs и др.), диагноз GIST устанавливают на основании морфологического исследования биоптатов с обязательным проведением иммуногистохимического исследования на вышеуказанные маркеры. Вместе с тем NCCN и ESMO рекомендуют обязательное удаление стромальных опухолей размером 2 см и более, тогда как канадские эксперты считают, что все подозрительные на GIST образования должны быть удалены, даже если их размер не превышает 1 см, поскольку такие опухоли склонны к метастазированию [12—15].
В настоящее время накоплены факты, свидетельствующие, что опухоли с мутациями, локализованными в 11-м экзоне гена KIT, более чувствительны к таргетной терапии гливеком, чем опухоли, которые данных мутаций не имеют [9]. Опухоли с некоторыми мутациями в гене PDGFRА к гливеку резистентны. Таким образом, молекулярная диагностика GIST является важным прогностическим исследованием, которое позволяет судить о клиническом течении, предполагаемом ответе опухоли на препарат и стартовой химиотерапевтической дозе. Мутационный анализ не является обязательным, однако для уточнения прогноза заболевания и при назначении таргетной терапии эти данные крайне важны.
GIST не подлежат классификации TNM, для определения прогноза используются определения «риск развития рецидива заболевания» или «риск агрессивности опухоли». На протяжении последних 10 лет накоплен большой материал по данной нозологии. За это время проведено огромное количество исследований, в которых оценивалось влияние различных факторов на прогноз заболевания. В настоящее время основными предикторами являются размер и локализация опухоли, количество митозов на 50 полей зрения, характер мутации, а также наличие разрыва капсулы опухоли до или во время хирургического вмешательства.
Лечение. Резектабельные GIST
Хирургическое вмешательство в настоящее время остается основным методом лечения больных с локализованными и местно-распространенными формами GIST. При лечении стромальных опухолей ЖКТ необходимо строго придерживаться признаков онкологического радикализма [12—15]. Резекцию органов выполняют, отступив на 2 см от макроскопически определяемых краев новообразования. В отличие от раковых опухолей, выполнение лимфаденэктомии при GIST не показано, за исключением случаев, когда имеются явные признаки поражения лимфатических узлов. Это обусловлено тем, что частота лимфогенного метастазирования при стромальных опухолях не превышает 3%. Очень важно не допускать разрыва капсулы опухоли на этапах мобилизации и удаления, поскольку в этом случае прогноз заболевания становится сопоставимым с метастатическим формами GIST. Следует с осторожностью относиться к лапароскопическим вмешательствам при GIST большого размера в связи с высоким риском повреждения капсулы. Некоторые авторы рекомендуют принципиальное удаление большого сальника при всех стромальных опухолях ЖКТ.
Соблюдение принципов радикализма при хирургическом лечении локализованных и местно-распространенных GIST позволяет добиться общей 5-летней выживаемости у 54—65% больных (при условии полной циторедукции). При наличии остаточной опухоли (операции в объеме R1-R2) медиана выживаемости до внедрения таргетной терапии не превышала 12 мес [16—18].
Рецидивы и метастатические GIST
До недавнего времени лечение больных с рецидивными и метастатическими формами GIST представляло серьезную проблему в связи с крайне низкой чувствительностью стромальных опухолей ЖКТ к существующим цитостатикам и лучевой терапии. 5-летняя выживаемость при хирургическом лечении в объеме полной циторедукции опухоли составляла 35% [19]. Ситуация изменилась с внедрением в клиническую практику гливека, а позднее сутента (сунитиниб). В настоящее время ингибиторы тирозинкиназ являются золотым стандартом лечения рецидивных, нерезектабельных и метастатических форм GIST.
Дозы препарата и эффективность лечения напрямую зависят от типа мутации в гене KIT. Опухоли с мутациями в 11-м экзоне и некоторыми мутациями в 13-м экзоне отличаются высокой чувствительностью к таргетной терапии, поэтому лечение гливеком начинают с дозировки 400 мг/сут. При мутации в экзоне 9 начальную дозу увеличивают до 800 мг/сут, что обусловлено меньшей частотой объективного ответа и худшим прогнозом. При невозможности генетического типирования GIST лечение начинают с 400 мг, поскольку известно, что большинство стромальных опухолей имеют мутацию в 11-м экзоне (до 70%) [20, 21]. В случае прогрессирования заболевания на дозе 400 мг/сут рекомендован переход на 800 мг/сут [13—15, 22—27].
Опухоли с мутациями в 12-м и 18-м экзонах гена PDGFRА имеют повышенную чувствительность к иматинибу, за исключением мутации p.D842V, которая, напротив, свидетельствует о резистентности. На резистентность к гливеку также указывают вторичные мутации в 13-м и 17-м экзонах гена KIT, которые возникают вследствие приема препарата через некоторое время. Таким образом, при выборе схемы лечения необходимо учитывать тип мутаций в генах KIT и PDGFRA и генотипирование первичных опухолей, в частности с высоким риском метастазирования, для установления мутантных типов с первичной резистентностью к иматинибу. Анализ вторичных мутаций в GIST на фоне приема гливека может быть выполнен для мониторинга лекарственной резистентности.
В работах J. Gold и соавт. (2007) [4] и С. Blanke и соавт. (2008) [23] представлены результаты лечения больных с рецидивными и метастатическими формами GIST. В первом исследовании больные получали только хирургическое лечение. При этом общая 2-годичная выживаемость составила 41%, а медиана выживаемости — 19 мес. Во втором исследовании при сочетании хирургического лечения с адъювантной терапией гливеком аналогичные показатели составили 72—76% и 51—55 мес соответственно.
При дальнейшем прогрессировании заболевания на высоких дозах гливека либо при развитии неконтролируемых побочных эффектов показана вторая линия терапии. Препаратом выбора в данном случае является сутент — пероральный мультитаргетный тирозинкиназный ингибитор, обладающий противоопухолевой и антиангиогенной активностью [28—30]. Препарат доказал свою эффективность при приеме 50 мг/сут в течение 4 нед с последующим двухнедельным перерывом. По данным G. Demetri и соавт. [28], сутент увеличивал время до прогрессирования с 6,4 до 27,3 нед (р<0,0001). Частичная резорбция опухоли отмечена у 6,8% больных, стабилизация процесса более 22 нед — у 17,4%.
Адъювантная таргетная терапия
При хирургическом лечении локализованных и местно-распространенных GIST примерно у половины больных в течение 5 лет развивается рецидив заболевания, что диктует необходимость проведения адъювантной терапии в группе высокого риска [17]. Ряд исследований, проведенных в Европе и США, показал возможность успешного применения иматиниба в качестве адъювантной терапии после хирургического лечения стромальных опухолей. Так, в рандомизированном плацебо-контролируемом исследовании III фазы Z9001 (ACOSOG) была оценена эффективность адъювантной терапии гливеком в дозе 400 мг в течение 1 года у больных с c-KIT-положительными GIST по сравнению с плацебо. По результатам исследования адъювантная терапия достоверно увеличила безрецидивную выживаемость с 83 до 98% соответственно по сравнению с плацебо (p<0,0001). Вместе с тем улучшения общей выживаемости отмечено не было, что может быть обусловлено недостаточными сроками наблюдения [31—33]. Таким образом, адъювантная таргетная терапия в течение 1 года рекомендована всем больным GIST c высоким риском прогрессирования. При опухолях низкого риска показано динамическое наблюдение.
Основными критериями при оценке риска рецидива стромальных опухолей после хирургического лечения являются локализация и размер опухоли, наличие перфорации опухоли, частота митозов и тип мутации. Наихудшими факторами прогноза являются локализация опухоли в тонкой кишке, размер более 10 см, частота митозов более 5 на 50 полей зрения при большом увеличении микроскопа, мутация в 9-м экзоне гена KIT [15, 34, 35].
Улучшение показателя только безрецидивной выживаемости без улучшения общей выживаемости не могло удовлетворить исследователей, в связи с чем было инициировано несколько протоколов по применению гливека в качестве адъювантной терапии в течение более длительного времени. Так, в протоколе EORTC 62024 изучена эффективность приема иматиниба в течение 2 лет по сравнению с хирургическим лечением у больных с промежуточным или высоким риском развития рецидива. В настоящее время опубликованы результаты по скандинавско-немецкому исследованию SSG XVIII/AIO. Согласно представленным данным, адъювантная терапия гливеком в течение 3 лет по сравнению с 1 годом статистически достоверно увеличивает не только безрецидивную, но и общую выживаемость больных с высоким риском развития рецидива (p=0,019). В то же время такая терапия хорошо переносится больными, а серьезные нежелательные явления возникают крайне редко. Таким образом, новым золотым стандартом в лечении данной группы пациентов после хирургического лечения является адъювантная терапия в течение 3 лет [36, 37].
Неоадъювантная терапия
Перспективным направлением в лечении стромальных опухолей является неоадъювантная терапия ингибиторами тирозинкиназ с последующим хирургическим вмешательством. Целью предоперационного воздействия является уменьшение опухолевой массы, повышение резектабельности и частоты выполнения органосохраняющих операций, а также снижение риска рецидива [4, 19]. По данным R. Andtbacka и соавт. [38], применение неоадъювантной терапии иматинибом в группе больных с рецидивными или метастатическим GIST позволяет повысить резектабельность опухоли в случае ответа на проводимую терапию. Так, при частичной резорбции опухоли частота радикальных операций (R0) составила 91%, тогда как при прогрессировании на фоне терапии — лишь 4% (р<0,001). Основными показаниями для проведения неоадъювантной терапии являются условно-резектабельные местно-распространенные и метастатические формы GIST. Длительность предоперационной терапии иматинибом варьирует в пределах от 6 до 12 мес. Такой временной интервал был выбран на основании данных протокола EORTC 62024, где было показано, что 80% ответов на терапию иматинибом получено через 6 мес после начала лечения, а среднее время до прогрессирования составляет 18 мес [36]. Более того, по данным S. Bonvalot и соавт. [39], частота полных циторедукций, выполненных в сроки от 6 до 12 мес после начала терапии иматинибом, составляет 80%, а в сроки от 12 до 18 мес — лишь 20% .
Заключение
Гастроинтестинальные стромальные опухоли являются наиболее распространенными мезенхимальными опухолями ЖКТ. Большинство мягкотканных образований, классифицируемых ранее как лейомиомы, шванномы, лейомиосаркомы и другие, в настоящее время отнесены к GIST на основании результатов иммуногистохимического исследования. Широкое внедрение молекулярной диагностики, а также появление препаратов таргетной терапии значительно изменили подходы к лечению и прогноз заболевания у больных с GIST.
При локализованных стромальных опухолях основным методом лечения остается хирургическое вмешательство, дополненное адъювантной таргетной терапией в группе высокого риска. При нерезектабельных и метастатических формах лечение начинают с консервативной терапии с дальнейшим решением вопроса о хирургическом лечении при значительной резорбции опухоли. Применение современных алгоритмов лечения больных c GIST, включающих хирургическое лечение и таргетную терапию, позволяет добиться 5-летней выживаемости даже при распространенном опухолевом процессе.
Основные причины возникновения солидных образований при раке
Солидное образование – это рак, который может появиться практически в любой системе организма. Однако существует ряд причин, которые, по заявлениям специалистов, являются своеобразными провокаторами и стимулируют появление и распространение метастазов.
Солидное образование (рак) может возникнуть вследствие следующих явлений:
- неблагоприятная экологическая обстановка, в особенности, в густонаселенных мегаполисах и городах с крупными заводами и фабриками;
- обилие стрессов и чрезмерная психологическая нагрузка;
- алкоголизм и табакокурение;
- плохая наследственность;
- слабая иммунная система;
- частые переломы и иные травмы.
Симптомы
Болезнь в течение длительного времени может протекать бессимптомно, без нарушения работы близлежащих органов. Первым симптомом опухоли забрюшинного пространства, с которым пациент впервые обращается к врачу, является боль в животе: от незначительной — тупой и ноющей, до приступообразной и интенсивной.
Но специфические признаки отсутствуют, проявления обусловлены не видом опухоли, а ее локализацией — в верхней, нижней или боковой части забрюшинного пространства, близостью нервов, сосудов, лимфатических путей и др. Однако нарушение работы близлежащих органов развивается, когда образование достигает внушительных размеров и начинает сдавливать рядом расположенные структуры.
Возможно появление тошноты и рвоты, чередование поносов с запорами, урчание и вздутие живота. При сдавлении мочевого пузыря появляются расстройства функции мочеиспускания, при давлении на диафрагму — одышка. В некоторых случаях на стороне поражения могут появляться признаки гипотермии и гипергидроза нижней конечности — излишнего потоотделения. Сдавление крупных сосудов забрюшинного пространства опухолью приводит к отекам нижних конечностей.
При злокачественном процессе отмечается: расстройство аппетита, тошнота, быстрая утомляемость, на поздней стадии — потеря веса, повышенная температура. Опухоли забрюшинного пространства злокачественного характера могут метастазировать, чаще метастазы обнаруживаются в печени и легких.
Классификация солидных образований
Любое солидное образование (онкология) относится к одной из следующих категорий: доброкачественное или злокачественное.
Доброкачественная опухоль
Медленно растет, может самостоятельно уменьшаться без дополнительного вмешательства. Отсутствуют метастазы.
Основная проблема, которую несет данное солидное образование (рак) – это сдавливание собой соседних органов или тканей.
Злокачественная опухоль
Состоит из неустанно делящихся клеток, изменивших свой вид и структуру, может дорасти до немалых размеров.
Явление проявляет себя крайне агрессивным образом, распространяет метастазы даже на самых ранних стадиях недуга.