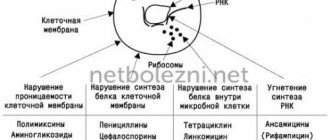
Спектр действия
Активность препаратов из группы цефалоспоринов постепенно меняется при переходе от поколения к поколению:
- Лекарства 1-2 поколений наиболее эффективны при заражении грамположительной флорой (стафило- и стрептококки, коринебактерии).
- Для 3 и 5 поколений цефалоспоринов уже имеет место возросшая активность к грамотрицательным бактериям (энтеробактер, гемофильная палочка, гонококк, менингококк, клебсиелла, моракселла, протей) и анаэробам (пептококк, пептострептококк, клостридии, бактероиды) наряду с высокой эффективностью против грамположительной флоры. В дополнение цефтазидим и цефиксим губительны для синегнойной палочки.
- Цефалоспорины 4 поколения отличаются: их эффект максимален для грамотрицательных бактерий, при этом цефепим так же обладает антисинегнойным эффектом.
Антибиотики из ряда цефалоспоринов относятся к β-лактамным антибиотикам. Каждый из их представителей имеет в своей структуре 7-АЦК (7-аминоцефалоспорановую кислоту) и отличается более высокой устойчивостью к особому ферменту бактерий β-лактамазе. Путем предотвращения синтеза компонентов клеточной стенки бактериальных клеток, цефалоспорины реализуют свое бактерицидное действие, т.е. полностью разрушают микробные клетки.
ЦЕФАЛОСПОРИНЫ III ПОКОЛЕНИЯ
СОВРЕМЕННАЯ АНТИМИКРОБНАЯ ХИМИОТЕРАПИЯ
СОВРЕМЕННАЯ АНТИМИКРОБНАЯ ХИМИОТЕРАПИЯ
Л.С. Страчунский, С.Н. Козлов. Руководство для врачей
| Содержание | ANTIBIOTIC.ru |
Антибактериальные препараты / Бета-лактамные антибиотики / Цефалоспорины
Цефалоспорины III поколения обладают более высокой, чем препараты I-II поколений, активностью против грамотрицательных бактерий из семейства Enterobacteriaceae
, включая многие нозокомиальные полирезистентные штаммы. Некоторые из цефалоспоринов III поколения (цефтазидим, цефоперазон) активны против
P.aeruginosa
. В отношении стафилококков их активность несколько ниже, чем у цефалоспоринов I поколения.
Как и все другие цефалоспорины, препараты III поколения не действуют на MRSA и энтерококки, имеют низкую антианаэробную активность, разрушаются β-лактамазами расширенного спектра.
Парентеральные цефалоспорины III поколения первоначально использовались только при терапии тяжелых инфекций в стационаре, однако в настоящее время в связи с ростом антибиотикорезистентности их нередко применяют и в амбулаторных условиях.
При тяжелых и смешанных инфекциях парентеральные цефалоспорины III поколения используют в сочетании с аминогликозидами II-III поколений, метронидазолом, ванкомицином.
Пероральные цефалоспорины III поколения применяют при среднетяжелых внебольничных инфекциях, вызванных грамотрицательной флорой, а также в качестве второго этапа ступенчатой терапии после назначения парентеральных препаратов.
ПАРЕНТЕРАЛЬНЫЕ ЦЕФАЛОСПОРИНЫ III ПОКОЛЕНИЯ
ЦЕФОТАКСИМ
Клафоран
Первый, так называемый «базовый», цефалоспорин III поколения, нашедший широкое применение.
Спектр активности
| Грам(+) кокки: | стрептококки (в том числе многие пенициллинорезистентные пневмококки); стафилококки (но действует слабее, чем цефазолин). |
| Грам(-) кокки: | N.gonorrhoeae, N.meningitidis, M.catarrhalis , включая β-лактамаза (+) штаммы. |
| Грам(-) палочки: | E.coli, Proteus spp., H.influenzae, Klebsiella spp., Enterobacter spp., цитробактеры, серрации, провиденции и др., в том числе штаммы, устойчивые к гентамицину. |
| Анаэробы: | преимущественно анаэробные кокки (пептострептококки и др.); не действует на B.fragilis . |
Фармакокинетика
Хорошо проникает в различные ткани, проходит через ГЭБ. Не вытесняет билирубин из соединения с альбуминами плазмы, поэтому предпочтителен у новорожденных. Метаболизируется в печени, причем метаболит (дезацетилцефотаксим) обладает антимикробной активностью. Выделяется почками. T1/2 — около 1 ч, метаболита — около 1,5 ч.
Показания
- Тяжёлые инфекции ВДП (острый и хронический синусит — при необходимости парентерального лечения).
- Тяжёлые инфекции НДП (внебольничная и нозокомиальная пневмония).
- Инфекции ЖВП.
- Тяжёлые внебольничные и нозокомиальные инфекции МВП.
- Интраабдоминальные и тазовые инфекции (в сочетании с антианаэробными препаратами).
- Кишечные инфекции (шигеллез, сальмонеллез).
- Тяжёлые инфекции кожи, мягких тканей, костей и суставов.
- Бактериальный менингит.
- Сепсис.
- Гонорея.
Дозировка
Взрослые
Парентерально — 3-8 г/сут в 2-3 введения; при менингите — 12-16 г/сут в 4 введения; при острой гонорее — 0,5 г внутримышечно однократно.
Дети
Парентерально — 50-100 мг/кг/сут в 3 введения; при менингите 200 мг/кг/сут в 4 введения. При менингите у новорожденных сочетают с ампициллином, который активен против листерий.
Формы выпуска
Флаконы по 0,25 г, 0,5 г, 1,0 г и 2,0 г порошка для приготовления раствора для инъекций.
ЦЕФТРИАКСОН
Роцефин, Лендацин, Форцеф, Цефтриабол
По спектру активности сходен с цефотаксимом.
Главные отличия:
- среди цефалоспоринов имеет самый длительный T1/2 (5-7 ч), поэтому вводится 1 раз в сутки, при менингите — 1-2 раза в сутки;
- высокая степень связывания с белками плазмы;
- двойной путь выведения, поэтому при почечной недостаточности не требуется коррекции дозировки (коррекция проводится только у пациентов, имеющих и печеночную, и почечную недостаточность).
Показания
- Тяжёлые инфекции ВДП (острый и хронический синусит, острый средний отит — при необходимости парентерального лечения).
- Тяжёлые инфекции НДП (внебольничная и нозокомиальная пневмония).
- Тяжёлые внебольничные и нозокомиальные инфекции МВП.
- Интраабдоминальные и тазовые инфекции (в сочетании с антианаэробными препаратами).
- Кишечные инфекции (шигеллез, сальмонеллез).
- Тяжёлые инфекции кожи, мягких тканей, костей и суставов.
- Бактериальный менингит.
- Бактериальный эндокардит.
- Сепсис.
- Гонорея.
- Боррелиоз (болезнь Лайма).
Предупреждение
Не следует использовать при инфекциях ЖВП, так как может выпадать в виде солей желчи (псевдохолелитиаз).
Не рекомендуется применять у новорожденных ввиду возможности вытеснения билирубина из связи с альбуминами плазмы и риска развития ядерной желтухи.
Дозировка
Взрослые
Парентерально — 1,0-2,0 г/сут в 1 введение; при менингите — 2,0-4,0 г/сут в 1-2 введения; при острой гонорее — 0,25 г внутримышечно однократно. При внутримышечном введении разводить в 1% растворе лидокаина.
Дети
Парентерально — 20-75 мг/кг/сут в 1-2 введения; при менингите — 100 мг/кг/сут в 2 введения (не более 4,0 г /сут). При остром среднем отите — 50 мг/кг/сут внутримышечно в течение 3 дней (не более 1,0 г на введение).
Формы выпуска
Флаконы по 0,25 г, 0,5 г, 1,0 г и 2,0 г порошка для приготовления раствора для инъекций.
ЦЕФТАЗИДИМ
Фортум, Кефадим
Главные отличия от цефотаксима:
- высокоактивен против P.aeruginosa
, часто превосходят пиперациллин, аминогликозиды и ципрофлоксацин; - менее активен в отношении грамположительных кокков (стафилококков, пневмококков);
- имеет более длительный Т1/2 (2 ч).
Показания
- Синегнойная инфекция, включая менингит.
- Нозокомиальная пневмония.
- Тяжёлые внебольничные и нозокомиальные инфекции МВП.
- Интраабдоминальные и тазовые инфекции (в сочетании с антианаэробными препаратами).
- Нейтропеническая лихорадка.
Дозировка
Взрослые
Внутривенно — 2,0-4,0 г/сут в 2 введения, при менингите — 6,0 г/сут в 3 введения.
Дети
Внутривенно — 30-100 мг/кг/сут в 2-3 введения, при менингите — 200 мг/кг/сут в 3 введения.
Формы выпуска
Флаконы по 0,25 г, 0,5 г, 1,0 г и 2,0 г порошка для приготовления раствора для инъекций.
ЦЕФОПЕРАЗОН
Цефобид
Главные отличия от цефотаксима:
- действует на P.aeruginosa
, но несколько слабее, чем цефтазидим; - имеет двойной путь выведения: с желчью (в основном) и с мочой, поэтому при почечной недостаточности не требуется коррекции дозировки;
- хуже проникает через ГЭБ;
- имеет более длительный Т1/2 (2 ч).
Показания
- Тяжёлые инфекции ВДП (острый и хронический синусит — при необходимости парентерального лечения).
- Тяжёлые инфекции НДП (внебольничная и нозокомиальная пневмония).
- Тяжёлые внебольничные и нозокомиальные инфекции МВП.
- Интраабдоминальные и тазовые инфекции (в сочетании с антианаэробными препаратами).
- Тяжёлые инфекции кожи, мягких тканей, костей и суставов.
- Сепсис.
- Нейтропеническая лихорадка.
Предупреждения
Может вызывать гипопротромбинемию. Нельзя употреблять алкогольные напитки вследствие риска развития дисульфирамоподобного эффекта, который сохраняется в течение нескольких дней после отмены препарата.
Ввиду того, что цефоперазон недостаточно хорошо проникает через ГЭБ, его не следует применять при менингите.
Дозировка
Взрослые
Парентерально — 4-12 г/сут в 2-3 введения (при синегнойной инфекции вводится каждые 6-8 ч).
Дети
Парентерально — 50-100 мг/кг/сут в 2-3 введения.
Формы выпуска
Флаконы по 1,0 г и 2,0 г порошка для приготовления раствора для инъекций с приложением растворителя (вода для инъекций).
ЦЕФОПЕРАЗОН/СУЛЬБАКТАМ
Сульперазон
Представляет собой комбинацию цефоперазона с ингибитором β-лактамаз сульбактамом в соотношении 1:1, является единственным ингибиторозащищенным цефалоспорином.
По сравнению с цефоперазоном значительно более активен против микроорганизмов, образующих β-лактамазы — грамотрицательных бактерий семейства Enterobacteriaceae
, ацинетобактеров. В отличие от других цефалоспоринов хорошо действует на
B.fragilis
и другие неспорообразующие анаэробы, поэтому при инфекциях брюшной полости и малого таза может применяться в виде монотерапии. По активности в отношении синегнойной палочки соответствует цефоперазону.
По другим параметрам (фармакокинетика, нежелательные реакции) цефоперазон/сульбактам практически не отличается от цефоперазона.
Показания
- Тяжёлые внебольничные и нозокомиальные (в том числе синегнойные) инфекции:
- ВДП (острый и хронический синусит — при необходимости парентерального лечения);
- НДП (внебольничная и нозокомиальная пневмония, абсцесс легкого);
- ЖВП (острый холецистит, холангит);
- МВП (острый пиелонефрит);
- интраабдоминальные и тазовые;
- кожи, мягких тканей, костей и суставов.
Дозировка
Взрослые
Парентерально — 2,0-4,0 г/сут в 2-3 введения. В тяжелых случаях — до 8 г/сут.
Дети
Парентерально — 40-80 мг/кг/сут в 2-4 введения. В тяжелых случаях — до 160 мг/кг/сут.
Форма выпуска
Флаконы по 2,0 г порошка для приготовления раствора для инфузий.
ПЕРОРАЛЬНЫЕ ЦЕФАЛОСПОРИНЫ III ПОКОЛЕНИЯ
ЦЕФИКСИМ
Цефспан, Супракс
Спектр активности
По сравнению с пероральными цефалоспоринами II поколения более активен против грамотрицательной флоры — H.influenzae, M.catarrhalis, N.gonorrhoeae
и семейства
Enterobacteriaceae
. Действует на стрептококки, включая БГСА, однако активность против пневмококков и стафилококков ниже, чем у цефуроксима.
Фармакокинетика
Биодоступность при приеме внутрь составляет около 50%. Выводится преимущественно с мочой и частично с желчью. Т1/2 — 3-4 ч.
Показания
- Обострение хронического бронхита, вызванное H.influenzae
или
M.catarrhalis
. - Инфекции МВП, вызванные полирезистентной флорой.
- Шигеллез.
- Гонорея.
- Пероральный этап ступенчатой терапии после применения парентеральных цефалоспоринов III-IV поколения.
Дозировка
Взрослые
Внутрь — 0,4 г/сут в 1-2 приёма независимо от приёма пищи.
Дети старше 6 месяцев
Внутрь — 8 мг/кг/сут в 1-2 приёма независимо от приёма пищи.
Формы выпуска
Капсулы по 0,1 г, 0,2 г и 0,4 г; порошок для приготовления суспензии 100 мг/5 мл.
ЦЕФТИБУТЕН
Цедекс
Среди пероральных цефалоспоринов имеет наибольшую устойчивость к β-лактамазам, но разрушается БЛРС.
Спектр активности
По сравнению с пероральными цефалоспоринами II поколения более активен против грамотрицательной флоры — H.influenzae, M.catarrhalis
, семейства
Enterobacteriaceae
. На пневмококки и стафилококки действует слабее, чем цефуроксим.
Фармакокинетика
Биодоступность выше, чем у цефиксима (65%). Экскретируется преимущественно почками. Т1/2 — 2,5-3 ч.
Показания
- Обострение хронического бронхита, вызванное H.influenzae
или
M.catarrhalis
. - Инфекции МВП, вызванные полирезистентной флорой.
- Пероральный этап ступенчатой терапии после применения парентеральных цефалоспоринов III-IV поколения.
Дозировка
Взрослые
Внутрь — 0,4 г/сут в один прием независимо от приёма пищи.
Дети
Внутрь — 9 мг/кг/сут в 1-2 приёма независимо от приёма пищи.
Формы выпуска
Капсулы по 0,4 г; порошок для приготовления суспензии 180 мг/5 мл.
| Copyright © 2000-2007 ANTIBIOTIC.ru Размещено: 15.05.2004 |
Адрес этой страницы: https://www.antibiotic.ru/books/mach/mac0106.shtml
Дата последнего изменения: 24.05.2004 18:56
Распространенные представители
Из многочисленного списка цефалоспоринов наиболее часто применяющимися в настоящий момент являются представители 3 поколения, а именно цефтриаксон, цефтибутен, цефдиторен. Это объясняется широким спектром их действия и относительно невысокой стоимостью. Кроме того, последние два препарата выпускаются в пероральной форме, что очень удобно для приема пациентами.
Может создаться впечатление, что цефалоспорины, выпускаемые в таблетках, — редко используемые лекарства. Это не так: такие препараты применимы даже при тяжелых инфекциях различных органов, когда иные антибиотики не оказывают должного эффекта.
Целесообразно сравнить самых распространенных представителей по ряду важнейших критериев:
Скорость эффекта (время максимальной концентрации в крови):
| Цефтриаксон | Цефтибутен | Цефдиторен |
|
|
|
Микробный спектр действия:
| Цефтриаксон | Цефтибутен | Цефдиторен |
| ||
|
|
|
Устойчивые штаммы бактерий:
| Цефтриаксон | Цефтибутен | Цефдиторен |
|
|
|
Побочные эффекты:
| Цефтриаксон | Цефтибутен | Цефдиторен |
| Нервная система | ||
|
|
|
| Сердечно-сосудистая система, кроветворение | ||
|
|
|
| Желудочно-кишечный тракт | ||
| ||
| Мочеполовая система | ||
|
|
|
| Аллергические реакции | ||
|
|
|
Применение у беременных и кормящих пациенток:
| Цефтриаксон | Цефтибутен | Цефдиторен |
|
|
|
См. Как отличить коронавирус от ОРВИ, гриппа, простуды. Пневмония при коронавирусе: симптомы, лечение Нобазит при ковиде Ингавирин при коронавирусе Симптомы и лечение коронавируса
Стратегические подходы к выбору цефалоспориновых антибиотиков при инфекциях дыхательных путей
Проблема рациональной антибиотикотерапии остается одной из самых сложных в клинической практике. Если ранее врач в вопросе выбора лекарственного препарата ориентировался на его эффективность, переносимость и безопасность, то сегодня этого оказывается недостаточно. Фактор удобства приема препарата и, что особенно непривычно для нашего понимания, вопросы цены и стоимости лечения в условиях серьезного ограничения финансирования здравоохранения часто могут оказаться определяющими. На приобретение лекарственных средств лечебные учреждения тратят 15–20% своего бюджета, причем 50–60% этих расходов приходится на долю антибактериальных препаратов, что заставляет пересмотреть существующие и искать новые подходы к их применению.
Путаница, возникающая при использовании различных антибактериальных препаратов, в том числе и цефалоспориновых антибиотиков (ЦА), связана с недопониманием или просто незнанием основных принципов клинической химиотерапии. В связи с этим мы хотели бы остановиться на некоторых ошибках и «заблуждениях» практикующих врачей, возникающих при назначении антибактериальных препаратов, на примере ЦА, а также определить их место в лечении инфекции дыхательных путей.
Часто от практикующих врачей приходится слышать о безусловных преимуществах IV поколения препаратов перед III, III поколения перед II и т. д. Это абсолютно неверно. Такая точка зрения приводит к использованию «резервных» и мощных препаратов при лечении банальной инфекции, способствует развитию резистентности, а значит, лишает возможности применять препараты первых поколений и, наконец, вызывает значительное и неоправданное увеличение стоимости курса лечения.
ЦА занимают одно из важных мест в лечении инфекций верхних и нижних дыхательных путей. Наиболее ответственным этапом в антибактериальной терапии данной категории пациентов является выбор первоначального препарата. От адекватности выбора зависит эффективность и безопасность лечения, а также его комфортность, переносимость, стоимость, эпидемиологическая ситуация.
Анализ имеющихся данных об использовании ЦА в России за 1997–1998 гг. позволяет выявить предпочтения врачами того или иного препарата (группы препаратов) и определенных методов его введения. Как видно из рис. 1, при назначении цефалоспориновых антибиотиков подавляющее большинство врачей выбирают парентеральные препараты.
Данный факт лишь подтверждает, что в нашей стране пероральные лекарственные средства, и особенно пероральные цефалоспорины, очень мало популярны и практически не используются. Такое отношение к таблетированным формам отражает некоторый консерватизм практических врачей, связанный с тем, что еще 15-20 лет назад существовавшие тогда пероральные средства не выдерживали сравнения с парентеральными препаратами ни по эффективности терапии, ни по ее переносимости. Лишь последние десятилетия с момента создания первого перорального цефалоспорина — цефалексина и появления новых пероральных бактерицидных препаратов эта лекарственная форма несколько укрепила свои позиции не только в амбулаторной, но и в стационарной практике. Однако радикально на положении дел это не сказалось.
Очевидно, что такая форма назначения препаратов имеет безусловные преимущества. Это проявляется и в возможности амбулаторного ведения больного, и в удобстве приема препарата, и в снижении риска постинъекционных осложнений и длительности пребывания в стационаре, и даже в избавлении от психологического дискомфорта, связанного с инъекциями.
Наличие антибактериальных препаратов в двух формах — для парентерального и перорального применения — делает возможным их использование для проведения так называемой ступенчатой терапии. Суть такого лечения состоит в назначении внутривенного или внутримышечного препарата и в последующем, через двое-трое суток после достижения клинического эффекта, переводе на пероральный прием. Возможность проведения ступенчатой терапии одним и тем же препаратом является существенным преимуществом данного лекарственного средства перед его аналогами. Ступенчатая терапия предоставляет клинические и экономические преимущества как пациенту, так и лечебному учреждению.
На основании приведенных данных трудно понять логику выбора цефалоспоринового антибиотика того или иного поколения и принципы, которыми руководствуется врач при назначении препарата. Анализ использования цефалоспориновых антибиотиков по поколениям (см. рис. 2 и 3) свидетельствует о предпочтительном назначении препаратов I и III поколений, причем из препаратов III поколения (61%) половина приходится на цефотаксим, а из препаратов I поколения большая часть приходится на цефазолин.
В клинической практике врач начинает проводить антибактериальную терапию, в большинстве случаев не имея результатов микробиологической верификации инфекционного агента, а зачастую и без перспектив получения такого рода данных. Поэтому при выборе антибактериального препарата по-прежнему приходится ориентироваться на сведения, полученные из литературы, данные микробиологического мониторинга, а также на особенности клинической ситуации. Все это позволяет с большей или меньшей долей вероятности определить этиологический инфекционный агент с учетом клинической формы инфекции дыхательных путей (пневмония, хронический бронхит, синусит и т. д.), возраста (дети, старики), сопутствующих заболеваний (сахарный диабет, хроническая алкогольная интоксикация, лечение глюкокортикоидами и цитостатиками). Необходимо также иметь в виду особенности развития инфекции в амбулаторных условиях или в стационаре (лечение по поводу другого заболевания, пребывание в реанимации) при соответствующей эпидемиологической ситуации. Следует отметить, что при выборе препарата важно отличать «госпитальную», или нозокомиальную инфекцию, возникшую спустя двое суток после поступления в стационар, от «амбулаторной» инфекции, долечиваемой в стационаре. В последнем случае тактика антибактериальной терапии должна существенно отличаться.
Таким образом, ориентировочная этиология бронхолегочной инфекции служит основанием для выбора среди ЦА конкретного препарата (или поколения препаратов) с соответствующей антимикробной активностью.
У больных с амбулаторной инфекцией верхних и нижних дыхательных путей, основными возбудителями которых являются стрептококки, Н. influenzae, Moraxella catarrhalis, — препаратами выбора могут быть ЦА I или II поколения. В амбулаторных условиях предпочтение следует отдавать оральным цефалоспоринам (цефаклор, цефуроксим аксетил, цефтибутен). В то же время необходимо иметь в виду недостаточную активность ЦА в целом в отношении атипических бактерий (8–35% в этиологии «домашней» пневмонии) и некоторых анаэробных микроорганизмов, вероятность влияния которых увеличивается у больных с хроническими синуситами и отитами.
При обострениях хронического бронхита особое значение приобретают препараты, высокоустойчивые к действию b-лактамаз, продуцируемых как грамотрицательными, так и грамположительными микроорганизмами (цефуроксим аксетил), и обладающие высокой активностью против Н.influenzae (цефтибутен).
При выявлении показаний для госпитализации больных с «домашней» инфекцией, подразумевающих более тяжелое течение, чаще обнаруживаются Streptococcus pneumonia, Staphylococcus aureus, Н.influenzae и Еntеrobacteriacea. В этом случае более обосновано назначение парентеральных цефалоспоринов II поколения (цефуроксим, цефамандол). Однако именно в таких ситуациях чаще всего и допускаются ошибки: при госпитализации больного в стационар с «домашней» пневмонией нередко назначают бензилпенициллин, аминопенициллины и ЦА I поколения (малоэффективные ввиду высокой резистентности патогенной флоры), либо, для «перестраховки» и при наличии в стационаре, ЦА III поколения (цефотаксим, реже цефтриаксон). Однако более обосновано — и это определяется спектром активности препарата — назначение ЦА II. Среди больных, получающих терапию в стационаре по поводу инфекций нижних дыхательных путей, преобладают нетяжелые случаи. Поэтому идеология назначения ЦА II поколения в качестве «стартовых» препаратов должна доминировать как с позиции адекватной клинической эффективности, экономической целесообразности, так и с позиции сохранения резерва в более тяжелых ситуациях.
Выбор ЦА в качестве первоначального антибиотика при внебольничной пневмонии у больных моложе 60 лет без сопутствующей патологии следует считать, по-видимому, не всегда оправданным. Это обусловлено этиологически широким спектром пневмоний в данной ситуации, который может включать не только пневмококки и Н.influenzae, но и так называемые атипичные возбудители — Мусорlаzma pneumоniaе, Legionella, Chlamidia pneumоniaе, которые не чувствительны к цефалоспоринам всех генераций. Между тем рациональная эмпирическая антибактериальная терапия бронхолегочных инфекций, в том числе пневмоний, должна предусматривать выбор препарата, по возможности активного против всех вероятных в данной ситуации возбудителей. К сожалению, сегодня трудно назвать препарат, полностью удовлетворяющий этим требованиям, за исключением нового поколения фторхинолонов или «респираторных» фторхинолонов. Некоторые из них — например, грепафлоксацин — проходят сейчас в нашей стране регистрацию. В случаях назначения ЦА при данном варианте пневмоний предпочтение следует отдавать ЦА I и II поколения. Применение в подобных ситуациях ЦА III поколения нерационально ввиду высокого риска развития резистентности. Выбор конкретного препарата среди ЦА I–II поколения должен осуществляться исходя из преимущества лекарственных форм, фармакокинетических свойств, стоимости и др. При нетяжелых пневмониях возможно назначение оральных цефалоспоринов. При этом необходимо иметь в виду их различную противомикробную активность по отношению к различным микроорганизмам. Так, например, цефтибутен обладает наибольшей активностью в отношении Н.influenzae, а цефуроксим аксетил — в отношении S.аureus.
Общие принципы выбора первоначального ЦА сохраняются и у больных пневмонией на фоне тяжелых сопутствующих заболеваний (ХОЗЛ, сердечная недостаточность, сахарный диабет, алкогольная интоксикация и др.) и в возрасте старше 60 лет. Этиологическое значение в данной клинической ситуации приобретают Н.influenzae, S.аureus, некоторые грамотрицательные микроорганизмы (Е.соli, Сlebsiella), возрастает частота бета-лактамазопродуцирующих бактерий. В связи с этим возрастает значение препаратов, активных в отношении названных возбудителей. Известно, что противомикробное действие ЦА при переходе активности от первого поколения к последующим характеризуется снижением противостафилококковой активности и преобладанием активности против некоторых грамотрицательных микроорганизмов. Ценным свойством является устойчивость ЦА II поколения к b-лактамазам. В связи с этим врач должен ориентиро-ваться в данной ситуации на цефалоспорины II или по крайней мере III поколения.
Иной подход, определяющий выбор ЦА для лечения бронхолегочной инфекции, наблюдается у больных с «госпитальной» инфекцией. Госпитальные пневмонии занимают особое место среди всех внутрибольничных инфекций из-за тяжести течения и трудностей терапии. Основными возбудителями госпитальных пневмоний являются грамотрицательные микроорганизмы семейства Еntеrobacteriacea — Сlebsiella, Protei, Enterobacter, Providencia, Serracia, а также Staphylococcus аureus, как чувствительный, так и устойчивый к метициллину. Вероятность этиологической роли того или иного инфекционного агента при госпитальных пневмониях определяется особенностями клинической ситуации (послеоперационный период, пребывание в реанимации, искусственная вентиляция легких и т. д.). У больных реанимационных и ожоговых отделений, с иммунодефицитами и муковисцидозом основным микроорганизмом бактериальных осложнений является синегнойная палочка, выявляемая в 70–95% случаев. Наряду с ней у таких больных высевается золотистый стафилококк или гемофильная палочка, устойчивая к ЦА II–III поколения. Основное место в лечении госпитальных пневмоний среди ЦА занимают препараты III (цефтазидим, цефоперазон) и IV поколений (цефпиром, цефепим). С учетом вероятности этиологической роли Pseudomonas aeruginoza в соответствующих ситуациях (ИВЛ, наличие трахеостомы, предшествующая глюкокортикоидная терапия) назначаемые ЦА должны обладать антисинегнойной активностью. Среди имеющихся в распоряжении врача ЦА наибольшей активностью в отношении Pseudomonas aeruginoza обладают цефалоспорины III поколения (цефтазидим, цефоперазон) и IV поколения (цефпиром), которые, однако, не имеют серьезных преимуществ в отношении синегнойной палочки перед цефтазидимом. Появление в терапевтическом арсенале ЦА IV поколения расширяет возможности антибактериальной терапии госпитальных пневмоний с высокой вероятностью грамотрицательной флоры, в том числе золотистого стафилококка, и могут рассматриваться как препараты ургентных ситуаций.
| Цефалоспорины, открытые более 50 лет тому назад, продолжают занимать прочные позиции в лечении различных бактериальных заболеваний, несмотря на появление новых антимикробных средств. Цефалоспориновые антибиотики подразделяются на четыре поколения, отличающиеся по спектру действия, антибактериальной активности, стабильности в присутствии b-лактамаз, фармакокинетическому профилю. Все это наряду с многообразием лекарственных форм и стоимостью определяет их различные показания. Очевидно, что по мере появления новых поколений цефалоспориновых антибиотиков в клинической практике возникает немаловажная проблема дифференцированного назначения препарата с учетом свойств как самого антибиотика, так и особенностей инфекционно- воспалительного процесса у конкретного больного |
Таким образом, рациональный выбор первоначального ЦА для лечения инфекций верхних и нижних дыхательных путей определяется в первую очередь вероятностью этиологической роли того или иного микроорганизма в конкретной клинической ситуации. Такой подход требует от практического врача (а именно от него зависит адекватный выбор препарата) умения выявлять особенности каждого случая пневмонии (эпидемиологическую обстановку, фоновую патологию, факторы риска и др.) и ориентировки в антимикробном спектре назначаемого антибиотика. Однако в клинической практике при выборе ЦА, как, впрочем, и других антибиотиков, приходится наряду с ориентировочной этиологией бронхолегочной инфекции учитывать и другие факторы. Среди последних имеет значение фармакокинетика препарата, наличие разнообразных лекарственных форм, риск развития побочных эффектов, стоимость и др.
В настоящее время не окончательно определено место пероральных препаратов III поколения в клинической практике, так как их сравнительная клиническая и бактериологическая эффективность мало отличается от препаратов II поколения. Более того, как было сказано выше, преимущество цефалоспоринов III поколения состоит в их высокой активности в отношении b-лактамазопродуцирующих бактерий, наиболее часто вызывающих серьезные стационарные инфекции. Но поскольку в этом случае больные находятся в стационаре, то уже более обоснованно получают парентеральную терапию. В то же время ввиду сниженной активности в отношении грамположительных бактерий, часто являющихся причиной именно амбулаторной инфекции, назначение препаратов III поколения имеет меньше преимуществ перед препаратами II поколения.
Цель антибактериальной терапии состоит не только в достижении клинического эффекта, но и в полной эрадикации возбудителя, т. е. бактериологической эффективности. Это в основном определяется адекватным дозированием препарата для достижения необходимой концентрации в очаге инфекции. Высокая степень накопления препарата в тканях является необходимым требованием к лекарственному веществу.
ЦА первого поколения хуже проникают в ткани, что уменьшает степень бактериальной эрадикации.
Данные о биодоступности оральных ЦА следует иметь в виду при дифференцированном назначении их больным с сопутствующей патологией кишечника, связанной с нарушением всасывания, а также при одновременном приеме антисекреторных препаратов, антацидов, с учетом влияния пищи на всасывание ЦА.
Знание путей элиминации ЦА наряду с оценкой функционального состояния печени и почек (возраст, сопутствующая патология) также может определять выбор более адекватного для данной ситуации препарата. Выбирая ЦА для лечения тяжелых госпитальных пневмоний, например, у новорожденных и стариков или у больных с патологией почек, при наличии почечной недостаточности предпочтение следует отдать цефоперазону с учетом его преимущественно билиарной экскреции.
При дифференцированном выборе ЦА необходимо учитывать риск развития побочных эффектов. Наиболее типичны реакции гиперчувствительности (лихорадка, кожная сыпь), гематологические синдромы (цитопения, эозинофилия), нарушения со стороны желудочно-кишечного тракта (тошнота, рвота, диарея), печени (повышение активности трансаминаз), почек (повышение уровня креатинина), ЦНС (головная боль), флебиты при внутривенном введении. Поэтому анамнестические и клинико-лабораторные данные о наличии у больных какой-либо патологии должны влиять на выбор соответствующего препарата.
Флебиты часто возникают при введении цефалотина, цефотаксима, цефепима. Цефуроксим, цефоперазон, цефтибутен могут вызывать анемию (чаще гемолитическую), а при назначении цефалотина, цефамандола, цефотаксима, цефтазидима иногда выявляются фиксированные на эритроцитах антитела. Повышение активности печеночных ферментов возможно на фоне лечения цефоперазоном, цефтриаксоном, цефтазидимом, цефуроксимом. Уровень креатинина может повышаться при лечении цефалексином и цефподоксимом. Оральные цефалоспорины чаще всего вызывают нарушения со стороны желудочно-кишечного тракта (тошнота, рвота, диарея). При лечении парентеральными ЦА отмечено увеличение протромбинового времени, за исключением цефтазидима, не влияющего на синтез факторов протромбинового комплекса и показатели свертываемости крови. Возможны реакции гиперчувствительности (кожная сыпь, лихорадка, эозинофилия) на фоне применения почти всех ЦА III поколения.
Таким образом, дифференцированный выбор ЦА для лечения инфекций верхних и нижних дыхательных путей должен базироваться на учете и адекватной оценке многих факторов, включающих как особенности клинической ситуации, так и антимикробную активность и фармакокинетические характеристики назначаемого препарата.
Классификация цефалоспоринов
В ряд цефалоспоринов входят лекарственные препараты пяти поколений. Разделение их на группы происходило постепенно, параллельно открытию новых веществ и их свойств. Внутри каждого поколения выделяют пероральные (принимаемые «через рот») и парентеральные (поступающие в организм через инъекции) формы.
1 поколение:
| Представители | Торговое название | Способ применения, цена |
| Цефазолин (парентеральный) | Цефазолин | Порошок для изготовления инъекционного раствора: 0,5 гр. (разведя в 2 мл стерильной воды) – 2,0 гр. (разведя в 4 мл стерильной воды) в сутки в 3-4 приема, вводить внутривенно. 20-910 руб. |
| Цефазолин-АКОС | Порошок для изготовления инъекционного раствора: по 0,5 гр. х 2 раза в день внутривенно (разведя в 5 мл стерильной воды) или внутримышечно (разведя в 2 мл стерильной воды).30-50 руб. | |
| Цефалотин (парентеральный) | Цефалотин | Порошок для изготовления инъекционного раствора: 0,5-1,0 гр. каждые 6 часов внутривенно или внутримышечно. 800-1000 руб. |
| Цефалексин (парентеральный, пероральный) | Цефалексин | Капсулы: 0,25-0,5 гр. каждые 6 часов, запивая водой, за 30-60 минут до приема пищи. 80-120 руб. |
| Гранулы для приготовления суспензии внутрь во флаконе: добавить 80 мл дистиллированной воды, встряхнуть, полученную смесь пить в соответствии с мерной ложкой (флакон содержит 0,25 гр. вещества). 1,0-2,0 гр. в сутки, при этом в 1 мл готовой смеси находится 25 мг цефалексина. 80-100 руб. | ||
| Экоцефрон | Капсулы: 0,25-0,5 гр. каждые 6 часов, запивая водой, за 30-60 минут до приема пищи. 80-100 руб. | |
| Цефадроксил (пероральный) | Дурацеф | Капсулы, таблетки, гранулы для суспензии – исключены из реестра применяемых лекарств в РФ. |
| Биодроксил |
2 поколение:
| Представители | Торговое название | Способ применения, цена |
| Цефуроксим (парентеральный, пероральный) | Зинацеф | Порошок для изготовления инъекционного раствора: 0,75-1,5 гр. внутривенно х 3 раза в день. 130-250 руб. |
| Зиннат | Капсулы: по 0,25-0,5 х 2 раза в день после еды. 220-400 руб. | |
| Гранулы для приготовления суспензии внутрь во флаконе: 0,125-0,25 гр. в сутки во время приема пищи. 250-330 руб. | ||
| Аксосеф | Таблетки: 0,25-0,5 гр. х 2 раза в день. 400-600 руб. | |
| Порошок для изготовления инъекционного раствора: 0,75-1,5 гр. внутривенно х 3 раза в день. Максимально 6,0 гр. в сутки. 120-250 руб. | ||
| Цефамандол (парентеральный) | Цефат | Порошок для изготовления инъекционного раствора: 0,5-1,0 гр. каждые 6 часов внутримышечно (растворив в 3 мл стерильной воды) или внутривенно (растворив в 10 мл изотонического хлорида натрия). 120-360 руб. |
| Цефаклор (пероральный) | Цеклор | Капсулы, таблетки, гранулы для суспензии – исключены из реестра применяемых лекарств в РФ. |
| Цефаклор Штада | ||
| Альфацет |
3 поколение:
| Представители | Торговое название | Способ применения, цена |
| Цефотаксим (парентеральный) | Клафоран | Порошок для изготовления инъекционного раствора: 0,5-2,0 гр. (в зависимости от инфекции) х 1 раз в сутки внутримышечно (прежде растворив 1,0 гр. – в 4 мл, 2,0 гр. – в 10 мл стерильной воды) или внутривенно (прежде растворив в 40-100 мл стерильной воды) медленно. 130-150 руб. |
| Цефосин | Порошок для изготовления инъекционного раствора: 1,0 гр. каждые 8-12 часов внутримышечно (растворив 1,0 гр. в 4 мл стерильной воды), внутривенно медленно (прежде растворив 1,0 гр. – в 4 мл, 2,0 гр. – в 10 мл стерильной воды) или капельно (50-100 мл изотонического раствора хлорида натрия на 1,0-2,0 гр. вещества). 50-70 руб. | |
| Цефтазидим (парентеральный) | Фортум | Порошок для изготовления инъекционного раствора: 1,0-6,0 гр. х 1 раз в сутки в 2-3 внутривенные или внутримышечные инфузии. 450-520 руб. |
| Цефтидин | Порошок для изготовления инъекционного раствора: 1,0-6,0 гр. х 1 раз в день (обычно по 1,0 гр. каждые 8 часов) внутривенно или внутримышечно. 150-200 руб. | |
| Цефтриаксон (парентеральный) | Цефтриаксон | Порошок для изготовления инъекционного раствора: 1,0-2,0 гр. х 1 раз в день внутримышечно/внутривенно. 30-900 руб. |
| Азаран | Порошок для изготовления инъекционного раствора: 1,0 гр. растворить в 3,5 мл 1% раствора лидокаина гидрохлорида, применять 1 раз в день внутримышечно. 2300-2700 руб. | |
| Цефоперазон (парентеральный) | Цефобид | Порошок для изготовления инъекционного раствора: 2,0-4,0 гр. в сутки внутримышечно, разделив общую суточную дозу на 2 приема. 250-300 руб. |
| Цефпар | Порошок для изготовления инъекционного раствора: 2,0-4,0 гр. в сутки внутривенно или внутримышечно, дозу разделить на прием равными частями каждые 12 часов. 30-100 руб. | |
| Цефиксим (капсулы, суспезия) | Супракс | Капсулы: 0,4 гр. одиножды в сутки. 700-780 руб. |
| Панцеф | Таблетки: 0,4 гр. х 1 раз в день или 0,2 гр. х 2 раза в день. 380-590 руб. | |
| Гранулы для приготовления суспензии внутрь во флаконе: флакон хорошо встряхнуть, добивать 66 мл кипяченой воды комнатной температуры, еще раз встряхнуть, принимать по 0,4 гр. х 1 раз в день или 0,2 гр. х 2 раза в день (используя мерный колпачок). 390-700 руб. | ||
| Супракс Солютаб | Шипучие таблетки: 0,4 гр. х 1 раз в день или 0,2 гр. х 2 раза в день, растворив в стакане с водой. 800-1000 руб. | |
| Цефтибутен (капсулы) | Цедекс | Капсулы: 0,4 гр. х 1 раз в сутки. 800-1100 руб. |
| Цефдиторен (в таблетках) | Спектрацеф | Таблетки: 0,2/0,4 гр. дважды в день. 1300-1400 руб. |
4 поколение:
| Представители | Торговое название | Способ применения, цена |
| Цефепим (парентеральный) | Максипим | Порошок для изготовления инъекционного раствора: 0,5-2,0 гр. каждые 12 часов, вводить внутривенно медленно (развести 5/10 мл стерильной воды) или внутримышечно (развести в 1,3/2, мл стерильной воды). 350-400 руб. |
| Цефепим | Порошок для изготовления инъекционного раствора: 0,5-1,0 гр. каждые 12 часов, введение внутривенное или внутримышечное (объемы разведения аналогичны). 120-150 руб. | |
| Цефпиром (парентеральный) | Цефанорм | Порошок для изготовления инъекционного раствора: 1,0-2,0 гр. внутривенно каждые 12 часов. 1300-1500 руб. |
| Изодепом | Порошок для изготовления инъекционного раствора: 0,25/0,5/1,0/2,0 гр., разделив введение пополам на каждые 12 часов. Вводить внутривенно медленно/капельно или внутримышечно (разводить дозу в 25/50/100/200 мл стерильной воды или изотонического раствора хлорида натрия соответственно). 600-900 руб. |
5 поколение:
| Представители | Торговое название | Способ применения, цена |
| Цефтобипрол (парентеральный) | Зефтера | Лиофилизат для изготовления инъекционного раствора – исключен из реестра применяемых лекарств в РФ. |
| Цефтаролин (парентеральный) | Зинфоро | Порошок для изготовления инъекционного раствора: по 0,6 гр. каждые 12 часов в виде внутривенной инфузии в течение 60 минут (после добавления в порошок 20 мл стерильной воды, полученную смесь встряхнуть и перенести во флакон, куда добавить 50/100/250 мл изотонического раствора хлорида натрия). 25000-27000 руб. |
Специально для защиты от разрушительного действия ферментов бактерий β-лактамаз создана комбинация цефоперазон + сульбактам в парентеральных препаратах:
- Сульперазон (порошок для изготовления инъекционного раствора: 1,0-2,0 гр. цефоперазона + 1,0-2,0 гр. сульбактама в соотношении 1:1, поделив дозу на 2 приема, вводить внутривенно, внутримышечно). 480-550 руб.
- Сульперацеф (порошок для изготовления инъекционного раствора: 0,5-1,0 гр. цефоперазона + 0,5-1,0 гр. сульбактама в отношении 1:1, вводить внутримышечно или внутривенно каждые 12 часов). 2400-3000 руб.
Все препараты из списка цефалоспоринов абсолютно запрещены к употреблению совместно с алкогольными напитками любой крепости. В обратном случае развивается антабусный эффект – острое смертельно опасное токсическое воздействие на организм в виде расстройств дыхания, сердечной деятельности и бронхоспазма.
Место пероральных цефалоспоринов третьего поколения в терапии острого пиелонефрита у женщин и детей
Обсуждается роль пероральных цефалоспоринов третьего поколения в терапии инфекций верхних мочевых путей у женщин (беременных и небеременных) и детей. Представлены данные по чувствительности современных возбудителей неосложненных амбулаторных пиелонефритов в данных группах пациентов. Рассмотрены схемы антибиотикотерапии острых неосложненных пиелонефритов, предлагаемые клиническими рекомендациями Европейской ассоциации урологов 2014 г. Определено место пероральных цефалоспоринов третьего поколения при пиелонефритах различной степени тяжести.
Инфекции мочевых путей являются одними из наиболее распространенных инфекционных заболеваний как в амбулаторной, так и в госпитальной практике [1]. Острый пиелонефрит, или так называемая острая инфекция верхних мочевых путей, представляет собой серьезное инфекционно-воспалительное заболевание. Как известно, основным риском данного состояния является высокая вероятность развития тяжелого сепсиса, летальность при котором достигает 30–50%. Ключевыми составляющими успеха лечения больных острым пиелонефритом являются:
- своевременная и точная установка диагноза, определение тяжести процесса;
- раннее выявление и по возможности устранение факторов, осложняющих течение инфекционно-воспалительного процесса в почке и/или снижающих эффективность антибиотикотерапии;
- собственно рациональная антибиотикотерапия.
Кратко охарактеризуем принципы диагностики пиелонефрита, поскольку именно корректная и своевременная диагностика во многом обусловливает эффективность терапии. В соответствии с современными клиническими рекомендациями Европейской ассоциации урологов [2] помимо оценки клинических проявлений заболевания, которые общеизвестны, обязательными диагностическими тестами при подозрении на острый пиелонефрит являются:
- общий анализ крови;
- общий анализ и посев средней порции мочи;
- ультразвуковое исследование почек с целью исключения ряда осложняющих факторов (дилатация верхних мочевых путей, камни, абсцессы и т.д.).
Трудно переоценить роль бактериологического исследования (посева) мочи при остром пиелонефрите, поскольку этот метод позволяет не только подтвердить наличие мочевой инфекции, но и своевременно скорректировать антибиотикотерапию в случае, если эмпирически назначенный препарат оказался неэффективным. В соответствии с клиническими рекомендациями Европейской ассоциации урологов посев мочи также необходимо повторять у всех больных на 5–10-е сутки терапии пиелонефрита. При подозрении на сепсис необходимыми исследованиями являются определение уровня прокальцитонина сыворотки крови и бактериологическое исследование крови.
Более подробно рассмотрим принципы антибиотикотерапии неосложненного пиелонефрита у женщин детородного возраста (небеременных и беременных) и инфекций верхних мочевых путей у детей. Отметим, что названные категории пациентов составляют подавляющее большинство среди больных, страдающих инфекциями верхних мочевых путей. Именно у этих пациентов использование пероральных цефалоспоринов третьего поколения представляется наиболее целесообразным.
Столь широкое применение пероральных цефалоспоринов у пациентов с неосложненными пиелонефритами обусловлено следующими свойствами рассматриваемых препаратов:
- высокая природная чувствительность основных уропатогенов – энтеробактерий (в первую очередь кишечной палочки);
- способность препаратов достигать высоких концентраций в моче и паренхиме почек;
- благоприятная фармакокинетика, позволяющая сохранять высокую эффективность при приеме один раз в сутки (что в свою очередь обеспечивает хорошую комплаентность терапии);
- низкая токсичность и хорошая переносимость, позволяющие применять их во время беременности, лактации и в детском возрасте.
Очевидно, что эффективность эмпирической антибиотикотерапии пиелонефрита напрямую зависит от превалирующих уропатогенов и профиля их резистентности в отдельно взятом регионе. Именно поэтому так важно регулярно обновлять данные об особенностях чувствительности возбудителей инфекций мочевых путей и каждый раз пересматривать рекомендуемые препараты. В соответствии с современными клиническими рекомендациями Европейской ассоциации урологов эмпирический прием антибактериального препарата нецелесообразен при резистентности к нему в популяции более 10–20% штаммов микроорганизмов.
Учитывая вышесказанное, особый интерес представляют результаты исследования ДАРМИС, в ходе которого были изучены характеристики почти тысячи возбудителей как неосложненных, так и осложненных инфекций мочевых путей у взрослых пациентов из 20 регионов России [3]. При амбулаторных (негоспитальных) неосложненных инфекциях мочевых путей у женщин основной уропатоген (кишечная палочка) демонстрировал наиболее высокую чувствительность к фосфомицину (98,6%), нитрофурантоину (98,6%), а также двум пероральным цефалоспоринам – цефтибутену (97,9%) и цефиксиму (95,9%). Среди всех представителей семейства Enterobacteriaceae
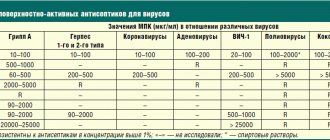
наиболее высокая чувствительность была отмечена к цефтибутену (95,9%), фосфомицину (95,7%), цефиксиму (93,5%) и фуразидину (90,5%). Подчеркнем, что ни фосфомицин, ни нитрофурантоин, ни фуразидин не могут применяться для лечения пиелонефритов, поскольку не способны достигать высоких концентраций в почечной ткани. Интересно, что и ранее, в исследовании С.В. Яковлева 2006 г. [4], устойчивость амбулаторных возбудителей инфекций мочевых путей к цефалоспоринам третьего поколения не превышала 10%, а значит, за прошедшие пять лет резистентность к этой группе антибиотиков среди амбулаторных уропатогенов не выросла.
В исследовании S. Mårild и соавт. 2009 г. [5] у детей с острым неосложненным пиелонефритом все 368 (100%) выделенных штаммов Escherichia coli
оказались чувствительны к пероральному цефалоспорину цефтибутену.
Таким образом, в настоящее время уровни резистентности возбудителей острого неосложненного пиелонефрита к цефалоспоринам третьего поколения как у взрослых, так и у детей остаются невысокими (не превышают 10%), что позволяет рассматривать их в качестве одного из оптимальных вариантов для эмпирической терапии.
Для небеременных женщин репродуктивного возраста в клинических рекомендациях Европейской ассоциации урологов указаны следующие схемы антибиотикотерапии острого неосложненного пиелонефрита легкой и средней тяжести:
- цефтибутен peros
по 400 мг один раз в сутки в течение 10 дней; - левофлоксацин per os по 500 мг один раз в сутки в течение 7–10 дней;
- левофлоксацин per os
по 750 мг один раз в сутки в течение 5 дней; - ципрофлоксацин per os
500–750 мг два раза в сутки в течение 7–10 дней; - амоксициллина клавуланат per os
500/125 мг три раза в сутки в течение 14 дней (только при грамположительном уропатогене).
Выбор той или иной схемы должен быть обусловлен низким уровнем устойчивости локальных уропатогенов. Этому принципу, как мы убедились выше, полностью соответствуют пероральные цефалоспорины, в частности цефтибутен. Лечение этих пациенток в подавляющем большинстве случаев проводится амбулаторно.
При тяжелом течении (с высокой лихорадкой, выраженными системными проявлениями) острых неосложненных пиелонефритов у небеременных лечение начинается парентеральными препаратами в условиях стационара. В данном случае в качестве препаратов выбора могут рассматриваться цефалоспорины третьего поколения в парентеральной форме. Пероральные цефалоспорины у данной категории больных могут применяться в ступенчатой терапии, то есть при продолжении курса антибиотикотерапии в амбулаторных условиях после улучшения состояния пациенток и выписки их из стационара.
У беременных, как известно, спектр антибиотиков, разрешенных к использованию, значительно сужен, и цефалоспорины представляются оптимальными препаратами при многих бактериальных инфекциях, в том числе пиелонефритах. Несмотря на то что ни одна мочевая инфекция во время беременности не может расцениваться как неосложненная, клинические рекомендации Европейской ассоциации урологов допускают амбулаторное лечение соответствующим антибиотиком (например, пероральным цефалоспорином третьего поколения цефтибутеном) при условии легкой степени выраженности симптомов и тщательном наблюдении. Схема приема цефтибутена беременными, страдающими острым неосложненным пиелонефритом, аналогична таковой у небеременных. Кроме цефалоспоринов третьего поколения, все препараты, рекомендуемые Европейской ассоциацией урологов беременным с пиелонефритами, подразумевают парентеральное (и соответственно стационарное) применение.
У детей продолжительность и алгоритм лечения пиелонефрита напрямую зависят от тяжести мочевой инфекции. Так, при простой мочевой инфекции (не очень высокая температура, ребенок хорошо пьет, достаточная комплаентность терапии) Европейская ассоциация урологов предлагает следующие схемы антибиотикотерапии (продолжительность лечения составляет 5–7 дней):
- цефалоспорин третьего поколения per os
: цефтибутен 9 мг/кг один раз в день, цефиксим 8 мг/кг два раза в день; - амоксициллин per os
50–100 мг/кг/сут в два-три приема; - амоксициллина клавуланат per os
37,5–75 мг/кг/сут в три приема.
Клиническая эффективность лечения пиелонефрита у детей пероральными цефалоспоринами высока. Так, в соответствии с данными S. Mårild и соавт. [5], при лечении цефтибутеном в стандартной дозировке в течение 10 дней она составляет 93%.
При тяжелой мочевой инфекции у детей (лихорадка 39 °С и выше, рвота, выраженная дегидратация и плохая комплаентность) Европейская ассоциация урологов рекомендует следующие режимы первичной эмпирической антибиотикотерапии (курс лечения 10–14 дней):
- цефтриаксон в/в 50–100 мг/кг/сут в одно введение до исчезновения лихорадки, затем цефалоспорин третьего поколения per os
(например, цефтибутен 9 мг/кг/сут в один прием); - амоксициллина клавуланат в/в 60–100 мг/кг/сут в три введения до исчезновения лихорадки, затем per os
37,5–75 мг/кг/сут в три приема.
Из приведенных схем видно, что у детей с тяжелыми мочевыми инфекциями также представляется оптимальной ступенчатая терапия: переход от парентеральной к пероральной терапии препаратом той же фармакологической группы.
Несмотря на длительную историю применения, цефалоспорины третьего поколения сохраняют высокую эффективность в отношении возбудителей негоспитальных неосложненных пиелонефритов у женщин (беременных и небеременных) и детей. Пероральные цефалоспорины, в частности цефтибутен, применяются не только при лечении амбулаторных пиелонефритов, но и в ступенчатой терапии тяжелых инфекций верхних мочевых путей, обладают высокой клинической эффективностью и хорошей переносимостью.
Применение в детском возрасте
Антибиотики группы цефалоспоринов в своем большинстве не противопоказаны к применению у пациентов детского возраста. Средние суточные дозировки для детей составляют:
| Цефалоспорин | Доза |
| Цефазолин |
|
| Цефалотин | 0,02-0,04 гр/кг в сутки, разделив введение на каждые 6 часов. |
| Цефалексин |
|
| Цефуроксим |
|
| Цефамандол |
|
| Цефотаксим |
|
| Цефтазидим |
|
| Цефтриаксон |
|
| Цефоперазон | 0,05-0,2 гр/кг в сутки (вводить за 2 раза). |
| Цефиксим |
|
| Цефтибутен |
|
| Цефдиторен |
|
| Цефепим |
|
| Цефпиром |
|
| Цефтаролин | Нет полноценной информации о безопасности и эффективности препарата у детей до 18 лет. |
Цефалоспорины всех поколений не теряют актуальности на современном этапе развития медицины. Благодаря большому спектру действия этих препаратов представляется возможным излечение от широкого круга инфекционных заболеваний. К сожалению, микроорганизмы постоянно изменяют свою структуру, пытаясь стать невосприимчивыми к губительному действию антибиотиков. Во избежание этого не принимайте антибактериальные препараты без назначения врача.
Автор:
Селезнева Валентина Анатольевна врач-терапевт
КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ЦЕФАЛОСПОРИНОВ IV ПОКОЛЕНИЯ
Цефалоспориновые антибиотики в настоящее время занимают ведущее место при лечении инфекций в стационаре различной локализации, являясь средствами выбора при многих инфекциях. В то же время ограничением применения цефалоспоринов является развитие резистентных к ним штаммов. Статья посвящена появившемся в последние годы новым высокоэффективным цефалоспориновым антибиотикам, химической особенностью молекулы которых является наличие одновременно отрицательного и положительного зарядов. Эта биполярная структура характерна для цефалоспоринов IV поколения, среди которых наиболее важными и изученными являются цефепим и цефпиром.
Today cephalosporin antibiotics occupy a prominent place in the inpatient treatment of infections at different sites, which are the drugs of choice in many infections. At the same time the limited use of cephalosporins is the development of their resistant strains. The paper deals with novel highly effective cephalosporin antibiotics which have recently come into use. The chemical feature of their molecule is the simultaneous presence of negative and positive charges. This bipolar structure is typical of fourth generation cephalosporins among which cefepime and cefpirome are most important and well studied.
С.В. Яковлев — Московская медицинская академия им. И.М. Сеченова S.V. Yakovlev — I.M. Sechenov Moscow Medical Academy
Н
есмотря на большие успехи в области антимикробной химиотерапии, достигнутые в последние годы, частота тяжелых госпитальных инфекций остается высокой, и они во многих случаях являются причиной смерти больных. Особую сложность лечения представляют инфекции в отделениях интенсивной терапии и у больных с нейтропенией. Трудности лечения госпитальных инфекций связаны с особенностями возбудителей инфекции, нередко обладающих резистентностью ко многим антибактериальным препаратам. К таким «проблемным» микроорганизмам относятся прежде всего Staphylococcus aureus и коагулазонегативные стафилококки (в основном Staphylococcus epidermidis), в том числе штаммы, резистентные к метициллину, множественно резистентные энтерококки (Enterococcus faecalis и E. faecium), а также пенициллинрезистентные пневмококки (Streptococcus pneumoniae). Среди грамотрицательных микроорганизмов следует выделить синегнойную палочку (Pseudomonas aeruginosa) и другие псевдомонады (Pseudomonas spp.), группу энтеробактерий — Enterobacter cloacae, Klebsiella pneumoniae, Serratia spp., продуцирующих b-лактамазы расширенного спектра и резистентных к цефалоспоринам III поколения, Stenotrophomonas maltophilia, вызывающая гидролиз большинства b-лактамных антибиотиков, в том числе карбапенемов. Эти микроорганизмы являются частыми возбудителями госпитальных инфекций различной локализации (пневмония, перитонит, раневая инфекция, сепсис). Поиск новых антибактериальных средств с расширенным спектром действия для лечения больных с тяжелыми инфекциями является актуальной задачей современной химиотерапии.
Таблица 1. Сравнительная активность in vitro цефалоспориновых антибиотиков (схематично) [2, в модификации]
| Поколения цефалоспоринов | Активность в отношении | Стабильность к b-лактамазам | ||
| Грамположительных бактерий | Грамотрицательных бактерий | Грамположительных бактерий | Грамотрицательных бактерий | |
| Первое | +++ | +/- | + | — |
| Второе | ++ | + | + | +/- |
| Третье | + | +++ | +/- | + |
| Четвертое | ++ | +++ | + | ++ |
Цефалоспориновые антибиотики в настоящее время занимают ведущее место при лечении инфекций в стационаре различной локализации. Широкий спектр антибактериальной активности, хорошие фармакокинетические характеристики, низкая токсичность, хорошая сочетаемость с другими антибактериальными средствами делают цефалоспорины средствами выбора при многих инфекциях. В то же время ограничением применения цефалоспоринов является развитие резистентных к ним штаммов микроорганизмов в результате продукции бактериями b-лактамаз. Особенно эта проблема стала актуальна в последние годы из-за широкого применения цефалоспоринов, иногда неоправданного и часто бесконтрольного. Рис. Химическая структура цефепима и цефпирома
Группа цефалоспориновых антибиотиков насчитывает более 50 препаратов, которые принято разделять на поколения. Сравнительная антимикробная активность цефалоспоринов представлена в табл. 1. В последние годы появились новые высокоэффективные цефалоспориновые антибиотики, химической особенностью молекулы которых является наличие одновременно отрицательного и положительного зарядов. Эта биполярная структура характерна для цефалоспоринов IV поколения (рис. 1), среди которых наиболее важными и изученными являются цефепим и цефпиром. Цефемовое ядро антибиотиков несет отрицательный заряд. Четвертичный азот циклопентопиридиновой группы несет положительный заряд и придает молекуле структуру цвиттериона. Таблица 2. Спектр антимикробной активности цефалоспоринов IV поколения
| Обычно чувствительные (МПК < 4 мг/л) Escherichia coli Salmonella spp. Shigella spp. Proteus spp. Providencia spp. Klebsiella spp. Citrobacter spp. Enterobacter aerogenes Serratia spp. Neisseria spp. Moraxella catarrhalis Haemophilus influenzae Streptococcus pneumoniae Streptococcus spp. Staphylococcus spp. MS Peptostreptococcus spp. Clostridium perfringens Propionbacterium spp. Lactobacillus spp. | Умеренно чувствительные (МПК 4-32 мг/л) |
| Pseudomonas aeruginosa Pseudomonas spp. Acinetobacter spp. Enterobacter cloacae Enterococcus faecalis Yersinia spp. | |
| Резистентные (МПК > 32 мг/л) Pseudomonas cepacia Stenotrophomonas maltophilia Staphylococcus spp. MR Enterococcus faecium Clostridium difficile Bacteroides spp. Listeria |
Особенности химической структуры цефалоспоринов IV поколения придают им ряд свойств [3, 4]. Биполярная структура цефпирома и цефепима обеспечивают быстрое проникновение молекулы через наружную мембрану грамотрицательных бактерий; положительный заряд служит проводником молекулы для нахождения благоприятной позиции в пориновом канале бактериальной клетки. Аминотиазолин-метокси-имино группа, прикрепленная в 7 положении цефемового ядра, оказывает более выраженное действие на грамотрицательные микробы и придает устойчивость к b-лактамазам. Проникая в микробную клетку, цефалоспорины IV поколения достигают высоких концентраций в периплазматическом пространстве и связываются с пенициллинсвязывающими белками (преимущественно 3 типа), к которым имеют большое сродство. Эти свойства цефалоспоринов IV поколения (быстрое проникновение через наружную мембрану бактерий, низкое сродство к b-лактамазам и эффективное связывание с пенициллинсвязывающими белками) обеспечивают их активность в отношении грамотрицательных бактерий, в том числе штаммов, резистентных к цефалоспоринам III поколения.
Таблица 3. Антимикробная активность in vitro цефалоспоринов IV поколения [4-9]
| Микроорганизмы | Препараты | МПК, мг/л | % чувствительных штаммов | ||
| Диапазон | МПК 50 | МПК 90 | |||
| Грамотрицательные | |||||
| Escherichia coli | Цефепим Цефпиром | 0,015-2 0,06-32 | 0,03 0,06 | 0,12 0,25 | 100 99 |
| Proteus mirabilis | Цефепим Цефпиром | 0,06-0,12 0,06-32 | 0,06 0,06 | 0,12 1 | 100 96 |
| Proteus vulgaris | Цефепим Цефпиром | 0,06-16 0,06-32 | <0,5 0,06 | 0,5 2 | 100 93 |
| Klebsiella pneumoniae | Цефепим Цефпиром | 0,008-2 0,06-32 | 0,03 0,06 | 1 4 | 100 92 |
| Enterobacter cloacae | Цефепим Цефпиром | 0,015-8 0,06-32 | 0,06 0,12 | 8 16 | 100 90 |
| Enterobacter aerogenes | Цефепим Цефпиром | 0,03-0,06 0,06-32 | 0,03 0,12 | 0,03 4 | 100 94 |
| Serratia marcescens | Цефепим Цефпиром | 0,06-8 0,06-32 | 0,5 0,12 | 8 8 | 100 99 |
| Citrobacter freundii | Цефепим Цефпиром | 0,015-0,12 0,06-16 | 0,03 0,12 | 0,12 2 | 100 97 |
| Haemophilus influenzae | Цефепим Цефпиром | 0,007-2 0,06-0,25 | <0,06 0,06 | 0,06 0,13 | 100 100 |
| Acinetobacter spp. | Цефепим Цефпиром | 1-8 0,06-32 | 8 4 | 8 і32 | 100 67 |
| Pseudomonas aeruginosa | Цефепим Цефпиром | <0,5-64 0,06->32 | 2 4 | 8-16 і32 | 87 69 |
| Pseudomonas spp. | Цефепим Цефпиром | 0,06-32 0,06->32 | 4 8 | 32 і32 | 77 63 |
| S. maltophilia | Цефепим Цефпиром | 1->64 0,06->32 | 32 і32 | >64 >32 | 17 17 |
| Грамположительные | |||||
| Staphylococcus aureus MS | Цефепим Цефпиром | 0,125-16 0,06-32 | 2 0,5 | 4 1 | 98 98 |
| Staphylococcus aureus MR | Цефепим Цефпиром | 8->64 8->64 | >64 >64 | >64 >64 | 9 8 |
| Staphylococcus CN MS | Цефепим Цефпиром | 0,03-16 0,06-32 | 0,5 0,5 | 8 4 | 74 96 |
| Streptococcus pneumoniae | Цефепим Цефпиром | 0,007-0,25 0,005-0,25 | 0,03 0,05 | 0,06 0,06 | 100 100 |
| Enterococcus faecalis | Цефепим Цефпиром | 0,06-32 | 64 8 | >64 і32 | 11 55 |
| Enterococcus faecium | Цефепим Цефпиром | 0<06->32 | >64 32 | >64 і32 | 9 21 |
| MS – метициллинчувствительный MR – метициллинрезистентный CN — коагулазонегативный | |||||
Антимикробная активность
Цефалоспорины IV поколения обладают широким, хорошо сбалансированным антимикробным спектром, который сочетает активность цефалоспоринов I-II поколения в отношении грамположительных бактерий с высокой активностью в отношении грамотрицательных бактерий цефалоспоринов III поколения. Антимикробный спектр цефепима и цефпирома охватывает грамотрицательные бактерии (семейство Enterobacteriaceae, Neisseriaceae, Haemophilus influenzae, Moraxella catarrhalis, Pseudomonas spp., Acinetobacter spp.), грамположительные бактерии (метициллинчувствительные стафилококки, стрептококки, пневмококки) и некоторые анаэробные микроорганизмы (табл. 2). Антимикробная активность цефепима и цефпирома в отношении наиболее важных клинических штаммов микроорганизмов представлена в табл. 3. Активность цефалоспоринов IV поколения в отношении грамотрицательных бактерий не уступает или превышает таковую наиболее активных цефалоспоринов III поколения — цефотаксима и цефтриаксона и сравнима с активностью фторхинолонов и карбапенемов. Цефалоспорины IV поколения в большей степени, чем цефалоспорины III поколения, устойчивы к гидролизу b-лактамазами, продуцируемых грамотрицательными бактериями, в том числе расширенного спектра. Важное свойство цефепима и цефпирома заключается в том, что они часто сохраняют активность даже в отношении штаммов, резистентных к цефалоспоринам III поколения [10, 11]. По выраженности действия на грамотрицательные энтеробактерии (Enterobacteriaceae) наиболее активные препараты располагаются в следующем порядке: меропенем > ципрофлоксацин > цефалоспорины IV = имипенем > цефалоспорины III = амикацин. Цефалоспорины IV поколения обладают умеренной активностью в отношении P. aeruginosa; по активности в отношении этого микроорганизма они немного уступают цефтазидиму, меропенему и ципрофлоксацину, но превосходят гентамицин, пиперациллин/тазобактам и равны по активности имипенему и амикацину. В целом в отношении грамотрицательных энтеробактерий и P. aeruginosa цефепим несколько превосходит цефпиром.
Таблица 4. Фармакокинетические параметры цефепима и цефпирома [4, 10, 12, 13]
| Параметры | Цефепим 1 г в/в | Цефпиром 1 г в/в |
| Cmax , мг/л | 67-82 | 53-97 |
| Vdss , л | 18 | 21 |
| F при в/м введении, % | ~ 100 | >90 |
| AUC, мг•ч/л | 137-149 | 119-156 |
| CLt , мл/мин | 122-155 | 109-177 |
| T 1/2, ч | 1,3-2,3 | 1,5-2,5 |
| Связь с белками, % | 16-19 | 5-13 |
| Cmax — максимальные концентрации в крови Vdss — стационарный объем распределения F — абсолютная биодоступность AUC — площадь под фармакокинетической кривой в интервале 0-24 ч CLt — общий клиренс T ? — период полувыведения | ||
Активность цефалоспоринов IV поколения в отношении стафилококков сравнима с активностью цефалоспоринов I и II поколений и превосходит цефалоспорины III поколения. Цефепим и цефпиром высокоактивны в отношении пневмококков, в том числе штаммов со сниженной чувствительностью к пенициллину. Умеренной и непостоянной активностью в отношении Enterococcus faecalis обладает цефпиром. Клиническое значение этого феномена не ясно: возможно, при применении цефпирома может отмечаться меньший риск развития энтерококковой суперинфекции, что характерно для всех остальных препаратов цефалоспоринового ряда. Цефалоспорины IV поколения, как и другие цефалоспорины, не активны в отношении метициллинрезистентных стафилококков, Enterococcus faecium и листерий. В отношении грамположительных бактерий цефпиром умеренно превосходит цефепим.
Цефепим и цефпиром обладают определенной активностью в отношении некоторых анаэробов, однако они не действуют на наиболее частых возбудителей анаэробных инфекций брюшной полости и ран и поэтому в этих случаях, как правило, требуют сочетанного назначения с метронидазолом или клиндамицином.
Таблица 5. Проникновение цефепима и цефпирома в жидкости и ткани организма [4, 10, 14-15]
| Ткани и жидкости | Коэффициент пенетрации (соотношение концентраций ткань/кровь) | |
| Цефепим | Цефпиром | |
| Воспалительная жидкость | 0,8 | 0,9 |
| Перитонеальная жидкость | 0,66 | 0,98 |
| Мокрота | 0,1 | 0,05-0,2 |
| Бронхиальная ткань | 0,6 | 0,46 |
| Жидкость простаты | 0,43 | 0,31-0,46 |
| Женские половые органы | 0,6 | 0,58 |
| Спинномозговая жидкость (при менингите) | 0,2 | 0,19-0,25 |
| Грудное молоко | <0,01 | 0,04 |
Фармакокинетика
Цефпиром и цефепим плохо всасываются из желудочно-кишечного тракта и поэтому применяются только парентерально — внутривенно или внутримышечно. При внутримышечном введении оба препарата характеризуются высокой биодоступностью. При внутривенном введении в крови быстро достигаются высокие концентрации, которые затем снижаются биэкспоненциально с периодом полураспределения около 0,3 часов. Период полувыведения цефепима и цефпирома не зависит от дозы и длительности применения и составляет около 2 часов. Антибиотики обнаруживаются в крови в терапевтических концентрациях в течение 12 часов, что является обоснованием для их применения 2 раза в сутки. Через 12 часов после в/в введения в дозе 1 и 2 г сывороточные концентрации цефпирома составляют 1 и 2,5 мг/л, что выше значений МПК для большинства чувствительных грамотрицательных и грамположительных бактерий, за исключением P. aeruginosa, Acinetobacter spp. и Enterococcus spp. Цефепим и цефпиром обладают сходными фармакокинетическими параметрами (табл. 4). Оба препарата в незначительной степени метаболизируют в организме и в неизмененном виде выводятся с мочой. Почечный клиренс составляет 80-70% от общего клиренса. Таблица 6. Дозирование цефепима и цефпирома
| Заболевания | Разовая доза, г | Интервал, ч |
| Инфекции у больных с нейтропенией | 2 | 8-12 |
| Инфекции в отделении интенсивной терапии | 2 | 12 |
| Госпитальная пневмония | 2 | 12 |
| Интраабдоминальная инфекция | 2 | 12 |
| Сепсис | 2 | 12 |
| Инфекция, вызванная | 2 | 12 |
| P. aeruginosa | ||
| Внебольничная пневмония | 1 | 12 |
| Инфекции кожи и мягких тканей | 1 | 12 |
| Инфекции мочевыводящих путей | 0,5-1 | 12 |
Цефепим и цефпиром в незначительной степени связываются с белками плазмы и хорошо проникают в жидкости и ткани организма, причем концентрации препаратов в тканях легких, коже и мягких тканях, асцитической жидкости превышают МПК основных возбудителей этих инфекций (табл. 5). У больных пожилого возраста наблюдается некоторое изменение фармакокинетических параметров цефепима и цефпирома, характеризующееся увеличением периода полувыведения в 1,7-2 раза и снижением общего клиренса. Однако эти изменения фармакокинетики не требуют рутинной коррекции режима дозирования препаратов у пожилых. Заболевания печени не оказывают влияния на фармакокинетику цефепима и цефпирома, в то время как при нарушенной функции почек требуется коррекция режима дозирования с учетом степени почечной недостаточности. У больных с уремией рекомендуемые дозы цефепима и цефпирома составляют 0,5 г с интервалом 24 часа плюс дополнительно 0,25 г после сеанса гемодиализа. У детей выраженных изменений кинетики этих препаратов не наблюдается.
Клиническое применение
Цефалоспорины IV поколения применяются в клинической практике с начала 90-х годов, и за этот период проведено большое количество сравнительных и несравнительных исследований этих препаратов при различных инфекциях, главным образом госпитальных. Анализ результатов клинических испытаний цефепима и цефпирома приведен в фундаментальных обзорах L. Barradell & H. Bryson [10], H. Giamarellou [16] и S. Norrby [17]. Цефепим и цефпиром показали высокую эффективность, превышающую 80% при различных госпитальных инфекциях — пневмонии, кожи и мягких тканей, интраабдоминальных, малого таза, мочевыводящих путей, сепсиса. По сводным данным клиническая эффективность цефпирома и цефепима при внебольничной пневмонии тяжелого течения составила >70% [4, 10]. Высокий клинический эффект этих препаратов наблюдался при особо тяжелых инфекциях в стационаре — в отделениях интенсивной терапии, в отделениях онкогематологии, у лихорадящих больных с нейтропенией. При сравнительных исследованиях цефепим и цефпиром показали сходную клиническую эффективность с цефалоспоринами III поколения — цефотаксимом, цефтриаксоном и цефтазидимом, при этом положительный бактериологический эффект при применении цефалоспоринов IV поколения в ряде случаев был выше, чем препаратов сравнения. В большинстве исследований отмечено, что цефпиром и цефепим в суточной дозе 4 г не уступают цефтазидиму в суточной дозе 6 г при лечении тяжелых госпитальных инфекций. В двух исследованиях изучена сравнительная эффективность цефалоспоринов IV поколения и имипенема: при инфекциях кожи и мягких тканей клинический эффект при применении цефпирома и имипенема был достигнут у 95 и 98% больных [4], при осложненных интраабдоминальных инфекциях клиническая и бактериологическая эффективность цефепима с метронидазолом (88 и 89%) оказалась выше, чем при применении имипенема (76 и 76%) [18]. В многоцентровом исследовании, проведенном в России в 6 клинических учреждениях у 111 больных с различными госпитальными инфекциями [19], отмечена высокая клиническая и бактериологическая эффективность цефпирома, которая при инфекциях нижних дыхательных путей составила 91 и 88%, при инфекциях мочевыводящих путей — 95 и 70%, при хирургической инфекции кожи и мягких тканей — 96 и 80%. Цефпиром и цефепим характеризуются хорошей переносимостью даже при лечении тяжелых больных. Анализ результатов контролируемых исследований показал, что частота нежелательных явлений при применении этих препаратов не превышает таковую при применении других цефалоспориновых антибиотиков [4, 20]. Дозирование цефалоспоринов IV поколения представлено в табл. 6.
Заключение
К наиболее важным свойствам цефалоспоринов IV поколения, определяющим область их применения, относятся: * Широкий спектр антимикробной активности (более широкий по сравнению с цефалоспоринами III поколения); * Стабильность к различным b-лактамазам, в том числе расширенного спектра; * Активность в отношении многих штаммов грам- отрицательных бактерий, резистентных к цефалоспоринам III поколения; * Хорошее проникновение препаратов в ткани, сохранение там бактерицидных концентраций в течение 12 часов; * Удобство дозирования (каждые 12 часов); * Хорошая переносимость и отсутствие токсичности; * Доказанная эффективность в сравнительных клинических исследованиях. Указанные свойства цефепима и цефпирома объясняют их высокую клиническую эффективность в режиме монотерапии при лечении различных госпитальных, в том числе особо тяжелых инфекций. Цефпиром и цефепим могут назначаться в качестве средств 1-го ряда при эмпирической терапии тяжелых госпитальных инфекций различной локализации: * Госпитальная пневмония тяжелого течения, в том числе вентилятор-ассоциированная; * Перитонит (в комбинации с метронидазолом); * Гинекологическая инфекция; * Сепсис, вызванный грамотрицательными микроорганизмами; * Инфекции у больных в отделении интенсивной терапии; * Инфекции у лихорадящих больных с нейтропенией; * Инфекции у онкологических больных. Кроме того, цефпиром и цефепим показаны при выделении госпитальных штаммов микроорганизмов, резистентных к цефалоспоринам III поколения. В указанных клинических ситуациях цефалоспорины IV поколения эффективны в режиме монотерапии. При смешанных аэробно-анаэробных инфекциях цефепим и цефпиром целесообразно комбинировать с антианаэробными средствами (метронидазолом или клиндамицином). При инфекциях, вызванных P. aeruginosa, цефепим и цефпиром следует сочетать с аминогликозидами или фторхинолонами. Таким образом, в распоряжении врачей появились новые высокоэффективные цефалоспориновые антибиотики IV поколения — цефепим и цефпиром, которые могут применяться в режиме монотерапии при лечении тяжелых госпитальных инфекций, в том числе вызванных мультирезистентными микроорганизмами.
Литература:
1. Neu HC. Infection problems of the 90’s — do we have an answer? Scand. J. Inf. Dis. 1993;91:7-13. 2. Piriti P. Introduction: cephalosporin generations. J. Chemotherapy 1996;8 (Suppl. 2):3-6. 3. Laws A, Page M. The chemistry and structure-activity relationships of C3-quaternary ammonium cephem antibiotics. J. Chemotherapy 1996;8(Suppl. 2):7-22. 4. Яковлев В.П., Яковлев С.В. Цефпиром: антибиотик группы цефалоспоринов четвертого поколения. Москва: АО «Фармарус», 1997;112. 5. Hancock RE, Bellido F. Antibacterial in vitro activity of fourth generation cephalosporins. J. Chemotherapy 1996;8 (Suppl. 2):31-6. 6. Kessler RE, Fung-Tomc J. Susceptibility of bacterial isolates to beta-lactam antibiotics from U.S. clinical trials over a 5-year period. Am. J. Med. 1996;100 (Suppl. 6A):13S-19S. 7. Schafer V, Shah PM, Doerr HW, et al. Invitro activity of cefpirome against isolates from patients with urinary tract, lower respiratory tract and wound infections. J. Antimicrob. Chemother. 1992;29 (Suppl. A):7-12. 8. Thornsberry C, Brown SD, Yee YC, et al. Invitro activity of cefepime and other antimicrobials: survey of European isolates. J. Antimicrob. Chemother. 1993;32 (Suppl. B):31-53. 9. Verbist L. Epidemiology and sensitivity of 8625 ICU and hematology/oncology bacterial isolates in Europe. Scand. J. Infect. Dis. 1993;Suppl. 91:1424. 10. Barradell LB, Bryson HM. Cefepime. A review of its antibacterial activity, pharmacokinetic properties and therapeutic use. Drugs 1994;47:471-505. 11. Blahova J, Krcmery V, Kralikova K. In vitro activity of cefepime against multiresistant nosocomial gram-negative bacteria . 8th European Congress of Clinical Microbiology and Infectious Diseases, Lausanne, May 25-28;1997;165. 12. Rybak M. The pharmacokinetic profile of a new generation of parenteral cephalosporin. Am. J. Med. 1996;100 (Suppl. 6A):39S-44S. 13. Van der Auwera P, Santella PJ. Pharmacokinetics of cefepime: a review. J. Antimicrob. Chemother. 1993;32 (Suppl. B):103-116. 14. Baldwin DR. The penetration of the fourth generation parenteral cephalosporins. J. Chemotherapy 1996;8 (Suppl. 2):71-82. 15. Craig WA. The pharmacokinetics of cefpirome: rationale for a twelve-hour dosing regimen. Scand. J. Infect. Dis. 1993;Suppl. 91: 33-40. 16. Giamarellou H. Clinical expirience with the fourth generation cephalosporins. J. Chemotherapy 1996;8 (Suppl. 2):91-104. 17. Norrby SR. Cefpirome: efficacy in the treatment of urinary and respiratory tract infections and safety profile. Scand. J. Infect. Dis. 1993;Suppl. 91:41-50. 18. Barie PS, Vogel SB, Dellinger EP, et al. A randomized, double-blind clinical trial comparing cefepime plus metronidazole with imipenem-cilastatin in the treatment of complicated intra-abdominal infections. Arch. Surg. 1997;132:1294-1302. 19. Яковлев С.В., Дворецкий Л.И., Шахова Т.В., Еремина Л.В. Цефпиром — цефалоспориновый антибиотик IV поколения для лечения тяжелых госпитальных инфекций. Антибиотики и химиотерапия 1996;41 (12):34-39. 20. Neu HC. Safety of cefepime: a new extended-spectrum parenteral cephalosporin. Am. J. Med. 1996;100 (Suppl. 6A):68S-75S.