Синдром Шегрена — что это такое? Причины, симптомы и лечение
Синдром Шегрена («сухой синдром») проявляется снижением функции желез внешней секреции, вследствие такой патологии появляется выраженная сухость кожных покровов и слизистой оболочки влагалища, трахеи, носоглотки, глаз, полости рта, также наблюдается уменьшение секреции пищеварительных ферментов, которые вырабатывает поджелудочная железа.
Чаще всего данный синдром сопровождает целый ряд аутоиммунных патологий соединительной ткани – дерматомиозит, склеродермию, и в таких случаях носит название – вторичный синдром Шегрена. Если же патология развивается самостоятельно, то название звучит, как первичный синдром Шегрена, или болезнь Шегрена.
Патоморфология
Основным морфологическим признаком является инфильтрация желез внешней секреции лимфо- и плазмоцитами. В первую очередь страдают слезные и слюнные железы, чуть реже – железы бронхов, пищеварительного тракта и влагалища.
- Поражаются и крупные, и мелкие железы. Сначала, на раннем этапе болезни, в процесс вовлекаются лишь мелкие протоки; по мере прогрессирования ее инфильтрат распространяется далее, на собственно ткань железы, в результате чего железистая ткань атрофируется и замещается соединительной. В ряде случаев описанные выше инфильтраты возникают не только в экзокринных (внешней секреции) железах, но и в других органах и системах организма, в частности, в мышцах, легких и почках. Это в конечном итоге приводит к нарушению функции пораженного органа.
- У 30-40% больных в материале, взятом путем биопсии слюнных желез, определяется метаплазия (видоизменение) выстилающих протоки клеток: появляются миоэпителиальные островки.
Дольки пораженных желез у ряда больных разрушены, а у других дольковая структура сохранена. Железы либо увеличены в размере, либо находятся в пределах нормы.
Что интересно, даже при отсутствии яркой клинической симптоматики синдрома Шегрена, у больного каким-либо заболеванием соединительной ткани вероятнее всего обнаружатся гистологические признаки воспаления слюнных желез.
Качество жизни пациенток с болезнью Шегрена на фоне проводимой базисной терапии
Качество жизни пациенток с болезнью Шегрена на фоне проводимой базисной терапии
Е.Ю. Ган, к. м. н, врач-ревматолог высшей категории хозрасчетной поликлиники1, ассистент кафедры терапии2
Л.П. Евстигнеева, д. м. н., зав. ревматологическим отделением1, доцент кафедры терапии2, гл. внештатный специалист-ревматолог Минздрава Свердловской области
1ГАУЗ СО «Свердловская областная клиническая больница № 1», г. Екатеринбург
2Факультет повышения квалификации и профессиональной переподготовки ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России, г. Екатеринбург
Quality of life of patients with Sjogren’s disease with ongoing therapy with disease-modifying antirheumatic drugs
E.Yu. Gan, L.P. Evstigneeva
Sverdlovsk Regional Clinical Hospital N 1, Ural State Medical University; Ekaterinburg, Russia
Резюме
Цель исследования. Оценка ассоциации уровня качества жизни пациенток с болезнью Шегрена с проводимой терапией болезнь-модифицирующими антиревматическими препаратами. Материал и методы. Исследование проведено на базе областного ревматологического центра консультативно-диагностической поликлиники Свердловской областной клинической больницы № 1. В основу работы положены результаты одномоментного исследования 74 пациенток с болезнью Шегрена (БШ), распределенных по трем группам сравнения, получавших различные базисные антиревматические препараты хлорамбуцил, метотрексат и гидроксихлорохин. Установление диагноза БШ осуществлялось с применением европейско-американских критериев AECGC (2002) [18]. С целью анализа качества жизни пациенток с БШ использовался опросник 36-Item Short Form Health Survey (SF-36) [28]. Статистическая обработка данных проводилась с использованием программы Statistica 7.0. Результаты исследования. Оценка качества жизни пациенток с БШ, являющегося интегративным критерием здоровья и благополучия человека, выявила отсутствие статистически значимых различий (p > 0,05) по восьми шкалам и двум компонентам здоровья опросника SF-36 в анализируемых группах, различающихся по проводимой терапии болезнь-модифицирующими антиревматическими препаратами хлорамбуцил, метотрексат и гидроксихлорохин. Заключение. Полученные данные свидетельствуют о равнозначной ассоциации уровня качества жизни пациенток с БШ с терапией болезнь-модифицирующими антиревматическими препаратами (метотрексатом, хлорамбуцилом и гидроксихлорохином), в связи с чем гидроксихлорохин может рассматриваться в качестве альтернативной базисной терапии у пациентов с БШ, имеющих определенные ограничения и противопоказания к назначению метотрексата и хлорамбуцила.
Ключевые слова: болезнь Шегрена, качество жизни, гидроксихлорохин, хлорамбуцил, метотрексат.
Summary
Purpose of the study. Assessing the association between the life quality of patients with Sjogren’s Disease and ongoing therapy with various disease-modifying antirheumatic drugs. Material and methods. The study was conducted on the basis of the regional rheumatology center of the consultative diagnostic clinic of the Sverdlovsk Regional Clinical Hospital No. 1. This work is based on the results of a simultaneous study of 74 patients with primary Sjogren’s Disease (SD), distributed in three comparison groups receiving various disease-modifying antirheumatic drugs chlorambucil, methotrexate and hydroxychloroquine. The diagnosis of SD was carried out according to European-American criteria AECGC (2002) [18]. In order to analyze the quality of life of patients with SD, the 36-Item Short Form Health Survey (SF-36) was used. Statistical data processing was carried out using Statistica 7.0 program. Results. Assessment of the quality of life of patients with SD, which is an integrative criterion of human health and well-being, revealed the absence of statistically significant differences (p > 0.05) on eight scales and two health components of the SF-36 questionnaire in the analyzed groups that differ in the treatment of disease-modifying antirheumatic drugs chlorambucil, methotrexate and hydroxychloroquine. Conclusions. The obtained data indicate an equivalent quality of life in SD patients treated with different disease-modifying antirheumatic drugs methotrexate, chlorambucil and hydroxychloroquine, and therefore hydroxychloroquine can be considered as an alternative basic therapy in patients with SD with certain limitations and contraindications methotrexate and chlorambucil.
Key words: Sjogren’s disease, quality of life, hydroxychloroquine, chlorambucil, methotrexate
Введение
На современном этапе развития медицинской науки распространенной в практике врача-ревматолога становится системная патология соединительной ткани. Одним из представителей указанной группы болезней является первичный синдром Шегрена (болезнь Шегрена), сопровождающийся преимущественным поражением слезных (с развитием сухого кератоконъюнктивита) и слюнных (с развитием паренхиматозного сиаладенита) желез с возможным вовлечением в патологический процесс различных органов и наличием лабораторно-иммунологической активности [1]. Частота развития внежелезистых проявлений при болезни Шегрена (БШ), по данным разных авторов, составляет от 30 до 60% [2, 3].
Частота распространенности БШ в популяции составляет 0,5–1,0% и 2,0–4,8% среди лиц старше 50 лет [1]. При этом БШ занимает второе место по частоте встречаемости после ревматоидного артрита среди аутоиммунных ревматических заболеваний [4]. Женщины болеют в девять раз чаще мужчин. Дебют БШ обычно приходится на возраст 20–50 лет. Чаще заболевают женщины в периоде менопаузы (40–50 лет) [5, 6]. Как известно, раннее начало БШ, как правило, ассоциируется с более агрессивным течением патологического процесса, развитием системных проявлений и высокой лабораторной-иммунологической активностью.
Патогенетически в основе БШ лежит гиперактивность B-клеток с последующей продукцией аутоантител. С морфологической точки зрения, БШ характеризуется очаговой перидуктальной лимфоплазмоцитарной инфильтрацией с образованием лимфоидных фолликулов и возможным формированием «зародышевых» центров в железистой ткани [2], что нередко является фоном для развития в последующем лимфопролиферативных заболеваний (ЛПЗ), занимающих второе место в структуре летальности при описываемой патологии [1, 7]. Частота развития лимфом у пациентов с БШ достигает 5–10% [7, 8, 9]. Наиболее распространенными являются лимфомы из мукозоассоцированной лимфоидной ткани (MALT), на которые приходится 60% случаев, узловые лимфомы маргинальной зоны (NMZL) и диффузная крупная B-клеточная лимфома (DLBCL) [9, 10].
В настоящее время разработаны три группы предикторов развития лимфопролиферации при БШ: клинические, иммунологические и гистологические [7]. В качестве клинических маркеров рассматривают стойкое увеличение слюнных желез, лимфаденопатию, криоглобулинемический васкулит, периферическую нейропатию, гломерулонефрит, феномен Рейно, стабильно умеренную или высокую активность болезни (по индексу ESSDAI) [11]. К иммунологическим предикторам трансформации БШ в ЛПЗ относят моноклональную гаммапатию, криоглобулинемию, высокий ревматоидный фактор, гипокомплементемию C4, высокий уровень SSA- и SSB-антител, а также лейкопению. Гистологическими факторами риска развития ЛПЗ являются высокий фокусный счет и наличие «зародышевых» центров в биоптате слюнной железы. Под фокусом при БШ понимают очаг перидуктальной лимфоидной инфильтрации с количеством лимфоцитов 50 и более в пределах 4 мм2 ткани железы [7].
Общая 5-летняя выживаемость при развитии лимфом в настоящее время составляет 92%. При этом лучшая выживаемость при MALT-лимфомах (94,12%), хуже прогноз при NMZL (87,50%) и DLBCL (75,00%) [7].
На современном этапе развития медицинской науки терапевтическая тактика в отношении пациентов с БШ вызывает много вопросов и дискуссий, что обусловлено отсутствием определенности в отношении этиологических и патогенетических аспектов развития болезни, а также весьма гетерогенной картиной течения заболевания у разных пациентов.
Целью проводимой терапии является уменьшение выраженности клинических проявлений БШ, снижение лабораторно-иммунологической активности и предотвращение лимфоидной пролиферации. В конечном итоге лечение направлено на достижение ремиссии заболевания, замедление темпов его прогрессирования, снижение риска развития осложнений, прежде всего лимфопролиферативных процессов, и улучшение качества жизни пациентов с БШ как интегративного показателя здоровья и благополучия человека, являющегося значимым и объективным критерием успеха проводимой терапии [1, 7, 12].
Поскольку на сегодняшний день этиологические аспекты БШ остаются окончательно невыясненными, основную роль в достижении поставленных целей и задач терапии играет локальная терапия сухого синдрома, базисное патогенетически обоснованное лечение болезнь-модифицирующими антиревматическими препаратами, генно-инженерные биологические препараты, из которых на первом месте стоит ритуксимаб [1, 13, 14].
В российских клинических рекомендациях в качестве базисной антиревматической терапии БШ рекомендованы к использованию цитостатические препараты (хлорамбуцил и циклофосфамид) в связи с их эффективностью в отношении клинико-лабораторной активности болезни и профилактики развития лимфопролиферативных процессов [1, 14]. При этом, в связи с высоким риском развития нежелательных явлений и побочных эффектов, спектр показаний к терапии циклофосфамидом ограничен прежде всего вовлечением в процесс жизненно важных органов (легкие, почки, нервная система, васкулит). Глюкокортикоиды в малых дозах рекомендованы пациентам с рецидивирующими сиаладенитами и минимальными системными проявлениями, такими как суставной синдром, а также в составе комбинированной терапии с хлорамбуцилом и циклофосфамидом [14].
В реальной отечественной клинической практике в терапии пациентов с БШ нередко применяется метотрексат в связи с его потенциальной эффективностью, направленной на купирование суставного синдрома и снижение лабораторной активности болезни, что также рассматривается в качестве возможной альтернативы в терапии БШ в зарубежных публикациях [2].
В пилотном исследовании по оценке эффективности метотрексата при БШ в дозе 0,2 мг на 1 кг веса в неделю была показана положительная динамика по субъективным ощущениям сухости глаз и полости рта, однако по объективным критериям (проба Ширмера и сиалометрия) динамика отсутствовала. Не было эффекта и в отношении уровня иммуноглобулина G и скорости оседания эритроцитов (СОЭ) [15].
Вместе с тем вышеуказанные антиревматические препараты (циклофосфамид, хлорамбуцил, метотрексат) обладают высокой цитотоксической активностью, ассоциированной не только с их эффективностью, но и нередким развитием нежелательных явлений и побочных эффектов (токсический гепатит, цитопения, вирусные и бактериальные инфекции, мутагенные и тератогенные эффекты и т. д.), что нередко ставит под сомнение возможность и целесообразность проведения обсуждаемой активной базисной терапии. Особую актуальность указанные вопросы приобретают при имеющейся исходной цитопении (чаще лейкопении) или тенденции к ее развитию, наличии гепатитов различного генеза, сопровождающихся повышением трансаминаз печени, хронических инфекций, коморбидной патологии, при низкой клинико-лабораторной активности БШ, а также при планировании беременности. Частично данная проблема решается при помощи подключения к лечению глюкокортикоидов (ГК). Однако и указанная категория препаратов нередко имеет свои противопоказания и побочные явления, такие как эрозивно-язвенные процессы желудочно-кишечного тракта, артериальная гипертензия, сахарный диабет, остеопороз, катаракта и др. В таком случае необходимо детально взвесить соотношение пользы и риска при подборе и планировании терапии.
В связи с указанными обстоятельствами интерес представляет возможность альтернативного приема гидроксихлорохина в качестве базисной терапии БШ, назначение которого было бы оправданно у пациентов, имеющих низкую клинико-лабораторную активность процесса, наличие противопоказаний к терапии ГК и цитостатическими препаратами, побочные эффекты и осложнения в результате их приема, а также в тех случаях, когда потенциальный риск превышает ожидаемую пользу.
В зарубежных рекомендациях современный подход к выбору тактики терапии пациентов с БШ основан на варианте течения болезни и ориентирован на ведущий клинический синдром: суставной синдром (артралгии, артрит), «сухой» синдром (ксеростомия, ксерофтальмия), синдром усталости (утомляемости) и системный синдром (васкулит, вовлечение легких, почек, нервной системы) [3]. При этом при БШ обсуждается возможность использования различных болезнь-модифицирующих антиревматических препаратов, в том числе гидроксихлорохина.
В связи с этим все больше исследований и публикаций в иностранных изданиях посвящены исследованию эффективности и безопасности терапии пациентов с БШ гидроксихлорохином. По литературным данным, основные точки применения гидроксихлорохина при БШ – суставной синдром и синдром усталости [3, 16, 17, 18]. Результаты исследований по эффективности гидроксихлорохина неоднородны. В рекомендациях Американского общества по БШ (Sjogren’s Syndrome Foundation, SSF) гидроксихлорохин рекомендован в качестве терапии первой линии при суставном синдроме у пациентов с БШ [20]. В рекомендациях EULAR (2019) [13] приведены два РКИ с отсутствием статистически значимого улучшения по таким клиническим симптомам, как сухость слизистых оболочек, утомляемость и боль [21, 22]. Вместе с тем в исследовании J.-E. Gottenberg при отсутствии динамики в отношении клинических проявлений БШ обнаружена положительная лабораторная динамика лабораторной активности [21]. В исследовании A. Kruize выявлены тенденция к снижению СОЭ и значимое снижение в крови уровня иммуноглобулинов G и M [23]. В литературе также имеются данные об эффективности гидроксихлорохина при БШ на патогенетические и, как следствие, клинические характеристики [24]. Так, G. Mumcu et al. выявили статистически значимое снижение уровня фактора В-клеточной активации (BAFF) и увеличение уровня сиалометрии у пациентов с БШ на фоне терапии гидроксихлорохином. На основании результатов исследования авторы сделали вывод о возможности влияния гидроксихлорохина на повышение саливации, а также снижение степени активности БШ за счет уменьшения уровня BAFF, являющегося одним из ведущих аспектов в патогенезе БШ [24].
Интересной, с практической точки зрения, представляется оценка эффективности терапии БШ лефлюномидом. Так, van Woerkom et al. было проведено исследование, результаты которого показали на фоне терапии снижение усталости и уровня иммуноглобулинов G, A и M, ревматоидного фактора, тенденцию к увеличению пробы Ширмера. Пяти пациентам из 15 была повторно проведена биопсия малой слюнной железы, у четырех из них отмечено уменьшение на 1 фокус / 4 мм2 [25].
Проведено исследование комбинированной терапии гидроксихлорохином и лефлюномидом, результаты которого ожидаются в печати [2, 26].
В последние годы опубликованы и систематизированы [13] исследования по эффективности генно-инженерных биологических препаратов, большинство из которых оценивало влияние ритуксимаба. Российскими учеными описан положительный опыт лечения пациентки БШ ритуксимабом и белимумабом в виде комбинированной терапии [27].
Кроме субъективных и объективных клинических признаков БШ, лабораторно-иммунологической и гистологической активности заболевания, отражающих степень выраженности патологического процесса, крайне важным интегративным показателем здоровья является уровень качества жизни пациентов с БШ [28]. В публикациях последних лет много работ, свидетельствующих о снижении уровня качества жизни пациентов с БШ по сравнению со здоровой популяцией [20, 29]. Однако данных, касающихся оценки взаимосвязи качества жизни пациентов с БШ с получаемой ими базисной лекарственной терапией, практически нет, что и послужило поводом к проведению данного исследования.
Цель исследования: оценка ассоциации уровня качества жизни пациенток с болезнью Шегрена с проводимой терапией болезнь-модифицирующими антиревматическими препаратами.
Материал и методы
Исследование проведено на базе областного ревматологического центра консультативно-диагностической поликлиники ГАУЗ СО «Свердловская областная клиническая больница № 1». В основу работы положены результаты одномоментного исследования 74 пациенток с болезнью Шегрена, распределенных по трем группам сравнения, получающих различные болезнь-модифицирующие антиревматические препараты хлорамбуцил, метотрексат и гидроксихлорохин.
Критерии включения пациентов в исследование: возраст не старше 75 лет, добровольное согласие на участие в обследовании, отсутствие психических заболеваний, онкологической патологии, тяжелых сопутствующих соматических болезней, выраженной энцефалопатии и других аутоиммунных заболеваний (помимо БШ). Длительность приема болезнь-модифицирующих антиревматических препаратов составила не менее 3 лет.
Установление диагноза БШ осуществлялось с применением европейско-американских критериев (American-European Consensus Group Criteria for Sjögren’s Syndrome, 2002) [18]. Для оценки степени активности и варианта течения БШ использовались классификация, разработанная институтом ревматологии РАМН (2011) [1], и индекс активности ESSDAI (EULAR Sjogren Syndrom Disease Activity Index, 2009) [11].
С целью анализа качества жизни пациенток с БШ, основанного на оценке их физического, психического и социального благополучия, в качестве диагностического инструмента использовался опросник 36-Item Short Form Health Survey (SF-36) [28]. Русскоязычная версия опросника SF-36 валидирована Межнациональным центром исследования качества жизни (МЦИКЖ). В процессе исследования психометрических свойств были подтверждены надежность, валидность и чувствительность опросника, а также получены популяционные данные показателей качества жизни жителей г. Санкт-Петербурга. Указанная методика отражает общее благополучие человека и уровень его удовлетворенности теми сторонами жизни, на которые оказывает влияние его состояние здоровья. Опросник состоит из 36 вопросов, объединенных в восемь шкал: физическое функционирование (ФФ), ролевое физическое функционирование (РФФ), телесная боль (ТБ), общее здоровье (ОЗ), жизнеспособность (Ж), социальное функционирование (СФ), ролевое эмоциональное функционирование (РЭФ) и психическое здоровье (ПЗ). Шкалы сгруппированы в два компонента здоровья – физический (ФКЗ), включающий первые четыре шкалы, и психический (ПКЗ), объединяющий следующие четыре шкалы, которые рассчитывались по специальным формулам [30].
Статистическая обработка данных проводилась с использованием непараметрических критериев (тест Манна-Уитни, χ2). Данные, не имеющие нормального распределения, выражены через медиану (Ме), диапазон значений – через нижний и верхний квартили (LQ–UQ). Различия считались статистически значимыми при величине p <� 0,05. Использовалась программа Statistica 7.0.
Результаты и обсуждение
Все пациенты с БШ, включенные в описываемое исследование, женского пола. Медиана возраста больных в изучаемой группе составила 56 (LQ–UQ: 51–61) лет. В соответствии с выраженностью клинико-лабораторной активности на момент проведения исследования все пациентки были распределены по подгруппам, соответствующим минимальной (I) – 51 (54,84%), умеренной (II) – 28 (30,11%) и высокой (III) – 14 (15,05%) степеням активности БШ.
У большинства пациенток, 52 (55,91%), диагностирован подострый вариант течения БШ, а у 41 (44,09%) больной – хронический. Медиана длительности болезни составила 6 (LQ–UQ: 3–8) лет. Медиана возраста дебюта заболевания – 50 (LQ–UQ: 44–56) лет. Большинство пациентов дополнительно к базисным болезнь-модифицирующим препаратам принимали ГК в дозе 5–10 мг в сутки в пересчете на преднизолон без статистически значимых различий между группами.
Оценка структуры базисной антиревматической терапии показала преобладание в группе исследования пациенток, получающих метотрексат (около 52,7%), и практически равное количество больных, принимающих гидроксихлорохин (23,0%) и хлорамбуцил (24,3%) (табл. 1). Пациенток, принимающих циклофосфамид, лефлюномид и ритуксимаб в описываемой группе исследования не было.
Таблица 1
Распределение пациенток с болезнью Шегрена с учетом проводимой базисной антиревматической терапии
| Базисная антиревматическая терапия | Количество пациенток (n = 74) | |
| Абсолютное | Относительное, % | |
| Получают хлорамбуцил (2–4 мг в сутки) | 18 | 24,3 |
| Получают метотрексат (7,5–15 мг в неделю) | 39 | 52,7 |
| Получают гидроксихлорохин (400 мг в сутки) | 17 | 23,0 |
При анализе длительности приема базисной терапии выяснено, что все пациентки, использующие гидроксихлорохин и хлорамбуцил, получали его от 3 до 5 лет. Среди больных, принимающих метотрексат, 33 пациентки употребляли его от 3 до 5 лет, 6 больных – более 5 лет.
Все три группы больных достоверно не различались между собой по возрасту (p = 0,655) и длительности течения БШ (p = 0,183), а также по характеру течения (p = 0,216) и степени активности (p = 0,716) патологического процесса на момент исследования.
Проведена сравнительная оценка уровня качества жизни пациенток с БШ по трем группам в зависимости от принимаемого базисного антиревматического препарата (хлорамбуцил, метотрексат или гидроксихлорохин). Полученные данные представлены в табл. 2.
Таблица 2
Различия в показателях качества жизни пациенток с болезнью Шегрена в зависимости от принимаемого базисного антиревматического препарата
| Шкалы КЖ | Хлорамбуцил (1), Ме (LQ–UQ) | Метотрексат (2), Ме (LQ–UQ) | Гидроксихлорохин (3), Ме (LQ–UQ) | Значимость, p |
| ФФ | 70,00 (60,00–85,00) | 50,00 (35,00–75,00) | 50,00 (35,00–70,00) | p1–2 = 0,166 p1–3 = 0,316 p2–3 = 1 |
| РФФ | 50,00 (25,00–100,00) | 0,00 (0,00–50,00) | 0,00 (0,00–75,00) | p1–2 = 0,153 p1–3 = 0,207 p2–3 = 1 |
| ТБ | 45,00 (40,00–50,00) | 40,00 (20,00–60,00) | 40,00 (30,00–60,00) | p1–2 = 0,541 p1–3 = 1 p2–3 = 1 |
| ОЗ | 45,00 (40,00–65,00) | 45,00 (30,00–52,00) | 40,00 (25,00–57,00) | p1–2 = 0,532 p1–3 = 0,546 p2–3 = 1 |
| Ж | 50,00 (45,00–65,00) | 40,00 (30,00–55,00) | 35,00 (30,00–55,00) | p1–2 = 0,679 p1–3 = 0,612 p2–3 = 1 |
| СФ | 62,50 (62,50–87,50) | 62,50 (37,00–75,00) | 62,50 (50,00–87,50) | p1–2 = 0,185 p1–3 = 1 p2–3 = 1 |
| РЭФ | 50,00 (33,33–100,00) | 33,33 (0,00–100,00) | 33,33 (0,00–100,00) | p1–2 = 0,735 p1–3 = 0,935 p2–3 = 1 |
| ПЗ | 60,00 (52,00–72,00) | 52,00 (32,00–60,00) | 48,00 (44,00–64,00) | p1–2 = 0,205 p1–3 = 0,415 p2–3 = 1 |
| ФКЗ | 39,08 (35,01–43,27) | 34,31 (26,74–42,03) | 33,65 (27,56–43,78) | p1–2 = 0,182 p1–3 = 0,568 p2–3 = 1 |
| ПКЗ | 41,09 (37,72–55,02) | 39,43 (30,43–47,71) | 38,95 (33,59–46,72) | p1–2 = 0,560 p1–3 = 1 p2–3 = 1 |
Примечание: КЖ – качество жизни, ФФ – физическое функционирование, РФФ – ролевое физическое функционирование, ТБ – телесная боль, ОЗ – общее здоровье, Ж – жизнеспособность, СФ – социальное функционирование, РЭФ – ролевое эмоциональное функционирование, ПЗ – психическое здоровье, ФКЗ – физический компонент здоровья, ПКЗ – психический компонент здоровья.
Как видно из табл. 2, показатели КЖ больных колебались в широком диапазоне, особенно при оценке ролевого эмоционального функционирования. Наиболее низкими были ролевое эмоциональное функционирование и ролевое физическое функционирование. В группе пациенток, принимающих хлорамбуцил, качество жизни по ряду доменов было выше по сравнению с пациентками, принимающими метотрексат и гидроксихлорохин, но различия не достигали статистической значимости. Оба компонента здоровья (физический компонент здоровья и психический компонент здоровья) были практически одинаково снижены у всех пациенток, их значения существенно не различались между группами пациенток, принимающих различные болезнь-модифицирующие антиревматические препараты.
В целом по восьми шкалам (ФФ, РФФ, ОЗ, ТБ, Ж, СФ, З, РЭФ) и по обоим компонентам здоровья (ФКЗ и ПКЗ) опросника SF-36 не выявлено статистически значимых различий (p > 0,05) между группами пациенток, принимающих хлорамбуцил, метотрексат и гидроксихлорохин. Полученные данные могут свидетельствовать о равнозначной ассоциации уровня качества жизни пациенток с БШ с приемом болезнь-модифицирующей антиревматической терапии метотрексатом, хлорамбуцилом и гидроксихлорохином.
Лечение болезни Шегрена является сложной задачей. Следует отметить трудности в лечении пациентов с БШ, связанные с тем, что подходы к системной терапии указанной патологии в настоящее время недостаточно разработаны. Препараты, подтвердившие свою эффективность при ряде системных заболеваний соединительной ткани и системных васкулитах, не находят однозначного подтверждения при БШ [13]. Кроме этого, ни у одного из синтетических болезнь-модифицирующих и биологических препаратов в Российской Федерации нет зарегистрированных показаний при болезни Шегрена. С учетом того, что при лечении пациентов важен не только прогноз в плане риска развития ЛПЗ, но и качество жизни в настоящий момент времени, у ряда пациентов наряду с другими болезнь-модифицирующими антиревматическими препаратами может применяться гидроксихлорохин, который показал равнозначные показатели шкал качества жизни при сравнении с метотрексатом и хлорамбуцилом. Немаловажным является хороший профиль безопасности препарата – в клинических исследованиях при лечении БШ не сообщалось о серьезных нежелательных явлениях и ретинопатии [13].
На основании результатов исследования мы полагаем, что гидроксихлорохин может применяться в качестве базисной терапии у пациентов с БШ, имеющих определенные ограничения и противопоказания к назначению метотрексата и хлорамбуцила, учитывая полученные в группах сравнения схожие показатели уровня качества жизни больных, являющегося интегративным критерием здоровья и благополучия человека.
Заключение
Полученные в результате исследования данные свидетельствуют о наличии альтернативной возможности назначения в качестве базисной терапии пациентам с БШ гидроксихлорохина, с точки зрения его аналогичной ассоциации с качеством жизни больных при сравнении с метотрексатом и хлорамбуцилом. Это является важным аспектом в связи с тем, что в целом гидроксихлорохин обладает меньшим риском развития нежелательных явлений и побочных эффектов, имеет меньше противопоказаний к назначению, чем хлорамбуцил и метотрексат, что нередко ограничивает возможность применения последних у пациентов с БШ.
На основании полученных сведений мы полагаем, что гидроксихлорохин способен занимать свою нишу в качестве базисной терапии пациентов с БШ при низкой активности патологического процесса, наличии противопоказаний и развитии побочных явлений на фоне терапии хлорамбуцилом и метотрексатом.
Полученные результаты представляются нам интересными и свидетельствуют о необходимости проведения дальнейших проспективных исследований по оценке влияния болезнь-модифицирующих антиревматических препаратов на уровень качества жизни пациентов с БШ, а также на динамику клинических, иммунологических и гистологических проявлений патологического процесса.
Ограничения исследования
Ограничением исследования является малый объем выборки, что могло повлиять на отсутствие статистически значимых межгрупповых различий. Также следует отметить, что опросник SF-36 не является специфическим и на его показатели влияют другие составляющие оценки здоровья, в том числе сопутствующие заболевания и состояния. Кроме того, отсутствие рандомизации в ретроспективных исследованиях не может обеспечить сопоставимость групп по всем признакам, влияющим на результат. Для подтверждения гипотезы о равнозначном эффекте различных болезнь-модифицирующих антиревматических препаратов необходимы новые проспективные рандомизированные исследования.
Список литературы
- Сафонова Т.Н., Васильев В.И., Лихванцева В.Г. Синдром Шегрена: Руководство для врачей / Т.Н. Сафонова, В.И. Васильев, В.Г. Лихванцева; под ред. В.Г. Лихванцевой. М.: Издательство Московского университета, 2013. 600 с.
- Van der Heijden E, Kruize A, Radstake T, van Roon J. Optimizing conventional DMARD therapy for Sjögren’s syndrome. // Autoimmunity Reviews. 2021. Vol. 17. P. 480–492. doi.org/10.1016/j.autrev.2018.03.003.
- Del Papa N, Vitali C. Management of primary Sjögren’s syndrome: recent developments and new classification criteria. // Ther Adv Musculoskel Dis. 2021. Vol. 10 (2). P. 39–54. doi.org/10.1177/1759720×17746319.
- Tzioufas AG, Vlachoyiannopoulos PG. Sjögren’s syndrome: an update on clinical, basic and diagnostic therapeutic aspects. // J Autoimmun. 2012. Vol. 39 (1–2). P. 1–3.
- Maldini С, Seror R, Fain O, et al. Epidemiology of primary Sjögren’s syndrome in a French multiracial/multiethnic area. // Arthritis Care Res. 2014. doi.org/10.1002/acr.22115.
- Шеломкова О.А., Вельтищев Д.Ю., Васильев В.И., Лисицына Т.А. Стрессовые факторы и психические расстройства при болезни Шегрена: современные направления исследований. // Научно-практическая ревматология. 2012. – № 54 (5). С. 85–89.
- Alunno A, Leone MC, Giacomelli R, et al. Lymphoma and Lymphomagenesis in Primary Sjögren’s Syndrome. // Front. Med. 2021. DOI: 10.3389/fmed.2018.00102.
- Nocturne G, Mariette X. Advances in understanding the pathogenesis of primary Sjögren’s syndrome. // Nat Publ Gr. 2013. Vol. 9. DOI: 10.1038/nrrheum.2013.110.
- Singh AG, Singh S, Matteson EL. Rate, risk factors and causes of mortality in patients with Sjogren’s syndrome: a systematic review and meta-analysis of cohort studies. // Rheumatology (Oxford). 2021. Vol. 55. P. 450–460. DOI: 10.1093/rheumatology/kev354.
- Chiu YH, Chung CH, Lin KT, Lin CS, Chen JH, Chen HC, et al. Predictable biomarkers of developing lymphoma in patients with Sjögren syndrome: a nationwide population-based cohort study. // Oncotarget. 2021. Vol. 8 (30). P. 50098–500108. DOI: 10.18632/oncotarget.15100.
- Seror R, Bowman SJ, Brito-Zeron P, et al. EULAR Sjögren’s syndrome disease activity index (ESSDAI): a user guide. // RMD Open. 2015. DOI: 10.1136/rmdopen-2014-000022.
- Ramos-Casals M, Tzioufas AG, Stone JH, et al. Treatment of primary Sjögren syndrome: а systematic review. // JAMA. 2010. Vol. 304 (4). P. 452–460.
- Ramos-Casals M., Brito-Zeron P., Bombardieri S., et al. // EULAR-Sjogren Syndrome Task Force Group. EULAR recommendations for the management of Sjogren’s syndrome with topical and systemic therapies. // RMD Open. 2021. Vol. 5 (2): e001064.
- Васильев В.И. Болезнь (синдром Шегрена). Российские клинические рекомендации / под редакцией Е. Л. Насонова. М.: ГЭОТАР-Медиа. 2017. С. 228–239.
- Skopouli F, Jagiello P, Moutsopoulos H. Methotrexate in primary Sjögren’s syndrome. // Clin Exp Rheumatol. 1996. Vol. 14. P. 555–558.
- Carsons SE, Vivino FB, Parke A, et al. Treatment Guidelines for Rheumatologic Manifestations of Sjögren’s: Use of Biologics, Management of Fatigue and Inflammatory Musculoskeletal Pain. // Arthritis Care and Research. 2021. DOI: 10.1002/acr.22968.
- Bowman S, Everett CC, O’Dweyer, et al. Randomized controlled trial and cost-effectiveness analysis in treating fatigue and oral dryness in primary Sjögren’s syndrome. // Arthritis Rheumatol. 2017. Vol. 69.
- Leverenz DL, St Clair EW. Recent advances in the search for a targeted immunomodulatory therapy for primary Sjögren’s syndrome. // F1000 Res. 2021. Vol. 29. P. 8. DOI: 10.12688/f1000research.19842.1.
- ???
- Vivino FB, Carsons SE, Foulks G, et al. New Treatment Guidelines for Sjogren’s Disease. // Rheum Dis Clin N Am. 2021. Vol. 42. P. 531–551. doi.org/10.1016/j.rdc.2016.03.010.
- Gottenberg J-E, Ravaud P, Puéchal X, et al. Effects of Hydroxychloroquine on symptomatic improvement in primary Sjögren syndrome the JOQUER randomized clinical trial. // JAMA. 2014. Vol. 312. P. 249–258. DOI: 10. 1001/jama. 2014.7682.
- Yoon CH, Lee HJ, Lee EY, et al. Effect of hydroxychloroquine treatment on dry eyes in subjects with primary Sjögren’s syndrome: a double-blind randomized control study. // J Korean Med Sci. 2021. Vol. 31. P. 1127–1135.
- Kruize A, Hene R, Kallenberg C, et al. Hydroxychloroquine treatment for primary Sjögren’s syndrome: a two year double blind cross over trial. // Ann Rheum Dis. 1993. Vol. 52. P. 360–364.
- Mumcu G, Biçakçigil M, Yilmaz N, et al. Salivary and Serum B-cell Activating Factor (BAF) Levels after Hydroxychloroquine treatment in Primary Sjögren’s Syndrome. // Oral Health Prev Dent. 2013. Vol. 11 (3). P. 229–234.
- Van Woerkom JM, Kruize AA, Geenen R, et al. Safety and efficacy of leflunomide in primary Sjögren’s syndrome: a phase II pilot study. //Ann Rheum Dis. 2007. Vol. 66 (1026). P. 32. doi.org/10.1136/ard.2006.060905.
- Van der Heijden E, Hartgring S, Kruize A, et al. Additive inhibition of interferons, B and T cell activation and Tfh related cytokine CXCL13 by leflunomide and hydroxychloroquine supports rationale for combination therapy in pSS patients. // ARD EULAR J. 2017. Vol. 76 (2). P. 1206.
- Беневоленская С.С., Королькова А.А., Мячикова В.Ю. и др. Комбинированная биологическая терапия белимумабом и ритуксимабом у пациента с болезнью Шегрена. // Терапия. 2021. № 8. С. 140–150.
- Ware JE, Sherbourne СD. The MOS 36-item Short-Form Health Survey (SF-36): I. Conceptual framework and item selection. // Med Care. 1992. Vol. 30 (6). P. 473–483.
- Segal B, Bowman SJ, Fox PC, et al. Primary Sjogren’s Syndrome: health experiences and predictors of health quality among patients in the United States. // Health Qual Life Outcomes. 2009. Vol. 7. P. 46.
- Багирова Г.Г. Оценка качества жизни в ревматологии / Г.Г. Багирова, Т.В. Чернышева, Л.В. Сизова. М.: Бином, 2011. 248 с.
Причины развития
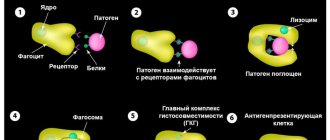
Причины возникновения синдрома Шегрена пока до конца не установлены. Среди наиболее вероятных является теория о патологической реакции иммунной системы организма. Такая реакция развивается в ответ на повреждение клеток внешних желез ретровирусом, в частности это – вирус Эпштейн-Барр, VI вирус герпеса, цитомегаловирус, вирус иммунодефицита человека. Несмотря на значительное сходство иммунологических нарушений с изменениями в организме, пораженном вирусом, прямых доказательств роли вируса, как причины развития патологии, не получено.
Сами вирусы и измененные от их воздействия эпителиальные клетки желез воспринимаются иммунной системой как антигены (чужеродные агенты). Иммунная система продуцирует антитела против таких клеток и постепенно вызывает разрушение тканей железы. Заболевание часто встречается как наследственное или семейное, особенно часто среди близнецов, что позволяет предположить о том, что существует генетическая предрасположенность.
Таким образом, предполагают, что в механизме развития и возникновения патологии важное значение имеет сочетание множества факторов:
- стрессовой реакции организма, которая возникает вследствие иммунного ответа;
- иммунная регуляция с участием половых гормонов, о чем говорит редкая заболеваемость среди лиц до 20 лет, при этом среди детей чаще всего болеют девочки;
- иммунный контроль с помощью Т-лимфоцитов;
- вирусный;
- генетический.
Есть два типа синдрома Шегрена: первичный — симптомы болезни являются первыми проявлениями ее, и вторичный, когда симптоматика проявляется у пациентов, страдающих иными ревматическими заболеваниями, такими как склеродермия, ревматоидный артрит или системная красная волчанка. Первичный и вторичный варианты синдрома встречаются примерно с одинаковой частотой. Это иногда затрудняет точную постановку диагноза. Синдром Шегрена достаточно распространен: в Великобритании, например, насчитывается около полумиллиона больных. Наиболее часто поражаются женщины в возрасте от 40 до 60 лет, тогда как только один пациент из 13 – мужчина.
Этиология
Этиология
неизвестна. Ряд исследователей рассматривают Шегрена болезнь как следствие развития иммунопатологических реакций на различные микробные, вирусные и другие антигены. Известна вирусная гипотеза развития Шегрена болезни, основанная на обнаружении вирусоподобных тубулоретикулярных структур в эпителии слюнных желез и выявлении в крови больных повышенного уровня антител к цитомегаловирусу. Как предполагают Шиллитоу (E. J. Shillitoe) с сотрудниками (1982), цитомегаловирус может быть этиологическим фактором развития Шегрена болезни, однако прямых доказательств вирусной этиологии заболевания пока не получено.
Симптомы синдрома Шегрена
Симптоматику заболевания делят на две группы:
- Железистые проявления, при которых поражаются эпителиальные железы и нарушаются их функции.
- Внежелизистые проявления. Симптоматика данной группы очень различается, вследствие поражения различных органов человека.
Железистые симптомы, можно выделить следующие:
- Патология слезных желез. В данном случае возникают неприятные и болезненные ощущения в глазах (жжение, глаза как будто начинает резать, ощущения песка в них), при этом появляется характерный зуд возле глаз, покраснение. В результате снижается зрение, возникновение точечных кровоизлияний, отеков, чувствительность к свету, глазные боли.
- Патология слюнных желез. Проявление воспаления главным образом околоушных желез, которые увеличены в размере, иногда с проявлением болезненных ощущений. Также возникает сухость слизистой оболочки рта, глотание пищи затруднено, нередко больным приходится запивать еду водой, вследствие с проблемой проглатывания. При этом слизистая оболочка рта принимает ярко-розоватый оттенок.
- Сухость дыхательных путей, которая приводит воспалению бронхов, трахеи, легких.
- Кожные нарушения, в результате чего кожа становится сухой.
- Поражение слизистой оболочки носа. Возникновение сухости в носу, покрытие внутриносовой коркой, вследствие чего развивается воспаление.
Внежелизистым проявлениям характерны следующие признаки:
- Возникновение трахеобронхита, сопровождающейся кашлем, отдышкой. Не редко при обследовании у больного обнаруживается пневмония или фиброз легких.
- Увеличение лимфатических узлов.
- Поражение периферической нервной системы. При этом начинают проявляться болевые ощущения (покалывание, жжение).
- Повышенная температура;
- Боли в суставах и мышцах.
- Поражение щитовидной железы. Является редким нарушением, при котором начинают проявляться аллергические реакции на различные продукты питания, лекарства и другие средства.
- Увеличенные лимфоузлы (подчелюстные, шейные, затылочные). Не редко наблюдается увеличение печени и селезенки.
- Воспаление сосудов, которое протекает на форе атеросклероза нижних конечностей, вследствие нарушения кровообращения. При нарушении функционирования сосудов, проявляются кожные заболевания (сыпь), которые сопровождаются зудом, жжением и повышенной температурой.
Нередко на фоне описываемой нами патологии у больных развивается повышенная индивидуальная чувствительность к некоторым лекарственным препаратам, в частности, к нестероидным противовоспалительным лекарственным средствам, некоторым антибиотикам (пенициллину), препаратам так называемой базисной терапии, цитостатикам.
Клиническая картина
Отличительным симптомом синдрома Шегрена является генерализованная сухость слизистых оболочек, чаще всего включающая в себя:
- Ксерофтальмия («сухой глаз», сухость глаз). На начальном этапе больные могут не предъявлять жалоб. При дальнейшем прогрессировании болезни появляется чувство жжения, рези, «песка» в глазах.
- Ксеростомия («сухой рот», сухость полости рта). Отмечается уменьшение слюноотделения из-за поражения слюнных желез. Развивается хронический паротит, стоматит, кариес. Больные жалуются на выраженную сухость в ротовой полости, «заеды» в уголках рта, затруднение при разговоре, а на поздних стадиях даже на нарушение глотания пищи (дисфагия).
Кроме того, синдром Шегрена может вызывать поражение:
- кожи — выраженная сухость;
- носоглотки — образование корок в носу, развитие отита при поражении евстахиевой трубы, синуситы;
- вагины — зуд, боль;
- дыхательной системы — трахеобронхиты;
- пищеварительной системы — атрофический гастрит с секреторной недостаточностью, гипокинетическая дискинезия желчевыводящих путей, панкреатит;
- почек — гломерулонефрит;
- кровеносных сосудов — синдром Рейно;
- периферической нервной системы — полинейропатии, неврит лицевого, тройничного нерва.
Часто развивается выраженный упадок сил, боли в суставах, мышцах.
Пациенты с вторичным синдромом Шегрена имеют симптомы первичного ревматического заболевания, например, системной красной волчанки, ревматоидного артрита или системной склеродермии.
Диагностика
Жжение глаз и сухость полости рта не всегда может означать, что речь идет о наличии у человека данного синдрома. Диагностировать синдром Шегрена можно лишь при наличии воспалительного поражения желез. Однако встречаются случаи, когда к подобному результату могут привести различные заболевания обмена веществ, при которых значительно снижается секреция слюны (чаще всего это сахарный диабет).
Вследствие этого у людей старческого возраста преждевременно снижаются функции слюнных и слезных желез. Данные формы сухости глаз и рта не имеют никакого отношения к синдрому Шегрена. Также для диагностики данного синдрома проводится исследование тканей. Для данного вида исследования берут небольшие фрагменты слизистой оболочки полости рта, которые исследуют при помощи микроскопа. Таким образом устанавливается поражение слизистых желез.
Патогенез
Аутоиммунный процесс приводит к апоптозу секретирующих клеток и эпителия выводных протоков, вызывая повреждение железистой ткани.
Синдром Шегрена ассоциирован с увеличенным уровнем в спиномозговой жидкости IL-1RA, антагониста интерлейкина-1 (ИЛ-1). Это позволяет предположить, что болезнь начинается с повышения активности системы ИЛ-1, что компенсаторно влечёт за собой повышение IL-1RA, чтобы уменьшить связывание ИЛ-1 с рецепторами. С другой стороны, синдром Шегрена характеризуется уменьшением уровня ИЛ-1 в слюне, что может вести к воспалению слизистой ротовой полости и её сухости.
Осложнения
Распространенные последствия синдрома Шегрена:
- лимфомы (новообразования, поражающие кровь, лимфоузлы);
- васкулит (воспалительный процесс в сосудах, который может возникать повсеместно);
- присоединение вторичной инфекции;
- развитие онкологических заболеваний;
- угнетение кровообразования, сокращение в крови лейкоцитов, эритроцитов и/или тромбоцитов.
Если больной долго не предпринимает никаких мер по лечению заболевания Шегрена или ему была назначена неверная терапия, патология прогрессирует, приводя к серьезным нарушениям работы органов и систем.
Лечение синдрома Шегрена
При наличии синдрома Шегрена лечение проводится в зависимости от стадии заболевания и наличия системных проявлений.
В целях стимуляции функции желез проводится:
- капельное введение контрикала.
- подкожное введение галантамина.
- с общеукрепляющей целью проводятся курсы витаминотерапии.
- в качестве симптоматического лечения назначаются «искусственные слезы» (капли в глаза) — с низкой вязкостью — Лакрисифи (200-250руб), Слеза натуральная (250 руб), средней вязкости Лакрисин, высокой вязкости Офтагель 180 руб, Видисик 200 руб, Лакропос 150 руб.
На начальных этапах при отсутствии поражения других систем и невыраженных лабораторных изменениях назначаются длительные курсы глюкокортикостероидов (преднизолон, дексаметазон) в небольших дозах.
Если симптоматика и лабораторные показатели значительно выражены, но нет системных проявлений, к кортикостероидам добавляются цитостатические иммунодепрессивные препараты — циклофосфамид, хлорбутин, азатиоприн. Поддерживающая терапия проводится этими же средствами в течение нескольких лет.
- При наличии симптомов системного поражения независимо от стадии заболевания сразу назначаются в высоких дозах кортикостероиды и иммунодепрессанты в течение нескольких дней с постепенным переводом на поддерживающие дозы.
- При генерализованном полиневрите, васкулите, поражении почек и других тяжелых проявлениях заболевания к вышеперечисленному лечению добавляются такие методы, экстракорпоральное лечение — плазмаферез, гемосорбция, плазменная ультрафильтрация.
- Остальные препараты назначаются в зависимости от осложнений и сопутствующих заболеваний — холецистит, гастрит, пневмония, эндоцервицит и др.
В определенных случаях необходимо соблюдение диетического питания и ограничение физических нагрузок.
Прогноз
Синдром Шегрена может повреждать жизненно важные органы с переходом в стабильное состояние, постепенным прогрессированием или, наоборот, длительной ремиссией. Такое поведение характерно и для других аутоиммунных заболеваний.
- Некоторые больные могут иметь слабо выраженные симптомы сухости глаз и ротовой полости, тогда как у других развиваются серьёзные осложнения. Одним пациентам полностью помогает симптоматическое лечение, другим приходится постоянно бороться с ухудшением зрения, постоянным дискомфортом в глазах, часто рецидивирующими инфекциями ротовой полости, отеком околоушной слюнной железы, затруднением жевания и глотания. Постоянный упадок сил и суставная боль серьёзно снижают качество жизни. У части пациентов в патологический процесс вовлекаются почки — гломерулонефрит, ведущий к протеинурии, нарушению концентранционной способности почек и дистальному почечному тубулярному ацидозу.
- Больные синдромом Шегрена имеют более высокий риск возникновения неходжкинской лимфомы по сравнению со здоровыми людьми и людьми, больными другими аутоиммунными заболеваниями. У около 5 % пациентов развивается та или иная форма лимфомы.
Кроме того, установлено, что у детей женщин, больных синдромом Шегрена во время беременности, более высокий риск развития неонатальной красной волчанки с врожденной блокадой сердца.
Профилактика
Специфических профилактических методов нет, так как не изучены до конца причины, вызывающие развитие синдрома. Есть общие рекомендации, которые позволяют уменьшить вероятность его появление. Они включают:
- Регулярные профилактические осмотры у врачей.
- Своевременное лечение инфекций, особенно ЛОР-направленности.
- Строгое соблюдение схем лечения, подобранных врачом.
- Исключение частых стрессов, эмоциональной перегрузки.
- Уменьшение нагрузки на органы зрения, пищеварения и речи.
- Отказ от солнечных ванн и посещения солярия.
- Прохождение вакцинации только по назначению врача.
Синдром Шегрена встречается у многих пациентов и сопровождается рядом неприятных признаков. Его лечение включает прием препаратов, ухудшающих работу иммунитета. Сохранить стабильное состояние можно только при комплексной терапии, подобранной стоматологом, гастроэнтерологом, окулистом и ревматологом. Лечение и профилактика определяются только врачами.