Боль в грудной клетке (торакалгия) является одним из самых серьезных симптомов, которые могут возникнуть у человека. Иногда даже врач не может сразу определить причину болей в груди и выяснить, не является ли этот симптом признаком состояния, угрожающего жизни.
- Боль в грудной клетке может быть в любой части и обусловлена заболеваниями сердца, легких, пищевода, мышц, костей, кожи.
- Из-за сложной иннервации организма, боль в груди может исходить из другой части тела.
- Боль в груди может быть обусловлена заболеваниями желудка или других органов брюшной полости.
Симптомы заболевания
Симптоматика данного заболевания достаточно проста и именно при данном варианте грудного остеохондроза обычно быстро и точно устанавливается диагноз. Клиническая картина представлена двумя основными и рядом сопутствующих симптомов:
- Боль в грудном отделе позвоночника. Боль может усиливаться при движениях, после статической физической нагрузки.
- Напряжение мышц грудного отдела позвоночника.
- Хруст в позвонках при движении.
- Дискомфорт, чувство ползания мурашек в межлопаточной области.
- Косвенным симптомом является усиление вышеперечисленных жалоб после переохлаждения, длительного нахождения в однообразной позе (работа за компьютером).
Чем отличается вертеброгенная торакалгия от торакалгии при ИБС?
*ИБС — ишемическая болезнь сердца.
Костно-суставные боли в грудном отделе позвоночника и грудной клетке
Н.В. ПИЗОВА
,
д.м.н, профессор, ГБОУ ВПО «Ярославская государственная медицинская академия» Минздрава РоссииВ статье подробно рассматриваются причины и механизмы возникновения вертеброгенных болевых синдромов. Представлен дифференцированный подход к терапии с учетом патогенеза и стадии основного заболевания. Описаны преимущества использования комбинированных препаратов (диклофенак и витамины группы В) в лечении пациентов с болью в спине.
Боль в спине — одно из наиболее частых страданий современного человека. С ней связаны существенные экономические потери, обусловленные временной и даже постоянной утратой трудоспособности у лиц молодого и среднего возраста. На боль в спине приходится до 6% всех прямых затрат на лечение различных заболеваний, 15% всех дней нетрудоспособности и 18% причин инвалидизации [1]. Острая и хроническая боль в спине могут быть проявлениями любого заболевания. И перед врачом любой специальности стоят две основные задачи — выявить причину боли и найти лекарственное средство, адекватно помогающее при ней.
Все болевые синдромы в спине можно классифицировать по следующим категориям:
1. по причине – вертеброгенные и невертеброгенные; 2. по механизму – рефлекторные, компрессионные, на фоне нестабильности позвоночно-двигательного сегмента (ПДС), сосудистые, воспалительные; 3. по локализации – локальные, отраженные и иррадиирующие; 4. по длительности – острые и хронические.
В течение жизни боли в спине возникают у 70–90% населения, а у 20–25% регистрируются ежегодно. У подавляющего большинства пациентов в результате проводимой терапии боли купируются в течение 4 недель. Вместе с тем у 73% больных в течение первого года развивается как минимум одно обострение [2, 3, 4]. Так, по данным российского исследования самой частой локализацией боли (576 пациентов – 60,6%) была спина. По данным медицинской документации, боль в спине расценивалась как дорсопатия у 417 (72,4%) пациентов и как следствие грыжи межпозвонкового диска у 104 (18,1%). У 34 (5,9%) больных установлены остеопоротические переломы тел позвонков, а у 21 – другие причины боли в спине [5].
Хронизация боли в спине отмечается в 20–25% случаев, причем на эту категорию больных приходится до 80% экономических затрат, связанных с болевым синдромом данной локализации [6]. Хроническая боль – это результат сложного взаимодействия между биологическими, психологическими, социальными и культурными факторами, которые затрудняют ее диагностику и лечение [7, 8]. Хронические боли в спине могут быть классифицированы как ноцицептивные, невропатические, воспалительные, дисфункциональные или могут быть смешанными, когда имеются характеристики нескольких типов боли [9]. Хотя причины их возникновения и клинические проявления отличны, механизмы, посредством которых эти типы боли возникают могут перекрываться, и у пациента может развиваться хроническая боль в спине с составляющими более чем одного типа боли.
Источником боли в спине может быть болевая импульсация, связанная как с самим позвоночником — вертебральные факторы (связки, мышцы, надкостница отростков, фиброзное кольцо, суставы, корешки), так и с другими структурами — экстравертебральные факторы (мышцы, висцеральные органы, суставы). Традиционно торакалгии, как и другие болевые синдромы, в зависимости от причины разделяют на вертеброгенные (патогенетически обусловленные изменениями позвоночника) и невертеброгенные болевые синдромы. К вертеброгенным торакалгическим синдромам относится поражение грудных корешков при грыже межпозвоночного диска, стенозе позвоночного канала, спондилолистезе и нестабильности, артропатический синдром при дегенеративном поражении дугоотростчатых и реберно-поперечных суставов. Вертеброгенные причины боли в грудном отделе позвоночника также включают относительно редко встречающиеся злокачественные новообразования позвоночника (первичные опухоли и метастазы), воспалительные (спондилоартропатии, в том числе анкилозирующий спондилит) и инфекционные поражения (остеомиелит, эпидуральный абсцесс, туберкулез), а также компрессионные переломы тел позвонков вследствие остеопороза. Причиной невертеброгенных болевых синдромов может служить патология внутренних органов и мышечные болевые синдромы, которые могут формироваться под влиянием как вертеброгенных, так и невертеброгенных изменений. Поэтому деление на вертеброгенные и невертеброгенные болевые синдромы можно считать достаточно относительным. Кроме того, возможной причиной невертеброгенной боли в грудной клетке являются психогенные болевые синдромы (панические атаки и гипервентиляционные нарушения).
Клинические синдромы при спондилогенной торакалгии включают в себя [10]:
1. локальный вертебральный синдром, часто сопровождающийся местным болевым синдромом, напряжением и болезненностью прилегающих мышц, болезненностью и деформацией, ограничением подвижности или нестабильностью одного или нескольких прилегающих сегментов позвоночника; 2. вертебральный синдром на удалении; 3. рефлекторные (ирритативные) синдромы: отраженная боль, мышечно-тонические, нейродистрофические синдромы, вегетативные (вазомоторные и т.д.) расстройства и др.; 4. компрессионные (компрессионно-ишемические) корешковые синдромы; 5. синдром сдавления (ишемии) спинного мозга.
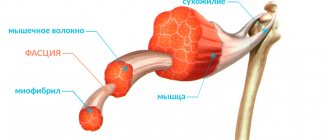
Вертеброгенные болевые синдромы условно делятся на рефлекторные (встречаются в 85–90% случаев) и компрессионные (наблюдаются в 10–15% случаев). Рефлекторные болевые синдромы возникают за счет раздражения рецепторного аппарата в мышцах, сухожилиях и фасциях, связках, суставах позвоночника, межпозвонковом диске и т.д. вследствие формирования участков ноцицепции с местной неспецифической воспалительной реакцией. В условиях активации синтеза и высвобождения провоспалительных и альгогенных субстанций (субстанция P, кинины, простагландины, лейкотриены, цитокины, оксид азота, фактор некроза опухоли и др.) повышается возбудимость (сенситизация) ноцицепторов. В результате формируется мощный поток ноцицептивной афферентации, который поступает через задние корешки в нейроны задних рогов спинного мозга, откуда по восходящим ноцицептивным путям достигает центральных отделов нервной системы (ретикулярной формации, таламуса, лимбической системы и коры головного мозга), вызывая в этих структурах NMDAзависимое увеличение концентрации внутриклеточного кальция и активацию фосфолипазы А2. Последняя стимулирует образование свободной арахидоновой кислоты и синтез простагландинов в нейронах, что, в свою очередь, усиливает их возбудимость [11, 12]. Одновременно в задних рогах спинного мозга поток болевых импульсов через вставочные нейроны активирует нейроны бокового рога с активацией адренергической (симпатической) иннервации и мотонейроны передних рогов спинного мозга. Активация последних приводит к спазму мышц, иннервируемых данным сегментом спинного мозга (сенсомоторный рефлекс). Мышечный спазм является дополнительным источником боли за счет активации ноцицепторов мышцы в связи с ее укорочением, развитием нейродистрофических изменений и нарушением микроциркуляции в мышечной ткани. В результате замыкается порочный круг «боль, неврогенное воспаление — усиление защитного мышечного напряжения, патологические изменения в мышцах — усиление боли», что способствует развитию стойкого рефлекторного мышечнотонического синдрома [11, 12, 13]. В норме существует строго сбалансированное взаимоотношение между интенсивностью стимула и ответной реакцией на него. Антиноцицептивная система осуществляет нисходящий ингибиторный церебральный контроль над проведением болевой импульсации, тормозит передачу болевых стимулов с первичных афферентных волокон на вставочные нейроны. Взаимодействие этих структур приводит к окончательной оценке боли с соответствующей поведенческой реакцией. Однако длительное сохранение ноцицептивной импульсации приводит к формированию устойчивых патологических связей, появлению выраженных дистрофических изменений в окружающих тканях, которые, в свою очередь, становятся источником болевых сигналов, тем самым усиливая периферическую болевую афферентацию, что способствует истощению антиноцицептивной системы [11, 12, 13]. Хроническому течению могут способствовать неадекватное лечение острой боли, чрезмерное ограничение физических нагрузок, «болевой» тип личности, пониженный фон настроения, в части случаев заинтересованность пациента в длительной нетрудоспособности, аггравация имеющихся симптомов или «рентное» отношение к болезни. При длительном течении заболевания происходят патологические изменения в корешках с развитием аксонального и/или демиелинизирующего процессов.
Термин «остеохондроз» был предложен в 1933 г. немецким ортопедом Hildebrandt для обозначения инволюционных изменений в опорно-двигательном аппарате [14]. Под остеохондрозом (греч. оsteon — кость, chondros — хрящ, osis — суффикс, обозначающий патологическое состояние) понимают врожденный или приобретенный дегенеративно-дистрофический каскадный процесс, в основе которого лежит дегенерация диска с последующим вторичным вовлечением тел смежных позвонков, межпозвонковых суставов и связочного аппарата. В свою очередь, межпозвонковый диск является компонентом межпозвонкового симфиза — сложного соединения позвонков в позвоночном столбе. В симфизах позвоночника в отличие от синовиальных суставов между поверхностями позвонков, покрытых гиалиновым хрящом, находится не синовиальная жидкость, а специфическое образование хрящевой природы — межпозвоночный диск, состоящий из пульпозного ядра и фиброзного кольца. Первое по морфологической структуре приближается к гиалиновому хрящу за счет высокого содержания протеогликанов, гиалуроновой кислоты, коллагена II типа и воды. Тогда как фиброзное кольцо относится к фиброзным хрящам с высоким содержанием коллагена (до 68%), преимущественно за счет коллагена I типа в наружных пластинах кольца, и богатым сульфитированными гликозаминогликанами, интегрированными в крупные молекулы протеогликанов, с характерной для них способностью удерживать воду [11, 15]. Тем не менее, несмотря на существующие различия в морфологической структуре синовиальных суставов и межпозвонковых симфизов, существует мнение о сходстве происходящих в них артрозных изменений, выраженных в нарушении равновесия анаболических и катаболических процессов в матриксе хряща [16]. Дисбаланс важнейших гомеостатических процессов приводит к снижению синтеза полноценных коллагенов и протеогликанов хондроцитами. Не является исключением и несульфатированный гликозаминогликан — гиалуроновая кислота, обеспечивающая образование агрегатов протеогликанов матрикса и гидратированность пульпозного ядра, играющего роль протекторной подушки (за счет гидратированности и изменения своего объема). Изменение качества и количества гиалуроновой кислоты при остеохондрозе приводит к снижению содержания связанной воды в пульпозном ядре и к деструкции коллагеновой сети, особенно в перицеллюлярных зонах хондроцитов [17, 18, 19]. Последнее связано в первую очередь с повышением синтеза металлопротеиназ (коллагеназа, стромелизин), приводящим в итоге к полному исчезновению перицеллюлярной коллагеновой сети, к потере амортизационных свойств межпозвонкового диска в целом.
Остеохондроз и спондилоартроз провоцируются идентичными патогенетическими факторами, в ответ на которые в задействованных структурах ПДС (включающего два смежных позвонка и межпозвонковый диск, собственный суставный, мышечно-связочный аппараты, сосудистую систему, а также соответствующий этому уровню участок спинного мозга, корешки и спинальные вегетативные ганглии с их связями в пределах данного сегмента) происходит выброс биохимически и иммунологически активных медиаторов, взаимодействующих с чувствительными рецепторами, что запускает, в свою очередь, сложные и еще не до конца изученные нейрофизиологические механизмы формирования болевых ощущений [11]. Установлено, что источником боли может служить анатомическая структура, иннервируемая немиелинизированными волокнами или содержащая субстанцию Р (либо сходные с ней пептиды) [20, 21]. Межпозвонковый диск долгое время считался индифферентным по отношению к генерации болевой импульсации образованием, так как в нем не было обнаружено нервных окончаний. Более детальные анатомические и гистохимические исследования показали наличие тонких нервных окончаний в наружной трети фиброзного кольца — на 1–2 сегмента выше или ниже своего выхода [11, 18, 19].
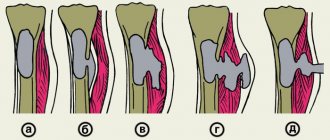
Другим источником боли принято считать дугоотростчатые (фасеточные) суставы, синовиальная капсула которых богато иннервируется суставными нервами, являющимися ветвями задних ветвей спинномозговых нервов, и малыми добавочными нервами от мышечных ветвей. Дугоотростчатые суставы вследствие их вертикальной ориентации оказывают очень небольшое сопротивление при компрессионных воздействиях, особенно при флексии. Вероятнее всего, что это небольшое сопротивление возникает за счет растяжения капсульных связок. В условиях экстензии на дугоотростчатые суставы приходится от 15 до 25% компрессионных сил, которые могут нарастать при дегенерации диска и сужении межпозвонкового промежутка [11, 21]. При резких неподготовленных движениях, связанных с вращением туловища, подъеме тяжестей, при работе с поднятыми над головой руками часто возникает фасеточный синдром. Патогенез данного синдрома связан со сближением суставных поверхностей дугоотростчатых (фасеточных) суставов и их блокированием при повышении нагрузки на сустав и его связочный аппарат. Боль, связанная с фасеточным синдромом в грудном отделе позвоночника, может варьировать от легкого дискомфорта до высокой интенсивности и приводить к выраженной инвалидизации. Она, как правило, усиливается при разгибании и уменьшается при сгибании позвоночника и может отражаться на переднюю поверхность грудной клетки. Ниже и выше уровня блокирования сустава нередко определяется рефлекторный спазм мышцы, выпрямляющей позвоночник [22, 23, 24, 25, 26].
Одной из причин болей в грудной клетке может быть синдром Титце, впервые описанный Tietze в 1921 г. Этот синдром является относительно редким состоянием, характеризующимся наличием неспецифического доброкачественного обратимого болезненного отека в области II (в 60% случаев) или III реберного хряща. В 80% случаев имеется одностороннее поражение, ограничивающееся одним реберным хрящом. Боль обычно хорошо локализована, однако может иррадиировать по всей передней поверхности грудной стенки, а также в надплечье и шею. Покраснение, повышение температуры и другие изменения кожи над областью поражения отсутствуют. Боль обычно регрессирует спонтанно через 2–3 недели, однако нередко беспокоит в течение нескольких месяцев, а резидуальный отек может сохраняться до нескольких лет. Обычно заболевание развивается в молодом или детском возрасте. Причины его неизвестны [22, 23, 24, 25, 26].
Одной из наиболее частых причин болей в грудной клетке является реберно-грудинный синдром. Данный синдром встречается значительно чаще, чем синдром Титце. При реберно-грудинном синдроме пальпация в 90% случаев выявляет множественные зоны болезненности: в левой парастернальной области, ниже левой молочной железы, в проекции грудных мышц и грудины. Локальный отек при реберно-грудинном синдроме отсутствует. Наиболее часто поражаются хрящи II и V ребер. При поражении верхних реберных хрящей нередко отмечается иррадиация боли в область сердца. Боль обычно усиливается при движениях грудной клетки. Заболевание чаще встречается у женщин после 40 лет [22, 23, 24, 25, 26].
Еще одной частой причиной болей в грудной клетке служит синдром «скользящего» ребра. Синдром характеризуется интенсивной болью в проекции нижнего края реберной дуги и увеличением подвижности переднего конца реберного хряща, как правило, X и реже VIII и IX ребер. Считается, что данное состояние имеет травматическое происхождение и связано с рецидивирующим подвывихом реберного хряща при ротации туловища. В отличие от вышерасположенных ребер, хрящевые части которых формируют грудино-реберные суставы, хрящевые части VIII–X ребер образуют сочленения с хрящевыми частями вышерасположенных ребер с помощью наружной межреберной мембраны. Эта зона является анатомически наиболее слабой областью грудной клетки, предрасположенной к травматизации. Вслед за повреждением хрящевого сочленения свободная хрящевая часть ребра отклоняется вверх, смещаясь в вертикальном или переднезаднем направлении при дыхании относительно вышележащего хряща, что сопровождается болью и характерным ощущением щелчка. Боль, как правило, носит острый или стреляющий характер, локализуется в верхнем квадранте брюшной стенки и провоцируется гиперэкстензией грудной клетки при подъеме рук вверх. В острой стадии заболевания пациент нередко принимает вынужденное положение с наклоном туловища вперед и в больную сторону для уменьшения напряжения мышц брюшной стенки, прикрепляющихся к реберным углам. В ряде случаев смещающийся реберный хрящ может травмировать надхрящницу вышерасположенного ребра и межреберный нерв. Патогномоничным для данного состояния является тест, описанный Holms, заключающийся в подтягивании согнутым пальцем края ребра кпереди. При этом воспроизводится типичный болевой паттерн, сопровождающийся характерным щелчком. Проведение подобной манипуляции на здоровой стороне не сопровождается описанным феноменом. Диагноз также может быть подтвержден инфильтрацией пространства между отделенным хрящом и ребром 5 мл 0,5% раствора лидокаина, приводящей к полному регрессу болевых ощущений через 10 мин после процедуры [22, 23, 24, 25, 26].
Диффузный идиопатический скелетный гиперостоз (болезнь Форестье) — заболевание, относительно часто встречающееся у лиц среднего и пожилого возраста, в основном у мужчин. Основными симптомами обычно являются боли легкой и умеренной интенсивности и ощущение скованности в грудном и поясничном отделах позвоночника. При осмотре определяется усиление грудного кифоза, ограничение объема движений в грудном отделе позвоночника и экскурсии грудной клетки. Часто выявляется локальная болезненность при пальпации грудного и поясничного отделов позвоночника. Для подтверждения диагноза диффузного идиопатического скелетного гиперостоза необходимо проведение рентгенографии позвоночника, которая выявляет гиперостоз, наиболее выраженный в грудном отделе и проявляющийся линейной оссификацией по передней поверхности четырех смежных позвонков и более с сохранением рентгенологического просветления между костными отложениями и телами позвонков, а также относительной сохранностью высоты межпозвонкового промежутка. Также характерно формирование остеофитов между телами соседних позвонков, смыкающихся между собой в виде «мостиков» [22, 23, 24, 25, 26].
Диагностика вертеброгенных болевых синдромов включает установление характера болей и их связь со статическими и динамическими нагрузками, выявление триггерных точек, симптомов натяжения нервных стволов. Важное значение для определения характера процесса, оценки степени имеющихся изменений имеют компьютерная и магнитнорезонансная томографии, рентгенография. Для определения функционального состояния корешков, определения места и стадии их поражения применяется электронейромиография [2, 6, 12, 13]. Уже при первом обследовании пациента следует исключать симптомы опасности («красные флаги»), которые общепризнаны при дорсалгиях, а именно обращать внимание на наличие лихорадки, локальной болезненности и местного повышения температуры в паравертебральной области, которые характерны для инфекционного поражения позвоночника. В пользу опухоли (первичной или метастатической) может свидетельствовать беспричинное уменьшение массы тела, злокачественное новообразование любой локализации в анамнезе, сохранение боли в покое и ночью, а также возраст пациента старше 50 лет. Компрессионный перелом позвоночника чаще отмечается при травме, применении кортикостероидов и у лиц старше 50 лет. При опухолевом поражении спинного мозга боль может быть постоянной или рецидивирующей, появляться в покое и уменьшаться при движении, часто приводит к нарушению сна, заставляя двигаться или спать в вынужденном положении, например сидя. На фоне постоянных болей часто отмечаются прострелы, провоцирующиеся кашлем или чиханьем. Выявляются двигательные и чувствительные нарушения, соответствующие уровню поражения. При сирингомиелии и рассеянном склерозе также могут отмечаться боли, локализация которых зависит от области поражения спинного мозга.
Другими причинами поражения грудных корешков могут являться опоясывающий герпес с развитием постгерпетической невралгии, сахарный диабет, а также переломы грудных позвонков. Боль в этих случаях, как правило, длительная, интенсивная, локализуется в зоне соответствующего сегмента, носит стягивающий или жгучий характер, часто сопровождается короткими прострелами, может быть ланцинирующей. Боль усиливается ночью и при движениях в грудном отделе позвоночника. Часто выявляется гиперестезия, гипералгезия и гиперпатия в пораженных сегментах. Для уточнения диагноза необходимо проведение рентгенографии, КТ, МРТ грудного отдела позвоночника. При травмах ребер могут поражаться межкостные нервы, что сопровождается острыми поверхностными, жгучими болями в зоне их иннервации. Боль усиливается при вдохе или при движении грудной клетки, напоминая боль при плеврите. Как правило, выявляется небольшой участок сегментарной гипералгезии или гиперестезии, возникающий даже при поражении одного нерва.
После выявления причины, механизма, характера и длительности болевого синдрома решается вопрос о подборе адекватной терапии. Лечение всегда должно быть индивидуальным. Оно зависит от характера основного заболевания и подразделяется на недифференцированную и дифференцированную терапию. Основными задачами недифференцированной терапии является уменьшение болевого синдрома или реакций пациента на боль и устранение вегетативных реакций. Главным направлением дифференцированной терапии болевых синдромов в спине является влияние на их патогенетические механизмы, лечение также зависит от фазы основного заболевания. Основные принципы консервативного лечения включают: 1) медикаментозное лечение с применением анальгетиков, нестероидных противовоспалительных препаратов (НПВП), дегидратации, сосудистых и флеботонических средств, ангиопротекторов, антигипоксантов, антиоксидантов, миорелаксантов, витаминов группы В, биостимуляторов, хондропротекторов, десенсибилизирующих средств, иммунокорректоров, нейропротекторов, метаболитов, антихолинестеразных, рассасывающих и вегетотропных препаратов; 2) рефлекторное лечение с использованием акупунктуры, лазерной терапии, физиотерапии, массажа (сегментарного), тепловых процедур, лечебной физкультуры (ЛФК), мануальной терапии, местно-раздражающих средств; 3) ортопедическое лечение с привлечением иммобилизации, тракционной терапии, массажа, ЛФК, мануальной терапии; 4) местно-анастезирующее лечение с назначением орошения хлорэтилом, блокад, аппликаций димексида, аналгезирующих и противовоспалительных мазей, гелей, пластырей.
Первая и принципиально важная задача, стоящая перед врачом, — максимально быстрое и эффективное купирование боли. НПВП являются наиболее широко используемыми препаратами для симптоматического купирования боли [27]. Они достаточно эффективны, удобны в использовании, недороги и в целом хорошо переносятся. Необходимо отметить, что эффективность НПВП как анальгетиков определяется не только периферическим действием, связанным со снижением синтеза простагландинов, а также иных медиаторов боли и воспаления в поврежденных или воспаленных тканях.
Наиболее широко используются НПВП из группы неселективных ингибиторов циклооксигеназы (ЦОГ). Основные рекомендации по использованию НПВП (в режиме монотерапии или в комбинации с другими анальгетическими препаратами): 1) их назначение целесообразно при острых или хронических заболеваниях и патологических состояниях, проявляющихся болями, связанными как с воспалительным, так и дегенеративным поражением органов опорно-двигательной системы, острой травмой и оперативными вмешательствами; 2) длительность применения НПВП зависит от длительности и интенсивности боли в конкретной ситуации; 3) для купирования острого болевого синдрома желательно назначать парентеральные формы НПВП или дающие максимально выраженный анальгетический эффект с минималным риском развития побочных явлений; 4) при длительном курсе лечения рекомендуются НПВП со средним или длительным периодом полувыведения перорально или в виде ректальных свечей. Эти препараты характеризуются хорошим обезболивающим и противовоспалительным действием, обеспечивают относительно быстрое устранение болевого синдрома.
В современной медицине признанным стандартом для лечения заболеваний с выраженным болевым синдромом признан диклофенак, который является одним из наиболее часто назначаемых обезболивающих препаратов. Как и другие НПВП, дилофенак угнетает активность фермента ЦОГ, участвующего в образовании простагландинов из арахидоновой кислоты. Диклофенак также угнетает активность фермента липоксигеназы. По данным российских исследований при одновременном назначении диклофенака и витаминов группы В отмечались более высокая величина показателя Сmax по сравнению с применением только одного диклофенака [28]. Чтобы увеличить лечебный эффект диклофенака, максимально уменьшив при этом его дозу, с помощью витаминов группы В был создан высокоэффективный комбинированный препарат Нейродикловит, в одной капсуле которого содержится 50,0 мг диклофенака, 50,0 мг витамина В1, 50,0 мг витамина В6 и 250,0 мкг витамина В12. Витамины группы В обладают широким спектром фармакодинамических свойств и участвуют в качестве коферментных форм в большинстве обменных процессов. Известно, что тиамин (витамин В1) оказывает существенное влияние на процессы регенерации поврежденных нервных волокон, обеспечивает энергией аксоплазматический транспорт, регулирует белковый и углеводный обмен в клетке, влияет на проведение нервного импульса, способствует развитию анальгетического эффекта. Пиридоксин (витамин В6) является кофактором для многих ферментов, действующих в клетках нервной ткани, участвует в синтезе нейромедиаторов антиноцицептивной системы (серотонина, норадреналина), поддерживает синтез транспортных белков и сфингозина – структурного элемента мембраны нервного волокна. обеспечивает доставку жирных кислот для клеточных мембран и миелиновой оболочки. Цианкобаламин (витамин В12) обеспечивает доставку жирных кислот для клеточных мембран и миелиновой оболочки. Применение витамина В12 способствует не только ремиелинизации (за счет активации реакции трансметилирования, обеспечивающей синтез фосфатидилхолина мембран нервных клеток), но и снижению интенсивности болевого синдрома, что связано с собственным антиноцицептивным действием высоких доз цианокобаламина [29]. В экспериментальных работах показано, что витамин В1 самостоятельно или в комбинации с витаминами В6 и В12, способен тормозить прохождение болевой импульсации на уровне задних рогов спинного мозга и таламуса [30]. Витамины группы В выполняют функцию коферментов в обмене веществ, в частности в нервной ткани, что усиливает обезболивающий эффект диклофенака. Используя витамины группы В в терапии болевого синдрома, следует помнить о том, что анальгетические свойства их уменьшаются соответственно: В12˃В6˃В1 и что поливитаминный комплекс (В1+В6+В12) обладает более выраженным обезболивающим действием, чем монотерапия витамином В1, В6 ли В12. При лечении острой боли в спине комбинация витаминов группы В с НПВС более эффективна, чем монотерапия НПВС [31]. Препарат применяется при воспалительных и дегенеративных заболеваниях суставов и позвоночника (хронический полиартрит, ревматический и ревматоидный артрит, анкилозирующий спондилит, остеоартроз, спондилоартроз). Нейродикловит обладает низкой частотой развития нежелательных осложнений и хорошей индивидуальной переносимостью, что позволяет рекомендовать его для широкого применения при лечении пациентов с костно-суставными болями в грудном отделе позвоночника и грудной клетке.
Основные лечебные мероприятия отдельных форм представлены в таблице 1.
Таблица 1. Основные лечебные мероприятия
| Нозологическая форма | Лечебные мероприятия |
| синдром Титце | Местные согревающие процедуры и применение НПВП. При высокой интенсивности болевого синдрома — инфильтрация пораженных сочленений местными анестетиками (0,25–0,5% раствор новокаина), иногда в сочетании с кортикостероидами. |
| реберно-грудинный синдром | Блокады межреберных нервов с местными анестетиками по задней подмышечной линии |
| синдром «скользящего» ребра | Разъяснение пациенту доброкачественной природы состояния, НПВП, блокады с местными анестетиками и кортикостероидами. При неэффективности перечисленных мероприятий иногда прибегают к резекции края ребра. |
| грудино-ключичный гиперостоз | НПВП, согревающие физиопроцедуры и упражнения, направленные на укрепление мышц спины. |
| фасеточный синдром | Инфильтрации пораженных суставов раствором местного анестетика, согревания болезненной области и активная лечебная физкультура, направленная на укрепление мышц брюшной стенки и мышцы, выпрямляющей позвоночник. |
Литература:
1. Statistisches Bundesamt. Health report for Germany: Federal Health Bulletin. Wiesbaden: Metzler-Poeschel; 1998. 2. Путилина М.В. Особенности диагностики и лечения дорсопатий в неврологической практике. Consilium medicum: журнал доказательной медицины для практикующих врачей. 2006;8(8):4448. 3. Федин А.И. Дорсопатии (классификация и диагностика). Атмосфера. Нервные болезни. 2002;2:28. 4. Manek N., MacGregor A.J. Epidemiology of low back disorders. Curr. Opin. Rheumatol. 2005;17(2):134140 5. Наумов А.В., Семенов П.А. Боль в России: факты и умозаключения. Consilium Medicum 2010;12(2):38–41. 6. Buchner M., Neubauer E., ZahltenHinguranage A., Schiltenwolf M. Age as a predicting factor in the therapy outcome of multidisciplinary treatment of patients with chronic low back pain a prospective longitudinal clinical study in 406 patients. Clin. Rheumatol. 2007;26:385392. 7. Hainline B. Chronic pain: Physiological, diagnostic, and management considerations. Psychiatr Clin North Am. 2005;28:713-5. 8. Morley S. Psychology of pain. Br J Anaesth. 2008;101:25-31. 9. Costigan M., Scholz J., Woolf C.J. Neuropathic pain: A maladaptive response of the nervous system to damage. Annu Rev Neurosci. 2009;32:1-32. 10. Справочник по формулированию клинического диагноза болезней нервной системы / Под ред. В.П. Штока, О.С. Левина. — М.: МИА, 2006. — 520 с. 11. Иванова М.Ф., Евтушенко С.К. Дорсалгия, обусловленная дегенеративнодистрофической патологией позвоночника. Новости медицины и фармации. 2010;15(335):1617. 12. Боль (практическое руководство для врачей) / Под ред. Н.Н. Яхно, М.Л. Кукушкина. — М.: Издательство РАМН, 2011. — 512 с. 13. Дамулин И.В. Боли в спине: диагностические и терапевтические аспекты. — М.: РКИ Северо пресс, 2008. — 40 с. 14. Мендель О.И., Никифоров А.С. Дегенеративные заболевания позвоночника, их осложнения и лечение. Русский медицинский журнал. 2006;14(4):34-39. 15. Шостак Н.А. Современные подходы к терапии боли в нижней части спины. Consilium mеdicum. 2003;5(8):457-461. 16. Ходырев В.Н., Голикова Л.Г. Клиническая эффективность алфлутопа при остеохондрозе позвоночника (12-месячное исследование). Научно-практическая ревматология. 2005;2:33-36. 17. Зборовский А.Б., Мозговая Е.Э. Алфлутоп: опыт многолетнего клинического применения. Фарматека. 2006;19:35-40. 18. Mense S. Pathophysiology of low back pain and transition to the chronic state — experimental data and new concepts. Schmerz. Der. 2001;15:413-420. 19. Камчатов П.Р. Острая спондилогенная дорсалгия — консервативная терапия. Русский медицинский журнал. 2007;15(10):64-74. 20. Голубев В.Л. Неврологические синдромы: Руководство для врачей / Под ред. В.Л. Голубева, А.М. Вейн. — 2-е изд., доп. и перераб. — М: МЕДпресс-информ, 2007. — 736 с. 21. Подчуфарова Е.В. Хронические боли в спине: патогенез, диагностика, лечение. Русский медицинский журнал. 2003;11(25):1395-1401. 22. Данилов А.Б. Кардиалгии и абдоминалгии. Болевые синдромы в неврологической практике / Под ред. Вейна А.М. — М.: Медпресс-информ, 2001. 23. Хабиров Ф. А. Клиническая неврология позвоночника. — Казань, 2003. — 472 с. 24. Подчуфарова Е.В., Яхно Н.Н. Боли в спине и конечностях // Болезни нервной системы: Руководство для врачей / Под ред. Н.Н. Яхно. — М., 2005. — Т. 2. 25. Bonomo L., Fabio F., Larici A.R. Non-traumatic thoracic emergencies: acute chest pain: diagnostic strategies. Eur. Radiol. 2002;12:1872-85. 26. Ho K.Y., Kang J.Y., Yeo B. Non-cardiac, non-oesophageal chest pain: the relevance of psychological factors. Gut. 1998;43:105-10. 27. Применение нестероидных противовоспалительных препаратов: Клинические рекомендации. Насонов Е.Л., Лазебник Л.Б., Беленков Ю.Н. и др. М.: Алмаз, 2006. 28. Журавлева М.В., Махова А.А., Ших Е.В. Место мильгаммы в комплексной терапии болевого синдрома в спине. Фарматека. 2013;19:1-4. 29. Зайченко А.В., Баринов А.Н., Махинов К.А., Брюханова Т.А. Лечение боли в спине, рефрактерной к НПВС Медицинский совет. 2013;12:2-8. 30. Пизова Н.В. Мильгамма и Мильгамма композитум в лечении неврологических заболеваний. Неврология, нейропсихиатрия и психосоматика. 2009;3-4:75-81. 31. ЭФ. Неврология и психиатрия. 2012;4:1-7.
Лечение
К сожалению, именно локализация остеохондроза в грудном отделе предполагает наименьшую эффективность, быстроту наступления эффекта от терапии. Также, нередко, сроки терапии остеохондроза грудного отдела увеличиваются до месяца и более. Лечение торакалгии должно осуществляться врачом-неврологом. Как и при других локализациях патологического процесса, в терапии используется стандартные противовоспалительные препараты (мелоксикам, диклофенак, целебрекс, аэртал и другие), миорелаксанты при имеющихся мышечно-тонических нарушениях (мидокалм, баклосан, сирдалуд), нейропротекторные препараты (витамины группы В, тиоктовая кислота и т.д.).
Хроническая торакалгия – болевой синдром вертеброгенного генеза
Хроническая вертеброгенная торакалгия отличается рецидивирующим длительным течением. периоды обострения болевых ощущений сменяются ремиссией, при которой любые неприятные ощущения отсутствуют и пациент считает себя полностью здоровым. Несмотря на ощущение общего благополучия даже в течение периода ремиссии синдром вертеброгенной торакалгии постоянно развивается. Происходит дальнейшее разрушение нервного волокна. Чем дольше протекает этот синдром, тем сложнее восстановить процесс нормальной иннервации мягких тканей грудной клетки.
Торакалгия как болевой синдром может присутствовать при целом ряде патологий. Напрмиер, болезненность в грудной клетке может наблюдаться при патологиях поджелудочной железы, толстого кишечника, желчного пузыря и печени. Этот синдром может указывать на общую интоксикацию организма и наблюдаться при дисфункции эндокринной системы.
Слабовыраженный синдром торакалгии грудного отдела может быть следствием остеопороза. на этот факт стоит обратить внимание пациентам, чей возраст перевалил через рубеж в 50 – 5 лет. В этом возрастном периоде может возникать вторичная недостаточность кальция. важно следить за состоянием толстого кишечника, проверять периодически состояние щитовидной железы, сдавать анализ крови для определения уровня витамина D.
У детей торакалгия вертеброгенного генеза может быть связана с рахитом, нарушением процесса формирования физиологических изгибов позвоночного столба. В подростковом возрасте практически в 100 % случаев развивающаяся торакалгия свидетельствует о нарушении осанки. В результат искривления позвоночного столба происходит перенапряжение мышц спины. Это вызывает резкую боль.
ЛФК упражнения
ЛФК упражнения очень важны, однако они малоэффективны в острой стадии. Ведь грудной отдел имеет ограниченную подвижность и спазм мышц возможно снять подчас лишь лекарственными препаратами. Однако как средство профилактики рецидива торакалгии, именно упражнения ЛФК стоят на первом месте. При заболевании показаны комплексы упражнений, на укрепления мышечного корсета, плавание, кардионагрузки с целью снижения лишней массы тела. Нежелательно заниматься единоборствами (риск травмы), тяжелой атлетикой (перегрузки), баскетболом (частые вертикальные нагрузки).