Острые краткосрочные осложнения сахарного диабета
Кетоацидоз
Диабетический кетоацидоз ДКА – острый дефицит инсулина. При поздней диагностике без лечения может привести к коме и смерти. Может развиться при любом типе СД, но чаще характерен для I типа.
Причины развития
Без инсулина глюкоза не поступает в клетки. В качестве источника энергии вместо нее организм начинает расщеплять жиры. В результате в избытке образуются токсичные кетоновые тела. В течение нескольких дней они поступают в кровь и мочу.
Ранние признаки патпроцесса:
- сухость во рту, жажда, сухость кожи;
- высокий уровень сахара в крови–13 ммоль/л и выше;
- постоянная усталость;
- частые мочеиспускания;
- снижение веса.
Когда уровень кетоновых тел в организме становится критическим, развивается острый кетоацидоз. Его симптомы:
- боль в животе, тошнота и рвота;
- характерный фруктовый запах изо рта (как правило чувствуют окружающие, а не сам больной);
- высокий уровень кетоновых тел в крови и моче;
- сонливость, вялость;
- частое, глубокое, иногда затрудненное дыхание;
- невозможность сконцентрировать внимание;
- нарушение сознания.
С момента появления рвоты патология начинает прогрессировать стремительно до угрожающего жизни состояния. При появлении перечисленных симптомов нужно срочно вызвать врача либо скорую помощь.
Лечебная тактика при симптомах ДКА
Сначала измеряют уровень глюкозы в крови. Если он 13 ммоль/л и выше, измеряют уровень кетоновых тел в моче с помощью тест-полосок.
Если этот показатель в норме:
- вводят инсулин короткого или ультракороткого действия;
- назначают обильное питье – в среднем 1 л/час;
- контролируют уровень сахара в крови и уровень кетоновых тел в моче каждые 4-6 часов (интервал определяет врач);
- проводят лечение сопутствующих патологий (если есть);
- ограничивают физическую активность до минимально возможной (она способствует более интенсивному образованию кетоновых тел).
Если уровень кетоновых тел выше нормы, показана инфузионная терапия (проводится в стационаре или дома под контролем врача).
Гиперосмолярная кома
Гиперосмолярная диабетическая кома – крайняя степень нарушения обмена вещества без кетоацидозана фонекритической гипергликемии (33 ммоль/л и выше). Организм обезвоживается, в крови повышается уровень азота, натрия и хлора. При поздней диагностике и терапии смертность при гиперосмолярной коме – 30-50%.
Причины состояния:
- кровопотери;
- значительное увеличение объема выводимой мочи – из-за приема диуретиков или других лекарств, диализа, введения солевых растворов;
- диарея и рвота;
- острые нарушения кровообращения;
- травмы и ожоги;
- тяжелые инфекционные заболевания.
Отягчающие факторы – повышение уровня глюкозы в крови и присоединение сопутствующих заболеваний.
Признаки гиперосмолярной комы
В течение 5-14 дней перед приступом наблюдается повышенная жажда и аппетит, частые и/или обильные мочеиспускания, упадок сил и мышечная слабость вплоть до полного прекращения двигательной активности.
Что делать
Необходимо вызывать скорую помощь – лечение проводят в реанимационном отделении или палате интенсивной терапии. Лечебная тактика включает:
- регидратацию – капельное внутривенное введение лекарственных растворов под контролем венозного и артериального давления, уровня обезвоживания и уровня электролитов в плазме крови;
- инсулинотерапию.
Гипогликемия
Снижение уровня глюкозы в крови ниже 3,9 ммоль/л. В сравнительно легкой форме неопасна: больной сам может восстановить нормальный уровень сахара. Тяжелые формы гипогликемии наносят вред клеткам головного мозга и опасны для жизни.
Состояние возникает:
- из-за передозировки инсулина;
- передозировки сахароснижающих препаратов;
- увлечения чувствительности к инсулину из-за физических нагрузок;
- местного нагрева, массажа, чрезмерной глубины инъекции;
- увеличения интервала между инсулином и едой;
- пропуска приема пищи;
- недостатка углеводов;
- голодания;
- замедления эвакуации содержимого желудка;
- приема алкоголя.
Признаки гипогликемии
Большинство пациентов чувствуют нарастание гипогликемии – у них появляются симптомы-предвестники:
- дрожь;
- сердцебиение;
- бледность;
- усталость;
- невозможность сосредоточиться;
- тревожность;
- потливость;
- повышение аппетита;
- нарушения чувствительности – мурашки, онемение и т. п.;
- ночные кошмары.
По мере снижения уровня сахара добавляются головокружения, нарушения речи и зрения, судороги. При гипогликемической коме человек теряет сознание.
Лечение
При гипогликемии важно восстановить нормальный уровень глюкозы крови. При сравнительно легких формах достаточно съесть сахар, конфету, кусочек шоколада, мед. При тяжелых формах нужно вызывать врача или скорую помощь. Внутривенно капельно больному вводят декстрозу либо глюкан.
Лактацидотическая кома
Резкое повышение уровня молочной кислоты в крови.
Причины
Развивается из-за дефицита кислорода в тканях при анемиях, шоке, отравлении угарным газом, алкоголем или некоторыми лекарствами. Может возникнуть на фоне болезней почек, печени, костного мозга, кровотечений. Причиной также может стать инфаркт миокарда, тяжелые заболевания или избыточные физические нагрузки.
Признаки лактацидотической комы
Состояние развивается стремительно, в течение нескольких часов. Основные проявления – боль за грудиной, понос, шумное дыхание, боль в животе и рвота, сонливость либо бессонница. Могут пропадать рефлексы и нарушаться двигательная активность – снижается мышечная деятельность или наоборот появляются непроизвольные движения. У больного понижается температура тела, перестает выделяться моча, снижается сократительная способность сердечной мышцы, формируются тромбы и даже некроз пальцев.
Лечение
- Капельное введение раствора соды, метиленового синего или триамина, а также малых доз инсулина на 5% глюкозе.
- В тяжелых случаях показано подключение к аппарату«искусственная почка».
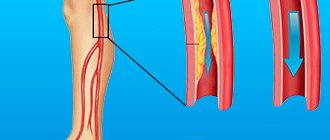
Поражение мелких сосудов при диабетической ангиопатии
При поражении мелких сосудов происходят изменения в их стенке, нарушается свертывание крови и замедляется кровоток. Все это создает условия для образования тромбов. В основном поражаются мелкие сосуды почек, сетчатки глаза, мышцы сердца, кожи. Наиболее ранним проявлением диабетической ангиопатии является поражение нижних конечностей.
Процессы, происходящие в сосудах, бывают двух типов: утолщение стенки артериол и вен или утолщение капилляров. Вначале под воздействием токсических продуктов, которые образуются при неполной утилизации глюкозы, набухает внутренний слой сосудов, после чего они сужаются. Первыми проявлениями диабетической ангиопатии являются мелкие кровоизлияния под ногтевую пластинку большого пальца стопы. Пациент ощущает боль в конечностях, замечает, что кожа становится бледной, на ней появляются пятна, ногти становятся ломкими, «усыхают» мышцы голеней. Пульс на основных артериях нижних конечностей не меняется, а вот на стопе он может быть слабым.
Могут определяться изменения артерий сетчатки глаза и появиться белок в моче. На коже стоп появляется специфический безболезненный пузырь, заполненный кровянистой жидкостью. Он заживает самостоятельно, рубец при этом не образуется, однако, в ткани могут попасть микроорганизмы и вызвать воспаление.
Для диагностики диабетической ангиопатии применяют такие методы исследования:
- капилляроскопия;
- инфракрасная термография;
- введение радиоактивных изотопов;
- лазерная флуометрия;
- полярография или оксигемография.
Поздние хронические виды осложнений сахарного диабета
Диабетическая микро- и макроангиопатия
Поражение стенок крупных сосудов и капилляров, сопровождающееся нарушением функционального состояния крови.
Причины
Возникает при декомпенсации диабета – при больших суточных колебаниях уровней глюкозы, белков и жиров. Отягчающие факторы развития – ожирение, гипертония, курение.
Признаки
Из-за метаболических нарушений поражаются сосуды органов-мишеней – сердца и конечностей, глазной сетчатки и почечных клубочков. Поступление кислорода к тканям из-за этого снижается, нарушается гормональный баланс и обменные процессы.
В результате:
- ухудшаются зрительные функции;
- развивается сердечно-сосудистая и почечная недостаточность;
- нарушается мозговая деятельность и нервная проводимость;
- развиваются трофические язвы на руках и ногах.
Без лечения ангиопатии прогрессируют и могут приводить к полной слепоте, ампутациям конечностей, инфарктам и интоксикациям, ухудшению умственных способностей.
Лечение
Диабетическая ангиопатия требует коррекции лечебной схемы, а также нормализации веса и артериального давления, отказа от курения.Кроме этого, врач может назначить препараты, укрепляющие сосудистую стенку – флавоноиды, венотоники и флеботоники.
Диабетическая полинейропатия
Поражение нервных окончаний вплоть до полной ишемии – потери чувствительности на пораженных участках.
Причины
Развивается при повышенном уровне сахара в крови – когда препарат или доза подобраны неправильно.
Признаки
Проявляется болью, нарушением чувствительности, онемением, ночными судорогами. При поражении крупных нервных волокон возможна утрата равновесия.
Лечение
Цель лечения – компенсация сахарного диабета. Также показаны средства, улучшающие нервно-мышечную проводимость и симптоматические препараты при болях и судорогах.
Диабетическая энцефалопатия
Поражение структур головного мозга – преимущественно нейронов и белого вещества. Развивается медленно и незаметно, поэтому нередко проявляется уже на поздних стадиях.
Причины
Типичные метаболические расстройства на фоне длительного течения сахарного диабета. Кроме этого, факторы риска – атеросклероз, гипертония, повышенный уровень С-пептида в крови.
Признаки
- ухудшения умственной деятельности – легкие и умеренные (слабоумие развивается редко);
- эмоциональная нестабильность;
- повышенная тревожность;
- склонность к депрессивным состояниям;
- синдром хронической усталости.
Лечение
Регулярные когнитивные скрининги и поддержание нормального уровня сахара в крови. Для улучшения мозговой деятельности назначают ноотропные, антиоксидантные, антиагрегантные и вазоактивные препараты, витамины группы В, Е и альфа-липоевую кислоту.
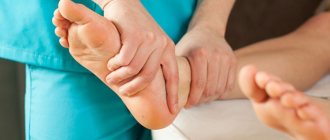
Синдром диабетической стопы
Гнойно-некротические и язвенные поражения стоп.
Причины
Состояние возникает из-за комплексных изменений на фоне диабетических патологий сосудов, нервов и тканей.
Признаки
Проявляется повышенной травматизацией и инфицированием тканей, гнойно-некротическими процессами, которые могут потребовать ампутации.
Лечение
- контроль и коррекция уровня глюкозы в крови;
- контроль и коррекция АД и уровня холестерина;
- профессиональный уход за стопами, ежемесячные осмотры врача-подолога;
- разгрузка стопы;
- антисептики и антибиотики при признаках инфицирования ран;
- обезболивающие средства;
- препараты,улучшающие нервную проводимость;
- лекарства, улучшающие кровоток.
При образовании флегмон и абсцессов показано их хирургическое вскрытие. По показаниям проводят пластику сосудов и стентирование. В крайних случаях могут понадобиться щадящие резекции или ампутации.
Диабетическая нефропатия
Поражение структур почек из-за диабетических нарушений обмена веществ.
Причины
Повышенный уровень сахара в крови вызывает повышение давления в почечных клубочках. Из-за этого почки начинают выводить с мочой белок. Со временем это вызывает фиброз почечных тканей. Фактор, ухудшающий прогноз, – сопутствующий атеросклероз.
Признаки
Болезнь годами протекает бессимптомно и в результате приводит к почечной недостаточности. Ее симптомы – резкое снижение суточного объема мочи и критическое нарушение процессов мочевыделения.
Лечение
Побор корректной лечебной схемы позволяет не допустить процесса и даже вызвать его обратное развитие на ранних стадиях болезни. Специфическое лечение проводят ингибиторами АПФ или блокаторами ангиотензинных рецепторов. Нередко назначают нефропротекторы; в тяжелых случаях – гемодиализ.
При повышенном уровне холестерина показаны статины, при гипертонии – гипотензивные препараты. Диабетикам с нефропатией назначают диету с умеренным ограничением животного белка. Также важно нормализовать вес и бросить курить.
Диабетическая ретинопатия
Поражение сосудов сетчатки глазных яблок.
Причины
Развивается из-за декомпенсации диабета. Из-за повышенного уровня глюкозы крови барьерные свойства тканей глазной сетчатки снижаются, просвет сосудов и кровоток в них увеличиваются, внутренняя стенка сосудов повреждается, капилляры становятся проницаемыми. Из-за повторяющихся кровоизлияний развивается дегенерация глазных структур.
Признаки
Диабетическая ретинопатия проявляется ухудшением зрения вплоть до полной слепоты. Возможна болезненность глаз.
Лечение
Ежегодное обследование у офтальмолога, специализирующегося на диабете, контроль уровня сахара и диетотерапия. Животные жиры заменяют растительными, исключают быстрые углеводы, вводят в рацион продукты-липотропы – рыбу, овсянку и творог – для нормализации уровня холестерина.
Также в меню включают больше фруктов и овощей (кроме крахмалистых). Нередко назначают витаминотерапию и ангиопротекторы. На 3-й и 4-й стадии диабетической ангиопатии может быть рекомендована лазерная фотокоагуляция.
Методы диагностики и лечения диабетической макроангиопатии
П
о данным Международной диабетической федерации в настоящее время в мире насчитывается 4,9 миллиона больных сахарным диабетом (СД) 1 типа и ожидается увеличение до 5,3 миллионов к 2011 году, в то время как количество больных СД 2 типа в мире 151 миллион, а к 2011 году ожидается 213 миллионов [1]. Это заболевание является весомым и независимым фактором риска атеросклероза. По современным представлениям клиническое течение и индивидуальный прогноз развития сахарного диабета зависят от степени распространенности и выраженности сосудистых расстройств при этом заболевании [1,2].
Большинство больных СД погибают от сердечно–сосудистых осложнений
, при этом ишемическая болезнь сердца (ИБС) занимает среди причин смерти лидирующие позиции. Риск развития ИБС и облитерирующих атеросклеротических поражений артерий нижних конечностей у лиц, страдающих СД, повышен в 3–5 раз [3]. ИБС развивается на фоне СД раньше, чем при его отсутствии, а течение заболевания чаще осложняется нестабильной стенокардией, инфарктом миокарда, угрожающими нарушениями ритма, быстрее развивается застойная сердечная недостаточность. Хронические облитерирующие заболевания артерий нижних конечностей (ХОЗАНК) у пациентов с СД характеризуются более тяжелым течением, возникновением в более молодом возрасте, отсутствием распределения по половому признаку, симметричностью поражения, более частым вовлечением в патологический процесс глубокой артерии бедра, подколенной артерии и сосудов голени [4]. Заболевание чаще осложняется появлением трофических нарушений дистальных отделов стопы, развитием гангрены и безболевых форм заболевания [5].
Изменение артериального русла при сахарном диабете как 1, так и 2 типа носит системный характер, в патологический процесс вовлекаются все жизненно важные органы, а нарушения преобладают на уровне микроциркуляции. Своевременное получение любых объективных дополнительных данных о состоянии артериального русла у больных СД трудно переоценить. В настоящее время общепринято мнение, что у больных СД чаще, чем в популяции в целом, развивается распространенный атеросклероз магистральных артерий
[3,6,7]. Диагностика этих заболеваний на фоне СД нередко затруднена, поскольку при таком сочетании ИБС и ХОЗАНК часто протекают бессимптомно, вплоть до безболевых форм. Поэтому лицам, страдающим СД, следует более активно проводить скрининговые исследования на ИБС и ХОЗАНК, особенно при сопутствующих факторах риска, для раннего выявления атеросклеротических поражений – до момента клинических проявлений заболевания.
Всем пациентам с СД необходимо проводить обычные и визуализирующие стресс–тесты, суточное мониторирование ЭКГ. При верифицированной ИБС наличие СД следует рассматривать, как дополнительный фактор в пользу проведения коронарографии для визуализации коронарного русла. Исследование, проведенное в Cleveland Clinic, показало, что у 90% пациентов, прошедших плановую коронарографию перед операцией на сосудах нижних конечностей, имеется атеросклероз коронарных сосудов разной степени выраженности, а у 28% была выявлена тяжелая трехсосудистая коронарная болезнь сердца [8].
С целью изучения гемодинамики в артериях нижних конечностей и топической диагностики поражений артериального русла используют следующие инструментальные методы исследования: ультразвуковая допплер–сфигмоманометрия, тредмил–тест, ультразвуковое ангиосканирование, в том числе дуплексное, транскутанная оксиметрия и рентгеноконтрастная аортоартериография.
Допплерография и сегментарная допплероманометрия
позволяют определить степень ишемических поражений, уровень и протяженность окклюзии, а также оценить состояние коллатерального сосудистого русла.
Фиксируемый допплеровский сигнал используется для измерения сегментарного систолического давления и анализа записанной на ленте допплеровской кривой. Большей объективизации измерения способствует вычисление индексов, т.е. относительных показателей. Наиболее часто используется лодыжечно–плечевой индекс (лодыжечный индекс давления) – ЛПИ, рассчитываемый, как отношение артериального систолического давления в передней или задней большеберцовой артерии к этому показателю в плечевой артерии. В норме ЛПИ составляет от 1,0 до 1,5. Снижение этого показателя ниже 1,0 указывает на поражение артерии проксимальнее или в месте измерения, Повышение индекса до 1,3 говорит о наличии нейропатии. Более высокие цифры систолического давления и ЛПИ на голени и стопе при сахарном диабете связаны со снижением эластичности берцовых артерий и артерий стоп (за счет склероза Менкеберга), которые противодействуют компрессии сосудов манжетой. В связи с этим измерение ЛПИ у больных СД является менее информативным тестом в оценке степени ишемии конечности, чем в общей популяции. Полученные результаты не всегда отражают клиническую картину заболевания. Иногда значения ЛПИ у больных СД не отличаются от нормальных даже при III–IV степенях ишемии конечности. В данной ситуации информативным оказывается измерение пальцевого систолического давления
(ПСД). Средняя оболочка пальцевых артерий обычно остается интактной, что позволяет получить достоверные результаты исследования. В норме ПСД несколько ниже, чем в плечевой артерии, и составляет 60% или более от ожидаемого систолического давления в артериях голени. Однако не у всех больных СД возможно произвести измерение ПСД из–за трофических изменений дистального отдела стопы [4].
В некоторых случаях для верификации диагноза облитерирующего атеросклероза артерий нижних конечностей могут дополнительно использоваться нагрузочные тесты. Стандартный тредмил–тест
проводится в течение не более 5 минут или до появления дискомфорта в области сердца, укорочения дыхания, появления одышки или сильной боли в ногах. Манжетка тонометра для определения давления в артериях голени, наложенная перед обследованием, остается на пациенте в течение всего исследования. Сразу же после окончания стресс–теста, через 2,5 и 5 минут производится измерение давления в артериях голени [9].
Ультразвуковое дуплексное сканирование
. Преимуществом метода является возможность неинвазивного получения изображения сосуда в реальном масштабе времени с регистрацией допплеровской кривой в выбранном участке сосуда в любой плоскости. Метод позволяет определить диаметр сосуда и толщину его стенок, визуализировать дополнительные эхообразования в просвете, оценить гемодинамические показатели – линейную и объемную скорости кровотока, индексы сопротивления.
Дуплексное сканирование сочетает 2 режима: двумерную серошкальную эхографию – В–режим и один из допплеровских режимов. Исследование артерий нижних конечностей проводится линейным датчиком, работающим в частотном диапазоне от 5 до 10 (15) МГц. Повышение частоты сканирования целесообразно для исследования сосудов дистальных отделов – стопы [10].
Атеросклеротический процесс сопровождается структурными и функциональными изменениями тканей сердца и периферической сосудистой системы. Маркером ранней диагностики доклинической стадии атеросклеротического процесса является толщина комплекса интима–медиа сонных артерий (КИМ). В крупном эпидемиологическом исследовании the Atherosclerosis Risk in Communities
(ARIC), которое включало больше 14000 мужчин и женщин в возрасте 45–64 лет, толщина КИМ пациентов с СД была на 0,08 мм больше по сравнению с сопоставимыми по полу, возрасту, национальности, привычке курения, ИМТ лицами без нарушения углеводного обмена. Также у пациентов с гипергликемией натощак и гиперинсулинемией без СД толщина КИМ была на 0,02 мм больше, чем в здоровой популяции [11].
Другим показателем, определяемым при помощи ультразвукового дуплексного сканирования и отражающим ранние стадии атеросклеротического процесса, является Модуль Юнга, который позволяет оценить эластико–тонические свойства артериальной стенки. Г.И. Кунцевич и соавт. показали, что Модуль Юнга и КИМ могут служить маркерами развития и прогрессирования атеросклеротического процесса у больных СД [2,12].
В последнее десятилетие отмечается большой интерес к изучению вазорегулирующей функции эндотелия при атеросклерозе и его факторах риска (ожирение, артериальная гипертония). Для оценки вазодилатирующей функции эндотелия в настоящее время в клинических исследованиях применяются два метода. Первый метод – химическая стимуляция мускариновых рецепторов эндотелия ацетилхолином, который вводится в артерию и вызывает эндотелий–независимую вазодилатацию (ЭНЗВД), измеряемую с помощью веноокклюзионной плетизмографии (ВОП). Второй метод – механическая стимуляция эндотелия повышенным кровотоком, которая оценивается по изменению диаметра артерии (чаще плечевой артерии) с помощью ультразвука высокого разрешения. Суть первого метода заключается в оценке при помощи ВОП кровотока предплечья при введении в плечевую артерию эндотелий–стимулирующих препаратов (ацетилхолин, метахолин, субстанция Р) и прямых вазодилататоров (нитроглицерин, нитропруссид натрия). Однако этот инвазивный метод менее удобен для повторных исследований динамики эндотелиальной дисфункции, а также для раннего выявления нарушенной функции эндотелия у лиц с факторами риска, еще до появления клинических признаков заболевания [13].
Широкое применение нашел разработанный Celermajer et al. в 1992 г. неинвазивный метод определения вазорегулирующей функции эндотелия потоком вызванной дилатации с применением ультразвука высокого разрешения
в сопоставлении с эндотелий–независимой вазодилатацией (ЭНЗВД) после сублингвального приема нитроглицерина [14,15,16]. Он основан на том, что под воздействием физического или химического стимула эндотелий регулирует сосудистый тонус путем высвобождения сосудосуживающих и сосудорасширяющих веществ, таких как эндотелин и оксид азота соответственно. Механическая стимуляция эндотелия плечевой артерии в пробе с реактивной гиперемией дает представление о состоянии ЭЗВД. Оценка индуцируемой потоком вазодилатации проводится по изменению диаметра плечевой артерии. Снижение ЭЗВД отражает дисфункцию эндотелия, которая обычно ассоциирована с наличием факторов риска ИБС.
В таблице 1 приведено несколько клинических исследований, посвященных изучению ЭЗВД у пациентов с СД [17]. В большинстве исследований выявлены нарушения ЭЗВД плечевой артерии наряду с сохраненной ЭНЗВД в ответ на нитраты, но в некоторых исследованиях нарушения эндотелиального ответа выявлено в обоих случаях. Изолированное повреждение эндотелиального ответа в дебюте СД, к которому по мере прогрессирования заболевания присоединяется нарушение ответа гладкомышечных клеток, может объяснять различия полученных результатов. Подтверждением этой гипотезы служит обнаружение дисфункции эндотелия у лиц с метаболическим синдромом (инсулинорезистентностью). Выявление вазоконстрикции при пробе с реактивной гиперемией у больных СД может свидетельствовать о наличии структурной патологии сердца и сосудов и гипертрофии левого желудочка и/или атеросклеротического поражения [18].
Значительным событием в развитии ультразвукового дуплексного сканирования стало использование цветного дуплексного картирования, позволяющего получить информацию о кровотоке в тех сосудах, которые не удается визуализировать с помощью дуплексного сканирования. Диагностическая ценность метода при этом увеличивается на порядок [19,20].
Транскутанная оксиметрия (Tc pO2)
относится к методам оценки микрогемодинамики. Транскутанное измерение напряжения кислорода позволяет оценить функциональное состояние сосудистой системы, т.е. наличие адекватного коллатерального кровотока, определить степень ишемии тканей, сделать правильный выбор между консервативным и оперативным методом лечения. Зная степень насыщения кислородом, можно прогнозировать возможность заживления язвенного дефекта (табл. 2) [4]. Точность проводимого теста зависит от комплекса системных (фракционная концентрация кислорода во вдыхаемом воздухе, состояние легочной системы, уровень гемоглобина крови и сердечный выброс) и местных (толщина кожи, архитектоника капиллярного русла и наличие или отсутствие воспаления и отека) факторов.
Идея бескровного измерения содержания кислорода в коже впервые была реализована в 1951 году M. Baumberger и R. Goodfriend, которые использовали для этого ртутный каплевидный электрод в подогретом буферном растворе, куда был помещен палец исследуемого пациента. При этом удалось обнаружить, что напряжение кислорода (рО2) в буферном растворе приближается к значению рО2 артериальной крови. Однако вследствие своей сложности и недостаточной точности получаемых данных эта методика в то время не нашла применения в клинической практике. Новые ее возможности открылись после изобретения мониторов с модифицированным электродом типа Clark для длительного определения рО2 со специальным нагревательным устройством. Создаваемая с помощью тепла локальная реактивная гиперемия вызывает местное усиление кровообращения и диффузию газов через мембрану электрода. Измеряемое таким электродом транскутанное напряжение кислорода (Тс рО2) достоверно коррелирует с рО2 артериальной крови как у новорожденных детей, так и у взрослых, и количественно характеризует кожный кровоток. Возможность изучения с помощью этих приборов кожного кровотока и его изменений способствовала широкому использованию данной методики при обследовании больных с облитерирующими заболеваниями сосудов нижних конечностей. В 1978 г. A. Tonnesen установил, что при поражениях периферических артерий нижних конечностей происходит значительное снижение Тс рО2 по сравнению с рО2 артериальной крови. Кроме того, он выявил корреляционную зависимость между тяжестью хронической артериальной недостаточности и Тс рО2 [9].
В 1984 г. Hauser et al. дополнили метод измерения Tc pO2 [21]. Было проведено сравнение результатов, полученных у пациентов с ишемией конечности в положении стоя, лежа и при подъеме ноги для определения степени тяжести поражения, прогнозирования вероятности заживления язвенного дефекта и выбора уровня необходимой ампутации. Был вычислен индекс местной перфузии (RPI) для каждой конечности, который определяется, как отношение показателя транскутанного напряжения кислорода в нижней конечности к показателю на груди, умноженный на 100. В исследовании было показано, что у пациентов с бессимптомным ХОЗАНК более достоверным является положение с поднятой конечностью, в то время как у пациентов с 3–4 ст. ишемии достоверной разницы в результатах получено не было. Также было выявлено преимущество метода измерения Tc pO2 по сравнению с методом измерения сегментарного давления в артериях голени у пациентов с сахарным диабетом.
Широко использовавшийся ранее метод реовазографии в настоящее время признан малоинформативным, и проведение этого исследования у больных сахарным диабетом нецелесообразно.
«Золотым стандартом
» диагностики облитерирующих заболеваний сосудистого русла остается
рентгеноконтрастное ангиографическое исследование
. С его помощью возможно точно определить локализацию, протяженность, степень и характер стеноза, множественность окклюзионных поражений магистральных артерий нижних конечностей, оценить состояние коллатерального русла, прогнозировать характер и объем реконструктивной операции, а также осуществлять контроль за эффективностью лечения и хирургического вмешательства. Также в последнее время получает распространение
магнитно–резонансная ангиография
, которая обладает высокой разрешающей способностью.
Лечение макроангиопатии
Поскольку СД представляет собой сочетание сразу нескольких факторов сердечно–сосудистого риска (гипергликемия, дислипидемия, артериальная гипертония, курение, избыточный вес), считается, что мероприятия по их устранению и коррекции должны начинаться рано и более активно. Принцип активного воздействия на факторы риска относится как к немедикаментозным профилактическим мероприятиям, так и к назначению лекарственных средств. Непременным базисным условием консервативного и хирургического лечения является компенсация углеводного обмена.
Одной из важнейших задач в лечении больных с ИБС и СД является проведение антиангинальной терапии
. Предупреждение/устранение болевых приступов у пациентов со стабильной стенокардией напряжения в значительной степени улучшает качество жизни больных. В настоящее время применяются препараты из группы нитратов, b-адреноблокаторов, антагонистов кальция. Традиционно лечение стенокардии начинается с назначения нитратов, которые улучшают толерантность к физической нагрузке. С появлением новых селективных b-адреноблокаторов (небиволол) описанные раннее их отрицательные эффекты (ухудшение липидного спектра, сглаживание ощущения гипогликемии) обычно незначительны, и в настоящее время СД не рассматривается, как противопоказание к назначению данной группы препаратов. Следует отметить, что небиволол заметно отличается от ряда традиционных b-блокаторов тем, что стимулирует синтез эндогенного N0 в клетках эндотелия, вызывая тем самым релаксацию гладкомышечных клеток в артериях и физиологическую вазодилатацию.
Следующим важным этапом в лечении диабетической макроангиопатии является коррекция нарушений липидного обмена
. Контроль за уровнем липидов сыворотки крови необходимо осуществлять при первичном обращении к врачу, в случае выявления нормального липидного спектра – ежегодно, а при выявлении гиперлипидемии – 1 раз в 3 месяца. Если при соблюдении диеты с ограничением животных жиров, снижении веса, устранении факторов риска, достижении компенсации углеводного обмена уровень общего холестерина превышает 4,8 ммоль/л, а триглицеридов 1,7 ммоль/л (European Diabetes Policy Group, 1998–1999), то рекомендован прием гиполипидемических препаратов. В настоящее время имеется несколько групп препаратов, нормализующих липидный спектр крови (табл. 3).
К радикальной терапии рефрактерных к лечению гиперлипидемий относятся хирургические методы (шунтирование тонкого кишечника, плазмаферез ЛПНП) [22].
Следующим важным этапом является коррекция нарушений свертывающей системы крови
. В связи с повышенным риском тромбозов и тромбоэмболий при СД в тех случаях, когда имеются показания к назначению антикоагулянтной терапии пациентам с СД, ее следует проводить с учетом всех показаний и противопоказаний и контролем за ходом лечения. Хорошими антитромботическими свойствами обладает такое распространенное средство, как ацетилсалициловая кислота. В свете имеющихся на сегодняшний день данных антиагрегационная терапия с использованием ацетилсалициловой кислоты, ингибирующей выработку тромбоксана тромбоцитами, является наиболее доступным средством в профилактике тромботических осложнений. К другим препаратам, влияющим на реологические свойства крови, относятся пентоксифиллин и дипиридамол. Данные проведенных мультицентровых исследований показывают, что применение антиагрегационной терапии в качестве стратегии вторичной профилактики развития ИБС и ХОЗАНК позволит снизить заболеваемость сердечно–сосудистыми заболеваниями на 25%, инфарктом миокарда на 30%, а смертность соответственно на 15% [23]. В последние годы распространение получила терапия простаноидами (алпростадил) и антикоагулянтами (гепарин, сулодексид, фраксипарин). Широко используемый раннее гепарин является антикоагулянтом прямого действия, влияет непосредственно на факторы свертывания крови, уменьшает агрегацию тромбоцитов. Он относится к группе препаратов, обладающих антитромбиновой активностью, действие которых опосредуется эндогенными кофакторами, в основном АТ III. Антитромбины назначают для предупреждения развития тромботических осложнений. В настоящее время большое внимание уделяется использованию низкомолекулярных гепаринов (сулодексид, фраксипарин) в лечении нарушений свертывающей системы крови у больных СД. Они обладают комплексной антикоагулянтной активностью (блокада каскада коагуляции на более ранних этапах, угнетение высвобождения фактора фон Виллебрандта, увеличение высвобождения ингибитора тканевого фактора), что позволяет надеяться на их более высокую эффективность. У пациентов с диабетической макроангиопатией, которые имеют высокий риск тромботических осложнений, низкомолекулярные гепарины являются основным средством с антитромбиновым механизмом действия.
Высокоэффективным методом консервативного лечения больных с ХОЗАНК и СД стопы является внутривенное введение простагландина Е1
. Препарат обладает сосудорасширяющим действием, уменьшает агрегацию тромбоцитов, повышает фибринолитическую активность плазмы. Около 60% больных на фоне лечения отмечают выраженное клиническое улучшение. Если же явления критической ишемии купированы первичным курсом, то больной переводится на стандартную дезагрегантную терапию. Более того, показания к длительной инфузии препаратов простагландина Е1 (сроком до 30–40 дней) возникают очень часто у больных с ишемической формой диабетической стопы на фоне тотальной окклюзии артерий голени и стопы, когда нет возможности выполнить стандартную реконструктивную операцию на магистральных артериях конечности. Исходя из этого, становится ясной возможность использования препаратов простагландина Е1 в плане предотвращения ампутации и в комплексной терапии больных на фоне поражения магистральных артерий нижних конечностей.
Наличие СД, следствие диффузного характера поражений артерий, высокой частоты рестенозов после стентирования и окклюзии шунтов, ухудшает операционный и послеоперационный прогноз при ангиопластике коронарных артерий, операции коронарного шунтирования (АКШ), чрескожной баллонной ангиопластике, стентировании и протезировании сосудов нижних конечностей. По результатам ретроспективных исследований пациентам с СД и ИБС предпочтительнее проводить АКШ
. При наличии у больного стеноза подвздошных артерий проводится транслюминальная ангиопластика. Пролонгированные стенозы или окклюзии при сохраненных путях оттока являются показанием к выполнению стандартных шунтирующих операций: аорто–бедренное, бедренно–подколенное, бедренно–тибиальное шунтирование. При дистальной форме поражения артериального русла конечности больным может быть выполнена артериализация венозного кровотока стопы.
В заключение следует подчеркнуть необходимость ранней диагностики диабетической макроангиопатии и своевременного назначения адекватной патогенетической терапии с целью предупреждения прогрессирования атеросклеротического процесса. Лечение диабетической макроангиопатии должно быть комплексным. Наряду с коррекцией метаболических нарушений (гипергликемия, дислипидемия) необходим строгий контроль уровня артериального давления, назначение комбинированной антигипертензивной терапии с достижением целевого уровня артериального давления, исключение других факторов риска прогрессирования атеросклероза, применение препаратов, улучшающих реологические свойства крови.
Литература:
1. Дедов И.И., Шестакова М.В. Сахарный диабет.//Универсум паблишинг Москва, 2003.
2. Кунцевич Г.И. Ультразвуковая диагностика в абдоминальной и сосудистой хирургии//Минск, 1999.
3. Stamler J, Vaccaro O, Neaton DJ. et al.//Diabetes Care, –1993; –16, –pp. 434 – 444.
4. Дедов И.И., Анциферов М.Б., Галстян Г.Р., Токмакова А.Ю. Синдром диабетической стопы.//М.: Федеральный диабетологический центр МЗ РФ, 1998.
5. Jude EB, Oyibo SO, Chalmers N, Boulton AJM. Peripheral arterial disease in diabetic and nondiabetic patients.//Diabetes Care, –2001; –24, –pp. 1433 – 1437
6. Kannel CW et al. Fibrinogen and risk of cardiovascular disease: The Framingham Study.//JAMA, –1997; –258, –pp. 1183–1186.
7. TransAtlantic Inter–Society Consensus (TASK). Management of peripheral arterial disease.//J Vasc Surg, –2000; –1 (suppl) 1 – 296.
8. Hertzer NR, Beven EG, Young JR, et al. Coronary artery disease in peripheral vascular patients: a classification of 1000 coronary angiograms and results of surgical management.//Ann Surg, –1984; –199, –pp. 223 – 233.
9. Levin and O’Neal’s. The diabetic foot. – 6th edition/ edited by J. H. Bowker, M.A. Pfeifer. 2001.
10. Лелюк В.Г., Лелюк С.Э. Ультразвуковая ангиология.//М.: Реальное время, 1999.
11. Folsom AR, Eckfeldt JH, Weitzman S, et al. Relation of carotid artery wall thickness to diabetes mellitus, fasting glucose and insulin, body size, and physical activity.//Stroke, –1994; – 25, –pp. 66 – 73.
12. Кунцевич Г.И., Барабашкина А.В. Оценка состояния артриального русла у больных сахарным диабетом с помощью цветного доплеровского картирования и импульсной допплерографии.//М., 1998.
13. Затейщикова А.А., Затейщиков Д.А. Эндотелиальная регуляция сосудистого тонуса: методы исследования и клиническое значение.//Кардиология, –1998; – 9, –с. 68–80.
14. Celermajer DS, Sorensen KE, Gooch VM et al. Non–invasive detection of endothelial dysfunction in children and adults at risk atherosclerosis //Lancet, –1992; –Vol. 340, – pp. 1111–1115.
15. Celermajer DS, Sorensen KE, Spiegelhalter DJ et al. Aging is associated with endothelial dysfunction in healthy men years before the age–related decline in women //J. Amer. Coll. Cardiology, –1994; –Vol. 24, –pp. 471–476.
16. Corretti MC, Anderson TJ, Benjamin EJ, Celermajer D, Charbonneau F, Creager MA, Deanfield J, Vallance P, Vita J, Vogel R. Guidelines for the ultrasound assessment of endothelial–dependent flow–mediated vasodilatation of the brachial artery.A Report of the International Brachial Artery Reactivity Task Force.//J Am Coll Card, –2002; –vol 39, – pp. 257 – 265.
17. Storey AM, Perry CJ, Petrie JR. Endothelial dysfunction in type 2 diabetes.//The British J of Diabetes and Vascular disease, –2001; –Vol 1, Issue 1, –pp. 22 – 27.
18. Карпов Р.С., Кошельская О.А., Тарбокова А.Ю., Ефимова Е.В., Атрошенков А.В., Груздева О.В., Семина Е.А. Макрососудистая реактивность у больных сахарным диабетом 2 типа в сочетании с артериальной гипертензией.//Сахарный диабет, –2001; –2, –с. 37 – 39.
19. Hatsukami TS, Primozich SF, Zierler RE. Color Doppler imaging of infrainguinal arterial occlusive disease//J Vasc Surg, –1992; 16, –pp. 51 – 56.
20. Vascular Surgery//Ed. R.B. Rutherford. – Philadelphia: W.B. Saunders. – 1995. – Vol. 1–2. – 2033 p.
21. Hauser CJ, Klein SR, Hehringer CM, et al. Superiority of transcutaneous oximetry in noninvasive vascular diagnosis in patients with diabetes.//Arch Surg, –119: 690, – 1984.
22. Аронов Д.М. Лечение и профилактика Атеросклероза//М.: Триада Х, 2000, –с. 18–21.
23. Colwell JA. Aspirin therapy in diabetes [position statement].//Diabetes Care, –1997; – 20, –pp. 1772 – 1773.
Профилактика осложнений сахарного диабета:
- корректная схема лечения – правильно подобранный препарат и доза (уровень сахара постоянно в норме);
- выполнение всех назначений врача;
- нормализация веса;
- нормальная двигательная активность;
- достаточный сон;
- сбалансированный рацион;
- регулярные осмотры эндокринолога, сосудистого хирурга, невропатолога, офтальмолога, подолога, нефролога.
Профессиональный врачебный контроль, самодисциплина пациента и здоровый образ жизни позволяют свести осложнения диабета к минимуму или даже вообще их не допустить.
Поражение крупных сосудов при диабетической ангиопатии
При диабетической ангиопатии могут поражаться средние и крупные сосуды. В них утолщается внутренняя оболочка, откладываются соли кальция и образуются атеросклеротические бляшки.
Проявление заболевания в этом случае аналогичны тем, которые бывают при поражении мелких артерий. Беспокоит боль в стопах, они становятся холодными и бледными, нарушается питание тканей, которые со временем отмирают. Развивается гангрена пальцев, а затем и стоп. Диабетическая ангиопатия внутренних органов
При сахарном диабете патологическим процессом чаще всего поражаются сосуды сетчатки глаза и внутренних органов. Это происходит вследствие образования токсических продуктов при неполном «сжигании» глюкозы. Почти у всех пациентов, имеющих повышенное содержание глюкозы в крови, отмечается заболевание сетчатки, которое называется ретинопатия. При этом заболевании вначале снижается острота зрения, а затем в сетчатку изливается кровь, и она отслаивается. Это приводит к полной потере зрения.
Вторым органом-мишенью, сосуды которого поражаются при сахарном диабете, являются почки – развивается нефропатия. В начальных стадиях заболевание ничем себя не проявляет, изменения можно выявить только во время обследования пациента. Спустя пять лет нарушается функция почки и в моче появляется белок. Если изменения выявлены на этой стадии, то они еще могут быть обратимыми. Но в том случае, когда лечение не проводится, патологический процесс в сосудах почек прогрессирует, и через десять лет появляются видимые признаки заболевания. Прежде всего, с мочой начинает выделяться большое количество белка. Его становится меньше в крови, а это приводит к скоплению жидкости в тканях и отекам. Вначале отеки видны под глазами и на нижних конечностях, а затем жидкость скапливается в грудной и брюшной полостях организма.
Организм начинает использовать для жизнедеятельности собственные белковые вещества, и пациенты очень быстро теряют в весе. У них появляется слабость, головная боль. Также в это время повышается артериальное давление, которое упорно держится на высоких цифрах и не снижается под воздействием медикаментов.
Финалом диабетической ангиопатии почек является конечная стадия почечной недостаточности. Почки практически полностью отказывают, они не выполняют своей функции, и моча не выделяется. Происходит отравление организма продуктами белкового обмена.