Симптомы
Признаки болезни различны, они зависят от того, где именно локализованы амилоидные отложения, насколько сильно распространена болезнь, есть ли осложнения. Зачастую наблюдается комплекс симптомов, отражающих поражение нескольких органов.
При амилоидозе ЖКТ наблюдаются:
- увеличение языка;
- трудности с глотанием;
- нарушение стула;
- изжога, тошнота;
- боли в животе.
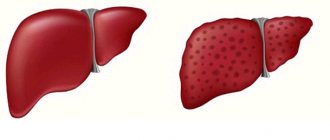
Признаки амилоидоза печени:
- изменение размеров печени;
- боли в подреберье справа;
- тошнота, отрыжка;
- желтуха.
Для амилоидоза поджелудочной присуща боль в левом подреберье слева тупого характера.
Амилоидоз сердца выражается в нарушении ритма, поражениях миокарда, сердечной недостаточности.
Амилоидоз нервной системы имеет следующие симптомы:
- периферическая полиневропатия (онемение конечностей, чувство покалывания, жжения);
- головные боли, головокружение, повышенное потоотделение;
- недержание мочи и кала;
- половая дисфункция.
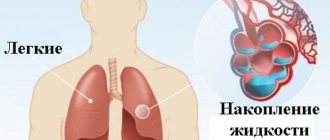
При амилоидозе органов дыхания наблюдается хриплость голоса, бронхит.
Случай первичного амилоидоза с преимущественным поражением сердца, легких и плевры
За последние десятилетия представления об амилоидозе радикально изменились, что связано с установлением гетерогенности белкового состава амилоидных фибрилл. На основании специфичности белка амилоида строится современная классификация. Разделяют системные и локальные формы амилоидоза. Распространенность АL–амилоидоза, по данным Национального центра медицинской статистики США, составляет 4,5 случая на 100000 [1]. Рост заболеваемости, стандартизированный по возрасту, составляет 5,1–12,8 на миллион человеко–лет, что составляет примерно 3200 новых случаев в год в США [2]. В настоящее время считается, что в основе развития первичного идиопатического амилоидоза лежит доброкачественная плазмаклеточная дискразия костного мозга. Аномальный клон плазматических клеток продуцирует амилоидогенные иммуноглобулины, представляющие легкие цепи моноклонального иммуноглобулина, чаще лямбда (л), реже каппа–типа (k) (их соотношение составляет 3:1). Аминокислотный анализ показывает, что некоторые аминокислоты в вариабельных участках легких цепей этих иммуноглобулинов занимают необычную позицию, что приводит к нестабильности и склонности к фибриллогенезу. Отмечено, что наиболее часто встречаемые подгруппы легких цепей в АL–депозитах представлены л VI и I типами. Это позволяет предполагать, что именно они считаются амилоидогенными. В дальнейшем происходит процесс преципитации амилоидных белков в тканях органов–мишеней [3]. Основные органы–мишени при АL–амилоидозе – сердце, почки, желудочно–кишечный тракт, респираторная система и другие органы. Клиническая картина первичного амилоидоза многообразна и обусловлена прежде всего преимущественным поражением тех или иных органов. Первыми симптомами заболевания являются слабость и снижение веса. Поражение сердечно–сосудистой системы, по данным О.М. Виноградовой (1980), клинически встречается у 70% больных, при анатомическом исследовании – в 87% случаев. Патология сердца является ведущим проявлением первичного амилоидоза и в первую очередь характеризуется поражением миокарда. Амилоид откладывается межмышечно, периваскулярно, вызывая атрофию мышечных волокон. Миокард теряет свою эластичность, становится ригидным, в результате чего страдает функция диастолического расслабления. Полости левого и правого желудочка не дилатируются, а полости предсердий резко расширяются. Развивается кардиомегалия, вплоть до cor bovinum. Увеличение массы миокарда бывает настолько выраженным, что на вскрытии сердце занимает большую часть грудной клетки (масса сердца может доходить до 1 кг). Депозиты амилоида могут располагаться в проводящей системе сердца, что приводит к различным нарушениям ритма и может стать причиной внезапной смерти [4]. Отложение амилоида также происходит и в стенках коронарных сосудов, вызывая ишемию миокарда. Вовлечение клапанного аппарата встречается у 12–15% больных и в 35% при анатомических исследованиях. Как правило, отмечается утолщение, деформация клапанов с развитием их недостаточности, а при отложении в области фиброзного кольца формируется стеноз [5]. Наиболее типичными признаками, выявляемыми при инструментальном обследовании, являются низкий вольтаж ЭКГ, аритмии и нарушения проводимости, патологические зубцы Q, симулирующие инфаркт миокарда; ЭхоКГ признаки: симметричное утолщение стенок желудочков, картина рестриктивной кардиомиопатии с признаками диастолической дисфункции; многие авторы описывают эхопозитивные включения в миокарде в виде мелких гранул, которые считаются частицами амилоидных включений, возможен перикардиальный выпот [6]. Поражение респираторной системы при системных формах амилоидоза встречается достаточно часто. Так, по данным О.М. Виноградовой (1980), клинические признаки поражения респираторной системы наблюдались у 50% больных и у 83% по патологоанатомическим данным. Выделяют диффузное и локальное поражение легких. Weis (1960) в своей классификации выделял генерализованный амилоидоз, подразделяемый на нодулярный и диффузный легочный и ограниченный амилоидоз, в котором отдельно выделялся трахеобронхиальный и изолированный нодулярный легочный амилоидоз. Впоследствии были описаны смешанные диффузно–нодулярные формы амилоидоза). John L. Berk выделяет 5 форм экстраваскулярного поражения легких при АL–амилоидозе [7]: 1. Диффузно–интерстициальное, или альвеолярно–септальное поражение, при котором амилоид откладывается между эндотелием сосудов и альвеолярным эпителием легочного интерстиция. 2. Нодулярное отложение. 3. Поражение плевры. 4. Интра– и экстраторакальная аденопатия. 5. Поражение диафрагмы, встречающееся крайне редко. Отдельного внимания заслуживает диффузно–интерстициальная форма, поскольку именно она сочетается с кардиопатическим вариантом течения первичного амилоидоза и часто не диагностируется, так как ее клинико–рентгенологическая картина принимается за проявления застойной сердечной недостаточности. John L. Berk [7] представлял данные аутопсии 12 АL–пациентов: у всех определялись депозиты в интерстиции, альвеолярных перегородках, на базальных мембранах между клетками альвеолярного эпителия и клетками эндотелия капилляров, стенках мелких сосудов и воздушных путях. Несмотря на распространенные гистологические проявления амилоидного поражения, у 64% пациентов отсутствовали клинические признаки поражения дыхательных путей. Только в 1 случае из 12 поражение легких предопределило исход заболевания. По данным других авторов, диффузно–интерстициальное поражение явилось причиной смерти 10% пациентов. Клиническими признаками этого варианта являются прогрессирующая одышка и сухой приступообразный кашель. При исследовании функции внешнего дыхания выявляется рестриктивный тип вентиляционных нарушений. При рентгенологическом и КТ–исследовании отмечают диффузное усиление легочного рисунка за счет сосудистого и интерстициального компонента. Поражение плевры при AL–амилоидозе встречается редко и наблюдается приблизительно у 6% пациентов (по данным О.М. Виноградовой, составляет 6,6%). John L. Berk указывает 6% [8], характеризуется формированием плеврита агрессивного течения и торпидного к проводимой диуретической терапии. Плевральный выпот может быть односторонним, но чаще – билатеральный. Преимущественно носит транссудативный характер, хотя бывают и экссудаты. В цитограмме преобладает лимфоцитоз. Плевральный выпот весьма часто встречается у больных с амилоидной кардиомиопатией, поэтому развитие плеврального выпота связывается с декомпенсированной сердечной недостаточностью. Однако проведенное исследование медицинского центра Бостонского университета, включавшее 636 пациентов за период 1994–2001 гг., опровергает это мнение [8]. Анализировались две группы пациентов с АL–амилоидозом: в первую входили пациенты с амилоидным поражением сердца и плевральным выпотом (35 чел.), вторая группа с амилоидной кардиомиопатией без плеврального выпота (120 чел.) [8]. Результаты исследования показали, что дисфункция левого желудочка и низкое онкотическое давление плазмы не являются основополагающими в развитии плеврального выпота. Образование плеврального выпота связано в первую очередь с отложением амилоида в межклеточных промежутках, в субмезотелиальных лимфатических сосудах. Амилоидные депозиты ингибируют резорбцию плевральной жидкости, в результате чего страдает дренажная способность плевры. В свою очередь, амилоидные отложения изменяют и секреторную функцию плевры [9]. Диагностика амилоидоза сложна и требует проведения комплекса лабораторно–инструментальных исследований, но окончательно диагноз должен быть подтвержден морфологически. Изменения лабораторных данных неспецифичны и отражают нарушение функции того или иного пораженного органа. У 85% пациентов при иммуноэлектрофоретическом исследовании сыворотки белка и мочи выявляется моноклональный парапрoтеин, который представлен легкими цепями иммуноглобулинов чаще л–, реже к–цепей. При коагулогическом исследовании выявляется дефицит Х фактора свертывания. Исследование костного мозга показывает его умеренную плазматизацию 5–10% (до 20%). Сочетание характерной клинической картины с наличием моноклональных белков в сыворотке крови и мочи и увеличение плазматических клеток в костном мозге является недостаточным для установления диагноза первичного амилоидоза. Достоверным методом является гистологическое исследование пораженного органа (почка, печень, миокард и др.) [10]. Достаточно информативной является биопсия слизистой прямой кишки, при которой вероятность выявления амилоида составляет 50–70%. Биопсия слизистой десны малоинформативна, за рубежом широко используют аспирационную биопсию подкожно–жировой клетчатки из передней брюшной стенки. Чем более распространен процесс, тем выше вероятность выявления амилоида в различных местах. Для определения амилоида в гистологическом материале используют окрасочные методы: при обнаружении конгофилии препарат исследуют в поляризованном свете для выявления эффекта двойного лучепреломления, при этом только амилоид приобретает яблочно–зеленую окраску. Для типирования амилоида пользуются окрасочным методом с раствором щелочного гуанидина, который изменяет конгофильные свойства амилоида различных типов в зависимости от времени экспозиции в растворе гуанидина. Но наиболее точным является иммуногистохимическое исследование с использованием моноклональных антител к белкам – предшественникам амилоида. Диагностика амилоидоза является трудной задачей, что подтверждает представленное нами наблюдение.
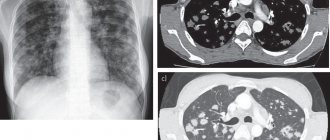
Больная К., 54 лет, поступила в клинику с жалобами на одышку при небольшой физической нагрузке, сухой кашель, возникающий при перемене положения тела, давящие боли в груди при физической нагрузке и в покое, выраженную общую слабость, отсутствие аппетита, снижение веса за последний год на 16 кг. Из анамнеза известно, что впервые стала отмечать повышение АД во время первой беременности в 23 года, диагностирована нефропатия беременности. С 30–летнего возраста уровень АД стабилизировался на цифрах 140–150/90–100 мм рт.ст. с повышением до 170–190/90–100 мм рт.ст. Постоянную гипотензивную терапию не получала, ситуационно принимала клонидин. В 1986 г. проводилась сцинтиграфия почек, выявившая незначительное снижение выделительной функции с обеих сторон, без изменения секреторной функции. УЗ–исследование выявило двустороннюю пиелоэктазию. В анализах мочи наблюдалась лейкоцитурия. На основании этого было сделано заключение о наличии у больной хронического пиелонефрита и формировании вторичной артериальной гипертензии. С 1998 года больная стала отмечать появление геморрагических высыпаний размером со спичечную головку на коже параорбитальных областей, которые со временем гиперпигментировались. В 2000 году на фоне ОРВИ появляется стойкая осиплость голоса. В 2001 после перенесенной надвлагалищной ампутации матки с левыми придатками по поводу миомы матки и эндометриоза левого яичника, течение артериальной гипертонии осложнилось высокими цифрами, пациентка стала отмечать появление одышки при обычных физических нагрузках. При ЭхоКГ впервые выявлена гипертрофия миокарда ЛЖ (толщина межжелудочковой перегородки и толщина задней стенки составляла 12 мм) без дилатации камер сердца. Был назначен эналаприл, который принимала нерегулярно. После стресса в январе 2003 г. появились неинтенсивные давящие боли за грудиной, снижение толерантности к физическим нагрузкам в виде одышки, слабость. К врачам не обращалась. Летом отметила появление отеков на нижних конечностях и прогрессирование одышки. В сентябре после физического перенапряжения в течение недели отметила резкое ухудшение самочувствия: усиление одышки, появление интенсивных болей за грудиной, увеличение отеков голеней и стоп. При обращении в поликлинику на ЭКГ выявлены рубцовые изменения передне–перегородочной области и верхушки ЛЖ, при ЭхоКГ – акинез передне–септальной области и снижение фракции выброса ЛЖ; по данным рентгенографии грудной клетки – застойные явления в легких, двусторонний гидроторакс. Больная срочно госпитализирована в ОРИТ 3 Центрального военного госпиталя им. А.В. Вишневского, где данных в пользу острого инфаркта миокарда не получено. Состояние было расценено, как постинфарктный кардиосклероз. На фоне проводимой терапии нитратами, ингибиторами АПФ и мочегонными препаратами состояние улучшилось (исчезли отеки на ногах, уменьшилась одышка, на момент выписки жидкости в плевральных полостях не отмечалось). От предложенной коронарографии отказалась. Впоследствии вновь нарастают явления сердечной недостаточности, появилась тенденция к нормотонии. В июне 2004 года госпитализируется в ВКНЦ, где при ЭхоКГ: картина гипертрофии миокарда ЛЖ (ТЗС–ТМЖП – 14 мм), расширение полости ЛП до 4,2 см, нарушение диастолической функции миокарда ЛЖ, ФВ – 60%, впервые выявлены признаки легочной гипертензии (СДЛА 45 мм рт.ст.), начальные явления стеноза левого АВ–отверстия, митральная регургитация 2 ст. Проведенная коронарография не выявила признаков стенозирования коронарных артерий. Состояние расценивалось, как формирование гипертонического сердца у больной с длительно существующей некорригируемой артериальной гипертонией, изменения на ЭКГ в виде рубцов и наличие синдрома стенокардии расценивались, как проявления гипертрофической кардиомиопатии. Назначена терапия бисопрололом, эналаприлом, гидрохлортиазидом. Уровень АД нормализовался, но сохранялись одышка и слабость. Ухудшение состояния с февраля 2005 года. Вновь нарастает одышка, что потребовало усиления мочегонной терапии, появилась склонность к гипотонии. В апреле 2005 возникли сухость и неприятный вкус во рту, пропал аппетит, появились тянущие боли в эпигастрии, ознобы после приема пищи, больная стала терять в весе. При ЭГДС патологии не выявлено, при УЗИ брюшной полости – признаки диффузных изменений поджелудочной железы, двусторонний гидроторакс. В июне появляется сухой надсадный кашель, прогрессируют одышка и слабость. В октябре больная госпитализируется в стационар, к этому моменту потеря веса составила 10 кг, что заставило провести онкопоиск (КТ брюшной полости, КТ малого таза, УЗИ молочных желез, щитовидной железы, гениталий, ЭГДС, колоноскопия), не выявивший онкопатологии. При КТ исследовании органов грудной клетки обнаружено: правосторонний плевральный выпот, зона уплотнения легочной ткани диаметром 10 мм в Х сегменте правого легкого, обогащение сосудистого рисунка за счет утолщения междольковых перегородок. Эти изменения интерпретированы как правосторонняя нижнедолевая пневмония, плевральный выпот справа, интерстициальный отек или лимфогенный карциноматоз. Проведена плевральная пункция, при исследовании обнаружен транссудат, атипичных клеток не найдено. В биохимических (электрофорез белковых фракций не проводился) и иммунологических анализах крови – без патологических сдвигов, за исключением 10–кратного повышения уровня онкогена яичников (СА 125). Проводились антибактериальная, гипотензивная (периндоприл, небиволол) и мочегонная (гидрохлортиазид 100мг) терапия, с незначительным улучшением выписана домой. Состояние больной медленно ухудшается, прогрессирует одышка, накапливается жидкость в плевральных полостях, присоединяются ночные ортопноэ без повышения уровня АД, что заставляет продолжать диагностический поиск. При повторных КТ–исследованиях легких выявляется усиление легочного рисунка, которое расценивается, как интерстициальный и начинающийся альвеолярный отек легких. Больная поступает в пульмонологическое отделение клиники госпитальной терапии ММА имени И.М. Сеченова. При поступлении: состояние средней тяжести. Астенического телосложения, пониженного питания. Вес 50 кг, рост – 162 см. ИМТ – 19. Кожные покровы бледные, сухие. Цианоз губ. Пальпируются подмышечные лимфоузлы. Варикозное расширение поверхностных вен нижних конечностей. Голени пастозны, больше – правая (за счет венозной недостаточности). Носовое дыхание свободное. ЧДД – 20 в 1 мин. в покое. Грудная клетка обычной формы, правая половина отстает в акте дыхания. В нижних отделах обоих легких при перкуссии определялось притупление до уровня 5 ребра. Дыхание над легкими везикулярное с жестким оттенком, справа в базальных отделах дыхание не проводится, слева – ослабленное. Область сердца не изменена. Границы относительной тупости сердца расширены влево. Тоны сердца приглушены, ритмичные, ЧСС– 80 уд. в мин. Акцент 2 тона на аорте и легочной артерии, в области верхушки выслушивается систолический шум. АД – 90/60 мм рт.ст. Живот при пальпации мягкий, чувствителен в эпигастрии, в остальных отделах безболезненный. Печень опущена, край ровный, безболезненный. Селезенка не увеличена. Почки не пальпируются. Симптом поколачивания – отрицательный. Дизурии нет. Грубой неврологической симптоматики нет. Анализы крови: СОЭ – 3 мм/ч, лейкоциты – 11000 , нейтрофилы – 74%, эозинофилы – 4 %, моноциты – 2%, лимфоциты – 16%, базофилы – 1 %. Гемоглобин –145 г /л, эритроциты – 4,7 млн, тромбоциты – 443 000, ЦП–0,92. общ. белок – 7 (6–8) г/дл, альбумин– 4,1 г/дл, креатинин – 1,1 мг/дл. При электрофоретическом исследовании белковых фракций выявлен М–градиент в зоне гамма–глобулинов, при иммунохимическом исследовании белков сыворотки крови обнаружена парапротеинемия G, составлявшая 12,7% от общего белка сыворотки крови, или 9,1 г/л, уровень бета–2–микроглобулина и СРБ – в норме. Повышение уровня онкомаркера СА 125 в 3 раза. В общем анализе мочи следовая протеинурия, в остальном без патологических отклонений. Электрофоретическое исследование белков мочи не выявило белка Бенс–Джонса (в том числе при иммунофиксации с антисывороткой к свободным легким цепям). При рентгенографии органов грудной клетки определялась жидкость в плевральных полостях справа до 6 ребра, слева – 6 межреберье. В нижних долях обоих легких определяется диффузная деформация легочного рисунка, имеющая сетчато–ячеистое строение, сосудистый рисунок в этих зонах не прослеживался. Верхушки легких не изменены. Корни легких не расширены, структурны, ширина легочной артерии на уровне правого легкого 1,3 см (норма). Сердце горизонтально расположено. Аорта расширена, удлинена (рис.1). При КТ легких – в плевральных полостях определяется жидкость, больше в правой. Легочный рисунок усилен во всех отделах за счет сосудистого компонента. Отмечалось незначительное увеличение лимфоузлов средостения. При ЭхоКГ выявлялась концентрическая гипертрофия миокарда ЛЖ (ТМЖП–ТЗС–14 мм) с дилатацией полости ЛП до 4,8 см, КДР/КСР ЛЖ соответственно 4,9/3,6 см, ФВ – 52%, размеры ПЖ – 2,7 см, умеренная гипертрофия стенки ПЖ – 0,52 см. Небольшое снижение глобальной систолической функции ЛЖ. Фиброз створок МК, увеличение градиента давления на МК до 8 мм рт.ст., площадь сечения 3,7 см, однако движение створок МК в противофазе. Регургитация МК 2–3 степени. Диастолическая дисфункция ЛЖ по 2 типу. Среднее давление в ЛА 20 мм рт. ст. (при норме – до 15 мм рт. ст.). Небольшое количество жидкости в полости перикарда. Обращал на себя внимание специфический опалесцирующий, усиленный эхосигнал от стенок левого желудочка. Впервые высказано предположение об амилоидозе сердца. ФВД – значительные вентиляционные нарушения по рестриктивному типу (ЖЕЛ–1,93 л (66%), ОФВ1–1,53 л (62%). Больной была выполнена пункция правой плевральной полости, эвакуировано 500 мл соломенно–желтой прозрачной жидкости. При исследовании удельный вес 1003, белок 5,05%, глюкоза 150 мг%, проба Ривальта – отрицательная, при цитологическом исследовании – лейкоцитов – 5–10–15, лимфоцитов – 75%, нейтрофилов – 25%, эритроцитов – 40–60. Атипичные клетки и БК не найдены. Исследованиями методом ПЦР и люминисцентной микроскопии микобактерии туберкулеза не выявлены. В стернальном пунктате незначительное повышение плазматических клеток (до 1,8%). Обсуждались вероятные диагнозы: синдром Мейгса, мезотелиома плевры, лимфонгаит легких, туберкулез. Выполненное УЗИ малого таза не выявило патологии со стороны правого яичника, были пересмотрены блоки биоптатов удаленных в 2001 году матки и левого яичника – данных, подтверждающих неопластический процесс, не получено. Таким образом, диагноз синдрома Мейгса стал крайне сомнительным. Отсутствие микобактерий туберкулеза при исследовании плевральной жидкости, специфического поражения легких и очагов вне легочного туберкулеза позволяло исключать туберкулезный характер заболевания. Для уточнения диагноза выполнена видеоторакоскопия с атипичной резекцией верхней доли правого легкого. В ходе операции аспирировано 1,5 литра прозрачной желтого цвета жидкости. Париетальная и висцеральная плевра не утолщена, сосуды инъецированы. Отмечалось полнокровие легкого. В 1 сегменте участок рубцового изменения легочной ткани с утолщенной белесоватой плеврой. Проведен механический и химический плевродез с использованием 1% раствора йодопирона. При морфологическом исследовании – в препаратах ткань легкого с фиброзом плевры. В фиброзированной плевре очаговые лимфогистиоцитарные инфильтраты, склероз сосудов и местами явления лимфостаза, кровоизлияния. В субплевральных отделах интерстициальный фиброз и гиалиноз, в просвете отдельных альвеол крупные макрофаги с бурым пигментом в цитоплазме. При окраске Конго–рот и тиофлавином обнаружено отложение амилоида в стенках сосудов, легочном интерстиции и в плевре. Проведенное типирование подтвердило наличие AL–амилоидоза. Генетическое исследование сыворотки крови не выявило мутаций в гене транстиретина. После установления диагноза больная отказалась от лечения. В дальнейшем больная госпитализируется в лечебное учреждение г. Москвы, где, с ее слов, был проведен курс терапии мелфаланом и преднизолоном в щадящих дозах. Второй курс из–за плохой переносимости лечения не проводился. Через 4 мес. больная скончалась при прогрессирующих явлениях сердечно–сосудистой недостаточности. Таким образом, у пациентки диагностирован АL–амилоидоз с поражением легких и плевры (диффузно–интерстициальный тип), сердца (недостаточность кровообращения II А стадия с нарушением диастолической функции по рестриктивному типу, поражение митрального клапана с формированием стеноза левого АV–отверстия), вегетативной нервной системы (ортостатическая гипотензия, охриплость голоса), сосудов. При ретроспективном анализе анамнеза заболевания пациентки можно утверждать, что заболевание дебютировало в 1998 году с кожных проявлений – появление петехиальных высыпаний в параорбитальных зонах. Появление осиплости голоса в 2000 году являлось первым признаком вегетативных нарушений, что ошибочно расценивалось больной и врачами, как осложнение после перенесенного гриппа. В последующем формируется гипертрофическая кардиомиопатия, рассматривавшаяся в программе некорригируемой артериальной гипертонии. Очень интересный факт – формирование митрального стеноза поначалу обсуждалось в программе ревматического поражения; после того как ревматизм был отвергнут, остановились на атеросклеротическом генезе, несмотря на то, что коронарные сосуды (по данным коронарографии) были интактны. Теперь уже с уверенностью можно утверждать, что поражение фиброзного кольца левого АV–отверстия и створок МК обусловлено отложением в них амилоида. Первые признаки поражения легких появились в 2003 году; тогда они неверно интерпретировались, как проявления сердечной недостаточности. Накопление транссудата в плевральных полостях при сохранной сократительной способности миокарда и незначительных признаках недостаточности кровообращения (ограничивающейся только малым кругом) свидетельствовали о поражении плевры и потери ее барьерной функции. А развитие стойкой гипотензии у больной, длительно страдающей артериальной гипертонией, было связано с поражением вегетативной нервной системы, а не прогрессирующей сердечной недостаточностью. Необходимо отметить, что возникновение петехиальных высыпаний в параорбитальных областях является специфическим для AL–амилоидоза симптомом и рассматривается, как патогномоничный и прогностически неблагоприятный признак клинического течения амилоидоза, но, вопреки общепринятому мнению, в представленном нами случае от начала заболевания до финала прошло 8 (!) лет. Возможно, правильная оценка этого симптома в начале заболевания позволила бы установить диагноз на более раннем этапе и дала больше шансов для лечения и продления жизни пациентки. Следует отметить, что особенностью данного клинического случая является отсутствие поражения почек даже в развернутой стадии заболевания, что значительно затруднило подходы к диагнозу. Только объединение разнообразных, на первый взгляд, симптомов позволило подойти к диагнозу первичного амилоидоза, который был подтвержден морфологически. В нашем сообщении мы бы хотели привлечь внимание к патологии, довольно редко встречающейся как в пульмонологической, так и общетерапевтической практике. Трудность диагностики, как уже отмечалось, связана с многообразием проявлений первичного амилоидоза. При использовании общепринятых стандартов дифференциального поиска теряется принцип индивидуального подхода к пациенту, что затрудняет определение истинного диагноза. Изучая разработанные и рекомендованные схемы дифференциального поиска при плевральных выпотах отечественных авторов, необходимо заметить, что амилоидоз в этот круг заболеваний не входит. Между тем в статьях зарубежных авторов на эту тему амилоидоз включен в поиск причин плеврального выпота [11].
Литература 1. Gertz M.A., Kyle R.A., Thibodeau S.N. Familial amyloidosis: a study of 52 North American– born patients examined during a 30–year period. Mayo Clin Proc 1992; 67:428–440. 2. Simms R.W, Prout M.N, Cohen A.S. The epidemiology of AL and AA amyloidosis. Baillieres Clin Rheumatol 1994;8:627–634. 3. Kyle R.A, Gertz MA. Primary systemic amyloidosis: clinical and laboratory features in 474 cases. Semin Hematol 1995;32:45–59. 4. Koyama J, Ray–Sequin PA, Davidoff R, et al. Usefulness of pulsed tissue Doppler imaging for evaluating systolic and diastolic left ventricular function in patients with AL (prima¬ry) amyloidosis. Am J Cardiol 2002; 89:1067–1071. 5. Виноградова О.М.. Первичный и генетические варианты амилоидоза. М., «Медицина», 1980. 6. Моисеев С.В. Инфильтративные поражения миокарда. Рестриктивная кардиомиопатия. М.,Фарма Пресс,1998. 7. Berk J.L., O’Regan A., Skinner M. Pulmonary and tracheobronchial amyloidosis. Semin Respirat Crit Care Med 2002; 23:155–165. 8. Berk J.L., Keane J., Seldin D.C., et al. Persistent pleural effusions in primary systemic amyloidosis. Chest 2003; 124;969–977. 9. Mathews V, Vasudevan AR, Nair S, et al. Primary systemicamyloidosis: pleural involvement with exudative pleural effu¬sion. J Assoc Physicians India 1996; 44:345–346 10. Козловская Л.В., Варшавский В.А., Чегаева Т.В. и др. Амилоидоз современный взгляд на проблему. //Практическая нефрология. — 1998. — 2:24–26. 11. Pleural effusion: Article bu Fredrick M Abrahamian, DO Jan.11.2005.
Лечение и профилактика
В большинстве случаев лечение амилоидоза проводится в домашних условиях. При наличии осложнений больному может быть показана госпитализация.
Терапия амилоидоза включает в себя приём препаратов и соблюдение ряда рекомендаций врача. Но в тяжелых случаях проводится удаление селезёнки, может потребоваться трансплантация почек или печени.
Перечень лекарств зависит от локализации отложений, степени поражения организма, существующих осложнений. Так, при вторичном амилоидозе необходимо специфическое лечение первичного заболевания. Кроме того, назначаются препараты для устранения симптоматики.
Также больному нередко показана специальная диета (ограничение приёма белка и соли).
Специфической профилактической программы амилоидоза не существует, так как точные причины возникновения заболевания неизвестны.
Амилоидоз —это комплексное заболевание, требующее постоянного лечения. Пациент с амилоидозом должен регулярно наблюдаться у специалиста и проходить обследования с целью контроля состояния здоровья. Медицинский обладает современным диагностическим оборудованием, что позволяет поставить точный диагноз в кратчайшие сроки. А опытные высококвалифицированные специалисты центра назначат эффективное лечение и обеспечат надлежащий уход за пациентом.
Классификация (виды) амилоидоза
Номенклатурный комитет Международного союза иммунологических обществ в 1993 году разработал классификацию, по которой системный амилоидоз делится на:
- вторичный при хронических воспалительных заболеваниях или средиземноморской семейной лихорадке
- первичный, связанный с миеломной болезнью
- у пациентов, находящихся на плановом гемодиализе
- наследственно-семейный
У людей пожилого возраста развивается часто локализованная форма заболевания:
- старческий А. предсердий
- при болезни Альцгеймера
- при инсулиннезависимом сахарном диабете
Диагностика
Диагностика амилоидоза проводится лабораторными исследованиями и другими специальными исследованиями органов человека.
При распознавании амилоидоза лабораторными исследованиями выявляют анемию в крови, лейкоцитоз, повышение СОЭ (скорость оседания эритроцитов), гипопротеинемию и гиперглобулинемию, гипонатриемию, гипопротромбинемию и гипокальциемию. При поражении печени проявляется гиперхолестеринемия, иногда гипербилирубинемия. Проводят оценку функций щитовидки, почек. Исследуют мочу, выявляя в осадке не только белок, но и лейкоциты и эритроциты, цилиндры. Увеличенное содержание амилоида в моче и крови определяет первичный амилоидоз. При выявлении признаков воспалительных заболеваний проявляется вторичный амилоидоз. Проводится копрологическое исследование с выявлением стеатореи и амилореи, креатореи.
Иные исследования для выявления амилоидоза – это эхокардиография, рентген, при котором:
- пищевод гипотоничен, а перистальтика ослаблена, при горизонтальном положении больного бариевая взвесь надолго задерживается в пищеводе – это амилоидоз пищевода;
- эвакуация содержимого из желудка, сглаженные складки слизистой оболочки, ослабленная перистальтика – амилоидоз желудка;
- наблюдается сглаженность рельефа слизистой оболочки кишки и развернутость кишечных петель, утолщение складок – амилоидоз кишечника.
Также проводится биопсия.
При поражениях ЖКТ наблюдают язвенную болезнь желудка и хронический гастрит.
Синдром запястного канала и периферическая полиневропатия, рестриктивная кардиомиопатия, нефротический синдром, обструкция мочевыводящих путей, острый канальцевый некроз, симметричный полиартрит, заболевания легких, токсическое воздействие на почки, болезнь Альцгеймера и деменция при множественных инфарктах мозга приводят к амилоидозу.