Что это такое?
Аногенитальные бородавки – это разрастания, выступающие над поверхностью кожи или слизистых, которые появляются на половых органах или в области заднего прохода. Они образуются после заражения вирусом папилломы человека. Всего известно больше ста типов вируса, причем он также может вызывать и обычные бородавки. Они отличаются от аногенитальных расположением и образуются на коже ладоней, коленей, пальцев, выступают над ней, на ощупь являются уплотненными, могут срастаться.
Те типы вируса, которые вызывают появление аногенитальных бородавок, с раком шейки матки не связаны. Его в 70% случаев вызывает ряд других типов возбудителя. Тем не менее, такие новообразования требуют контроля и лечения у дерматолога или венеролога. Подробнее об – в нашей статье «Вирус папилломы человека».
Причины развития
Появление аногенитальных бородавок в 90% случаев происходит после инфицирования 6 или 11 типом ВПЧ. От момента заражения до разрастания новообразований на коже у мужчин в среднем проходит 11-12 месяцев, у женщин – 5-6 месяцев. Быстрый рост генитальных бородавок связывают с дефицитом иммунитета, беременностью. Частая мацерация кожи (ее набухание, сморщивание из-за долгого контакта с водой) может ускорять распространение новообразований.
Рисунок 1. Вирусы папилломы человека. Фото: iLexx / Depositphotos
Где появляются кондиломы?
Острые кондиломы могут передаваться любым типом полового контакта – вагинальным, оральным, анальным. Место их расположения тесно связано с местом заражения.
Генитальная кондилома
Изменения обычно развиваются через 3–8 месяцев после контакта с вирусом, то есть с зараженным партнером. В более чем в 75% случаев у людей, которые имели сексуальный контакт с партнером, у которого есть генитальные бородавки, симптомы развиваются в течение трех месяцев.
У мужчин кондиломы чаще всего встречаются на головке члена в основном под крайней плотью, что может привести к осложнениям в виде фимоза, на центральной части полового члена, иногда на мошонке. Развитию кондилом способствуют тепло и влага, под их влиянием они быстро растут, становятся больше и принимают форму цветной капусты.
У женщин они растут еще быстрее во время беременности, вероятно, под влиянием гормона беременности – прогестерона. Если бородавки очень большие и находятся на стенке влагалища, оно может стать менее эластичным, что может затруднить роды.
В целом, генитальные и анальные бородавки имеют тенденцию сохраняться или увеличиваться и исчезать годами. Самоудаление происходит в 10-30% случаев инфекции. В большинстве случаев новообразования образуются вновь.
Пути передачи
Заразиться вирусом папилломы человека могут и взрослые, и дети. У взрослых самый распространенный путь передачи – через половой акт. Заражение может происходить в результате контакта с пораженным участком кожи. Передача типов ВПЧ, вызывающих появление аногенитальных бородавок, также возможна при анальном сексе. Использование презервативов снижает риск инфицирования, но не исключает его полностью. В группе риска – люди, часто меняющие половых партнеров.
Важно! Заражение вирусом папилломы человека возможно даже от человека с бессимптомным течением болезни.
Дети заражаются ВПЧ несколькими путями. Если беременная женщина инфицирована, возможна передача вируса ребенку при родах. Пренатальная передача (до родов) происходит редко. Заражение также возможно при контакте с пораженными участками кожи.
Бороться с бородавками сложно
Это правда, что натуральная медицина имеет свои собственные способы лечения кондилом. В основном это внешнее воздействие – компрессы мочи, применение белых пленок цитрусовых, пропитанных уксусом, компрессы из масла чайного дерева, яблочного уксуса. Но эти методы могут, и только только по согласованию с врачом, дополнять базовую терапию, ни в коем случае не являясь основной методикой борьбы с генитальными бородавками.
Параллельно можно использовать добавки, укрепляющие иммунную систему, например, чесночные капсулы или экстракт эхинацеи. Но и в таких случаях необходимо будет информировать лечащего врача.
Чесночные капсулы
Если болезнь повторяется и ваши собственные наблюдения подтверждают, что это происходит в состоянии стресса, стоит сосредоточиться на методах борьбы со стрессом.
Виды бородавок
ВПЧ может вызывать поражения кожи нескольких видов.
Остроконечные кондиломы
Выступающие над поверхностью кожи или слизистых новообразования. Могут состоять из узелков с петлеобразным строением, поверхность может быть пестрой. Их появление может сопровождаться дискомфортом, зудом (не во всех случаях). Кондиломы локализуются в области паха, промежности, анального отверстия, на половых органах;
Папулезные высыпания
Выглядят как сыпь, являются плоскими, почти не выступают над поверхностью кожи, локализованы также, как остроконечные кондиломы;
Пятна
Участки изменения цвета кожи или слизистых гениталий (появляются серовато-белые или красные пятна);
Бовеноидный папулез
Венерическое заболевание, которое сопровождается образованием множества узелков измененного цвета (бурого, серого, красного) на слизистой и коже половых органов. Позже такие узелки сливаются в крупные папулы;
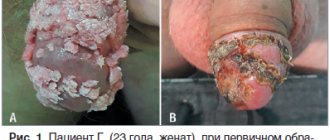
Гигантская кондилома
Сливающиеся между собой папилломы (выглядят как небольшие бородавки), формирующие большой по площади очаг поражения.
Рисунок 2. Кондиломы и бородавки. Источник: СС0 Public Domain
Появление бородавок и других новообразований при ВПЧ может сопровождаться дискомфортом и зудом. В редких случаях пораженные участки кожи могут растрескиваться, кровоточить и становиться болезненными.
Амбулаторное лечение бородавок на половых органах
Единственный эффективный способ борьбы с половыми кондиломами, признанный во всем мире – это их удаление.
Существует несколько методик, с помощью которых можно избавиться от неприятных новообразований в считанные минуты:
- Процедура лазерной терапии. Проводится под местной анестезией с помощью кольпоскопа, что облегчает обзор области вмешательства. Лазеротерапия очень эффективна и не оставляет возможности рецидивов. При многочисленных кондиломах процедуру повторяют через неделю.
- Криотерапия – замораживание поражений жидким азотом. Используется с недельными интервалами. После криотерапии развивается гиперпигментация или рубцевание. Эффективность лечения зависит от опыта врача.
- Трихлоруксусная кислота. Это сильное едкое вещество, вызывающее некроз тканей, как только состав наносится на пораженные участки. Этот метод борьбы с кондиломами эффективен при небольших изменениях, а его эффективность оценивается в 51-81%. Рецидивы возникают у 36% пациентов. Побочные эффекты – при чрезмерном использовании препарата остаются глубокие раны и шрамы.
- Хирургические методы. Процедура проводится под местной или общей анестезией. Самый высокий уровень излечения дают методы кюретажа и электрохирургии. Кондиломы после такого лечения рецидивируют менее, чем в 19% случаев.
- Фотодинамическая терапия – 5-аминолевулиновой кислотой. Метод можно использовать отдельно или в сочетании с лазерной терапией, криотерапией или кюретажем. Преимущество – незначительный процент побочных эффектов и высокий процент успешных процедур.
Криотерапия
Лазеротерапия
Фотодинамическая терапия
Риски при беременности
У женщин, инфицированных вирусом папилломы человека, беременность может провоцировать появление аногенитальных бородавок, их разрастание. Вирус может спровоцировать прерывание беременности. Мать может передавать вирус ребенку в период беременности (редко), при родах (чаще), при последующих контактах. Для новорожденного ВПЧ опасен поражением дыхательных путей (развитие респираторного папилломатоза, нарушения дыхания, голосообразования).
Для снижения связанных с ВПЧ рисков при планировании беременности желательно проходить профилактическое обследование и лечение при выявлении вируса. Если беременность уже наступила, лечение выполняют до срока в 36 недель, используя лазерную или криодеструкцию, электрокоагуляцию, чтобы убрать новообразования. Если есть обширные поражения, рекомендовано оперативное родоразрешение, чтобы снизить риск заражения ребенка.
Диагностика
Обратиться за консультацией к врачу нужно, если на коже или слизистых половых органов, заднего прохода появляются новообразования, узелки, уплотнения, участки изменения цвета.
При осмотре врач оценит клинические проявления, осмотрит пораженные области.
Чтобы подтвердить и уточнить диагноз возможно проведение лабораторных анализов:
- ПЦР-диагностика с определением генотипа вируса, дополнительно возможно определение степени вирусной нагрузки. Биоматериал – мазок из влагалища, соскоб из уретры, цервикального канала.
- Морфологическое, цитологическое исследование для оценки риска появления онкологической патологии.
Фото: freepik.com
Тяжесть состояния оценивается по количеству новообразований, объему пораженных тканей при осмотре и лабораторно (определяют число копий ДНК ВПЧ в исследуемых образцах).
Важно! Аногенитальные бородавки лечат, используя деструктивные методы (криодеструкцию, лазерную деструкцию, электрокоагуляцию). В связи с этим перед лечением обязательно сдаются тесты на ВИЧ, гепатиты, сифилис.
Диагностика проводится специалистами кожно-венерологических отделений. Дополнительно могут потребоваться консультации профильных врачей:
- уролога, если новообразования локализованы внутри уретры;
- проктолога, если бородавки обширно разрастаются в области анального отверстия;
- акушера-гинеколога при планировании и ведении беременности;
- иммунолога (при рецидивах заболевания или иммунодефицитных состояниях).
Лечение
Основное направление лечения – деструкция аногенитальных бородавок. В 70-80% случаев после удаления новообразований они не появляются повторно. Для деструкции используется несколько методов.
Фото: zhykova / Depositphotos
Электрокоагуляция
Разрушение тканей новообразования под действием тока высокой частоты. Вокруг участка новообразования происходит объемное термическое поражение тканей (образование сухой корочки). После ее заживления на коже не остается следов воздействия.
Лазерная деструкция
Воздействие лазером на контролируемую глубину для удаления новообразования в четких границах. После разрушения тканей бородавки нет кровотечения, не нужно закрывать рану.
Криодеструкция
Разрушение и удаление новообразований с использованием жидкого азота. Под действием сверхнизкой температуры происходит мгновенная некротизация тканей с последующим отторжением и заживлением раны.
Радиохирургия
Предполагает генерацию радиоволны большой мощности, которая проходит через ткани новообразования, разрушая их.
Если область поражения слизистых или кожи обширна, возможно удаление новообразований хирургическим способом. При любом методе деструкции до процедуры выполняется дезинфекция пораженного участка, его обезболивание.
Также возможно использование химических и цитотоксических методов деструкции аногенитальных бородавок. Для этого применяются местные препараты, постепенно разрушающие ткани новообразований. Такое лечение требует осторожности и может проводиться только по назначению лечащего врача.
Важно! Попытки самостоятельно удалить аногенитальные бородавки могут быть опасными: можно травмировать здоровые ткани, занести инфекцию, спровоцировать разрастание новообразований. Если бородавка была сорвана случайно, нужно обработать место поражения антисептиком, остановить кровотечение, обратиться к врачу.
Рисунок 3. Строение бородавки. Источник: СС0 Public Domain
В дополнение к методам деструкции аногенитальных бородавок могут применяться местные иммуномодуляторы и неспецифические противовирусные препараты.
Генитальные бородавки: эффективные методы лечения
М.А.ГОМБЕРГ, д.м.н., профессор, А.М.СОЛОВЬЕВ, к.м.н., доцент, Н.И.ЧЕРНОВА, к. м. н., доцент, С.Г.ИСАЕВА, МГМСУ, Москва Инфекции, вызванные вирусом папилломы человека (ВПЧ), очень широко распространены. Только в США по оценкам Центра по контролю заболеваемости (CDC), до 5,5 млн человек в год инфицируются ВПЧ (Armstrong G.L., et al., 2001).
В России аногенитальные бородавки, этиология которых связана с ВПЧ, регистрируются как инфекции, передаваемые половым путем (ИППП). Уровень официальной регистрации аногенитальных бородавок в России (около 35 на 100 000 населения в последние годы) существенно отличается от истинной распространенности ВПЧ-инфекции.
Между тем с широким внедрением в практику методов молекулярной диагностики врачи разных специальностей диагностируют ВПЧ-инфекцию при разнообразных клинических проявлениях папилломатоза за пределами области гениталий. Зачастую ВПЧ обнаруживают и без наличия ассоциированных с этой инфекцией проявлений. Это особый случай, и тактику ведения таких пациентов мы обсуждали ранее (Гомберг М.А, Соловьев А.М. // Медицинский совет. – 2009. — № 3. – С. 12-18).
Проблема ВПЧ-инфекции стала особенно актуальной после присуждения Нобелевской премии по медицине в 2008 г. Harald zur Hausen (Германия) за доказательство связи рака шейки матки именно с этим вирусом. В настоящее время об этом осведомлены не только врачи, но и пациенты.
Цель настоящей статьи – дать врачам, работающим на амбулаторном приеме, представление о современных подходах к ведению больных с ВПЧ-инфекцией, чтобы при обнаружении у пациентов аногенитальных бородавок они могли решать эту проблему самостоятельно, не направляя больного в специализированные центры.
Принципы лечения клинических проявлений ВПЧ
Согласно существующим принципам по ведению больных с генитальными клиническими проявлениями, связанными с ВПЧ, лечение направлено либо на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса, либо на стимуляцию противовирусного иммунного ответа, либо на сочетание этих подходов. Наиболее оптимальной является следующая классификация методов лечения аногенитальных бородавок: I. Деструктивные методы: 1. Физические — хирургическое иссечение; — электрохирургические методы; — криотерапия; — лазеротерапия. 2. Химические: — азотная кислота; — трихлоруксусная кислота; — солкодерм. II. Цитотоксические препараты: — подофиллин (ПФ); — подофиллотоксин (ПФТ); — 5-фторурацил. III. Иммунные методы: — интерфероны; — индукторы интерферонов; — иммунотропные препараты. IV. Комбинированные методы: — сочетанное применение различных методов, как правило, иммунных с деструктивными. При выборе наиболее оптимального метода в каждом конкретном случае врачу необходимо руководствоваться следующими основными характеристиками: — эффективностью при данной патологии; — частотой рецидивов после лечения; — переносимостью (минимумом побочных эффектов); — простотой выполнения процедур.
Лечение генитальных клинических проявлений, связанных с ВПЧ, направлено либо на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса, либо на стимуляцию противовирусного иммунного ответа, либо на сочетание этих подходов
Основным отличием физических деструктивных методов является то, что при их использовании происходит быстрое, часто — одномоментное разрушение поражений. При использовании других методов поражения ликвидируются через несколько часов или недель. Как правило, это время сопоставимо со временем заживления очагов после воздействия физических методов. Частота рецидивов, по данным литературы, не зависит от выбора метода лечения.
Таким образом, очевидные преимущества физических методов нивелируются. Для применения физических деструктивных методов необходимы специальные помещения, дорогостоящее оборудование, обученный персонал, имеющий сертификаты на данный вид медицинской деятельности. Все это ограничивает применение данных методов в широкой практике, особенно в условиях небольших медицинских центров или в районах, где в поликлинике имеются лишь дерматовенерологический, гинекологический или урологический кабинеты. В связи с этим особый интерес представляют консервативные методы лечения, которые может применить любой практикующий врач.
Химические деструктивные методы
Применяют концентрированные растворы кислот, щелочей, солей и др., например ферезол, перекись водорода, растворы акрихина и хингамина, препараты на основе салициловой и молочной кислот, уксусную и азотную кислоту, соки туи и чистотела. Все эти методы обладают невысокой, плохо прогнозируемой эффективностью, многочисленными побочными эффектами. Упорядоченных данных об эффективности этих препаратов немного.
Ферезол
Ферезол – раствор, содержащий 60% фенола и 40% трикрезола. Его применяют 1-2 раза с интервалом 3-4 мин 1 раз в неделю. Можно повторять 3-4 раза. Среди химических препаратов, обладающих деструктивным действием, о которых есть достаточно данных в литературе, следует отметить комбинированный кислотный препарат – солкодерм.
Солкодерм
Солкодерм – это водный раствор, активной составляющей которого являются продукты взаимодействия органических кислот (уксусной, щавелевой и молочной) и ионов металлов с азотной кислотой, имеющей концентрацию 6,6 Н. Раствор содержит нитриты в количестве 0,02 мг/мл. При местном применении на пораженных участках солкодерм ведет к прижизненной фиксации (сохраняется структура новообразования) с последующей мумификацией патологически измененной ткани, с которой препарат вступает в соприкосновение. Заживление происходит под струпом, что исключает образование открытой раневой поверхности. Осложнения лечения, такие как вторичная инфекция или образование рубцов, по данным литературы, наблюдаются крайне редко. Простота в использовании, эффективность в удалении пораженных тканей с минимальным негативным влиянием на окружающие ткани и способность контролировать масштаб обработки делает препарат солкодерм полезным для лечения широкого диапазона доброкачественных изменений кожи.
Уникальность солкодерма в том, что входящие в его состав кислоты, обладая невысокой концентрацией и, следовательно, небольшой вероятностью побочных эффектов, оказывают выраженный клинический эффект за счет окислительно-восстановительных реакций. Продукты окисления азота, которые образуются в результате этих реакций, имеют некоторые дополнительные клинические преимущества, характеризующиеся более полным разрушением пораженного участка и уменьшением повреждающего воздействия на окружающие здоровые ткани (Weiner M., et al., 1983).
Под нашим наблюдением находилось 24 больных (14 мужчин и 10 женщин) в возрасте от 17 до 41 года (средний возраст 25,8 лет): 16 больных с остроконечными кондиломами на половых органах, 3 больных с вульгарными бородавками на кистях рук, 2 больных с подошвенными бородавками и 3 – с невусами гладкой кожи. Солкодерм наносили специальным пластиковым шпателем или с помощью стеклянного капилляра на предварительно обезжиренную спиртом поверхность очага. Наиболее быстрый способ насыщения очага достигался при нанесении раствора с помощью капиллярных трубочек с последующим механическим воздействием пластиковым шпателем для более глубокой пенетрации раствора.
Обработку бородавок проводили до появления желтого окрашивания очагов, расположенных на коже, или белого окрашивания очагов, расположенных на слизистых оболочках. Появление равномерной желтой или белой окраски свидетельствует о достаточности обработки и является гарантией последующей мумификации образования. Контрольный осмотр больных проводили через 3-5 дней после первичной обработки. В случае необходимости проводили повторную обработку очагов солкодермом.
У больных остроконечными кондиломами и невусами в большинстве случаев было достаточно однократной обработки солкодермом. Полное отторжение струпа происходило в период от 5 (обычно при кондиломах) до 14 (в случае невусов) дней в зависимости от локализации и размера поражений. Для лечения вульгарных бородавок требовалось проведение 2-3 сеансов терапии, для лечения подошвенных бородавок – 3-4 сеанса. Во всех случаях удалось добиться полного исчезновения поражений. Лечение переносилось хорошо, серьезных побочных эффектов не отмечалось. При контрольном наблюдении в течение 6 месяцев у 3 больных с остроконечными кондиломами отметили рецидив заболевания.
Полученные нами данные о высокой эффективности и хорошей переносимости терапии солкодермом полностью совпадают с данными крупных зарубежных исследований. При лечении обыкновенных и подошвенных бородавок препарат оказался эффективен у 85-94% больных (уровень рецидивирования составил 6–10%) (Hettich R., Burri P., Binet O., 1984). При лечении остроконечных кондилом у мужчин и женщин эти показатели составили 80,1 и 7,0% соответственно, причем у 64,7% больных эффект был достигнут после однократной обработки (Brokalakis J., et al., 1984).
Кратковременность лечения, амбулаторный характер лечения и точность, с которой проводится нанесение препарата на патологические ткани, делают солкодерм удачным препаратом для лечения остроконечных кондилом, а также обыкновенных и подошвенных бородавок.
Цитотоксические препараты. Подофиллин
Подофиллин представляет собой смолу, полученную из растений P. pelatum и P. emodi, растущих в Северной Америке и Гималаях. Для лечения бородавок аногенитальной области применяют 10-25% раствор подофиллина в этаноле или настойке бензоина. Подофиллин является препаратом выбора в клиниках Великобритании (Reynolds M., et al., 1993). Он связывается с аппаратом микротрубочек клетки и ингибирует митозы, а также подавляет транспорт нуклеиновых кислот, в результате чего происходит ингибирование синтеза ДНК и размножения клетки (Handley J.M., et al., 1994). В России подофиллин не зарегистрирован. Некоторые исследователи выступают против применения препарата, особенно самими пациентами. В частности, Petersen, et al. (1995) считают подофиллин плохо изученным, грубо очищенным растительным экстрактом. Методом жидкостной хроматографии эти авторы определили, что примерно 10% сухого вещества 20%-ного раствора подофиллина составляют 2 мутагенных флавоноида – кверцетин и кемферол. В связи с этим предлагается использовать только высокоочищенные подофиллотоксины, но их самостоятельное применение можно рекомендовать больным только после проведения подробного инструктажа.
Подофиллотоксин
Подофиллотоксин представляет из себя наиболее активную в терапевтическом отношении фракцию в составе подофиллина. Выпускается в виде 0,25, 0,3 и 0,5% растворов, а также в виде 0,15, 0,3 и 0,5% крема.
В России зарегистрированы раствор и крем подофиллотоксина: — кондилин – 0,5% раствор. Применяют 2 раза/сут в течение 3 дней, затем перерыв 4 дня. Длительность лечения не более 5 недель. — вартек – 0,15% крем.
Несомненное достоинство подофиллотоксина – возможность безопасного самостоятельного применения препарата пациентами. Подофиллотоксин применяют 2 раза в день в течение 3 последовательных дней в неделю в течение 4-5 недель.
Для подофиллотоксина показатель эффективности составляет 26-87% у мужчин и 50-77% у женщин (Lassus A., 1987; Von Krogh G., 1987; Edwards A., et al., 1988; Kirby P., et al., 1990; Baker D.A., et al., 1990; Handley J.M., et al., 1991; Greenberg M.D., et al., 1991). Большой разброс показателей эффективности обусловлен различным сроком наблюдения за больными, а также тем, что в некоторых работах авторы не учитывают рецидивы. Наиболее частыми побочными эффектами применения подофиллотоксина по данным Bonnez W., et al. (1994) являются местные воспалительные реакции (у 57% пациентов), эритема, жжение (у 48%), болезненность (у 47%), зуд (у 44%), незначительное мокнутие и эрозии в области аппликации (у 39%). Хотя системных побочных эффектов не было описано, рекомендуется применять подофиллотоксин в количестве не более 0,2 мл за одну процедуру (Von Krogh G., 1982).
Handley J.M., et al. (1994) считает подофиллотоксин препаратом выбора для самостоятельного применения больными с небольшим количеством неороговевающих кондилом, располагающихся на крайней плоти, головке полового члена, в венечной борозде и вульве. Препарат малоэффективен при лечении бородавок перианальной области, влагалища и уретры.
Недостатками подофиллотоксина являются его высокая стоимость, большая длительность лечения в сочетании с не самой высокой эффективностью.
5-Фторурацил
5-фторурацил является антагонистом пиримидина и способен нарушать синтез как клеточной, так и вирусной ДНК. Для лечения бородавок аногенитальной области его назначают в виде 5%-ного крема (Krebs H.B., 1987). По мнению Handley, et al. (1994), 5-фторурацил является эффективным методом лечения интравагинальных бородавок и кондилом терминальной части уретры. При лечении интравагинальных бородавок препарат назначают 1 раз на ночь в течение недели или 1 раз в неделю в течение 10 недель (Krebs H.B., 1987). Хотя препарат при такой схеме лечения обладает достаточно высокой эффективностью (85-90%), при его применении могут возникать мокнущие эрозии на слизистой влагалища, вплоть до развития тяжелого мокнущего контактного дерматита.
При лечении бородавок терминальной части уретры крем вводится сразу после мочеиспускания, на ночь в течение 3-8 дней. Полное излечение внутриуретральных бородавок наблюдается у 90-95% мужчин (Dretler S.P., et al., 1975; Von Krogh G., 1976). Однако при лечении наблюдается множество побочных эффектов: стеноз и стриктуры уретры, дизурия, изъязвления (Krebs H.B., 1987).
Несмотря на достаточно высокую эффективность 5-фторурацила, доступность и невысокую стоимость, в широкой практике его применение ограничено из-за высокой частоты побочных эффектов. Препарат противопоказан при беременности.
Официнальных препаратов фторурацила для наружного применения в России нет, но крем необходимой концентрации может быть приготовлен по рецепту в аптечном производственном отделе из субстанции.
Иммунные методы. Интерферон
Так как ВПЧ сохраняется в эпителиальных клетках и использование деструктивных методов не гарантирует от рецидивов, перспективным в этом плане является применение интерферонов как в качестве монотерапии, так и в комплексе с другими методами лечения.
Установлено, что при применении интерферона у пациентов в очагах поражения снижается количество вирусной ДНК (по данным ПЦР), что коррелирует с клиническим улучшением или исчезновением поражений (Arany I., et al., 1995).
Интерферон в терапии аногенитальных бородавок можно применять местно, внутриочагово и системно (подкожно, внутримышечно, внутривенно или ректально).
В большинстве исследований была показана невысокая эффективность наружного применения интерферона (Keay S., et al. 1988). Gross G. (1996) считает, что важным показанием для наружного применения интерферона является наличие субклинических очагов ВПЧ-инфекции и ЦИН (особенно вызванных типами ВПЧ высокого онкогенного риска).
По данным различных авторов, при системном применении альфа-интерферона в дозе от 1,5 до 3 млн. МЕ внутримышечно или подкожно через день в течение 4 недель у 11-100% пациентов наблюдается полное исчезновение бородавок (Gross G., et al., 1986; Zwiorek L., et al., 1989).
При системном применении интерферона могут наблюдаться гриппоподобные явления, выраженность которых зависит от полученной дозы (Handley, et al., 1994). Эти побочные явления можно ослабить, назначив нестероидные противовоспалительные препараты.
Учитывая, что эффективность системной монотерапии интерфероном невысока и недостаточно предсказуема, а также принимая во внимание высокую стоимость лечения, этот метод не получил широкого распространения в клинической практике.
По данным различных авторов, наиболее эффективно внутриочаговое применение альфа- и бета-интерферона. Такой способ терапии приводит к исчезновению 35-62,5% бородавок, причем как леченных, так и не леченных (Corwin Vance J., et al., 1986; Reichman R.C., et al., 1988; Welander C.E., et al., 1990). На российском рынке представлен широкий выбор интерферонов различных производителей как отечественных, так и зарубежных – виферон, кипферон, реаферон, роферон-А, интрон А, реальдирон и др.
Предпочтительнее использовать рекомбинантные, а не человеческие интерфероны. К препаратам, зарегистрированным для лечения папилломавирусной инфекции, относятся:
Виферон – рекомбинантный интерферон альфа-2b. Выпускается в виде мази, геля и суппозиториев. При папилломавирусной инфекции суппозитории применяют по 500000 МЕ 2 раза/сут в течение 5-10 дней;
Интрон А – рекомбинантный интерферон альфа-2b. Применяется системно;
Роферон А – рекомбинантный интерферон альфа-2а. Применяют подкожно по 1-3 млн. МЕ 3 раза в неделю в течение 1-2 месяцев;
Альтевир – рекомбинантный интерферон альфа-2b. Применяется системно;
Вэллферон – очищенный интерферон альфа-n1. Применяют подкожно по 5 млн МЕ ежедневно в течение 14 дней, затем 3 раза в неделю в течение 6-8 недель.
Есть сообщения об эффективном применении индукторов интерферона в виде монотерапии. Представляет интерес местное применение низкомолекулярного производного имихидазохинолинамина – имихимода, который является индуктором цитокинов и, в частности альфа-интерферона (Baker D., et al., 1995; Trofatter K.E., 1997). Его применяют в виде 5% крема 3 раза в неделю либо ежедневно на ночь до полного исчезновения высыпаний (но не более 4 месяцев). Полное исчезновение кондилом наблюдается у 56% больных при первом режиме дозирования и у 71% при ежедневном применении (плацебо – 14%).
При контрольных обследованиях в течение 1 года рецидивы наблюдались лишь у 13-19% (Baker D., et al., 1995; Trofatter K.E., 1997). При ежедневном применении чаще развивались местные побочные эффекты: покраснение, отечность, эрозии. Крем особенно эффективен при лечении субклинической ВПЧ-инфекции (Gross G., 1996). Имихимод широко применяется в Европе, США, Японии и во многих других странах с конца 90-х годов XX века, однако в России этот препарат пока не зарегистрирован.
Профилактика рецидивов
Для предотвращения рецидивов ВПЧ-инфекции более предпочтительным является применение интерферона или его индукторов, а также других активаторов противовирусного иммунитета в качестве адьювантной терапии в комбинации с различными деструктивными методами. Иммунные препараты повышают эффективность лечения и позволяют снизить частоту рецидивов. Определенное значение комбинированная иммунотерапия имеет при лечении упорных, плохо поддающихся лечению бородавок.
Для лечения предложены различные методики, основанные на применении иммунных препаратов в сочетании с криотерапией, лазеротерапией, электрокоагуляцией, солкодермом и т.д. (Thin N., 1995). Так, например, выявлено, что сочетание интерферона с лазеротерапией более эффективно, чем только лазеротерапия: полное исчезновение бородавок наблюдается у 52 (81,5%) и 19 (61%) пациентов соответственно (Corwin Vance J., et al., 1990; Hohenleuter U., et al., 1990; Petersen C.S., et al, 1991).
Дополнение СО2-лазерного иссечения терапией низкими дозами альфа-интерферона (по 1-3 млн. МЕ в сутки в течение 5-7 дней, затем перерыв 3-4 недели, курс — 3-4 цикла) повышает эффективность лечения и позволяет снизить процент рецидивов, наблюдающихся после применения только лазеротерапии (Gross G., 1996). При небольших остроконечных кондиломах дополнение лазерной терапии или электрокоагуляции местным применением геля, содержащего бета-интерферон 0,1 млн МЕ/г, 5 раз в день в течение 4 недель эффективно предотвращает рецидивы (Gross G., 1996).
Однако, по данным The Condylomata International Collaborative Study Group (1993), применение альфа-интерферона (3 раза в неделю в течение 4 недель) после удаления всех видимых кондилом СО2-лазером не дает каких-либо положительных результатов в сравнении с плацебо (полное излечение наступило у 18%, рецидивы возникли у 35% больных). По данным Hopel M.R., et al. (1992), сочетание применения альфа-интерферона (3-6 пятидневных курсов с интервалом в 2 недели) с деструктивными и/или хирургическими методами, несмотря на повышение эффективности лечения упорных, неподдающихся терапии кондилом, не предотвращает развитие рецидивов, возникающих у 50% больных.
Для предотвращения рецидивов ВПЧ-инфекции более предпочтительным является применение интерферона или его индукторов, а также других активаторов противовирусного иммунитета в качестве адьювантной терапии в комбинации с различными деструктивными методами
Представляет интерес еще одна группа консервативных методов лечения ВПЧ-инфекции – это иммунные препараты, которые могут применяться самостоятельно или в комбинации с деструктивными методами.
Иммунотропные препараты
Воздействовать на противовирусный иммунитет можно применением индукторов эндогенного интерферона и других активаторов иммунитета. На российском фармацевтическом рынке представлено много иммуноактивных препаратов, которые согласно инструкции производителя или рекомендациям исследователей могут применяться в комбинированном лечения аногенитальных бородавок в сочетании с различными деструктивными методами.
Гепон
Гепон – синтетический олигопептид, состоящий из 14 аминокислотных остатков. Препарат относится к группе иммуномодуляторов, показан для повышения эффективности иммунной защиты от инфекций, лечения и профилактики оппортунистических инфекций, вызванных бактериями, вирусами или грибами.
Иммунофармакологическое и противовирусное действия препарата гепон обусловлено тем, что он: — вызывает продукцию альфа- и бета-интерферонов; — мобилизует и активирует макрофаги; — ограничивает выработку цитокинов воспаления (интерлейкинов 1, 6, 8 и фактора некроза опухоли); — стимулирует продукцию антител к различным антигенам инфекционной природы; — подавляет репликацию вирусов; — повышает резистентность организма в отношении вирусных и бактериальных инфекций.
У больных с ослабленной иммунной системой гепон: — увеличивает сниженное содержание CD4+ T- и NK-клеток; — повышает функциональную активность нейтрофилов и CD8+ T-клеток, являющихся ключевыми звеньями защиты организма от бактерий, вирусов и грибов; — усиливает выработку антител, специфичных к возбудителям оппортунистических инфекций, актуальных для данного больного; — предупреждает развитие рецидивов оппортунистических инфекций.
Хотя в инструкции по применению препарата нет прямых указаний на его использование при папилломавирусной инфекции (препарат рекомендуют для повышения иммунной защиты от инфекций, лечения и профилактики оппортунистических инфекций, вызванных бактериями, вирусами или грибами), накопленный клинический опыт его назначения позволяет рекомендовать гепон при ВПЧ. Так, например, аппликации гепона на очаги ВПЧ-поражений после их удаления любым деструктивным методом (от 3 до 6 аппликаций через день) позволяют ускорить процесс заживления и снижают уровень рецидивирования (Соловьев А.М., 2003). Системно препарат применяют по 2 мг перорально 3 раза в неделю. Курс можно повторять с интервалом в 1 неделю.
Иммуномакс
Перспективным является применение активатора противовирусного иммунитета – иммуномакса, представляющего собой кислый пептидогликан с молекулярной массой 1000-40000 кДа. Препарат выделен из растений комплексом биохимических методов, включающих ультрафильтрацию и хроматографию. Стерильный препарат иммуномакс выпускается в виде лиофилизированного порошка по 200 ЕД во флаконах для инъекций.
Имеются данные об использовании препарата при клинических проявлениях ВПЧ-инфекции в комбинации с любым из деструктивных методов. Больным удаляют остроконечные кондиломы и одновременно назначают внутримышечные инъекции иммуномакса по 200 ед 1 раз/сут на 1, 2, 3, 8, 9 и 10-й дни лечения (Перламутров Ю.Н. с соавт., 2003). У 68% больных сразу по окончании лечения наблюдается отсутствие рецидивирования кондилом, а после проведения дополнительных сеансов деструкции эффективность лечения достигает 98% (при контрольном наблюдении не менее 3 месяцев).
Эпиген-интим
Эпиген-интим – аэрозольный препарат растительного происхождения для местного применения, основным действующим веществом которого является глицирризиновая кислота, получаемая из корня солодки. Препарат активирует местный иммунитет за счет интерфероногенного действия, повышая при этом способность тканей к защите от инфекций. Глицирризиновая кислота, ингибируя ДНК и РНК вирусов, вызывает их инактивацию, блокирует внедрение активных вирусных частиц через мембрану внутрь клетки, нарушает синтез новых структурных компонентов вирусов. Основным механизмом противовирусной активности глицирризиновой кислоты является ингибирование киназы Р, влекущее за собой угнетение фосфорилирования клеточных и кодируемых вирусом белков в инфицированных клетках и находящихся в свободном состоянии.
Показано, что применение эпигена в комбинированной терапии анаогенитальных бородавок позволяет снизить частоту рецидивов (Чернова Н.И., 2004). Препарат также оказывает противовоспалительное и заживляющее действие, что важно при лечении кондилом деструктивными методами.
При периодическом использовании в течение длительного времени у больных с бессимптомным выделением ВПЧ эпиген оказывает профилактическое действие в отношении клинической манифестации инфекции – при наблюдении в течение 1 года кондиломы появились у 14,7%, тогда как в контрольной группе это произошло у 40% больных (Чернова Н.И., 2004).
Эпиген-интим применяют интравагинально, наружно и интрауретрально. При наружном применении препарат наносят на всю пораженную поверхность с расстояния 4–5 см путем 1–2 нажатий клапана. Интравагинально препарат впрыскивают путем 1–2 нажатий на специальную насадку. Препарат используют до удаления кондилом 3 раза в сутки, на фоне деструкции – 5 раз в сутки в течение 10 и более дней до заживления; для профилактики ближайших рецидивов – 3 раза в день в течение 1 месяца.
Иммунотропные препараты с прямым противовирусным действием
Иммунные препараты повышают эффективность лечения и позволяют снизить частоту рецидивов
Изопринозин (инозин пранобекс)
Изопринозин (инозин пранобекс) – противовирусное средство с иммуномодулирующими свойствами. Препарат нормализует дефицит или дисфункцию клеточного иммунитета, индуцируя созревание и дифференцирование Т-лимфоцитов и Т1-хелперов, потенцируя индукцию лимфопролиферативного ответа в митогенных или антиген-активных клетках. Изопринозин моделирует цитотоксичность Т-лимфоцитов и натуральных киллеров, функцию Т8-супрессоров и Т4-хелперов, а также повышает количество иммуноглобулина G и поверхностных маркеров комплемента. Изопринозин повышает синтез интерлейкина-1 (ИЛ-1) и интерлейкина-2 (IL-2), регулирует экспрессию рецепторов IL-2, существенно увеличивает секрецию эндогенного ?-интерферона и уменьшает продукцию интерлейкина-4 в организме.
Препарат усиливает действие нейтрофильных гранулоцитов, хемотаксис и фагоцитоз моноцитов и макрофагов. Изопринозин также обладает прямым противовирусным действием, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной РНК.
Одним из показаний применения препарата являются инфекции, вызванные вирусом папилломы человека: остроконечные кондиломы, папилломавирусная инфекция вульвы, вагины и шейки матки (в составе комплексной терапии).
При инфекциях, вызванных ВПЧ, изопринозин назначают по 3 г/сут (2 таблетки 3 раза/сут) как дополнение к местной терапии или хирургическому вмешательству в течение 14–28 дней пациентам с низкой степенью риска или 5 дней в неделю последовательно в течение 1–2 нед в месяц в течение 3 мес пациентам с высокой степенью риска.
В литературе описаны различные схемы и результаты применения изопринозина при папилломавирусной инфекции. Известно о зарубежном опыте применения инозин пранобекса в качестве терапии, дополняющей деструкцию аногенитальных бородавок (Mohanty K.C., et al., 1986). Препарат применяли по 1 г 3 раза/сут в течение 28 дней. Эффективность терапии повышалась с 41 до 94% при добавлении изопринозина к традиционным методам лечения.
Похожие результаты показаны в работах Прилепской В.Н. и соавт. (2007). Добавление к стандартному лечению изопринозина в дозе 1 г 3 раза в сутки в течение 5 дней до проведения деструкции повышает эффективность терапии с 65,6% до 87,5%, в 3 раза снижает частоту рецидивов. Также отмечается высокая частота элиминации ВПЧ из очагов поражения – 65,6%.
В работе Забелева А.В. и соавт. (2005) показано исчезновение атипичного эпителия после проведения курсов изопринозина женщинам с ВПЧ-ассоциированными плоскоклеточными интраэпителиальными поражениями низкой степени. Изопринозин назначали по 1 грамму 3 раза/сут в течение 5 дней, 3 курса с интервалом 1 месяц.
Аналогичные результаты – улучшение морфологической картины эпителия вульвы – показаны в исследовании Sun Kuie Tay (1996). Инозин пранобекс назначали по 1 г 3 раза/сут в течение 6 недель. Положительный эффект был достигнут у 63,5% больных, а в группе, принимавшей плацебо – у 16,7%. Для мониторинга и обработки результатов исследования с позиций доказательной медицины в 2008 г. была разработана и внедрена программа «Астра» – общероссийская многоцентровая программа мониторинга, обобщения и формирования статистической отчетности об особенностях и результатах применения изопринозина при лечении заболеваний, ассоциированных с HPV, в условиях обычной медицинской практики. В исследовании участвовали 6191 пациент (5896 женщин и 295 мужчин) (Костава М.Н. и соавт., 2009).
Пациенткам, принявшим участие в исследовании, лечение проводилось в соответствии с выявленными заболеваниями, в комплекс лечения был включен препарат изопринозин. При наличии только остроконечных кондилом вульвы и влагалища проводилась монотерапия изопринозином. Лечение CIN I-II, локализованное на ограниченном участке экзоцервикса, полностью доступное для кольпоскопии, без поражения цервикального канала у 58 пациенток также проводилось препаратом изопринозин. При отсутствии положительного эффекта производили адекватное иссечение пораженной ткани. Рекомендуемые терапевтические дозы изопринозина соответствовали тяжести поражения эпителия вирусом папилломы человека. При выявлении остроконечных кондилом в области вульвы и влагалища изопринозин назначали по 50 мг/кг в сутки в течение 5 дней тремя курсами с перерывом в месяц. При цитологических и гистологических данных, соответствующих CIN I–II, изопринозин применяли по 50 мг/кг/сут, 10 дней в месяц 3 курсами с перерывом в месяц. При субклинических формах ВПЧ-поражений эпителия препарат назначали по 50 мг/кг/сут, курс лечения – от 10 до 21 дня.
До лечения койлоцитоз при нормальной кольпоскопической картине был выявлен у 1367 пациенток, а после лечения – только у 71. Лечение остроконечных кондилом оказалось эффективным у 91% пациенток, комбинированное лечение CIN I – у 90%, комбинированное лечение CIN II – у 82%, лечение субклинической формы ВПЧ-инфекции — у 91% [Костава М.Н. и соавт., 2009].
Недавно был проведен метаанализ результатов применения изопринозина (Елисеева М.Ю. и соавт, 2009). Данные литературы, базирующиеся на 15 источниках, в которых описано 2369 случаев применения изопринозина в качестве монотерапии, 3369 – в комбинации с другими методами, в сравнении с 71 наблюдениями плацебо-контроля и 575 наблюдениями за традиционным лечением свидетельствуют об эффективности вспомогательной иммунотерапии изопринозином на фоне традиционных методов при терапии генитальных поражений, ассоциированных с ВПЧ.
Основным показателем эффективности любого метода удаления аногенитальных бородавок является отсутствие рецидивов. Так как частота рецидивов ВПЧ-инфекции не зависит от метода деструкции поражений (физической, химической или цитотоксической), то для врача на амбулаторном приеме особый интерес представляют методы деструкции, которые могут быть использованы непосредственно в кабинете. Поэтому в данной работе мы постарались сделать акцент на методиках, позволяющих быстро и эффективно бороться с проявлениями ВПЧ-инфекции и ее рецидивов без использования дорогостоящих методов деструкции, доступ к которым есть не в каждой специализированной клинике.
Преимуществом такого лечения является отсутствие риска заражения врача вирусными частицами, в отличие от проведения лазерной деструкции без использования врачом методов защиты. Для профилактики рецидивов ВПЧ-инфекции рекомендуется назначать иммунотропную терапию. Такой подход обеспечит эффективное лечение аногенитальных бородавок, что должно существенно сказаться на всех аспектах контроля ВПЧ-инфекции в популяции, включая уровень ее регистрации.
Основным показателем эффективности любого метода удаления аногенитальных бородавок является отсутствие рецидивов. Так как частота рецидивов ВПЧ-инфекции не зависит от метода деструкции поражений (физической, химической или цитотоксической), то в данной работе мы постарались сделать акцент на методиках, позволяющих быстро и эффективно бороться с проявлениями ВПЧ-инфекции и ее рецидивов. Для профилактики рецидивов ВПЧ-инфекции рекомендуется назначать иммунотропную терапию. Такой подход обеспечит эффективное лечение аногенитальных бородавок, что должно существенно сказаться на всех аспектах контроля ВПЧ-инфекции в популяции, включая уровень ее регистрации.
Следует признать, что даже современные достижения в исследованиях папилломавирусной инфекции и совершенствовании методов диагностики и терапии оставляют ряд нерешенных вопросов – отсутствие стандартов терапии ВПЧ, широкого распространения рекомендаций для пациентов по профилактике ВПЧ инфекции, алгоритмов ведения беременных женщин при ВПЧ.
Профилактика
Для профилактики появления аногенитальных бородавок нужно снизить риск заражения ВПЧ. Для этого исключают случайные половые связи, используют барьерные методы защиты.
Обязательная часть профилактики – вакцинация:
- для женщин применяется двух-, четырех- или девятивалентная вакцина с однократной или двукратной ревакцинацией;
- для мужчин используется четырех- или девятивалентная вакцина.
Вакцинацию для защиты от заражения ВПЧ рекомендовано начинать в детском возрасте. Иммунизацию для девочек можно выполнять с 7 лет, для мальчиков – с 9 лет. Для девочек прививки против ВПЧ особенно важны из-за связанного с заражением вирусом рака шейки матки.