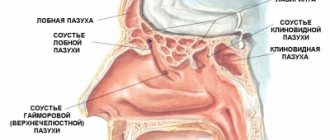
Острым миелобластным лейкозом (наиболее часто используемая аббревиатура — ОМЛ) называют злокачественную патологию крови и костного мозга, характеризующуюся бесконтрольным продуцированием незрелых (бластных) миелоцитарных клеток — эритроцитов, гранулоцитов, нейтрофильных лейкоцитов, тромбоцитов. Заболевание диагностируется в случаях, когда в миелограмме обнаруживается свыше 20% незрелых клеток. Его характерной особенностью является быстрое течение: в течение нескольких месяцев незрелые клетки начинают преобладать в составе крови, из-за чего она перестаёт выполнять свои основные функции. Состояние больного резко ухудшается, и при отсутствии лечения прогноз крайне неблагоприятен.
Виды
Онкогематологи различают несколько десятков разновидностей острого миелоидного лейкоза, которые группируются по сходным признакам:
- с типичными генетическими мутациями;
- с дисплазией, обусловившей изменение клеток;
- возникшие в результате лечения других заболеваний;
- с разрастанием миелоидного ростка на фоне синдрома Дауна;
- миелоидные саркомы;
- дендритноклеточные плазмацитоидные опухоли.
В зависимости от формы заболевания врач выбирает тактику лечения, так как продолжительность ремиссий и общий прогноз для разных видов имеют серьёзные отличия.
Как классифицируются острые лейкозы у взрослых?
При большинстве опухолей выделяют стадии заболевания (I, II, III и IV), которые основаны на размерах опухоли и ее распространенности.
Такое стадирование не подходит к лейкозам, потому что лейкоз — заболевание клеток крови, при котором обычно не образуется опухолевое образование.
Лейкоз поражает весь костный мозг и во многих случаях к моменту диагностики уже вовлекает в процесс другие органы. При лейкозе лабораторные исследования опухолевых клеток позволяют уточнить их характеристики, которые помогают в оценке исхода (прогноза) заболевания и выборе тактики лечения.
Выделено три подтипа острого лимфобластного лейкоза и восемь подтипов острого миелоидного лейкоза.
Различают четыре основных типа лейкозов:
острый по сравнению с хроническим
лимфобластный по сравнению с миелоидным
«Острый» означает быстро развивающийся. Хотя клетки растут быстро, они не способны созревать должным образом.
«Хронический» означает состояние, когда клетки выглядят зрелыми, но, на самом деле, они патологические (измененные). Эти клетки живут слишком долго и замещают некоторые типы лейкоцитов.
«Лимфобластный» и «миелоидный» указывает на два различных типа клеток, из которых возник лейкоз. Лимфобластный лейкоз развивается из лимфоцитов костного мозга, миелоидный лейкоз возникает из гранулоцитов или моноцитов.
Лейкоз может возникнуть как у детей, так и у взрослых, однако разные типы лейкозов преобладают в одной или другой группах.
Острый лимфобластный лейкоз (ОЛЛ)
— Встречается у детей и взрослых
— Чаще диагностируется у детей
— Составляет несколько более половины всех случаев лейкоза у детей
Острый миелоидный лейкоз (ОМЛ) (часто называется острым нелимфобластным лейкозом)
— Поражает детей и взрослых
— Составляет менее половины всех случаев лейкоза у детей
Хронический лимфоцитарный лейкоз (ХЛЛ)
— Встречается только у взрослых
— Выявляется в два раза чаще хронического миелоидного лейкоза (ХМЛ)
Хронический миелоидный лейкоз (ХМЛ)
— В основном поражает взрослых и очень редко выявляется у детей
— Диагностируется в два реже ХЛЛ.
Симптомы
В начальной стадии острого миелобластного лейкоза симптомы практически отсутствуют, с развитием болезни у пациента развиваются:
- бледность кожи и другие признаки анемии;
- кровотечения из носа и дёсен, многочисленные кровоподтёки на коже;
- повышенная температура в пределах 37-38 градусов (субфебрильная);
- обильное выделение пота по ночам;
- сыпь на коже в виде мелких красноватых пятнышек;
- одышка даже после небольших нагрузок;
- постоянные боли в костях и суставах;
- частые простудные и другие инфекции;
- увеличенные лимфоузлы;
- резкое снижение веса без видимых причин.
4.Как вылечить лейкемию?
Острый миелоидный лейкоз
– это совокупность онкологических заболеваний, поэтому лечение этого заболевания зависит в первую очередь от того, в каком органе произошло скопление патологически измененных клеток, а также от множества других факторов. Огромное значение в онкологии имеет своевременное лечение, поэтому его следует начинать сразу после установления диагноза.
В большинстве случаев лечение острого миелоидного лейкоза представляет собой совокупность методов, включающих в себя лучевую и химическую терапию, а также трансплантацию костного мозга.
Химиотерапия
основывается на использовании противоопухолевых препаратов: Преднизона, Цитарабина и других медикаментов. Как правило, этот метод лежит в основе лечения онкологических заболеваний.
Лучевая терапия
осуществляется с использованием высокоэнергетического излучения, которое убивает раковые клетки. Особенностью этого метода является то, что воздействию подвергаются только патологически измененные клетки.
Трансплантация костного мозга
заключается в пересадке стволовых клеток костного формирования от подходящего донора.
Рассмотрим более внимательно лечение острого миелоидного лейкоза. Оно условно подразделяется на несколько этапов: индукцию ремиссии и консолидации. Цель индукционной терапии заключается в достижении ремиссии, уничтожив максимальное количество вредоносных клеток. Терапия консолидации представляет собой терапию закрепления ремиссии. Она необходима для уничтожения остаточного количества аномальных бластных клеток во избежание рецидива – повторного возникновения заболевания.
Каковы показатели выживаемости при острой миелоидной лейкемии? За последние пять лет этот показатель увеличился на 24%. Подобный положительный прогноз свидетельствует о том, что это смертельное заболевание можно победить! Самое главное вовремя начать лечение острого миелоидного лейкоза и регулярно обследоваться для предотвращения повторного возникновения патологически измененных клеток.
Причины и факторы риска
В настоящее время неизвестно, какие именно воздействия побуждают ростки крови к злокачественным мутациям, однако онкологи хорошо изучили факторы, способствующие развитию острого миелобластного лейкоза.
- Воздействие канцерогенов. Некоторые химические соединения могут побуждать клетки к изменению. Это ряд продуктов, образующихся во время курения табака и неполного окисления жиров, многие виды промышленных выбросов, некоторые лекарственные препараты и т. д.
- Излучение. Рентгеновские лучи и другие радиоактивные, ионизирующие излучения изменяют наследственный аппарат живых клеток.
- Генетический фактор. Риск заболевания повышается в несколько раз для людей, у которых близкие родственники болели лейкозом.
- Заболевания. Некоторые болезни увеличивают вероятность рака крови. Это синдром Дауна, врождённая анемия и тромбоцитопения, нейрофиброматоз и т. д.
Лечение хронического миелолейкоза
На начальном этапе, до получения цитогенетического подтверждения диагноза (как мы уже знаем, хронический миелолейкоз выставляется при наличии филадельфийской хромосомы), назначается симптоматическая терапия гидроксимочевиной. Ее целью является снижение общего уровня лейкоцитов и тромбоцитов. При непереносимости препарата или недостаточном снижении уровня тромбоцитов может применяться анагрелид. Если имеются признаки лейкостаза (энцефалопатия, зрительные нарушения, нарушения работы почек), проводится лейкаферез.
После цитогенетического подтверждения диагноза, назначается специфическая противоопухолевая терапия. Главными препаратами являются ингибиторы тирозинкиназ (ИТК). Дозировка подбирается в зависимости от уровня лейкоцитов. На начальном этапе для профилактики синдрома лизиса опухоли необходима усиленная гидратация (дополнительное введение жидкости в объеме 2-2,5 л/м 2 , если нет противопоказаний со стороны сердечно-сосудистой системы) и назначение аллопуринола.
Целью специфического лечения хронического миелолейкоза является подавление опухолевого клона клеток, снижение риска прогрессирования патологии и продление жизни пациента до значений, сопоставимых с общепопуляционными показателями. С внедрением в практику ИТК эти задачи стали вполне выполнимы и не только позволили повысить общую выживаемость таких больных в несколько раз, но и оказаться от пожизненного приема препаратов и перехода под динамическое наблюдение у пациентов с хорошим молекулярным ответом опухоли.
В настоящее время согласно принятым протоколам лечения, ИТК должны назначаться всем больным с впервые выявленным хроническим миелолейкозом. В основе механизма их действия лежит блокада АТФ-связывающего кармана патологической молекулы BCR-ABL, что лишает этот белок тирозинкиназной активности, которая стимулирует избыточное деление опухолевых клеток. При постоянном приеме ИТК, опухолевый клон подвергается редукции, что дает возможность восстановлению нормального кроветворения.
В России для терапии первой линии зарегистрированы следующие препараты из группы ИТК:
- иматиниб,
- нилотиниб,
- дазатиниб.
Иматиниб
Иматиниб обладает избирательной активностью в отношении BCR-ABL тирозинкиназы и некоторых других тирозинкиназ. Назначается длительными курсами и должен приниматься ежедневно. Первоначальная дозировка составляет 400 мг в сутки при хронической фазе миелолейкоза, и 600 мг/сут при фазе акселерации или бластном кризе. Дозировка не зависит от роста, пола и массы тела пациента. Препарат выпускается в таблетированной форме или капсулах. Может применяться в амбулаторных условиях. При неудовлетворительном результате терапии, дозировка может быть увеличена, при развитии токсических осложнений — снижена.
Нилотиниб
Нилотиниб — высокоселективный ингибитор BCR-ABL тирозинкиназы. Был разработан на основе молекулы иматиниба и модифицирван для увеличения сродства к BCR-ABL тирозинкиназой. Выпускается в капсулах. Дозировка при терапии хронической фазы составляет 600 мг/сут, при терапии фазы акселерации — 800 мг/сут. Препарат принимают 2 раза в сутки с интервалом в 12 часов строго натощак, поскольку еда увеличивает биодоступность препарата, что повышает его концентрацию в плазме и может спровоцировать развитие токсических осложнений. При недостаточном терапевтическом эффекте в лечении хронической фазы, возможно увеличение дозировки до 800 мг/сутки. При развитии осложнений, дозу снижают.
Дазатиниб
Дазатиниб обладает активностью ко многим тирозинкиназам, в том числе и к мутантной BCR-ABL. Проникает через гематоэнцефалический барьер. Выпускается в формах для перорального применения. Рекомендуемая дозировка составляет 100 мг/сутки для хронической фазы и 140 мг/сут для фазы акселерации и бластного криза. При недостаточной эффективности терапии хронической фазы возможно увеличение дозировки до 140 мг/сут. При развитии токсических осложнений ее снижают до 80 мг/сутки.
Босутиниб
Босутиниб — относительно новый препарат, в России зарегистрирован в 2014 году и применяется для терапии второй и последующих линий при непереносимости или неэффективности вышеперечисленных препаратов. Стандартная суточная доза составляет 500 мг, при необходимости может быть увеличена до 600 мг.
Выбор препарата первой линии проводится индивидуально для каждого пациента. При этом учитывается фаза лейкоза, чувствительность опухолевого клона с отдельными мутациями, профиль токсичности каждого препарата и наличие у пациента сопутствующих заболеваний.
Определение спектра мутаций проводится при манифестации патологии с фазу акселерации или бластного криза, либо при неэффективности терапии выбранным препаратом и необходимости смены препарата, поскольку здесь есть вероятность возникновения резистентных клонов. Например, мутации F317L/V, T315A, V299L обуславливают низкую чувствительность к дазатинибу, поэтому его меняют на нилотиниб. Мутации Y253H, E255K/V, F359V/C, наоборот, делают опухолевые клетки резистентными к нилотинибу, поэтому таким пациентам показан дазатиниб.
Мутации E255K/V, G250E, V299L обуславливают устойчивость к босутинибу. Наличие мутации Т3151 определяет устойчивость ко всем видам ИТК, поэтому таким пациентам рекомендуется аллогенная трансплантация гемопоэтических стволовых клеток. Также возможен вариант терапии понатинибом, но он пока не зарегистрирован в России.
Эффект терапии первой линии может быть отнесен к одной из трех групп:
- Оптимальный ответ. Это хороший результат, который позволяет надеяться на длительный период безрецидивной выживаемости (7-8 и более лет). Критерием достижения оптимального ответа является полный гематологический ответ в течение 3 месяцев, полный цитогенетический ответ в течение 6 месяцев и большой молекулярный ответ в течение 12-18 месяцев.
- Предупреждение. При наличии предупредительных факторов требуется тщательный мониторинг состояния больного и готовность к смене режима лечения. Факторами предупреждения является группа высокого риска хронического миелолейкоза, увеличение более, чем в 10 раз уровня транскрипции мутантного гена, наличие дополнительных хромосомных аномалий в клетках с филадельфийской хромосомой.
- Неудача терапии. Сюда относят прогрессирование заболевания, возникновение новыхмутаций, появление дополнительных хромосомных аномалий в клетках с филадельфийской хромосомой. Требуется смена терапии.
Другие методы лечения хронического миелолейкоза
Трансплантация донорских стволовых клеток показана пациентам с неэффективностью терапии второй линии и пациентам с мутацией T315I. Пациентам с непереносимостью ИТК и невозможностью проведения трансплантации возможно лечение с помощью гидроксимочевины, интерферонов и цитостатиков.
Диагностика
Лабораторные анализы крови и образцов костного мозга являются основными способами диагностики острого миелобластного лейкоза. Это:
- общий анализ периферической крови;
- миелограмма;
- цитохимический анализ незрелых клеток;
- иммунофенотипирование;
- цитогенетический анализ;
- молекулярно-генетический анализ;
- HLA-типирование;
- биохимический анализ крови;
- проба Реберга;
- коагулограмма.
Кроме того, пациенту назначают инструментальные исследования внутренних органов для оценки их состояния: УЗИ брюшной полости, ЭКГ, рентген грудной клетки. Впоследствии могут быть назначены другие анализы и исследования.
Диагностика хронического миелолейкоза
В большинстве случаев хронический миелолейкоз является случайной находкой, которая обнаруживается при обследовании по другому поводу. Заподозрить его можно по общему анализу крови, в частности по увеличению количества лейкоцитов и преобладанию в формуле гранулоцитарного ростка кроветворения. При этом может увеличиваться не только количество нейтрофилов, но и базофилов с эозинофилами. Может быть умеренная анемия или отклонения в количестве тромбоцитов.
Если врач подозревает хронический миелолейкоз, пациента направляют на дальнейшее обследование — пункцию и биопсию костного мозга. Для подтверждения диагноза необходимо проводить стандартное цитогенетическое исследование костного мозга на предмет наличия филадельфийской хромосомы. Исследуется не менее 20 метафаз. При невозможности проведения цитогенетики, прибегают к флюоресцентной in situ гибридизации, с помощью которой выявляют химерный ген. Также определяется экспрессия химерного гена в клетках периферической крови посредством ПЦР. Если типичный транскрипт не обнаруживается, а при этом есть клинико-гематологические признаки хронического миелолейкоза, показано определение более редких мутаций — BCR-ABLp190, р230.
В фазе бластного криза проводят иммунофенотипирование бластных клеток, цитологическое и биохимическое исследование спинномозговой жидкости. При обнаружении хронического миелолейкоза в фазе активации или бластного криза, поиск филадельфийской хромосомы может осуществляться посредством секвенирования генетического материала клеток крови.
Лечение
Основным методом лечения острого миелобластного лейкоза является химиотерапия, которая проводится в два этапа:
- индукция — снижение количества незрелых клеток для достижения ремиссии;
- консолидация — максимальное продление ремиссии, предотвращение рецидивов, устранение остаточных явлений.
Интенсивная терапия, применяемая на этапе индукции, позволяет достигнуть ремиссии примерно в 70% клинических случаев. Но заканчивать на этом лечение категорически не следует, так как без программы консолидации у пациентов практически всегда спустя некоторое время наступает рецидив.
Консолидационный этап, в зависимости от состояния больного, включает до пяти курсов химиотерапии. Если риск рецидива достаточно высок, проводится пересадка костного мозга и/или стволовых клеток кроветворения. Лучшими донорами считаются родные братья и сёстры, особенно однояйцевые близнецы.
Кроме того, пациентам часто назначают введение эритроцитарной массы, трансфузионную терапию (переливания крови и её препаратов). Тактика лечения обычно выбирается в соответствии с возрастом пациента. Ремиссия считается достигнутой, если количество миелобластных клеток в костном мозге удаётся снизить до 20% и менее.
благотворительный фонд
Суть болезни
Лейкоз, или лейкемия – заболевание костного мозга, в обиходе иногда называемое «раком крови». При лейкозе нарушено нормальное кроветворение: производится избыточное количество аномальных незрелых клеток крови, обычно предшественников лейкоцитов. Эти бластные клетки, размножаясь и накапливаясь в костном мозге, мешают выработке и функционированию нормальных клеток крови, что и обуславливает основные симптомы заболевания.
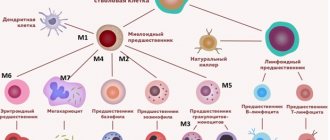
Как известно, различные клетки крови развиваются по-разному и имеют разных предшественников – то есть относятся к различным линиям кроветворения (см. схему в статье «Кроветворение»). Линия кроветворения, приводящая к появлению лимфоцитов, называется лимфоидной; остальные же лейкоциты и другие клетки крови относятся к миелоидной линии. Соответственно, различают лейкозы из клеток-предшественников лимфоцитов (такие лейкозы называют лимфобластными, лимфоцитарными или просто лимфолейкозами) и из предшественников других клеток (такие лейкозы называют миелобластными, миелоидными или просто миелолейкозами).
Острый миелоидный лейкоз (ОМЛ, острый миелобластный лейкоз, острый миелолейкоз, острый нелимфобластный лейкоз) – заболевание, сравнительно редко встречающееся у детей, однако с возрастом частота его возрастает. Термин «острый» означает быстрое развитие болезни, в противоположность хроническому лейкозу. Термин «миелоидный» (см. выше) означает, что незрелые клетки, составляющие основу болезни, принадлежат к так называемой миелоидной линии кроветворения. Эти клетки – как правило, миелобласты и их потомки, но возможно и присутствие других видов бластных клеток.
В рамках франко-американско-британской морфологической классификации (ФАБ, FAB) выделяют 8 основных вариантов ОМЛ.
* М0 (ОМЛ с минимальной дифференцировкой): <5% всех случаев ОМЛ * М1 (ОМЛ без созревания): 15-20% * М2 (ОМЛ с признаками созревания): 20-30% * М3 (Острый промиелоцитарный лейкоз): 10-15% * М4 (Острый миеломоноцитарный лейкоз): 20-25% * М5 (Острый моноцитарный лейкоз): 5-10% * М6 (Острый эритроидный лейкоз): <5% * М7 (Острый мегакариоцитарный лейкоз): 3-10%
Некоторые очень редкие варианты ОМЛ не включены в этот список. Варианты ОМЛ с М3 по М7, имеющие собственные названия и некоторые специфические особенности, более подробно рассмотрены в отдельных разделах нашего справочника.
Частота встречаемости, факторы риска
ОМЛ составляет у детей около 15% всех случаев онкологических заболеваний кроветворной системы, то есть встречается у них заметно реже, чем острый лимфобластный лейкоз. Среди детей до 14 лет частота ОМЛ составляет приблизительно 0.6-0.8 случаев на 100 тысяч человек в год, однако в возрасте после 40-45 лет происходит резкий подъем заболеваемости. Большинство больных ОМЛ – пожилые люди. В отличие от острого лимфобластного лейкоза, где пик заболеваемости наблюдается в детском возрасте, при ОМЛ дети составляют всего 10% больных.
В большинстве случаев ОМЛ невозможно назвать непосредственную причину заболевания. Однако некоторые факторы повышают вероятность возникновения ОМЛ: воздействие ряда химических препаратов, ионизирующей радиации (в том числе в ходе предшествующего лечения других онкозаболеваний). Иногда наблюдаются и случаи заболевания ОМЛ среди близких родственников, что говорит об определенной роли генетической предрасположенности. Но конкретные генетические особенности, повышающие риск развития лейкоза, во многих случаях пока не удается выделить, хотя исследования постоянно ведутся.
Развитию ОМЛ могут предшествовать некоторые заболевания кроветворной системы, такие как миелодиспластический синдром. Тогда говорят о вторичном лейкозе. Наконец, риск ОМЛ повышен при определенных генетически обусловленных аномалиях, включая синдром Дауна, анемию Фанкони и др.
Признаки и симптомы
ОМЛ характеризуется множеством различных признаков и у разных больных может проявляться по-разному. Ведущими, как правило, являются признаки анемии: утомляемость, бледность, одышка, снижение аппетита. Недостаток тромбоцитов проявляется повышенной кровоточивостью при порезах и ушибах, носовыми кровотечениями, «беспричинным» появлением синяков и кровоподтеков. Нередко встречаются устойчивые к лечению инфекции, так как у больного для борьбы с ними слишком мало «нормальных» (зрелых) лейкоцитов. Может возникнуть поражение слизистых оболочек рта и желудочно-кишечного тракта, припухлость десен. Нередко повышена температура тела, ощущаются боли в костях. Иногда возникают опухоли из лейкемических клеток вне костного мозга – миелосаркома.
Так как большинство симптомов может быть связаны и с другими заболеваниями и не специфично для ОМЛ, перед началом лечения необходимо уточнение диагноза на основании лабораторных методов, которое в срочном порядке производится в больничных условиях.
Диагностика
При ОМЛ возникают изменения в обычном клиническом анализе крови: недостаток эритроцитов и тромбоцитов, нередко избыток лейкоцитов, причем многие из них представлены незрелыми формами. Но надежно поставить диагноз можно только при исследовании образца костного мозга. Согласно критериям Всемирной организации здравоохранения, диагноз ОМЛ ставится, если содержание миелобластов в костном мозге не менее 20% (согласно франко-американо-британской классифиции FAB, пороговым значением является 30%).
Для лечения и оценки прогноза заболевания важно не только подтвердить диагноз «лейкоз», но и различить острый лимфобластный лейкоз и ОМЛ, разграничить лейкоз и миелодиспластический синдром, а также определить конкретный вариант ОМЛ (см. выше). Для этой цели применяется не только морфологическое исследование клеток (микроскопическое исследование специальным образом окрашенных препаратов), но и цитохимический анализ, а также иммунофенотипирование (изучение белков-антигенов на поверхности клеток). Цитогенетические исследования применяются для обнаружения хромосомных перестроек – в первую очередь транслокаций, имеющих большое значение для определения варианта болезни и прогноза. Возрастающую роль играют и молекулярно-генетические анализы.
Точная диагностика ОМЛ и его вариантов иногда представляет собой сложную задачу, требующую участия высококвалифицированных гематологов и гемопатологов в диагностическом процессе.
Как и при остром лимфобластном лейкозе, результаты диагностических исследований при ОМЛ используются для отнесения пациента к той или иной группе риска. Это необходимо для того, чтобы определить тактику лечения, оценить как вероятность ответа на химиотерапию, так и риск последующего рецидива. У пациентов, принадлежащим к группе низкого риска, больше шансов достичь долговременной ремиссии при стандартном химиотерапевтическом лечении, а при высоком риске для успеха терапии будет планироваться трансплантация костного мозга.
Группу риска определяют многие факторы. Перечислим некоторые из них:
- Возраст: у больных среднего и пожилого возраста прогноз в среднем хуже, чем у детей и молодых людей.
- Хромосомные изменения в лейкемических клетках. Так, транслокации t(15;17) или t(8;21) определяют у больных более низкий риск. В то же время, например, определенные цитогенетические изменения изменения связаны с ухудшением прогноза.
- Вариант лейкоза. Некоторые варианты ОМЛ (такие как М0, М6, М7) связаны с высоким риском, а некоторые, напротив, сравнительно хорошо поддаются современной терапии (ОМЛ М3).
- С более высоким риском связан вторичный лейкоз, возникший на фоне другого гематологического заболевания – такого как миелодиспластический синдром или анемия Фанкони, – или после прохождения лечения (химиотерапия, облучение) по поводу какой-либо злокачественной опухоли. Риск также повышается при рецидиве лейкоза.
Лечение
Главным методом лечения ОМЛ является химиотерапия. Как в случае острого лимфобластного лейкоза, лечение включает фазы индукции ремиссии и консолидации; иногда применяется также поддерживающая терапия.
Индукция ремиссии – интенсивная терапия, направленная на достижение ремиссии лейкоза. При большинстве вариантов ОМЛ индукция ремиссии производится при помощи интенсивной химиотерапии с использованием цитарабина (цитозара) и лекарств антрациклинового ряда (даунорубицин, идарубицин), иногда с добавлением других препаратов – например, этопозида или митоксантрона.
Специфической особенностью терапии при остром промиелоцитарном лейкозе (ОМЛ М3) является использование лекарства ATRA (полностью транс-ретиноевая кислота) или других лекарств с похожим действием (триоксид мышьяка).
Если в результате терапии индукции оказывается, что в костном мозге стало менее 5% бластных клеток (на фоне восстановления кроветворения) и у пациента нет других проявлений болезни, то констатируется достижение ремиссии.
В результате курсов индукции удается достичь ремиссии у большинства пациентов. Однако достигнутая ремиссия не может быть стойкой без терапии консолидации, то есть закрепления ремиссии. В фазе консолидации уничтожаются остаточные количества аномальных бластных клеток во избежание рецидива заболевания. Важнейшим препаратом в фазе консолидации при лечении ОМЛ является цитарабин, в том числе высокодозный; к нему часто добавляются другие препараты в разных сочетаниях.
При лечении рецидивов ОМЛ часто используются режимы химиотерапии, включающие в себя флударабин.
На этапах индукции и консолидации внутривенное введение химиотерапевтических препаратов производится в условиях больничного стационара.
Поддерживающая терапия используется далеко не во всех случаях (в отличие от острого лимфобластного лейкоза), однако при варианте ОМЛ М3 она важна. Эта терапия менее интенсивна, чем терапия индукции и консолидации, и не требует пребывания в больнице.
Иногда при ОМЛ к терапии добавляются современные таргетные препараты. Конкретные лекарства зависят от генетических особенностей опухолевых клеток. Например, при определенной генетической поломке эффективен препарат сорафениб.
Нейролейкемия менее характерна для ОМЛ, чем для острого лимфобластного лейкоза. Но иногда она встречается, чаще у детей при вариантах ОМЛ М3, М4 и М5. Для ее лечения и профилактики могут использоваться цитарабин, метотрексат и глюкокортикостероиды, вводимые интратекально, посредством люмбальной пункции спинномозгового канала.
Для снижения вероятности рецидива части пациентов показана трансплантация костного мозга. При ОМЛ она используется чаще, чем при остром лимфобластном лейкозе. Показаниями к трансплантации могут служить, например,
- вариант болезни, связанный с более высоким риском (см. выше),
- цитогенетические изменения в лейкемических клетках, связанные с высоким риском,
- рецидив лейкоза,
- вторичный ОМЛ, развившийся на фоне миелодиспластического синдрома или другой болезни крови, или же после предшествующего лечения злокачественных опухолей.
Вероятность успеха трансплантации максимальна, если проводить ее после достижения первой ремиссии. У детей трансплантации производятся чаще, чем у взрослых, и в среднем более успешны. Постоянно ведется работа над совершенствованием режимов трансплантации.
В ходе интенсивной химиотерапии ОМЛ практически всегда в той или иной мере подавляется нормальное кроветворение. Поэтому многим больным ОМЛ необходимы переливания компонентов крови: тромбоцитов во избежание кровотечений и эритроцитов для лечения анемии.
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения часто необходимы эффективные антибактериальные, противогрибковые и противовирусные лекарства для профилактики и терапии инфекционных осложнений. Опасность представляют как обычные, так и оппортунистические инфекции.
Лечение ОМЛ накладывает ограничения на образ жизни больного. В ходе интенсивной химиотерапии необходимо соблюдать диету и строгие правила гигиены, а также минимизировать контакты с внешним миром во избежание инфекций. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
Общая продолжительность лечения при различных формах ОМЛ составляет от нескольких месяцев до (в случае варианта М3) 2-3 лет.
Постоянно появляются новые таргетные лекарства, которые помогают излечивать больных со сложными случаями ОМЛ. Так, некоторым пациентам помогает венетоклакс («Венклекста») и/или даратумумаб («Дарзалекс»). Иногда используется конъюгированный препарат гемтузумаб озогамицин («Милотарг»). Кроме того, совершенствуются протоколы трансплантации костного мозга.
Прогноз
Без лечения ОМЛ, как правило, приводит к гибели больного в течение нескольких месяцев, иногда даже нескольких недель. Однако при современном лечении многих можно спасти. Прогноз зависит от конкретного варианта лейкоза, хромосомных особенностей лейкемических клеток, возраста, общего состояния больного и других факторов.
В настоящее время медицина в развитых странах способна излечить более 65% детей, заболевших ОМЛ. В частности, постоянно улучшаются результаты трансплантации костного мозга. В среднем и пожилом возрасте, к сожалению, вероятность излечения существенно ниже.
Следует отметить, что большинство пациентов с ОМЛ – это именно пожилые больные. По сравнению с молодыми они тяжелее переносят лечение и хуже на него отвечают. Лишь у меньшинства пациентов старше 60 лет удается достичь длительной ремиссии. Для остальных зачастую основным становится поддерживающее лечение (борьба с инфекциями, переливания компонентов крови, обезболивание) для продления жизни и улучшения ее качества.