28.06.2017
Заболевания мочеполовой системы | Почки
В названии этого недуга, образованного сочетанием греческого и латинских терминов, заложен:
- его характер — воспаление (лат. «ит»);
- орган-мишень — почка (греч. «нефрос»);
- внутриорганная локализация первичных повреждений — клубочек (лат. «гломус»).
Почечный клубочек — это составляющая рабочей единицы почки — нефрона (в каждой почке их около миллиона). Здесь осуществляется первый этап очистки крови и образуется т.н. первичная моча. Для дальнейшего «досмотра» и возвращения в организм полезных компонентов она отправляется в канальциевый аппарат нефрона и постепенно превращается в то, с чем организм готов расстаться — в т.н. вторичную мочу.
Острый гломерулонефрит
Воспалительное повреждение почечных клубочков (а в последующем — и других составляющих органа) имеет иммунную природу. Иммунные механизмы играют особую роль в начале заболевания (в дальнейшем к его развитию подключаются и не иммунные факторы). Соединения, образовавшиеся в ответ на внедрение «чужака» (особенно, повторное) с целью его обезвреживания (т.н. иммунные комплексы), оседают в почках, запуская каскад воспалительных реакций. Их итогом становится морфологическое и функциональное изменение нефронов, их постепенное истощение и отмирание. В результате почки перестают адекватно справляться с возложенной на них ролью. А организм, с одной стороны, теряет то, что ему нужно (например, белки и клетки крови), и вынужденно сосуществует с тем, от чего хочет и должен избавляться (токсичные продукты обмена).
Острому воспалению клубочкового аппарата, как правило, присуще и острое начало с ярко выраженной симптоматикой (см. ниже). Встречается и т.н. латентный тип с нерезкими признаками, преимущественно выявляемыми с помощью лабораторных исследований.
Острый характер недуга более присущ юному возрасту (дети и подростки) и имеет благоприятный прогноз. У 20% заболевших болезнь принимает хронический характер.
Хронический гломерулонефрит
Сценарий развития патологических изменений почечной ткани аналогичен острому типу (комбинация иммунных и не иммунных факторов). Течение длительное. Возможны обострения. Прогноз определяется стадией процесса на момент выявления (компенсированная, декомпенсированная, терминальная — тяжелая степеньпочечной недостаточности), клинической формой патологии (нефротическая, гипертоническая, гематурическая, латентная, смешанная). Чаще всего речь идет о повышении качества жизни и отодвигании сроков наступления почечной недостаточности. Иногда случается полная ремиссия.
Мембранозный гломерулонефрит
Морфологическая разновидность (выявляемая при анализе биопсийного материала) острого и хронического поражения клубочкового аппарата почек.
Гломерулонефрит у детей
На его долю приходится около половины показаний к использованию гемодиализа и последующей трансплантации почки. Симптомы и механизм развития недуга аналогичны «взрослому» варианту.
Особенности заболевания
В классификации гломерулонефрита выделяют следующие формы:
- нефротическую, с преобладанием мочевой симптоматики;
- гипертоническую, с повышением артериального давления и слабо выраженным мочевым синдромом;
- гематурическую, когда основным симптомом становятся эритроциты в моче;
- латентную, со слабыми проявлениями болезни;
- смешанную, при которой одинаково сильно выражены гипертонический и мочевой синдромы.
У детей гломерулонефрит является вторым по частоте заболеванием после инфекций мочевыводящей системы. Среди взрослых болезнь наиболее часто встречается у мужчин в возрасте до 50 лет, женщины и пожилые люди заболевают значительно реже.
Методы лечения гломерулонефрита
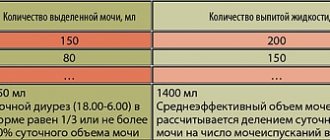
При активном процессе лечение проводится в специализированном стационаре. Назначается постельный режим, специальная диета. Определение суточного объема жидкости, который должен употреблять ребенок, проводится индивидуально для каждого пациента с учетом многих параметров.
Медикаментозное лечение является комплексным и включает в себя глюкокортикоиды, также возможно назначение цитостатиков. Кроме этого, в лечении применяют препараты, которые снижают артериальное давление, антибактериальные, антигистаминные препараты, при наличии показаний мочегонные средства, витаминотерапию, кардиометаболиты. В случае развития почечной недостаточности необходим гемодиализ.
Самолечение гломерулонефрита в домашних условиях является недопустимым и крайне опасным для здоровья и жизни ребенка.
В каких случаях развивается болезнь
Наиболее часто толчком к развитию воспалительного процесса в почечных клубочках становятся стрептококки либо стафилококки. Основными причинами гломерулонефрита медики считают:
- острые вирусные инфекции – грипп, пневмонию, ангину, скарлатину;
- вакцинацию «живыми» вакцинами»;
- аллергические реакции организма;
- системные болезни – красную волчанку, васкулиты.
Не стоит сбрасывать со счетов и сопутствующие неблагоприятные факторы, в первую очередь:
- хронические инфекции – кариес, гайморит, тонзиллит, вирусный гепатит и т. д.;
- бесконтрольный прием лекарственных препаратов;
- продолжительное пребывание на солнце;
- частое употребление соленых продуктов;
- наличие вредных для здоровья привычек – употребление алкоголя, наркотических препаратов.
Воспалительный процесс возникает из-за повреждения иммунного механизма: антитела образуют белковые комплексы с антигенами, оставленными в крови инфекцией, причем эти белки оседают на стенках капилляров в гломерулах. Кровообращение в почках ухудшается, клетки тканей начинают гибнуть, из-за чего ухудшается фильтрующая функция клубочков и нарастает общая интоксикация организма, что выражается в определенном наборе проявлений.
Острый гломерулонефрит у детей
Гломерулонефриты – это гетерогенная группа иммуновоспалительных заболеваний почек, характеризующаяся преимущественным поражением клубочков, в меньшей степени канальцев и межуточной ткани, различной клинико-морфологической картиной, разным течением и прогнозом.
Выделяют первичные и вторичные, возникающие при ряде патологических процессов (в том числе при системных васкулитах, диффузных болезнях соединительной ткани и т.д.), гломерулонефриты. У детей обычно встречаются первичные гломерулонефриты, и по течению их классифицируют на быстрый, хронический и быстропрогрессирующий.
Под острым гломерулонефритом понимают иммунокомплексное поражение клубочков, которое обычно возникает у детей 5–12 лет через 2–6 недель после перенесенной инфекции. В клинике при этом проявляется нефритический синдром, а морфологический субстрат заболевания представлен мезангиопролиферативными изменениями. Заболевание имеет циклическое течение, и в 80–85 % случаев заканчивается полным выздоровлением.
Ввиду связи заболевания с перенесенной инфекцией его часто называют острый постинфекционный гломерулонефрит (ОПИГН).
Наиболее часто острому гломерулонефриту предшествуют фарингит, острая ангина, обострение хронического тонзиллита, стрептодермия, скарлатина, рожа, реже — острая респираторная инфекция. Ввиду преобладания заболеваний стрептококковой этиологии, острый гломерулонефрит также часто называют острым постстрептококковым гломерулонефритом. Наиболее часто заболевание ассоциируется со специфическими нефритогенными штаммами В-гемолитического стрептококка группы А. Эти штаммы отличаются по ряду параметров от стрептококков, вызывающих острую ревматическую лихорадку.
Связь острого гломерулонефрита со стрептококковой инфекцией подтверждается повышением уровня антистрептококковых антител начиная со 2–3 недели заболевания, снижением содержания отдельных фракций комплемента (С3–5), повышением концентрации IgG A (реже М) в сыворотке крови. Также отмечается нейтрофильный лейкоцитоз, ускорение СОЭ, повышение уровня глобулинов и острофазовых белков.
В основе патогенеза заболевания лежит поражение клубочков почек циркулирующими иммунными комплексами, в состав которых входят антигены стрептококков, иммуноглобулины (обычно класса G) и комплемент. Вторым звеном патогенеза служит активация системы гемостаза с образованием внутри почечных клубочков тромбоцитарных агрегатов и нитей фибрина. Локальное тромбообразование приводит к нарушению микроциркуляции и высвобождению вазоактивных веществ (серотонин, простагландины, фактор проницаемости), что в дальнейшем приводит к воспалительной пролиферации клеток клубочков.
Мезангиопролиферативные изменения в клубочке зачастую сочетаются с нарушениями в проксимальных канальцах (дистрофия и деструкция эпителия) и интерстиции с их дисфункцией, что указывает на серьезный прогноз заболевания.
Латентный период в случаях острого гломерулонефрита, развившегося вследствие стрептококковой инфекции, длится от 2 до 8 недель. При фарингите и ангине продолжительность латентного периода обычно составляет 10–14 дней, при стрептодермии — 21 день и более.
Чаще всего поводом для обращения к врачу служат внезапно возникшие периорбитальные и периферические отеки, а также изменения цвета мочи, которая приобретает окраску цвета «мясных помоев». Больные также могут предъявлять жалобы на головную боль, общее недомогание, потерю аппетита, боли в животе, тяжесть в области поясницы. Несмотря на кажущееся разнообразие симптомов, все они, как правило, вписываются в рамки нефритического синдрома. Основными клиническими его проявлениями являются плотные симметричные, неподвижные отеки и артериальная гипертензия. Кроме этого, могут быть изменения со стороны сердечно-сосудистой системы: тахикардия, расширение границ сердца влево, напряженные тоны сердца, а также одышка и боли в животе.
Гипертензия возникает более чем у 75 % детей. Примерно у 5 % госпитализированных пациентов развивается тяжелая гипертензия, которая может привести к развитию ангиоспастической энцефалопатии. Основной причиной гипертензии служит нарушение клубочковой фильтрации. Вследствие задержки почками воды увеличивается внеклеточный объем жидкости (ОЦК), что сопровождается гипертензией. Нарушение микроциркуляции в клубочках приводит к непрерывному раздражению юкстагломерулярного аппарата, закономерной активации РААС, выделению альдостерона, что также приводит к задержке жидкости в кровеносном русле. Повышение ОЦК лабораторно проявляется как анемия разведения, наблюдающаяся с большим постоянством.
Все вышеперечисленные признаки относятся к экстраренальным.
К ренальным проявлениям относят 4 основных симптома: 1. Макрогематурия с выделением мочи бурой окраски с высоким удельным весом; 2. Протеинурия менее 1 г/м2 в сутки, либо менее 5 мг/кг в сутки, либо менее 3 г/л; 3. Цилиндрурия; 4. Олигурия.
У части больных с олигурией может повышаться содержание мочевины, креатинина, калия в крови, возникать сдвиг рН в сторону ацидоза, что рассматривается как нарушение функции почек острого периода.
Экстраренальные проявления обычно ликвидируются к концу 2–3 недели болезни, ренальные могут сохраняться до 1,5–3 месяцев и более. Микрогематурия может сохраняться в течение года, после чего она полностью ликвидируется. Данные положения справедливы для типичного (циклического) течения ОПИГН, однако в настоящее время также выделяют ациклическое (нетипичное) течение.
При ациклическом течении заболевание проявляется изолированным мочевым синдромом (гематурия, протеинурия без отеков и гипертензии). Нередко отмечается повышение СОЭ, иногда анемия, лейкоцитоз и эозинофилия. Функции почек сохранены или несколько нарушены. Олигурия сочетается с высокой относительной плотностью мочи. Незначительно снижается клубочковая фильтрация (до 50–60 мл/мин по клиренсу эндогенного креатинина). У трети детей отмечается небольшое повышение сывороточной мочевины, что трактуется как гиперазотемия острого периода, сохраняющаяся в течение 3–5 дней.
Несмотря на в целом благоприятное течение и прогноз заболевания, нередки и осложнения. Вследствие повышения ОЦК, например, может развиться острая сердечная недостаточность по левожелудочковому типу, которая проявляется одышкой, расширением границ сердца, влажным кашлем, отеком легких.
Ангиоспастическая энцефалопатия — еще одно частое осложнение ОПИГН, представляет собой спазм сосудов головного мозга вследствие повышения артериального давления. В активную стадию острого гломерулонефрита из-за повреждения клубочкового барьера, снижения клубочковой фильтрации, нарушения микроциркуляции в капиллярах клубочков происходит повышение ОЦК, активация ренин-ангиотензин-альдостероновой системы. Таким образом, ведущими звеньями патогенеза почечной эклампсии является ангиоспазм, нарушение мозгового кровообращения, гипоксия вплоть до отека мозга. Симптомами ангиоспастической энцефалопатии являются: артериальная гипертензия, брадикардия, бессонница, головная боль, тошнота, повторная рвота. В последующем присоединяются гипертоническая ретинопатия — нарушение остроты зрения, «мушки», потемнение в глазах, изменение полей зрения, утрата зрения. Возможны тонико-клонические судороги, кома.
В терапии ОПИГН используются следующие основные принципы: 1) Этиотропная терапия антибиотиками и противовирусными препаратами; 2) Патогенетическая (антикоагулянты, дезагреганты, неферментные активаторы фибринолиза); 3) симптоматическая (диуретики, гипотензивные средства и т. д.).
В терапии острого постстрептококкового гломерулонефрита предпочтение стоит отдавать препаратам пенициллинового ряда (30–50мг/кг/сут), макролидам (10мг/кг/сут 1р/сут), реже применяются цефалоспорины 1, 2 поколения. Курс лечения антибиотиками следует продолжать 10–14 дней, однако у детей, имеющих хронические очаги стрептококковой инфекции, после завершения курса пенициллинами необходимо использовать введения бициллина-5 (1500000 ЕД 1 раза в месяц для детей до 7 лет и до 800000 с 7 лет), ретарпена (2400000 ЕД). Режим противорецидивной терапии — 6–12–24 месяца. О необходимости продолжить противорецидивную терапию и/или увеличить/уменьшить дозу будет свидетельствовать уровень антистрептолизина.
При развитии иммунной фазы воспаления в ответ на появление возбудителя применение антибиотиков не устраняет патологического повреждения почек. Однако при их назначении ограничиваются возможности для формирования в сосудистом русле циркулирующих иммунных комплексов, что позволяет значительно снизить риски возникновения осложнений и улучшить прогнозы.
Патогенетическая терапия заключается в назначении дезагрегантов и антикоагулянтов. Показанием для их назначения будет являться гиперкоагуляция. Прямые антикоагулянты (гепарин и фраксипарин) назначают на 3–4 недели и отменяют постепенно. Дезагреганты можно назначать на более длительный срок, так как улучшение реологических свойств крови способствует более быстрому восстановлению эндотелия клубочков почек. Обычно их используют в терапевтической дозе на протяжении 4–6 недель, в поддерживающей дозе 1,5–2 месяца.
При нарушении функции почек в остром периоде вводятся исключительно калийуретические диуретики. При выраженных отеках, артериальной гипертензии, олигурии предпочтение отдается быстрым, сильным петлевым диуретикам, таким как фуросемид. В остальных случаях можно рекомендовать гипотиазид. К слову, лазикс в дозе 2мг/кг входит в программу неотложной помощи при эклампсии, когда очень важно снизить гиперволемию и вазоконстрикцию в короткие сроки. Помимо фуросемида, с целью снижения давления используют такие гипотензивные препараты, как ингибиторы ангиотензин-превращающего фермента и антагонисты кальция. В тяжелых случаях детям с высоким артериальным давлением, неврологической симптоматикой в условиях реанимационного отделения рекомендуют нитропруссид натрия, который вводят внутривенно капельно 0,5–0,8 мкг/кг/мин в растворе глюкозы. Нельзя применять этот препарат в комбинации с другими гипотензивными препаратами.
При судорогах используют седуксен 0,5 % раствор внутривенно, ГОМК, потому как именно эти препараты меньше всего угнетают дыхательный центр.
Ребенка, перенёсшего острый гломерулонефрит, в течение одного года наблюдения педиатр должен осматривать два раза в месяц за первые три месяца, один раз в месяц в последующие девять месяцев диспансеризации. В дальнейшем осмотр проводится один раз в 2–3 месяца и на фоне интеркуррентных заболеваний.
После пяти лет полной ремиссии, проведении обследования в нефрологической стационаре, либо стационаре одного дня, либо диагностическом центре больного можно снять с диспансерного наблюдения.
Прогноз у детей весьма благоприятен, в большинстве случаев у них наступает полное выздоровление. Тем не менее, у 5–15 % детей гломерулонефрит, к сожалению, переходит в хроническую форму.
Источники
1. Острый гломерулонефрит у детей, Angela Ciuntu, Departamentul Pediatrie USMF 2. Гломерулонефриты у детей, Лоскуткова С. А., 2015
Как распознать гломерулонефрит
Среди основных симптомов гломерулонефрита:
- наличие в моче эритроцитов, придающих ей характерный коричневатый или красноватый оттенок;
- отеки тканей лица (в особенности заметные на веках) и ног, появляющиеся по утрам;
- повышенное давление, которое не понижается после приема лекарств;
- ухудшение мочевыделения при сильной жажде;
- отсутствие аппетита, иногда тошнота, слабость, головная боль;
- одышка;
- увеличение массы тела.
При появлении признаков гломерулонефрита необходимо как можно быстрее обратиться к врачу, чтобы избежать перехода заболевания в хроническую форму. Статистика свидетельствует, что при отсутствии лечения это происходит в 60% случаев.
Диагностические исследования
В настоящее время диагностика гломерулонефрита не вызывает затруднений, особенно в тех случаях, когда симптомы болезни хорошо выражены. Но даже при слабой симптоматике лабораторные анализы и аппаратные исследования позволяют врачу установить полную картину заболевания, особенно при наличии предшествующей инфекции. Для этого он использует следующие назначения:
- общий и биохимический анализы крови;
- общий и биохимический анализы мочи;
- УЗИ почек и УЗГД почечных кровеносных сосудов;
- рентгенограмму и КТ почек;
- нефросцинтиграфию;
- экскреторную урографию (только для больных острой формой);
- ЭКГ;
- исследование глазного дна;
- биопсию почечной ткани (в отдельных случаях).
О наличии гломерулонефрита свидетельствует наличие в моче белка, гематурия, повышение содержания холестерина и азотистых шлаков в крови, а также критически высокие значения иммунных комплексов.
После установления диагноза нефролог назначает соответствующую терапию, учитывающую особенности течения заболевания и общее состояние пациента.
Рекомендации по профилактике гломерулонефрита
Чтобы предотвратить развитие гломерулонефрита, необходимо придерживаться следующих принципов:
- избегайте переохлаждения;
- своевременно лечите респираторные инфекции;
- при назначении врачом антибиотиков пропивайте весь курс до конца, следуя указаниям доктора;
- после перенесенной ангины или ОРВИ сдавайте общий анализ мочи, чтобы исключить бессимптомную (латентную) форму.
Тактика лечения болезни и её осложнений сугубо индивидуальна и зависит от многих факторов, которые обязательно учитываются.
Самолечение при помощи интернета или по совету фармацевтов в аптеке, чревато опасными осложнениями.
Как сегодня лечат гломерулонефрит
Поскольку это достаточно серьезная болезнь, терапия возможна только в условиях стационара, особенно в фазе ярко выраженной симптоматики либо при наличии почечной недостаточности. Современное лечение гломерулонефрита – это комплекс мер, из которых наиболее важное значение придается медикаментозной терапии, которая, в зависимости от особенностей течения болезни, включает:
- антибактериальные препараты для борьбы со стрептококками либо другой инфекцией, спровоцировавшей развитие воспаления почечных клубочков;
- противогрибковые лекарства, если болезнь вызвана грибковой инфекцией;
- противовоспалительные средства для уменьшения воспалительного процесса в почках;
- симптоматические лекарства – противогипертензивные, мочегонные, иммуносупрессоры, антикоагулянты и т.д.
Выраженная почечная недостаточность требует проведения гемодиализа. При серьезном поражении почки может понадобиться трансплантация.
Одним из мощных лечебных факторов служит специальная диета при гломерулонефрите, которая снижает нагрузку на почки, позволяя тканям восстанавливаться. Она базируется на ограничении:
- поваренной соли – не более 3-5 граммов в сутки;
- белков – не более 80 граммов в сутки;
- углеводов – не более 350 граммов в сутки;
- жиров – не более 90 граммов в сутки.
Основные блюда – супы из круп с картофелем, крупяные каши, макароны, зелень и овощи, нежирная молочная продукция, нежирные рыба, мясо и птица. Полностью исключены соления и копчености, жареные блюда, колбасы, шоколад, бобовые, консервы. В стационаре пациенты получают питание в рамках диеты № 7, но и после выписки рекомендуется придерживаться ограничений в пище.
Причины возникновения гломерулонефрита
В основе развития данного заболевания лежит иммуно-воспалительное поражение клубочков, которое возникает при наличии взаимодействия определенного провоцирующего фактора (триггера) и генетических факторов. После проведения многочисленных генетических исследований была доказана наследственная предрасположенность к развитию данной патологии.
В роли провоцирующих факторов могут выступать:
- перенесенные инфекционные заболевания, как бактериальные (в особенности, перенесенная стрептококковая инфекция), так и вирусные (вирус гриппа, аденовирус и др.);
- воздействие некоторых химических веществ и медикаментов;
- введение сывороток, вакцин;
- травма почек;
- переохлаждение.
Также одной из причин развития данной патологии является наличие у ребенка аутоиммунных заболеваний, на фоне которых формируется вторичный гломерулонефрит.
На современном этапе рассматривают два механизма развития гломерулонефрита. Первый — иммунокомплексный, при котором после ряда сложных иммунных реакций в организме формируется комплекс антиген-антитело, повреждающий почечные клубочки. Данный механизм реализуется в 80–90% случаев гломерулонефрита. Второй — аутоиммунный, при котором организм вырабатывает антитела к собственным тканям, в данном случае — к базальной мембране клубочков.