Артрит тазобедренного сустава (коксит) – суставная патология, которая характеризуется активацией воспалительного процесса в полости соответствующего сочленения различного генеза. Этиологическую основу составляют воспалительные поражения ТБС инфекционного, аутоиммунного, травматического происхождения и др. Болезнью может поражаться один или оба тазобедренных сустава. Воспаление изначально начинается в синовиальной оболочке, на последних стадиях переходит уже на хрящевые, связочные, костные ткани. Течение кокситов достаточно вариабельное: наблюдаются острые, подострые, хронические варианты.
Диагноз на рентгене.
Любой этиологии артрит в самом крупном, функционально значимом сочленении приносит немало страданий и испытаний, провоцируя мучительную боль, скованность, нарушение подвижности. Заболевание, длительно протекающее и/или с частыми рецидивами, в большинстве случаев приводит к стойкой хронизации процесса, серьезным осложнениям, в частности к разрушению всех структурных элементов сустава, грубой деформации костного соединения. Наиболее тяжелым видом, который при неадекватном лечении буквально за 2 года от дебюта симптомов приводит к инвалидности, признан ревматоидный артрит (РА). РА – коварнейший системный недуг, полностью вылечиться от которого невозможно.
Артритные патологии ТБС настолько прочно «обосновались» в современном социуме, что полноправно могут называться эпидемией века. По официальным данным, артрит ТБС диагностируется у людей всех возрастов: у пожилых, молодых, подростков и даже детей. Статистика показывает, что в 2-2,5 раза чаще заболеванием болеют женщины, чем мужчины. Пик заболеваемости припадает на возрастной диапазон 30-55 лет. Средний возраст пациентов – 47 лет. Что касается статистики общей численности пациентов с таким диагнозом, официально данные озвучиваются пока только по ревматоидному артриту. А именно: сегодня в России 2 млн. населения болеет РА всех типов и локализаций, из них примерно 35% больных имеют неблагополучный очаг именно в тазобедренных суставах.
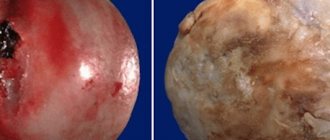
Удаленная головка бедренной кости с поражением артритом.
Специалисты акцентируют, что зарегистрированных пациентов с ревмоатритами ТБС и с другими формами коксита примерно столько же, сколько тех, кто не обращается в медицинские учреждения за диагностикой и лечением. Более того, буквально за каких-то 10 лет количество людей с артритами тазобедренных суставов возросло практически вдвое. Неимоверно быстрая тенденция роста заболеваемости прогнозируется и на будущую декаду, при этом эксперты не исключают еще худшие результаты.
Врачи призывают не пытаться самостоятельно лечить артритный патогенез. Это – сложное, многофакторное воспаление самого массивного и нагруженного сустава скелетно-мышечной системы, трудно поддающееся лечению. Самолечение не доведет до добра, а только еще больше усугубит проблему. Прогнозы прямо зависят от своевременности обращения к доктору, правильной диагностики и грамотного квалифицированного подхода в лечении, основанного на принципе индивидуальности. В противном случае слишком высоки риски значительной или полной утраты движений в ТБС, серьезных проблем со здоровьем (инфекционно-токсический шок, сепсис при запущенной инфекционной форме, тяжелые сердечные и легочные поражения при РА и др.), а в некоторых случаях даже летального исхода.
Малоинвазивное эндопротезирование в Чехии: врачи, реабилитация, сроки и цены.
Узнать подробнее
Причины и разновидности заболевания
Причинами появления воспалительной реакции в тканях тазобедренного сустава могут быть обусловлены инфекцией, аллергенами, системными заболеваниями. Кроме того, к развитию воспалительного поражения в опорно-двигательной области таз-бедро могут подтолкнуть травмы, физические перегрузки и даже банальное переохлаждение. Иногда суставные ткани воспаляются в связи с некогда проведенными оперативными вмешательствами любого содержания в пределах тазобедренного отдела. По сообщениям врачей, далеко не последнюю роль в появлении очага играют онкозаболевания, патологии крови, наследственный фактор.
В медицине насчитывается более 150 всевозможных формулировок диагнозов артритных заболеваний. Но в общем артрит тазобедренных суставов принято разделять на 3 преобладающие патогенетические формы: ревматоидную, инфекционную, реактивную. Подробнее о каждой в таблице.
| Форма артрита ТБС | Частые провокаторы | Особенности | Диагнозы |
| Ревматоидная | Этиология не установлена. Но, предположительно, РА может быть спровоцирован: вирусами (н-р, Эпштейна-Барр, простого герпеса, гепатита В), бактериями (чаще респираторной системы), токсинами табака, травмами, аллергиями, стрессами, патологиями обмена веществ, злоупотреблением стероидной терапией, наследственностью и пр. | Аутоиммунное воспаление синовиальных суставов по эрозивно-деструктивному типу. Это – тяжелая хроническая патология, вызванная аномальной выработкой агрессивных антител, направленных на уничтожение суставного аппарата. Специфичные аутоиммунные агрессоры поражают не только конкретно ТБ-суставы (по очереди или сразу два), но и другого вида сочленения, иногда даже с вовлечением внутренних органов. Моноартрит по ревматоидному типу встречается крайне редко, разве что в самом дебюте заболевания. Воспалительный процесс инициируют такие антитела, как РФ и АЦЦП, которые и являются ведущими биомаркерами при диагностике ревматоидного артрита ТБС. | Серопозитивный, серонегативный РА, болезнь Стилла, ювенильный РА и пр. |
| Инфекционная | Стрептококк Стафилококк Гонококк Микобактерии Бруцеллы Гемофильная палочка Синегнойная инфекция | Патогенная среда лимфогенным или гематогенным путем проникает непосредственно в полость сустава. Она может мигрировать в ТБС из любого инфицированного участка организма. Пагубные микроорганизмы оседают и активизируют в ТБС, из-за чего и возникает локальный очаг воспаления. Также возможно занесение инфекции инъекционным/хирургическим путем или из внешней среды при открытой травме. Важно: патологические микроорганизмы всегда высеиваются в ходе внутрисуставного бак-исследования синовиальной жидкости. | Гнойный септический, туберкулезный, бруцеллезный артриты и др. |
| Реактивная «стерильная» | Хламидии Уреаплазмы Микоплазмы Иерсиниозная инфекция Сальмонеллы Кампилобактер Клостридии Шигеллы | Иммуновоспалительная реакция в ответ на перенесенную острую или персистирующую мочеполовую или кишечную инфекцию. Инфекционный очаг, который индуцирует артрит, находится вне сустава – в урогенитальном тракте или ЖКТ. То есть инфекция не выявляется в средах сустава. Воспаление возникает из-за генетического фактора: носительство антигена HLA-B27. При сочетании указанная инфекция + HLA-B27 иммунная система вместе с уничтожением основного патогена начинает атаковать клетки тканей здорового сустава, ошибочно воспринимая их за чужеродных агентов. При диагностике в крови определяется HLA-B27, при этом ревматоидный фактор отсутствует. | Болезнь Рейтера, урогенный артрит, постэнтероколи-тический, пр. |
Нельзя не сказать, что отдельные группы составляют подагрические, псориатические и посттравматические артриты, первопричинные связи возникновения которых не имеют общего ни с инфекциями, ни с ревматизмом. Однако полностью исключать на момент диагностики выявления присоединившейся ревматоидной патологии, конечно же, нельзя. Подагрический и псориатический виды сопровождаются суставными воспалениями на почве непростых и, к сожалению, неизлечимых заболеваний системного характера: подагры и псориаза. Посттравматический тип – воспалительная реакция сустава, наступившая после закрытых травм или физической перегрузки.
- Артрит на фоне подагры
. Подагрический артрит обусловлен нарушением пуринового обмена в организме, из-за чего в крови повышается концентрация мочевой кислоты. По этой причине в полостях тазобедренных суставов откладываются ураты (кристаллы) мочевой кислоты, которые провоцируют местное воспаление и оказывают разрушающее воздействие на суставной хрящ и околосуставные ткани. Этиологическая основа подагрического артрита – системный метаболический сбой. - Артрит при псориазе
. Это – воспалительный процесс в ТБС, протекающий на фоне тяжелого кожного заболевания, механизм развития которого до сих пор остается загадкой для специалистов. В развитии воспаления суставов на почве псориаза принимает участие иммунологический фактор. Он характеризуется дисбалансом провоспалительных и противовоспалительных цитокинов, что производит деструктивно-воспалительный эффект на костно-хрящевой сегмент. - Посттравматический артрит ТБС
. Такая артритная болезнь часто возникает, например, после травмы с кровоизлиянием в суставную полость, после вывихов/подвывихов бедра, сильного локального ушиба с травматизацией капсулы или связочно-мышечного аппарата. Очаг может развиться и после систематических тяжелых физнагрузок, которые приводят к микроповреждениям суставного хряща. Под воздействием перечисленных факторов синовиальные оболочки и околосуставные ткани воспаляются, вследствие чего в суставах скапливается патологическая жидкость (выпот).
При своевременном (раннем) и правильном лечении избавиться навсегда от посттравматического артрита вполне реально. Это единственная форма, имеющая самые лучшие прогностические показатели. Однако недолеченные травмы и их осложнения в виде синовита способны перерасти в серьезную, уже хроническую артритную патологию, которая в свою очередь может осложниться необратимым деформирующим коксартрозом.
Общие сведения о болезни
Артрит тазобедренного сустава (коксит)– полиэтиологическое заболевание, в развитии которого принимает участие множество факторов. Существует несколько клинических форм болезни, в течении которых имеются, как сходные, так и различные симптомы. Код по МКБ-10 М00 – М99.
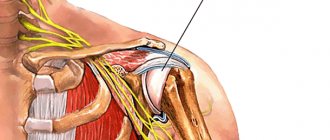
Тазобедренный сустав (ТБС) образован вертлужной впадиной тазовой кости и головкой бедренной кости. Шаровидная форма делает его подвижным, от головки бедренной кости к вертлужной впадине подходит связка, удерживающая суставные части в нормальном положении. Снаружи ТБС также укреплен связками и мощным слоем мягких тканей. Это ведущий опорный сустав, расположенный глубоко в тканях, поэтому выявить в нем медленно протекающий воспалительный процесс с неяркими симптомами не так просто.
Артрит бедренного сустава развивается в любом возрасте, так как заболевание может иметь разное происхождение. Самыми актуальными клиническими формами являются поражения в детском и юношеском возрасте, а также туберкулезные артриты.
Симптомы артрита тазобедренного сустава
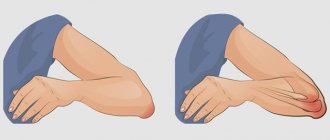
Стандартными симптомами артритов, поражающих тазобедренную часть костно-мышечного аппарата, являются местные признаки воспаления, а это:
- болевой синдром, ломота в соответствующей области (наиболее часто боль беспокоит в момент или после длительного состояния покоя, например, посреди ночного сна или с утра после пробуждения);
- отечность мягких тканей вблизи ТБ-сустава как следствие образования воспалительного выпота в суставе;
- ощущение «горячих» кожных покровов, покрывающих больное сочленение;
- чувство сдавливания и распирания в ТБС;
- покраснение кожи в воспаленной зоне (не всегда);
- ограничение объема движений, скованность.
Боль это главный симптом.
Поскольку базисом заболевания являются тяжелейшие аутоиммунные и инфекционные процессы внутри организма, клиническую картину нередко дополняют и отягощают симптомы общей интоксикации:
- повышение температуры тела;
- озноб и упадок сил;
- головная боль;
- головокружение;
- снижение аппетита, тошнота;
- нервозность;
- анемия;
- плохой сон.
На интенсивность симптомов влияет характер патологического процесса: острый, подострый или хронический. Острое течение характеризуется внезапным началом артритной болезни с ярко выраженной болезненной симптоматикой. Для подострого течения типичным является плавное нарастание признаков воспаления на протяжении 1-2 недель. Острый и подострый артрит может перейти в хроническую форму, когда периоды ремиссии будут периодически сменяться на периоды рецидивов.
Хронический вариант течения может быть и с самого начала (например, при РА). Причем такой артрит способен долгое время развиваться и особо не беспокоить, а спустя несколько лет начать упорно досаждать приступами воспаления, которые с увеличением срока заболевания становятся все более затяжными и мучительными. Если хроническую болезнь качественно не контролировать, она неизбежно приведет к разрушению суставных концов с дальнейшей их деформацией, сращением между собой, как результат, к неподвижности тазобедренного сустава, мышечной атрофии и инвалидизации пациента.
Общие клинические рекомендации
Чтобы избежать рецидивов тазобедренного артрита и забыть о боли, пациентам рекомендуется:
- вести активный здоровый образ жизни;
- правильно питаться;
- избавиться от лишнего веса и вредных привычек – курения и злоупотребления спиртным;
- ежедневно заниматься ЛФК; особенно полезно плавание;
- избегать тяжелых физических нагрузок, переохлаждений и стрессов;
- тщательно лечить все острые и хронические заболевания;
- проходить курсы противорецидивной терапии несколько раз в год по назначению врача.
Как не заболеть
Тазобедренные суставы нужно особенно беречь лицам с отягощенной наследственностью, имеющих родственников с аналогичной патологией. Для этого нужно избегать любых провоцирующих заболевание факторов: инфекций, переохлаждений, стрессов. Необходимо также больше двигаться, заниматься посильными видами спорта для укрепления мышц спины и нижних конечностей, а также поддерживать нормальную массу тела.
Чем питаться
Питание должно быть разнообразным и регулярным. Стоит ограничить: острые приправы, жареные, жирные, копченые блюда, алкоголь, сладости – все это может провоцировать воспалительные процессы в суставах.
Диагностика артрита ТБС
Сказать, что у пациента артрит, врачу не составит труда уже в ходе первичного выслушивания жалоб, пальпационного и визуального осмотра проблемного отдела. Но этого совершенно недостаточно, чтобы рекомендовать лечебные мероприятия больному. Тревожно, что с хорошими ревматологами, которые обладают высочайшей компетенцией по части дифференцирования форм артритных патологий среди громадного спектра возможных, в отечественных медучреждениях напряженка. По факту, пациентам сегодня слишком часто ставится диагноз «неопознанный артрит», из-за которого зачастую назначается неверное лечение, что еще больше усугубляет суставную проблему.
Диагноза на снимке.
Поэтому в интересах пациента важно найти высококвалифицированного доктора, который грамотно проведет обследование, используя эффективные средства диагностики, рекомендованные современной ревматологией. В итоге, безошибочно установит диагноз с определением его этиологии, тяжести и, прежде всего, исключит или подтвердит существование РА – наиболее агрессивного вида заболевания, известного своими наихудшими прогнозами. И, безусловно, грамотно разработает концепцию результативного лечения.
Как вы правильно поняли, клиническую ценность представляет корректно поставленный диагноз на раннем этапе проявлений артрита, в минимально отведенные сроки от первого обращения больного к врачу. Это называется «окном максимальных возможностей»: когда программа адекватной терапии сможет радикальным образом изменить течение и исход патологии в лучшую сторону. Специалисты для верификации истинного диагноза при наличии воспалительной артропатии применяют следующие диагностические инструменты:
- перечень классификационных особенностей конкретных нозологических форм;
- инструментальные методы обследования ТБС (осевой рентген, МРТ, УЗИ);
- лабораторные способы исследования:
- общий и биохимический анализ крови;
- анализы мочи и кала;
- иммунологические (на РФ и АЦЦП) и иммуногенетические тесты (на HLA);
- обследование крови на идентификацию инфекции (методы ИФА, ПЦР);
- пункционный забор синовиальной жидкости для органолептического, цитологического и бактериологического исследования;
- биопсия синовиальной мембраны;
- артроскопическое обследование суставной полости.
Первое место в диагностике, конечно же, отведено лабораторным способам обследования, которые значительно увеличивают вероятность постановки правильного диагноза. Следует подчеркнуть, что помимо всех перечисленных диагностических приемов, не последнюю роль играет и доскональное изучение всей истории болезней человека, анализ предшествовавших артриту заболеваний, состояний, образа жизни и т.п.
В диагностический и лечебный процесс, кроме ревматолога и ортопеда, в большинстве случаев необходимо подключать врачей других специальностей: гастроэнтеролога, уролога, дерматолога, инфекциониста, ЛОРа, пульмонолога, аллерголога, иммунолога, кардиолога или др.
Современная медикаментозная терапия ревматоидного артрита
Ревматоидный артрит — это заболевание, находящееся в фокусе внимания ревматологов всего мира в течение десятилетий. Это связано с большим медицинским и социальным значением этой болезни. Ее распространенность достигает 0,5–2% от общей численности населения в промышленно развитых странах [1, 2]. У больных ревматоидным артритом наблюдается уменьшение продолжительности жизни по сравнению с общей популяцией на 3–7 лет [3]. Трудно переоценить колоссальный ущерб, наносимый этим заболеванием обществу за счет ранней инвалидизации пациентов, которая при отсутствии своевременно начатой активной терапии может наступать в первые 5 лет от дебюта болезни.
Ревматоидный артрит — хроническое воспалительное заболевание неясной этиологии, для которого характерно поражение периферических синовиальных суставов и периартикулярных тканей, сопровождающееся аутоиммунными нарушениями и способное приводить к деструкции суставного хряща и кости, а также к системным воспалительным изменениям.
Патогенез заболевания весьма сложен и во многом недостаточно изучен. Несмотря на это, к настоящему времени хорошо известны некоторые ключевые моменты в развитии ревматоидного воспаления, которые определяют основные методы лечебного воздействия на него (рис. 1). Развитие хронического воспаления в данном случае связано с активацией и пролиферацией иммунокомпетентных клеток (макрофагов, Т- и В-лимфоцитов), что сопровождается выделением клеточных медиаторов — цитокинов, факторов роста, молекул адгезии, а также синтезом аутоантител (например, антицитруллиновых антител) и формированием иммунных комплексов (ревматоидные факторы). Эти процессы ведут к формированию новых капиллярных сосудов (ангиогенез) и разрастанию соединительной ткани в синовиальной оболочке, к активации циклооксигеназы-2 (ЦОГ-2) с повышением синтеза простагландинов и развитием воспалительной реакции, к выделению протеолитических ферментов, активации остеокластов, а в результате — к деструкции нормальных тканей суставов и возникновению деформаций.
Лечение ревматоидного артрита
Лечение включает:
- медикаментозную терапию;
- немедикаментозные методы терапии;
- ортопедическое лечение, реабилитацию.
Исходя из патогенеза заболевания, становится очевидным, что эффективно воздействовать на развитие заболевания можно на двух уровнях:
- подавляя избыточную активность иммунной системы;
- блокируя выработку медиаторов воспаления, в первую очередь простагландинов.
Поскольку, помимо собственно воспаления, активация иммунной системы сопровождается многими другими патологическими процессами, воздействие на первом уровне является существенно более глубоким и эффективным, нежели на втором. Медикаментозная иммуносупрессия представляет собой основу лечения ревматоидного артрита. К иммуносупрессорам, применяющимся для лечения данного заболевания, относятся базисные противовоспалительные препараты (БПВП), биологические препараты и глюкокортикостероиды. На втором уровне действуют нестероидные противовоспалительные препараты (НПВП) и глюкокортикостероиды.
В целом иммуносупрессивная терапия сопровождается более медленным развитием клинического эффекта (в широких рамках — от нескольких дней в случае биологической терапии до нескольких месяцев в случае применения некоторых БПВП), который в то же время бывает очень выраженным (вплоть до развития клинической ремиссии) и стойким, а также характеризуется торможением деструкции суставов.
Собственно противовоспалительная терапия (НПВП) может давать клинический эффект (обезболивание, уменьшение скованности) очень быстро — в течение 1–2 ч, однако при помощи такого лечения практически невозможно полностью купировать симптоматику при активном ревматоидном артрите и, по-видимому, оно совсем не влияет на развитие деструктивных процессов в тканях.
Глюкокортикостероиды обладают как иммуносупрессивным, так и непосредственным противовоспалительным эффектом, поэтому клиническое улучшение может развиваться быстро (в течение нескольких часов при внутривенном или внутрисуставном введении). Имеются данные о подавлении прогрессирования эрозивного процесса в суставах при длительной терапии низкими дозами глюкокортикостероидов и о положительном их влиянии на функциональный статус больного. В то же время из практики хорошо известно, что назначение только глюкокортикостероидов, без других иммуносупрессивных средств (БПВП), редко дает возможность достаточно эффективно контролировать течение болезни.
Немедикаментозные способы терапии ревматоидного артрита (физиотерапия, бальнеотерапия, диетотерапия, акупунктура и др.) представляют собой дополнительные методики, с помощью которых можно несколько улучшить самочувствие и функциональный статус пациента, но не купировать симптоматику и достоверно повлиять на деструкцию суставов.
Ортопедическое лечение, включающее ортезирование и хирургическую коррекцию деформаций суставов, а также реабилитационные мероприятия (лечебная физкультура и др.) имеют особое значение преимущественно на поздних стадиях заболевания для поддержания функциональной способности и улучшения качества жизни больного.
Основными целями лечения при РА являются [2, 6]:
- купирование симптомов заболевания, достижение клинической ремиссии или как минимум низкой активности болезни;
- торможение прогрессирования структурных изменений в суставах и соответствующих функциональных нарушений;
- улучшение качества жизни больных, сохранение трудоспособности.
Надо иметь в виду, что цели лечения могут существенно изменяться в зависимости от длительности болезни. На ранней стадии болезни, т. е. при длительности болезни 6–12 мес, достижение клинической ремиссии — вполне реальная задача, так же как и торможение развития эрозий в суставах. С помощью современных методов активной медикаментозной терапии удается добиться ремиссии у 40–50% пациентов [4, 5], показано также отсутствие появления новых эрозий по данным рентгенографии [7] и магнитно-резонансной томографии [8] у значительного количества больных при длительности наблюдения 1–2 года.
При длительно текущем ревматоидном артрите, особенно при недостаточно активной терапии в первые годы заболевания, достижение полной ремиссии теоретически тоже возможно, однако вероятность этого значительно ниже. То же самое можно сказать и о возможности остановить прогрессирование деструкции в суставах, уже существенно разрушенных за несколько лет болезни. Поэтому при далеко зашедшем ревматоидном артрите возрастает роль реабилитационных мероприятий, ортопедической хирургии. Кроме того, на поздних стадиях заболевания длительная поддерживающая базисная терапия может использоваться для вторичной профилактики осложнений болезни, таких как системные проявления (васкулит и др.), вторичный амилоидоз.
Базисная терапия ревматоидного артрита. БПВП (синонимы: базисные препараты, болезнь-модифицирующие антиревматические препараты, медленно действующие препараты) являются главным компонентом лечения ревматоидного артрита и при отсутствии противопоказаний должны быть назначены каждому пациенту с этим диагнозом [9]. Особенно важно максимально быстрое назначение БПВП (сразу после установления диагноза) на ранней стадии, когда имеется ограниченный период времени (несколько месяцев от появления симптоматики) для достижения наилучших отдаленных результатов — так называемое «терапевтическое окно» [10].
Классические БПВП обладают следующими свойствами.
- Способность подавлять активность и пролиферацию иммунокомпетентных клеток (иммуносупрессия), а также пролиферацию синовиоцитов и фибробластов, что сопровождается выраженным снижением клинико-лабораторной активности РА.
- Стойкость клинического эффекта, в том числе его сохранение после отмены препарата.
- Способность задерживать развитие эрозивного процесса в суставах.
- Способность индуцировать клиническую ремиссию.
- Медленное развитие клинически значимого эффекта (обычно в течение 1–3 мес от начала лечения).
БПВП существенно различаются между собой по механизму действия и особенностям применения. Основные параметры, характеризующие БПВП, представлены в таблице 1.
БПВП условно могут быть подразделены на препараты первого и второго ряда. Препараты первого ряда обладают наилучшим соотношением эффективности (достоверно подавляют как клиническую симптоматику, так и прогрессирование эрозивного процесса в суставах) и переносимости, в связи с чем назначаются большинству пациентов.
К БПВП первого ряда относятся следующие.
- Метотрексат — «золотой стандарт» терапии ревматоидного артрита. Рекомендуемые дозы — 7,5–25 мг в неделю — подбираются индивидуально путем постепенного повышения на 2,5 мг каждые 2–4 нед до достижения хорошего клинического ответа либо возникновения непереносимости. Препарат дается внутрь (еженедельно в течение двух последовательных дней дробно в 3–4 приема каждые 12 ч). В случае неудовлетворительной переносимости метотрексата при приеме внутрь за счет диспепсии и других жалоб, связанных с желудочно-кишечным трактом (ЖКТ), препарат может быть назначен парентерально (одна в/м или в/в инъекция в неделю).
- Лефлуномид (арава). Стандартная схема лечения: внутрь по 100 мг в сутки в течение 3 дней, затем 20 мг/сут постоянно. При риске непереносимости препарата (пожилой возраст, заболевания печени и др.) лечение можно начинать с дозы 20 мг/сут. По эффективности сопоставим с метотрексатом, имеет несколько лучшую переносимость. Есть данные о более высокой эффективности лефлуномида в отношении качества жизни больных, особенно при раннем ревматоидном артрите. Стоимость лечения лефлуномидом достаточно высока, поэтому он чаще назначается при наличии противопоказаний к применению метотрексата, его неэффективности или непереносимости, однако может использоваться и как первый базисный препарат.
- Сульфасалазин. В клинических испытаниях не уступал по эффективности другим БПВП, однако клиническая практика показывает, что достаточный контроль над течением болезни сульфасалазин обычно обеспечивает при умеренной и низкой активности ревматоидного артрита.
БПВП второго ряда применяются значительно реже в связи с меньшей клинической эффективностью и/или большей токсичностью. Они назначаются, как правило, при неэффективности или непереносимости БПВП первого ряда.
БПВП способны вызвать значительное улучшение (хороший клинический ответ) приблизительно у 60% пациентов. В связи с медленным развитием клинического эффекта назначение БПВП на сроки менее 6 мес не рекомендуется. Длительность лечения определяется индивидуально, типичная продолжительность «курса» лечения одним препаратом (в случае удовлетворительного ответа на терапию) составляет 2–3 года и более. Большинство клинических рекомендаций подразумевают неопределенно долгое применение поддерживающих дозировок БПВП для сохранения достигнутого улучшения.
При недостаточной эффективности монотерапии каким-либо базисным препаратом может быть избрана схема комбинированной базисной терапии, т. е. сочетания двух-трех БПВП. Наиболее хорошо зарекомендовали себя следующие сочетания:
- метотрексат + лефлуномид;
- метотрексат + циклоспорин;
- метотрексат + сульфасалазин;
- метотрексат + сульфасалазин + гидроксихлорохин.
В комбинированных схемах препараты обычно применяются в средних дозировках. В ряде клинических исследований было продемонстрировано превосходство комбинированной базисной терапии над монотерапией, однако более высокая эффективность комбинированных схем не считается строго доказанной. Комбинация БПВП ассоциирована с умеренным повышением частоты побочных эффектов.
Биологические препараты в лечении ревматоидного артрита. Термин биологические препараты (от англ. biologics) применяется по отношению к лекарственным средствам, производимым с использованием биотехнологий и осуществляющим целенаправленное («точечное») блокирование ключевых моментов воспаления с помощью антител или растворимых рецепторов к цитокинам, а также другим биологически активным молекулам. Таким образом, биологические препараты не имеют никакого отношения к «биологически активным пищевым добавкам». В связи с большим количеством «молекул-мишеней», воздействие на которые потенциально может подавлять иммунное воспаление, разработан целый ряд лекарственных средств из этой группы и еще несколько препаратов проходят клинические испытания.
К основным зарегистрированным в мире для лечения ревматоидного артрита биологическим препаратам относятся:
- инфликсимаб, адалимумаб, этанерсепт (воздействуют на фактор некроза опухоли (ФНО-α);
- ритуксимаб (воздействует на CD 20 (В-лимфоциты));
- анакинра (воздействует на интерлейкин-1);
- абатасепт (воздействует на CD 80, CD 86, CD 28).
Для биологических препаратов характерны выраженный клинический эффект и достоверно доказанное торможение деструкции суставов. Эти признаки позволяют относить биологические препараты к группе БПВП. В то же время особенностью группы является быстрое (нередко в течение нескольких дней) развитие яркого улучшения, что объединяет биологическую терапию с методами интенсивной терапии. Характерная черта биологических средств — потенцирование эффекта в сочетании с БПВП, в первую очередь с метотрексатом. В связи с высокой эффективностью при ревматоидном артрите, в том числе у резистентных к обычной терапии пациентов, в настоящее время биологическая терапия выдвинулась на второе по значимости место (после БПВП) в лечении этого заболевания.
К отрицательным сторонам биологической терапии относятся:
- угнетение противоинфекционного и (потенциально) противоопухолевого иммунитета;
- риск развития аллергических реакций и индуцирования аутоиммунных синдромов, связанный с тем, что биологические препараты по химической структуре являются белками;
- высокая стоимость лечения.
Биологические методы терапии показаны, если лечение препаратами из группы БПВП (такими, как метотрексат) не является адекватным вследствие недостаточной эффективности или неудовлетворительной переносимости.
Одной из наиболее важных молекул-мишеней служит ФНО-a, который имеет множество провоспалительных биологических эффектов и способствуют персистенции воспалительного процесса в синовиальной оболочке, деструкции хряща и костной ткани за счет прямого действия на синовиальные фибробласты, хондроциты и остеокласты. Блокаторы ФНО-α являются наиболее широко применяемыми биологическими средствами в мире.
В России зарегистрирован препарат из этой группы инфликсимаб (ремикейд), представляющий собой химерное моноклональное антитело к ФНО-α. Препарат, как правило, назначается в сочетании с метотрексатом. У пациентов с недостаточной эффективностью терапии средними и высокими дозами метотрексата инфликсимаб существенно улучшает ответ на лечение и функциональные показатели, а также приводит к выраженному торможению прогрессирования сужения суставной щели и развития эрозивного процесса.
Показанием к назначению инфликсимаба в комбинации с метотрексатом является неэффективность одного или более БПВП, применявшихся в полной дозе (в первую очередь метотрексата), с сохранением высокой воспалительной активности (пять и более припухших суставов, скорость оседания эритроцитов (СОЭ) более 30 мм/ч, С-реактивный белок (СРБ) более 20 мг/л). При раннем ревматоидном артрите с высокой воспалительной активностью и быстрым нарастанием структурных нарушений в суставах комбинированная терапия метотрексатом и инфликсимабом может быть назначена сразу.
До назначения инфликсимаба требуется провести скрининговое обследование на туберкулез (рентгенография грудной клетки, туберкулиновая проба). Рекомендуемая схема применения: начальная доза 3 мг/кг массы тела больного в/в капельно, затем по 3 мг/кг массы тела через 2, 6 и 8 нед, далее по 3 мг/кг массы тела каждые 8 нед, при недостаточной эффективности доза может повышаться вплоть до 10 мг/кг массы тела. Длительность лечения определяется индивидуально, обычно не менее 1 года. После отмены инфликсимаба поддерживающая терапия метотрексатом продолжается. Следует иметь в виду, что повторное назначение инфликсимаба после окончания курса лечения этим препаратом ассоциировано с повышенной вероятностью реакций гиперчувствительности замедленного типа.
Вторым зарегистрированным в нашей стране препаратом для проведения биологической терапии является ритуксимаб (мабтера). Действие ритуксимаба направлено на подавление В-лимфоцитов, которые не только являются ключевыми клетками, отвечающими за синтез аутоантител, но и выполняют важные регуляторные функции на ранних стадиях иммунных реакций. Препарат обладает выраженной клинической эффективностью, в том числе у больных, недостаточно отвечающих на терапию инфликсимабом.
Для лечения ревматоидного артрита препарат применяется в дозе 2000 мг на курс (две инфузии по 1000 мг, каждая с промежутком в 2 нед). Ритуксимаб вводится внутривенно медленно, рекомендуется проведение инфузии в условиях стационара с возможностью точного контроля за скоростью введения. Для профилактики инфузионных реакций целесообразно предварительное введение метилпреднизолона 100 мг. При необходимости возможно проведение повторного курса инфузий ритуксимаба через 6–12 мес.
Согласно европейским клиническим рекомендациям, ритуксимаб целесообразно назначать в случаях неэффективности или невозможности проведения терапии инфликсимабом. Возможность применения ритуксимаба в качестве первого биологического препарата служит в настоящее время предметом исследований.
Глюкокортикостероиды. Глюкокортикостероиды обладают многогранным противовоспалительным действием, обусловленным блокадой синтеза провоспалительных цитокинов и простагландинов, а также торможением пролиферации за счет воздействия на генетический аппарат клеток. Глюкокортикостероиды оказывают быстрый и ярко выраженный дозозависимый эффект в отношении клинических и лабораторных проявлений воспаления. Применение глюкокортикостероидов чревато развитием нежелательных реакций, частота которых также повышается с увеличением дозы препарата (стероидный остеопороз, медикаментозный синдром Иценко–Кушинга, поражение слизистой ЖКТ). Эти препараты сами по себе в большинстве случаев не могут обеспечить полноценного контроля над течением ревматоидного артрита и должны назначаться вместе с БПВП.
Глюкокортикостероиды при данном заболевании применяются системно и локально. Для системного применения показан основной метод лечения — назначение низких доз внутрь (преднизолон — до 10 мг/сут, метилпреднизолон — до 8 мг/сут) на длительный период при высокой воспалительной активности, полиартикулярном поражении, недостаточной эффективности БПВП.
Средние и высокие дозы глюкокортикостероидов внутрь (15 мг/сут и более, обычно 30–40 мг/сут в пересчете на преднизолон), а также пульс-терапия глюкокортикостероидами — внутривенное введение высоких доз метилпреднизолона (250–1000 мг) или дексаметазона (40–120 мг) могут применяться для лечения тяжелых системных проявлений ревматоидного артрита (выпотной серозит, гемолитическая анемия, кожный васкулит, лихорадка и др.), а также некоторых особых форм болезни. Продолжительность лечения определяется временем, необходимым для купирования симптоматики, и составляет обычно 4–6 нед, после чего осуществляется постепенное ступенчатое снижение дозы с переходом на лечение низкими дозами глюкокортикостероидов.
Глюкокортикостероиды в средних и высоких дозах, пульс-терапия, по-видимому, не обладают самостоятельным влиянием на течение ревматоидного артрита и развитие эрозивного процесса в суставах.
Для локальной терапии применяются препараты в микрокристаллической форме, назначающиеся в виде внутрисуставных и периартикулярных инъекций: бетаметазон, триамсинолон, метилпреднизолон, гидрокортизон.
Глюкокортикостероиды для локального применения обладают ярко выраженным противовоспалительным действием, преимущественно в месте введения, а в ряде случаев — и системным действием. Рекомендуемые суточные дозы составляют: 7 мг — для бетаметазона, 40 мг — для триамсинолона и метилпреднизолона, 125 мг — для гидрокортизона. Эта доза (суммарно) может использоваться для внутрисуставного введения в один крупный (коленный) сустав, два сустава среднего размера (локтевые, голеностопные и др.), 4–5 мелких суставов (пястно-фаланговые и др.), либо для периартикулярного введения препарата в 3–4 точки.
Эффект после однократного введения обычно наступает на протяжении 1–3 дней и сохраняется в течение 2–4 нед при хорошей переносимости.
В связи с этим повторные инъекции глюкокортикостероидов в один сустав нецелесообразно назначать ранее чем через 3–4 недели. Проведение курса из нескольких внутрисуставных инъекций в один и тот же сустав не имеет терапевтического смысла и чревато осложнениями (локальный остеопороз, усиление деструкции хряща, остеонекроз, нагноение). В связи с повышенным риском развития остеонекроза внутрисуставное введение глюкокортикостероидов в тазобедренный сустав в целом не рекомендуется.
Глюкокортикостероиды для локального применения назначаются в качестве дополнительного метода купирования обострений ревматоидного артрита и не могут служить заменой системной терапии.
НПВП. Значение НПВП в лечении ревматоидного артрита за последние годы существенно снизилось в связи с появлением новых эффективных схем патогенетической терапии. Противовоспалительное действие НПВП достигается с помощью подавления активности ЦОГ, или избирательно ЦОГ-2, и тем самым снижается синтез простагландинов. Таким образом НПВП действуют на конечное звено ревматоидного воспаления.
Действие НПВП при ревматоидном артрите — уменьшение выраженности симптомов болезни (боль, скованность, припухлость суставов). НПВП обладают обезболивающим, противовоспалительным, жаропонижающим эффектом, но мало влияют на лабораторные показатели воспаления. В подавляющем большинстве случаев НПВП не способны как-либо заметно изменить течение заболевания. Их назначение в качестве единственного противоревматического средства при достоверном диагнозе ревматоидный артрит в настоящее время считается ошибкой. Тем не менее НПВП являются основным средством симптоматической терапии при данном заболевании и в большинстве случаев назначаются в сочетании с БПВП.
Наряду с лечебным эффектом, все НПВП, включая селективные (ингибиторы ЦОГ-2), способны вызывать эрозивно-язвенное поражение ЖКТ (в первую очередь верхних его отделов — «НПВП-гастропатия») с возможными осложнениями (кровотечения, перфорации и пр.), а также нефротоксические и другие нежелательные реакции.
Основные характерные черты, которые необходимо учитывать при назначении НПВП, следующие.
- Не существует значимых различий между НПВП в плане эффективности (для большинства препаратов эффект пропорционален дозе вплоть до максимальной рекомендуемой).
- Существуют значительные различия между разными НПВП по переносимости, особенно в отношении поражения ЖКТ.
- Частота нежелательных эффектов обычно пропорциональна дозе НПВП.
- У пациентов с повышенным риском развития НПВП-ассоциированного поражения ЖКТ риск может быть снижен путем параллельного назначения блокаторов протонной помпы, мизопростола.
Существует индивидуальная чувствительность к различным НПВП как в отношении эффективности, так и переносимости лечения. Дозы НПВП при ревматоидном артрите соответствуют стандартным. Продолжительность лечения НПВП определяется индивидуально и зависит от потребности больного в симптоматической терапии. При хорошем ответе на терапию БПВП препарат из группы НПВП может быть отменен.
К наиболее часто применяющимся при ревматоидном артрите НПВП относятся:
- диклофенак (50–150 мг/сут);
- нимесулид (200–400 мг/сут);
- целекоксиб (200–400 мг/сут);
- мелоксикам (7,5–15 мг/сут);
- ибупрофен (800–2400 мг/сут);
- лорноксикам (8–12 мг/сут).
Селективные НПВП, по эффективности достоверно не отличаясь от неселективных, реже вызывают НПВП-гастропатии и серьезные нежелательные реакции со стороны ЖКТ, хотя и не исключают развитие этих осложнений. Ряд клинических исследований продемонстрировал повышенную вероятность развития тяжелой сосудистой патологии (инфаркт миокарда, инсульт) у пациентов, получавших препараты из группы коксибов, в связи с чем возможность лечения целекоксибом должна обсуждаться с особой осторожностью у больных с ИБС и другими серьезными кардиоваскулярными патологиями.
Дополнительные медикаментозные методы лечения. В качестве симптоматического анальгетика (или дополнительного анальгетика при недостаточной эффективности НПВП) может использоваться парацетамол (ацетаминофен) в дозе 500–1500 мг/сут, который обладает относительно невысокой токсичностью. Для локальной симптоматической терапии используются НПВП в виде гелей и мазей, а также диметилсульфоксид в виде 30–50% водного раствора в форме аппликаций. При наличии остеопороза показано соответствующее лечение препаратами кальция, витамина Д3, бифосфонатами, кальцитонином.
Общие принципы ведения больных РА
Больному с установленным диагнозом ревматоидный артрит должен быть назначен препарат из группы БПВП, который при хорошем клиническом эффекте может применяться как единственный метод терапии [9]. Другие лечебные средства используются по мере необходимости.
Больной должен быть информирован о характере своего заболевания, течении, прогнозе, необходимости длительного сложного лечения, а также о возможных нежелательных реакциях и схеме контроля за лечением, неблагоприятных сочетаниях с другими препаратами (в частности, алкоголем), возможной активации очагов хронической инфекции на фоне лечения, целесообразности временной отмены иммуносупрессивных препаратов при возникновении острых инфекционных заболеваний, о необходимости контрацепции на фоне лечения.
Терапия ревматоидного артрита должна назначаться врачом-ревматологом и проводиться под его наблюдением. Лечение биологическими препаратами может проводиться только под контролем ревматолога, имеющего достаточные знания и опыт для его проведения. Терапия является длительной и подразумевает периодический контроль активности болезни и оценку ответа на терапию. Упрощенный алгоритм представлен на рисунке 2.
Мониторинг активности болезни и ответа на терапию включает оценку показателей суставного статуса (число болезненных и припухших суставов и др.), острофазовых показателей крови (СОЭ, СРБ), оценку боли и активности болезни по визуальной аналоговой шкале, оценку функциональной активности больного в повседневной деятельности с помощью русского варианта опросника состояния здоровья (HAQ). Существуют признанные международным сообществом ревматологов методики количественной оценки ответа на лечение с помощью рекомендованного Европейской лигой по борьбе с ревматизмом (EULAR) индекса DAS (Disease Activity Score) и критериев Американской коллегии ревматологов (ACR) [1]. Кроме того, должен осуществляться мониторинг безопасности проводимой пациенту терапии (в соответствии и формуляром и существующими клиническими рекомендациями). В связи с тем, что эрозивный процесс может развиваться даже при низкой воспалительной активности, помимо оценки активности болезни и ответа на терапию обязательно применяется рентгенография суставов. Прогрессирование деструктивных изменений в суставах оценивают путем стандартной рентгенографии кистей и стоп с использованием рентгенологической классификации стадий ревматоидного артрита, количественных методик по индексам Sharp и Larsen. С целью мониторинга состояния больного обследование рекомендуется проводить с определенной периодичностью (табл. 2).
Лечение резистентного к терапии РА
Резистентным к лечению целесообразно считать пациента с неэффективностью (отсутствием 20% улучшения по основным показателям) как минимум двух стандартных БПВП в достаточно высоких дозах (метотрексат — 15–20 мг/нед, сульфасалазин — 2000 мг/сут, лефлуномид — 20 мг/сут). Неэффективность может быть первичной и вторичной (возникающей после периода удовлетворительного ответа на терапию либо при повторном назначении препарата). Существуют следующие пути преодоления резистентности к терапии:
- назначение биологических препаратов (инфликсимаб, ритуксимаб);
- назначение глюкокортикостероидов;
- применение комбинированной базисной терапии;
- применение БПВП второго ряда (циклоспорин и др.).
С точки зрения отдаленных результатов в отношении функциональных нарушений, качества жизни и ее продолжительности оптимальной стратегией терапии ревматоидного артрита является многолетнее лечение БПВП с планомерной сменой схемы их применения по мере необходимости [11].
Литература
- Клинические рекомендации. Ревматология/ под. ред. Е. Л. Насонова. М.: ГЭОТАР-Медиа, 2006. 288 с.
- Emery P., Suarez-Almazor M. Rheumatoid Arthritis// Clin Evid. 2003; 10: 1454–1476.
- Насонов Е. Л., Каратеев Д. Е., Чичасова Н. В., Чемерис Н. А. Современные стандарты фармакотерапии ревматоидного артрита// Клиническая фармакология и терапия. 2005. Т. 14. № 1. С. 72–75.
- Балабанова Р. М., Каратеев Д. Е., Кашеваров Р. Ю., Лучихина Е. Л. Лефлуномид (Арава) при раннем ревматоидном артрите// Научно-практическая ревматология. 2005. № 5. С. 31–34.
- Goekoop-Ruiterman Y. P., de Vries-Bouwstra J. K., Allaart C. F. et al. Clinical and radiographic outcomes of four different treatment strategies in patients with early rheumatoid arthritis (the BeSt study): a randomized, controlled trial// Arthritis Rheum. 2005; v. 52; 11: 3381–90.
- Smolen et al. Therapeutic strategies in early rheumatoid arthritis //Best Practice & Research Clinical Rheumatology. 2005; 19; 1: 163–177.
- Breeveld F. C., Emery P., Keystone E. et al. Infliximab in active early rheumatoid arthritis// Ann Rheum Dis 2004; 63: 149–155.
- Quinn M. A., Conaghan P. G., O’Connor P. J. et al. Very early treatment with infliximab in addition to methotrexate in early, poor-prognosis rheumatoid arthritis reduces magnetic resonance imaging evidence of synovitis and damage, with sustained benefit after infliximab withdrawal: results from a twelve-month randomized, double-blind, placebo-controlled trial// Arthritis Rheum. 2005; 52; 1: 27–35.
- American College of Rheumatology Subcommittee on Rheumatoid Arthritis Guidelines. Guidelines for the management of rheumatoid arthritis. 2002 Update// Arthritis Rheum. 2002; 46: 328–346.
- Quinn M. A., Emery P. Window of opportunity in early rheumatoid arthritis: possibility of altering the disease process with early intervention// Clin Exp Rheumatol. 2003; 21; Suppl 31: 154–157.
- Каратеев Д. Е. Ретроспективная оценка многолетней базисной терапии у больных ревматоидным артритом// Научно-практическая ревматология. 2003. № 3. С. 32–36.
Д. Е. Каратеев, доктор медицинских наук Институт ревматологии РАМН, Москва
1-2-3 стадии
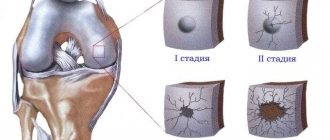
Тяжесть заболевания характеризуют 3 стадии. Первая – стадия синовита, вторая – продуктивно-деструктивная, третья – деформирующая и анкилозирующая.
- Первая стадия – это начальная и низко активная в отношении структур суставного аппарата. Характерными ее признаками являются воспаление и утолщение синовиальной оболочки тазобедренного сустава, скопление воспалительного экссудата в полости. Жизненно важные движения могут быть незначительно затруднены из-за ощущения болезненных явлений и отека на почве синовита. В общем, целостность и форма структур сохранена.
- Вторая стадия – артрит со средней степенью активности и тяжести. На этом этапе начинают прогрессировать процессы деструкции. То есть происходит изъязвление и потеря гиалинового хряща, который покрывает поверхности бедренной головки и вертлужной впадины. На рентгенограммах обнаруживается сужение суставной щели, может быть выявлен околосуставный остеопороз. Объем движений заметно сокращается, тугоподвижность выражена. К середине данного этапа суставной хрящ массово утрачен, а концы сочленовных костей практически оголены.
- На третьей фазе – высоко активной и тяжелой – стремительными темпами происходит деформация костных элементов, их частичное или абсолютное сращение в непорочном положении. Анкилоз – «классика» позднего ревматоидного артрита. Суставная щель критично сужена или полностью перекрыта. Больной не в состоянии нормально передвигаться и самостоятельно выполнять даже элементарные повседневные задачи. На этом этапе рекомендуется хирургическое вмешательство.
Болезнь в динамике.
Клиническое проявление артрозного поражения ТБС
На этапе зарождения клинической картины патологии, первые симптомы артроза тазобедренного сустава — это болезненные ощущения в области таза, возникающие после физического напряжения. Боль может иррадиировать в паховую зону и колено, особенно четко проявляясь в момент хождения. Через несколько секунд или минут интенсивность боли уменьшается, а через некоторое время снова увеличивается. В дальнейшем болезненные ощущения наблюдается в состоянии покоя, особенно в ночное время. При отсутствии консервативного лечения вскоре у пациента появляется типичная для артроза ТБС хромата и необходимость использования трости или даже ходунков.
Принципы лечения
Исходя из того, что болезнь имеет различные корни происхождения, одинаковой схемы терапии для всех не существует. Терапевтические методы разрабатываются только индивидуально с учетом всех клинических критериев патологического процесса, а также возраста и сопутствующих заболеваний в анамнезе пациента. Рекомендовать лечебные мероприятия должен исключительно узкопрофильный специалист! При грамотном подходе во многих случаях удается полностью ликвидировать патологию. Если речь идет о хронической болезни, то существенно сократить тяжесть ее течения, продуктивно притормозить или предотвратить разрушение функционально значимых структур.
Первостепенно важно при воспалительном обострении обеспечить ноге максимально полную иммобилизацию в выгодном положении. Запомните, что при проявлениях артрита противопоказано нагружать и пытаться разрабатывать проблемный отдел. Внимание! Физическая реабилитация (ЛФК для пораженной конечности, массаж, физиотерапия) возможны только после стихания острой фазы коксита.
Медикаментозное лечение
Единственным общим для всех видов артритных заболеваний медикаментозным методом является использование препаратов из ряда НПВС в виде таблеток, уколов (в/м), мазей. Они эффективно подавляют выраженность болевого синдрома, облегчают прочие местные симптомы воспаления, снижают температуру тела. Обычно врачи рекомендуют при выраженной болезненной симптоматике использовать такие противовоспалительные медикаменты, как Ибупрофен, Ксефокам, Найз, Диклофенак. Широко применяется против артритного воспаления Димексид (50%) в виде компрессов, наложенных на больной сустав.
При низкой эффективности или неэффективности анальгетиков и НПВС, в индивидуальном порядке специалистом может быть рассмотрен вопрос о возможности применения глюкокортикостероидов (Преднизолона, Дипроспана, Гидрокортизона).
В зависимости от причины болезни пациентам назначают иммунносупрессоры, антибиотики, обладающие выраженной антибактериальной активностью в отношении выявленного возбудителя.
- Из антибактериальных средств могут быть рекомендованы препараты из группы макролидов, фторхинолонов, тетрациклинового ряда или др. Антибиотикотерапия показана в случае причастности к патогенезу инфекционного агента, проводится она длительным курсом, обычно не менее чем в 1 месяц.
- При тяжелых аутоиммунных патологиях прописывается своеобразная терапия с использованием иммунодепрессантов, например, на основе сульфасалазина или цитостатика. Иммуносупрессоры опасны многими побочными явлениями, поэтому на фоне их применения обязательным является выполнение специальных контрольных гематологических и печеночных исследований.
Кроме того, в лечении артритов врачи нередко обращаются к метаболикам и витаминам (предпочтение группе В), а также противотоксическим препаратам для очищения организма от шлаков и токсинов. Нельзя забывать о том, что при подагре и псориазе стойкая ремиссия коксита возможна при достижении компенсации основного заболевания.
Физиотерапия
К физиопроцедурам приступают на стадии ремиссии или после максимального сокращения воспалительной картины. Данная категория лечения нацелена на улучшение кровообращения, метаболизма и питания суставных тканей, повышение выносливости проблемной зоны к неблагоприятным факторам. Физиотерапевтические тактики позволяют профилактировать появление в будущем болей и отеков, сокращать вероятность рецидивов, восстанавливать подвижность и регенерировать ослабленные мышцы ТБС. Эффективное лечебное воздействие производят следующие сеансы физиотерапии (местно):
- фонофорез с противовоспалительными лекарствами;
- ультразвуковая терапия;
- лазеролечение;
- УФО-облучение;
- электромагнитная терапия.
При реактивных формах популярна процедура плазмефереза, которая позволяет продуктивно нейтрализовать провоспалительные цитокины, уменьшать количество аутоантител, выводить из организма вредные токсины и шлаки. Однако при гнойных процессах данный способ очистки крови противопоказан.
Гимнастика
Лечебная физкультура – значимая часть лечения, но ее применяют сугубо при стихании болезненных проявлений. Пока пациент вынужден отдыхать в кровати, ему показаны общеукрепляющие занятия, дыхательные упражнения в сочетании с приемами мышечной релаксации. Чуть позже допускаются облегченные маховые движения и методики легкого покачивания ногой. Обязательно необходимо следить за достаточно частой сменой положения тела, будучи в кровати (со спины на живот, на здоровый бок и т. д.), чтобы не допустить нарушений со стороны дыхательной системы и угнетения функций кровообращения.
В дальнейшем вводят пассивные и пассивно-активные упражнения, которые человек выполняет сначала при помощи разгрузочного инвентаря, например, посредством специальных плоскостей на роликах, скользящих платформ и т.д. По мере выздоровления включаются специальные тренировки без разгрузки пострадавшей ноги: приседания, отведение конечности с удержанием, хождение по ступенькам, упражнения на сопротивление/отягощение и пр.
Лечебную гимнастику постепенно расширяют и разнообразят активными занятиями с мячом, на гимнастических стенках, снарядах-барьерах для перешагивания различных по форме и высоте препятствий, на велотренажере, балансирах для выработки координации, в бассейне. Комплекс лечебной физкультуры составляется и корректируется по мере надобности исключительно ведущими пациента специалистами – реабилитологом, методистом по ЛФК, врачом-ревматологом/артрологом.
Подход к лечению заболевания в клинике «Парамита», Москва
Пациентов с подозрением на тазобедренный артрит специалисты нашей клиники всегда тщательно обследуют с применением современных лабораторных и инструментальных методов, в том числе МРТ. В процессе обследования выявляют основное и сопутствующие заболевания и только после этого назначают индивидуально подобранное лечение.
Наши врачи имеют подготовку по всем существующим методам лечения данного заболевания. Применяемые ими западные методики позволяют воздействовать непосредственно на очаг воспаления, а восточные – на организм в целом, восстанавливая правильное функционирование всех органов и систем, в том числе ТБС.
Такой подход к лечению позволяет сначала быстро устранить болевой синдром и стимулировать стремление пациента к выздоровлению. Затем проводится основной курс лечения, направленный на подавление воспаления и прогрессирование болезни. Заключительный этап — восстановление утраченной суставной функции. Лечение позволяет больным забыть о боли и вести нормальный образ жизни. Подробнее информацию о методах лечения тазобедренных артритов можно получить нашем сайте.
Совмещаем проверенные техники востока и иновационные методы западной медицины
Подробнее о нашей уникальной методике лечения артритов
Операция при артрите ТБС
Малоинвазивное эндопротезирование в Чехии: врачи, реабилитация, сроки и цены.
Узнать подробнее
Среди хирургических технологий лечения сегодня преобладают эндопротезирование и артроскопическая синовэктомия. Эндопротезирование тазобедренного сустава в первую очередь показано людям с ревматоидным артритом, желательно на той фазе, пока сустав не «замкнулся». А это – 2 стадия РА. Если же костный анкилоз состоялся, операция эндопротезирования тоже возможна, хоть и будет сопряжена наибольшими техническими трудностями (разобщение анкилоза и определение направления остеотомии шейки бедра), но вполне преодолимыми для опытных специалистов. Установка эндопротеза на место родного сустава, пораженного тяжелым артритно-артрозным процессом, – единственный способ вернуть пациенту качество жизни с хорошими функциональными результатами. Различные консервативные методики в отношении сильно запущенных форм кокситов неэффективны.
Что касается синовэктомии, ее проводят в том случае, когда воспалительный процесс со скоплением патологической жидкости удерживается длительно и не поддается медикаментозному лечению. Хронический синовит лечится посредством артроскопической техники, которая отличается минимальной инвазивностью (процедура делается через маленькие проколы). Суть такой операции заключается в частичном или полном иссечении синовиальной оболочки тазобедренного сустава. Вместе с удалением данной ткани удаляются и находящиеся на ней патологические клетки, которые продуцировали большое количество комплемента и иммуноглобулинов, отвечающих за тканевое воспаление.
Отметим, что при помощи артроскопии при обостренном гнойном патогенезе могут произвести пункцию и промывание суставной полости с последующим введением в нее антибиотиков или антисептических средств
Частые вопросы по заболеванию
К какому врачу обращаться?
Лучше начать с терапевта, он посоветует, к кому обратиться. Хирург лечит гнойные процессы, ревматолог – все остальные, кроме туберкулезного, с ним нужно обращаться к фтизиатру.
Можно ли вылечить ювенильный артрит без операции?
При адекватном лечении можно избавиться от рецидивов заболевания и его прогрессирования. Современные методы консервативного лечения позволяют пациентам навсегда забыть об обострениях при проведении поддерживающего лечения. Операция – это крайний случай, но иногда она все же необходима.
Литература:
- Яблокова Е. А. Клинические особенности и нарушение минерализации костной ткани у детей с воспалительными заболеваниями кишечника. Дисс. канд. мед. наук. М., 2006. 185.
- Дзюба Г.Г., Резник Л.Б., Ерофеев С.А., Стасенко И.В. Современные методы лечения хирургической инфекции тазобедренного сустава // Современные проблемы науки и образования. – 2021. – № 5.
- D’Incà R., Podswiadek M., Ferronato A., Punzi L., Salvagnini M., Sturniolo G. C. Articular manifestation in inflammatory bowel disease patients. A prospective study // Dig Liver Dis. 2009, Mar 9.
- Rodriguez V. E., Costas P. J., Vazquez M., Alvarez G., Perez-Kraft G., Climent C., Nazario C. M. Prevalence of spondyloarthropathy in Puerto Rican patients with inflammatory bowel disease/Ethn Dis. 2008, Spring; 18 (2 Suppl 2): S2–225–9.
Темы
Артрит, Суставы, Боли, Лечение без операции Дата публикации: 09.12.2020 Дата обновления: 12.03.2021
Оценка читателей
Рейтинг: 5 / 5 (2)
Меры противоартритной профилактики
Во избежание повторения артрита после уже проведенной успешной терапии, а также недопущения болезни, если человек с ней еще не сталкивался, пожалуйста, ознакомьтесь с общими принципами профилактики и придерживайтесь их. Рекомендационные правила по осуществлению профилактического контроля следующего содержания:
- избегайте переохлаждения организма и суставов в частности, в холодную погоду одевайтесь соответственно;
- соблюдайте правильный режим дня – сбалансированность и нормальная кратность питания, рациональность по часам на отдых и работу, ежедневная зарядка и здоровая физическая активность;
- внесение в рацион продуктов, содержащих витамины группы В, если на вашем столе их недостаточно;
- мойте перед употреблением овощи и фрукты, а продукты, требующие обязательной термической обработки, готовьте до полной готовности;
- ежедневно выпивайте достаточное количество чистой воды (2-2,5 л);
- избегайте стрессов и нервных ситуаций;
- следите за весом, высокие показатели массы тела – враг для костей и суставов;
- своевременно и качественно лечите любые бактериальные, инфекционные и вирусные заболевания, включая даже банальные простуды и кариес;
- полностью откажитесь от курения, исключите алкоголь или максимально минимизируйте его употребление (по чуть-чуть и только по праздникам);
- не сидите подолгу в однообразной позе, искорените такие привычки, как скрещивание «нога на ногу» и поджатие конечностей в согнутом положении под себя;
- соблюдайте общую и интимную гигиену;
- будьте бдительны в отношении случайных половых связей (повышенная опасность подхватить ИПП), поэтому если не уверены в партнере, весь ПА используйте презерватив, а после обследуйтесь на половые инфекции;
- при первых же неприятных ощущениях, локализирующихся в суставе, немедленно идите к врачу (самолечение не обойдется без последствий);
- осуществляйте вовремя все лечебные мероприятия и профилактику всех существующих у вас хронических заболеваний, согласно предписаниям профильного врача.
Трохантерит: признаки, симптомы и лечение
При данном заболевании воспаление поражает непосредственно тазобедренную часть скелета, большой вертел ТБС (трохантер). По-другому эту патологию называют вертельным бурситом. Болевая симптоматика при вертельном бурсите часто похожа на признаки тазобедренного коксартроза. При трохантерите воспалительный процесс охватывает сухожилия и мышечные связки, расположенные на поверхности большого вертела бедра.
Чаще всего диагностируют поражение только одного тазобедренного вертела. Причем трохантерит, в сравнении с артрозом ТБС, не сопровождается ограничениями в двигательной активности.
В зависимости от местоположения воспалительного процесса, трохантерит может быть:
- асептической формы – воспаление охватывает синовиальную оболочку, но патогены в процессе не участвуют;
- септического течения – инфекционный, бактериальный, вирусный либо грибковый патоген распространяется по всей области таза. Гнойно-воспалительным процессом оказываются охвачены и другие поверхности в органах жизнедеятельности;
- туберкулёзной формы – достаточно редкая болезнь, по большей части диагностируется в детском возрасте. Отличительной особенностью является распространение воспаления как на большой вертел, так и на прилегающие к костям бедра ткани.
Возможные факторы формирования воспаления:
- избыточная масса тела;
- наличие анатомических нарушений в районе таза и ног;
- переохлаждения;
- проблемы с эндокринной системой;
- чрезмерные физические нагрузки.
Чаще всего трохантерит диагностируют у женщин 25-30-летнего возраста или во время климакса на фоне нарушений в гормональном фоне.
Независимо от возрастной категории и пола пациента болевые признаки, свойственные трохантериту, могут проявиться на фоне проблем с кальциевым обменом и после выраженного поражения костей и суставов остеопорозом.
Лечение врач подбирает, учитывая происхождение воспалительного процесса, протекающего в большом вертеле. Если причина развития патологии кроется в инфицировании организма, показан прием антибиотиков. Асептическая форма заболевания подразумевает лечение нестероидными противовоспалительными средствами. При обнаружении туберкулёзного трохантерита врач назначает медикаменты противотуберкулезной группы.
Благодаря интенсивному лечению буквально спустя 2 недели человека удается полностью вылечить. Главное условие – вовремя обратиться к специалисту.
Тазовые боли у женщин
Сустав, соединяющий тазовую и бедренную кость, в организме женщины несет наиболее тяжелую нагрузку, поэтому его износ тоже чрезвычайно высок. Частой причиной его повреждения становится перелом шейки бедра – травма, которой наиболее часто подвержены женщины в возрасте свыше 60 лет. В этом возрасте у многих из них после наступления менопаузы развивается остеопороз. Кости становятся хрупкими, и любое падение с высоты своего роста может привести к тяжелому перелому. В пожилом возрасте для его лечения, как правило, требуется хирургическая операция.
Еще одно часто поражающее женщин заболевание – коксартроз, для которого характерно постепенное разрушение межсуставной хрящевой ткани. Одно из типичных проявлений – боль в тазобедренном суставе при ходьбе, которая утихает в состоянии покоя. У женщин болезнь начинается во время климакса и неуклонно прогрессирует, иногда приводя к полной невозможности самостоятельного передвижения.
Вероятные осложнения посттравматического артрита
Несвоевременное обращение ко врачу, неточность диагностических мероприятий, а также отказ или отклонение от назначенного плана лечения может стать причиной развития нежелательных осложнений
, среди которых:
Причины посттравматического артрита
Прежде чем рассматривать симптомы посттравматического артрита, важно понимать причины его возникновения и развития.
Ключевая причина
посттравматического артрита – повреждение суставных тканей (мышечной, соединительной, костной), а также сосудов и нервов внутри них. Хрящевая ткань редко страдает от травмы, однако, расположенные около него воспалительные очаги провоцируют ускорение его износа.
Повреждения суставных тканей могут возникать вследствие таких причин, как:
- травмы, полученные в быту, на производстве или в ходе спортивной тренировки;
- повреждения, полученные в результате ДТП и при др. нестандартных ситуациях;
- операции и прочие медицинские мероприятия.
Кроме того, причинами посттравматического артрита не всегда являются серьезные повреждения. Патология может развиться на фоне отсутствия лечения даже легких ушибов.
Что такое посттравматический артрит?
Артрит
– это группа заболеваний, предполагающих поражение сустава дегенеративно-дистрофического типа. Патология может быть самостоятельным заболеванием или являться симптомом какого-либо другого.
Посттравматический артрит
– разновидность артрита, предполагающая развитие дегенеративно-дистрофических процессов на фоне перенесенной ранее травмы, в ситуации, когда наблюдается дисфункция поврежденной части тела.
Особо подверженными заболеванию принято считать спортсменов и людей преклонного возраста.
При отсутствии своевременной диагностики и необходимого лечения патология приводит к необратимой инвалидности пациента.