Перинатальная энцефалопатия — симптомы и лечение
Лечение перинатальной патологии в острый период проводится в отделении неонатологии.
Оперативное лечение может понадобиться при наличии у ребёнка большой гематомы внутри полости черепа — её удаление возможно только хирургическим путём.
При нарастающей закрытой гидроцефалии, чтобы избежать атрофии головного мозга от сдавления его жидкостью, детям проводят шунтирующую операцию — устанавливают шунт (пластиковую трубочку, по которой лишняя жидкость из полости черепа отводится в брюшную полость и там всасывается).
Однако большинство родителей сталкивается с необходимостью лечения ребёнка с перинатальной энцефалопатией в восстановительный период до 1 года в связи с нарушением мышечного тонуса, задержкой развития, гипертензионно-гидроцефальным синдромом и прочими проявлениями.
Наибольшего эффекта можно добиться с помощью комплексного лечебного подхода.
Лечебный медицинский массаж — проводится для нормализации мышечного тонуса и улучшения трофических процессов в тканях. Должен выполняться только массажистом, имеющим медицинское образование и опыт работы с детьми с перинатальным поражением головного мозга. Процедура проводится в детских поликлиниках и центрах реабилитации [3][5][7].
ЛФК — лечебная физкультура. Может включать различные виды:
- Войта-терапию;
- Бобат-терпию;
- лечебную гимнастику на мячах;
- механотерапию (занятия ЛФК на тренажере);
- занятия с инструктором в плавательном бассейне.
ЛФК должен проводить только инструктор, имеющий специальное образование [6][7][18].
Микротоковая рефлексотерапия (МТРТ) — новая медицинская технология, разрешённая Минздравом РФ и рекомендованная для лечения детей с органическим поражением головного мозга, с задержками развития двигательного, речевого, психического развития и ДЦП. Лечение проводится в амбулаторном режиме в реабилитационных центрах в различных регионах РФ.
Лечебное воздействие физиологичное и безболезненное, оказывается токами микроамперного диапазона на нейрорефлекторные зоны на различных участках кожного покрова. Микротоки в 10 раз меньшие, чем при стандартной физиотерапии. Лечение проводится по индивидуальной схеме с учётом всех имеющихся у ребёнка проявлений перинатальной энцефалопатии.
В процессе лечения восстанавливается нормальная рефлекторная деятельность головного мозга, нормализуется мышечный тонус: спастичные (напряжённые) мышцы — расслабляются, гипотоничные (ослабленные) — стимулируются. МТРТ стабилизирует тонус сосудов головного мозга, что позволяет скомпенсировать внутричерепное давление.
Метод способствует приобретению новых двигательных навыков за счёт восстановления активности нейронов различных зон коры головного мозга и мозжечка, пострадавших от гипоксии и гидроцефалии [4][6][9][14][15].
Лекарственные препараты ноотропной группы («Кортексин», «Пантогам», «Цераксон» и др.) должны назначаться только детским неврологом строго по показаниям, т. е. при наличии у ребёнка задержки психомоторного развития и отсутствии противопоказаний [11][16].
Мочегонные препараты целесообразно использовать только при повышении внутричерепного давления (расширение ликворных пространств на НСГ, наличие клинических проявлений гипертензионно-гидроцефального синдрома).
Детские неврологи, как правило, назначают мочегонный препарат «Диакарб», который также оказывает дополнительное воздействие на сосудистые сплетения головного мозга — уменьшает избыточное образование ликвора и снижает внутричерепное давление. Однако он должен применяться только в сочетании с «Аспаркамом», так как применение этого диуретика приводит к потере такого микроэлемента как калий, «Аспаркам» восполняет его потерю [16]. В лёгких случаях в младенческом возрасте целесообразно использовать щадящие фито-препараты: фенхелевый чай, укропная вода, разрешённые к применению в детском возрасте.
Гипоксически-ишемическая энцефалопатия (ГИЭ)
Что такое перинатальная энцефалопатия?
Перинатальные поражения нервной системы у новорожденных – ряд состояний и заболеваний головного, спинного мозга и периферических нервов, объединѐнных в общую группу по времени воздействия повреждающих факторов. К перинатальному периоду относятся антенатальный, интранатальный и ранний неонатальный периоды. Антенатальный период начинается с 22 недели внутриутробного развития и оканчивается началом родового акта. Интранатальный период включает в себя акт родов от начала родовой деятельности до рождения ребенка. Неонатальный период подразделяется на ранний неонатальный (соответствует первой неделе жизни ребенка) и поздний неонатальный (от 8-х по 28-е сутки жизни включительно) периоды.
Почему возникает перинатальная энцефалопатия?
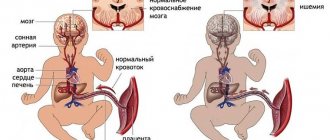
Перинатальная энцефалопатия является частым осложнением патологии беременности и родов. Это состояние обусловлено, как правило, кислородным голоданием центральной нервной системы, возникающее при различных отклонениях течения сложного для ребенка перинатального периода. Перинатальные повреждения мозга составляют более 60% всей патологии нервной системы раннего детского возраста, и непосредственно участвуют в развитии таких заболеваний, как детский церебральный паралич, эпилепсия, минимальная мозговая дисфункция. В зависимости от степени повреждения центральной нервной системы, а так же от наличия правильного и своевременного лечения, возможны различные исходы перинатальной энцефалопатии — треть пациентов, как правило, требует минимальной реабилитационной поддержки для выздоровления, треть нуждается в серьезном, в том числе и медикаментозном лечении, а треть даже при грамотно и длительно оказываемой медицинской помощи, все равно в дальнейшем будет иметь те или иные нарушения здоровья.
Среди причин перинатальных поражений мозга ведущее место занимает внутриутробная и интранатальная (в родах) гипоксия плода, второе по значимости место принадлежит фактору механической травматизации ребенка в процессе родов – как правило, в сочетании с той или иной выраженностью, предшествующей внутриутробной гипоксии. Также в структуру этиопатогенетических факторов перинатальной патологии включают инфекционные (в том числе вирусные) и токсико-метаболические варианты поражения нервной системы. Таким образом, среди факторов, обусловливающих перинатальное поражение ЦНС, выделяют следующие:
- Внутриутробная гипоксия (кислородное голодание) плода
- Гипоксия плода в родах
- Механическая травматизация в процессе родов
- Инфекционные (вирусные) факторы
- Токсические факторы
- Наследственные факторы
- Сочетание перечисленных факторов
Среди факторов риска перинатальной энцефалопатии у детей, большой удельный вес принадлежит материнской заболеваемости, которая по данным многочисленных исследований, не только нарушает преконцепционное здоровье, то есть здоровье, отвечающее за рождение здорового потомства, родительской пары, но и оказывает непосредственное негативное влияние на плод.
При изучении структуры общей патологии беременных женщин в динамике последних пяти лет, отмечается значительный рост их заболеваемости, в первую очередь, за счет увеличения частоты сахарного диабета и болезней щитовидной железы. Во время беременности эти заболевания приводят к плацентарной недостаточности и нарушению всасываемости и усвоения питательных веществ через плаценту, а также дефициту транспорта кислорода и углекислоты, что проявляется синдромом задержки развития плода, внутриутробной гипотрофией, незрелостью легких и сурфактанта. Установлено, что снижение маточно-плацентарного кровотока служит объективным показателем гипоксического поражения мозга.
Чем проявляется перинатальная энцефалопатия?
Клинически перинатальная энцефалопатия проявляется несколькими симптомокомплексами, наиболее частыми из которых являются: «задержка моторного и психического развития», «гипертензионно-гидроцефальный синдром», «синдром мышечной дистонии», «судорожный синдром», «синдром поражения ствола мозга».
Что такое задержка психомоторного развития и как ее лечить?
Самый сложный период в жизни ребенка — это период младенчества. Темпы роста и развития младенцев просто стремительны. В то же время, ребенок рождается с далеко еще не законченным развитием всех органов и тканей, которые уже после рождения постепенно совершенствуются и приближаются по своему строению и функциям к органам взрослого человека, поэтому подробное изучение основных сторон развития ребенка первого года жизни является насущной необходимостью для детских врачей всех специальностей. Прослеживая развитие малыша от периода новорожденности до 1 года, специалисты ориентируются на антропометрические данные ребенка, его психомоторное развитие (двигательную активность), речевое развитие, формирование навыков и умений.
Исходя из особенностей психомоторного статуса здорового новорожденного ребенка, внимательно прослеживая во времени угасание врожденных рефлексов и приобретение двигательных и социальных навыков, можно оценить на сколько правильно и гармонично протекает развитие малыша на первом году жизни.
Задержка психомоторного развития и становления двигательных навыков наблюдается при различных наследственных заболеваниях, у детей с патологией центральной нервной системы, приводящей к формированию стойких двигательных нарушений, вплоть до детского церебрального паралича. При этом под задержкой понимается отставание в развитии на 2 и более месяцев. Особое внимание следует уделять детям с регрессом ранее приобретенных двигательных и психоречевых навыков, что может свидетельствовать о дегенеративных заболеваниях нервной системы.
Легкая (темповая) форма задержки развития часто встречается у недоношенных детей, при хронических не неврологических болезнях, рахите. При умеренных и тяжелых задержках рекомендуется провести специальное обследование и лечение.
Немедикаментозная коррекция психомоторных задержек у детей первого года жизни включает:
Физическую реабилитацию: разнообразный лечебный массаж, лечебную гимнастику, лечение «положением» (укладки, туторы, «воротники» и т. д.), Войта-терапию; упражнения в воде и гидромассаж; сухую иммерсию (имитация невесомости); физиотерапию (переменное магнитное поле, синусоидальные модулированные токи, электрофорез, парафинотерапия, лазеротерапия, свето- и цветотерапия)
Психолого-педагогическую коррекцию: коррекционную (кондуктивная) педагогику; психотерапевтическую коррекцию в диаде «мать–дитя» (контакт «кожа-к-коже», «кенгуру»); музыкотерапию, эстетотерапию; тактильно-кинестетическую стимуляцию. Для недоношенных детей особенно рекомендуется сочетание двух-трех «мягких» методов физического воздействия с психоэмоциональной и психосенсорной коррекцией, что помогает моделировать эффект так называемых «сенсорных комнат», применяемых в реабилитации более старших пациентов.
Медикаментозную терапию, которую применяют неврологи с целью коррекции двигательного и психического развития на первом году жизни, в основном, представлена пептидными препаратами, которые запускают эндогенные механизмы компенсации и возвращают ребенка к нормальному развитию.
Что такое синдром мышечной дистонии и как его лечить?
Тонусные нарушения у младенца могут быть локальными (связанными с одной группой мышц) или распространенными (связанными с несколькими мышечными группами). По характеру изменения мышечного тонуса они подразделяются на гипотонию (сниженный тонус), гипертонус (повышенный тонус) и дистонию (неправильное сочетание повышенного и пониженного тонуса).
Типичным и наиболее часто встречающимся локальным тонусным нарушением можно считать младенческую кривошею.
Кривошея, как правило, бывает обусловлена негрубым недоразвитием или травматическим повреждением грудино-ключично-сосцевидной мышцы и корешков, выходящих из С5 — С6 сегментов спинного мозга или добавочного нерва, к возрасту 6-9 месяцев кривошея обычно исчезает. Однако легкие симптомы кривошеи можно обнаружить и в более старшем возрасте. Ощущается сопротивление при повороте в противоположную пораженной мышце сторону.
В качестве лечения вашему ребенку могут назначить аппликации, электрофорез или обкалывание траумелем, ректальные свечи вибрукол, укладки головы в правильное положение с помощью подушки «баранки».
Мышечная гипотония (синдром «вялого ребенка») проявляется главным образом уменьшением сопротивления пассивным движениям и увеличением их объема (появления разболтанности в суставах). В тяжелых случаях гипотония оказывает влияние на позу ребенка: крайним выражением диффузной мышечной гипотонии является «поза лягушки». Синдром «вялого ребенка» может иметь место при большом спектре заболеваний: тяжелые не неврологические заболевания, рахит, тяжелая перинатальная гипоксия (кислородная недостаточность) и родовая травма, приводящие к формированию церебрального паралича, нарушения обмена веществ, нервно-мышечные болезни, аномалии развития и дегенеративные заболеваний нервной системы, хромосомные синдромы, некоторые формы эндокринной патологии.
Диффузная мышечная гипотония часто встречается при наследственной патологии. В таком случае возможно присоединение недостаточной прибавки в весе и росте, эпилептических приступов, эпизодов острого нарушения мозгового кровообращения. Выраженное снижение мышечного тонуса часто встречается у недоношенных детей, причем к 3-6 месяцам у них возможна трансформация гипотонии в спастический синдром.
При выраженной стойкой мышечной гипотонии, особенно в сочетании с задержкой психомоторного развития, необходимо проведение регулярных реабилитационных курсов (массаж, ЛФК, физиотерапия, гидро и бальнеотерапия, иглорефлексотерапия, логопедические занятия, медикаментозное лечение).
Мышечный гипертонус может проявляться от незначительного (не затрудняющего движения и развитие) до выраженного вплоть до спастического синдрома (крайняя форма гипертонуса). Повышение мышечного тонуса может сочетаться с активацией тонических рефлексов и задержкой угасания безусловных рефлексов.
Тонические рефлексы в сочетании с повышенным мышечным тонусом оказывают патологическое влияние на позу ребенка. Такая картина зачастую наблюдается у недоношенных и незрелых детей, а также при формировании детского церебрального паралича. В последнем случае безусловные рефлексы могут даже усиливаться.
Дистонии и гиперкинезы (неправильные, лишние, вычурные и избыточные движения) — данные клинические проявления часто появляются отсрочено, после 3-6 месяцев жизни, но могут отмечаться и с рождения.
Гиперкинезы, как правило, характеризуют поражение подкорковых ядер головного мозга, которые часто сочетаются с другими неврологическими симптомами (например, с тугоухостью). Как гипертонус, так и дистонии, формируя длительные неправильные позовые установки у ребенка, с течением времени приводят к деформациям скелета малыша. Поэтому при наличии двигательных нарушений, помимо невролога, такого ребенка обязательно должен наблюдать ортопед.
С момента установления диагноза рекомендуется начать курс восстановительного лечения. Проведение восстановительной терапии (при отсутствии противопоказаний со стороны сердечно-сосудистой, дыхательной систем, отсутствии эпилептических пароксизмов и др.) включает массаж, лечебную физкультуру, ортопедические укладки, физиотерапевтическое лечение, гидро и бальнеотерапию, иглорефлексотерапию, логопедические занятия, занятия в сенсорных комнатах.
Методики раннего развития и медикаментозную терапию выбирают индивидуально, в зависимости от выраженности синдрома и сочетания его с задержкой развития, гиперкинетическим и дистоническим синдромами.
Медикаментозная терапия, назначаемая с целью коррекции мышечного тонуса у детей на первом году жизни, подразделяется на препараты, снижающие мышечный тонус (антиспастические препараты) и препараты, корригирующие мышечную гипотонию.
Что такое гипертензионно-гидроцефальный синдром и как его лечить? В норме прирост окружности головы на 1 году жизни составляет 11-12 см:
- За первый триместр жизни окружность головы увеличивается на 4 см (1.5 см/месяц)
- За второй триместр жизни — на 3 см (1 см/месяц)
- За второе полугодие жизни окружность головы увеличивается 3-4 см (0.5 см/месяц)
Патологический прирост окружности головы как симптом гидроцефалии развивается вследствие закупорки ликворных путей на различных уровнях и при нарушении взаимоотношений между процессами выработки и всасывания спинномозговой жидкости.
Гидроцефалия:
Врожденная гидроцефалия — заболевание, которое формируется у плода во время беременности и ребенок рождается уже больным. Основные причины врожденной гидроцефалии – пороки развития, реже внутриутробная инфекция, значительно реже причиной гидроцефалии является кровоизлияние в желудочки мозга у плода.
Приобретенная гидроцефалия — болезнь формируется после рождения ребенка, иногда на самых ранних сроках жизни. Причинами приобретенной гидроцефалии являются внутрижелудочковые кровоизлиянии, инфекция с поражением центральной нервной системы – менингиты, энцефалиты, черепно-мозговая травма, опухоли головного мозга.
Клинические симптомы внутричерепной гипертензии:
- Изменения в поведении ребенка: беспокойство, частый и монотонный плач, запрокидывание головы, частое срыгивание
- Задержка психического, моторного и психоречевого развития
- Раскрытие сагиттального шва более 0.5см, выбухание, напряжение большого родничка
- Изменения формы черепа с высоким лбом (башенный череп) или с резко выступающим затылочным бугром в сочетании с избыточным приростом окружности головы, преобладание окружности головы над окружностью груди
- Симптом Грефе, «застойные» изменения на глазном дне
- Повышение мышечного тонуса, преимущественно в кистях и стопах
- Тремор (дрожание) кистей рук с тенденцией к их раскрытию
Помимо гидроцефалии, обладателями черепа «гидроцефальной формы» с большой окружностью головы могут быть дети со следующими состояниями:
- Рахит
- Конституционально большеголовые дети
- Младенцы с синдромальными состояниями и наследственными заболеваниями
Для адекватной оценки ситуации необходимо всегда сопоставлять окружность головы с окружностью груди, оценивать размеры головы у родителей ребенка, ориентироваться на результаты дополнительных методов исследования (осмотр глазного дна, НСГ, КТ, МРТ).
Медикаментозная терапия, для коррекции гидроцефального синдрома на первом году жизни, в основном, представлена препаратами диуретического и сосудистого действия.
Гидроцефалия — это заболевание, которое лечит не невролог, а нейрохирург. Без консультации нейрохирурга невролог принимать решение о лечении гидроцефалии не может. Если по каким-либо причинам, оперативное лечение гидроцефалии ребенку не показано, невролог с нейрохирургом наблюдают такого пациента вместе.
Недостаточный прирост окружности головы отмечается при прогрессирующих наследственно-дегенеративных заболеваниях, при органических поражениях с тяжелым течением (вторичная микроцефалия — когда не растет мозг и из-за этого замедляется рост черепа), при краниостенозах (патология костей черепа, требующая оперативного лечения у нейрохирурга).
Следует обратить внимание на то, что скорость зарастания большого родничка у каждого ребенка строго индивидуальна, и, скорее связана с особенностями минерального обмена, чем с патологией нервной системы. Сохранение открытого большого родничка к концу второго полугодия жизни малыша при отсутствии неврологических жалоб не является причиной для большого беспокойства, так же как ускоренное закрытие большого родничка ни в коем случае не является причиной для прекращения плановой профилактики рахита у младенца.
Что такое судорожный синдром и как его лечить? В практике детского невролога есть немало состояний, протекающих пароксизмально, т.е. возникающих внезапно, кратковременно существующих и резко прекращающихся. Примером пароксизмов являются эпилептические припадки, обычно сопровождающиеся потерей сознания. Однако не все пароксизмы протекают с нарушением сознания, некоторым из них свойственна весьма необычная симптоматика, что может стать причиной диагностических ошибок.
Особую сложность представляет выявление и дифференциация различных пароксизмальных состояний в младенческом возрасте. Для выбора правильной тактики лечения необходимо различать пароксизмальные состояния эпилептической и неэпилептической природы, однако, четко разграничить причину пароксизмов и их прогноз может только опытный невролог-эпилептолог.
Аффективно-респираторный пароксизм представляет собой кратковременную остановку дыхания на высоте плача с побледнением или посинением кожных покровов. Необходимо дифференцировать аффективно-респираторные пароксизмы с синдромом апноэ (прекращения дыхания), который часто встречается у недоношенных и незрелых младенцев, а также у детей с патологией сердечно-сосудистой и дыхательной систем, ствола мозга. Для четкой дифференциации проводят исследование полисомнографию, позволяющую с помощью одновременной регистрации ЭЭГ, электрокардиограммы и спирограммы (графика дыхания) определить, что является первопричиной нарушения дыхания у малыша. Сами по себе, аффективно-респираторные пароксизмы не являются эпилептическими, однако частота их дальнейшей трансформации в эпилепсию довольно высока.
Пароксизмальные нарушения сна представляют собой достаточно большую группу состояний, которые необходимо дифференцировать как с не неврологическими болезнями, так и с эпилептическими пароксизмами. Наиболее характерные представители пароксизмальных нарушений сна – ночные кошмары, во время которых малыш резко и пронзительно начинает кричать и плакать, не пробуждаясь при этом полностью и мало реагируя на окружающее. Наличие часто повторяющихся ночных кошмаров может указывать на неблагополучие психической сферы ребенка.
Фебрильные судороги являются самым распространенным вариантом пароксизмальных состояний в детском возрасте. Фебрильные судороги (ФС) — это пароксизмы различной продолжительности, протекающие преимущественно в виде судорожных припадков у детей грудного и раннего возраста при температуре тела не менее 37,8—38,5°С. ФС имеют повышенную вероятность трансформации в эпилепсию.
Выделяют типичные и атипичные ФС. Первые имеют небольшую продолжительность (до 15 минут), генерализованный характер (вовлечены все конечности, кратковременно утрачивается сознание); показатели психомоторного развития ребенка обычно соответствуют возрастным, нет типичных изменений на ЭЭГ. При атипичных ФС продолжительность приступа составляет более 15 минут (до нескольких часов), имеется преимущественная заинтересованность конечностей с одной стороны; иногда после приступа возникают Тоддовские парезы – преходящая мышечная слабость в конечностях, заинтересованных судорогой (в 0,4% случаев), на ЭЭГ нередки эпилептические очаговые изменения.
Неонатальные судороги (НС), возникают в течение первых 4 недель жизни доношенного новорожденного (с 1-го по 28-й день) и несколько позже у недоношенных. Неонатальные судороги довольно сложно отличить по клиническим проявлениям от доброкачественных движений ребенка — их наличие устанавливается с помощью ЭЭГ с видеозаписью. Наиболее тяжелый прогноз имеют миоклонические приступы и могут свидетельствовать о дебюте ранней тяжелой эпилепсии.
Эпилепсия — это хроническое заболевание головного мозга, характеризующееся повторными непровоцируемыми судорожными приступами, вызывающими нарушение двигательных, чувствительных, вегетативных, мыслительных или психических функций, возникающих вследствие чрезмерных нейронных разрядов в коре головного мозга. Распространенность эпилепсии среди детского населения составляет около 10 случаев на 1000 детей.
Эпилепсия — это очень неприятное, но очень распространенное неврологическое заболевание, особенно в детском возрасте. Помимо создания угрожающих жизни младенца состояний при затяжных и осложненных судорожных припадках, эпилепсия приводит к отдаленным негативным последствиям, нарушая познавательное, психо-социальное и двигательное развитие ребенка. Современные противосудорожные препараты дают возможность контролировать большинство форм эпилепсии, но родители боятся давать их детям из-за плохой репутации противосудорожных препаратов старших поколений, опасаясь их побочных эффектов. Все ваши опасения нужно обсудить со специалистом. Не лишайте из-за своих предрассудков своего ребенка здорового будущего.
Какими бывают симптомы поражения ствола мозга и чем их лечат?
Мозговой ствол, или ствол головного мозга — традиционно выделяющийся отдел головного мозга, представляющий собой протяжённое образование, продолжающее спинной мозг.
В стволе мозга сконцентрированы жизненно-важные центры, отвечающие за дыхание, глотание, сердечную деятельность, согласованные движения глаз и т.п. У новорожденных с неврологическими проблемами деятельность этих центров может быть недостаточно сформирована или повреждена. Недооценка симптомов поражения ствола головного мозга может привести к критическим последствиям.
Бульбарные, псевдобульбарные расстройства у детей с поражением нервной системы отмечаются с рождения. Проявляются вялым сосанием, затем начинают поперхиваться слюной и пищей, захлебываться, пища выливается через нос, изменяется тонус языка, нарушается формирование речи.
Глазодвигательные расстройства очень характерны для детей младенческого возраста с патологией ЦНС. Спектр возможных нарушений включает в себя нистагм (дрожание глазных яблок), различные виды косоглазия. Крайне важно выделение из этой группы пациентов – слабовидящих, так как глазодвигательные нарушения могут являться первыми симптомами нарушения зрительной функции (например, так называемый, «плавающий нистагм слепых»). Пациенты нуждаются в совместном наблюдении невролога и офтальмолога.
Нарушения дыхания и сердечного ритма – также характерны для пациентов с нарушенной функцией стволовых структур. Особенно подвержены нарушениям (выпадениям) дыхания или апноэ и аритмиям младенцы, родившиеся недоношенными и маловесными. В такой ситуации принципиальной задачей является дифференциальная диагностика неврологических и не неврологических (кардиологических, дыхательных) причин выявленных нарушений. Такие пациенты требуют тщательной диагностики и наблюдения невролога, пульмонолога, кардиолога и ЛОР-врача.
Обязательно спросите специалистов о наличии стволовых нарушений у вашего малыша. Их последствия могут быть очень грозными (например, дыхательные нарушения по типу апноэ обуславливают синдром внезапной младенческой смерти, а нарушения глотания и хронические «поперхивания» приводят к тяжелейшим аспирационным пневмониям), но при правильном и тщательном уходе (правильная поза ребенка во время сна, кормление с приподнятым головным концом и специальная диета) неприятностей можно избежать даже без дополнительных лекарственных препаратов.
Все ли отклонения в развитии младенца требуют специального лечения?
Вариантами нормы на первом году жизни являются следующие события:
- Физиологический тремор — ритмичные подергивания ручек или подбородка во время крика или кормления. В норме имеет место у половины детей в возрасте до 3 месяцев. Часто тремор наблюдается у недоношенных новорожденных до 6 месяцев
- Физиологическая астазия-абазия — с 2 до 5 месяцев ребенок при «подвешивании» не опирается на плоскость ногами, поджимает их, в соответствии с этим и нет шаговых движений (в связи с угасанием рефлекса опоры)
- Яктация — укачивающие (самоуспокаивающие) движения туловища и/или головы, появляющиеся у ребенка преимущественно перед сном, характерны для детей, воспитывающихся без попечения родителей
- Комплекс оживления – разнообразные хаотичные движения, сопровождающие эмоциональные, как правило, позитивные «всплески». Особенно характерны для детей с иммобилизованными конечностями (например, получающими лечение гипсованием или ортопедическими аппаратами
Таким образом, все дети с перинатальной энцефалопатией нуждаются в длительном динамическом наблюдении специалистов и проведении индивидуально подобранных повторных курсов восстановительного лечения, с интервалом не более 3 месяцев и с регулярным контролем его эффективности, в течение первого года жизни условиях амбулаторных реабилитационных центров, отделений стационаров и районных поликлиник.
Однако, для того чтобы реабилитационный процесс был непрерывным, специалистов здравоохранения недостаточно — необходимо вовлекать в реабилитационный процесс семью ребенка. Профессионалы, заинтересованные в результате своего труда, с удовольствием проведут обучение матерей основам занятий ЛФК, грудничкового плавания, методикам раннего развития детей. Вопреки укоренившемуся мнению, восстановительное лечение детей с перинатальной патологией нервной системы должно начинаться сразу после постановки диагноза, и прекращаться только после того как ребенок по всем параметрам физического, моторного и психоречевого развития «догонит» своих сверстников.
О.В. Быкова
Д.м.н., главный научный сотрудник Научно-практического центра детской психоневрологии
Департамента Здравоохранения г. Москвы
Диагностика
Перинатальный синдром ишемии на фоне гипоксии мозга начинают диагностировать, делая визуальный осмотр ребенка. Так же и со взрослыми. Несмотря на все достижения медицины, уникальный тест, позволяющий точно выявить ГИЭ, до сих пор не придуман. Все лабораторные методики направлены на выявление того, насколько сильно поврежден мозг и текущее состояние всего организма.
Какими будут исследования, зависит от симптомов, и как они развивались. Для расшифровки анализов есть специальные биомаркеры, которые дают полную картину о степени ГИЭ. Для исследования нужна кровь больного.
Нейровизуализацию проводят с помощью:
- нейросонографа и/или МРТ, томографа, показывающего внутренние повреждения мозга и изменения в нем;
- доплерографа, фиксирующего работу мозгового кровотока;
- электронейромиографа для определения чувствительности волокон периферии нервной системы.
Дополнительного могут использовать:
- электроэнцефалограф для выявления задержки развития на ранней стадии и есть ли эпилепсия;
- видеомониторинг для изучения двигательной активности малышей.
При необходимости пострадавшего осматривает окулист, чтобы определить состояние зрительных нервов и глазного дна, а также на наличие болезней генетического типа в этой области.
Новый метод лечения ГИЭ
При ГИЭ используют мононуклеарную фракцию пуповинной крови, содержащую стволовые клетки. Когда ее вводят ребенку внутривенно, происходят восстановление и регенерация клеток головного мозга, регулируется работа иммунной системы. Если терапию начали проводить на раннем этапе заболевания, то энцефалопатия может быть излечена за счет мощного регенеративного потенциала пуповинной крови и восстановления популяции нервных клеток. Уникальность клеточной терапии при энцефалопатии заключается в достижении высоких результатов лечения в каждом случае. На сегодня только в России уже спасено более 330 детей, страдающих ДЦП, с помощью заготовленной пуповинной крови.
Лечение гипоксически-ишемической энцефалопатии мононуклеарной фракцией пуповинной крови на ранних этапах является важнейшим фактором благоприятного прогноза, снижения риска развития ДЦП, а также правильного развития ребенка и улучшения качества его жизни в последующие годы.
Таким образом, приняв решение о сохранении пуповинной крови, родители дают своему малышу замечательную «биологическую страховку» от ДЦП: при необходимости к лечению можно приступить с первого дня жизни новорожденного, используя его же собственные клетки пуповинной крови, прямо в родильном доме.
Родители – будьте бдительны: заготовьте пуповинную кровь своего ребенка и тем самым вы спасете его от многих заболеваний.
Виды
Врачи выделяют врожденную и приобретенную энцефалопатию. Первая возникает на фоне неправильного течения беременности или родов и, зачастую, развивается еще во время пребывания плода в утробе матери. Ее признаки обнаруживаются сразу после родов или появляются в первые недели жизни. Диагностикой и лечением этого состояния занимаются неонатологи и педиатры.
Приобретенная энцефалопатия встречается уже во взрослом возрасте. Она подразделяется на несколько видов в зависимости от причины гибели нейронов:
- посттравматическая: возникает на фоне перенесенной черепно-мозговой травмы; зачастую, развивается уже через несколько лет после нее и нередко приводит к тяжелым расстройствам психики;
- токсическая: связана с острым или хроническим отравлением организма алкоголем, ядами, наркотическими препаратами, лекарственными средствами, солями тяжелых металлов и т.п.; нередко в рамках этого вида отдельно выделяют алкогольную энцефалопатию;
- метаболическая: связана с нарушением обмена веществ в организме; выделяют следующие подвиды патологии: печеночная: возникает при поражении печени или желчевыносящих путей;
- уремическая: связана с нарушением работы почек;
- диабетическая: является одним из частых осложнений сахарного диабета, возникает на фоне стойкого нарушения микроциркуляции и повышения вязкости крови;
- аноксическая: развивается после перенесенной клинической смерти и связана с кислородным голоданием головного мозга с последующим развитием «метаболической бури»;
- синдром Гайе-Вернике: энцефалопатия, вызванная дефицитом витамина В1;
- панкреатическая: является осложнением воспаления поджелудочной железы;
- гипогликемическая: возникает на фоне резкого снижения глюкозы крови;
- атеросклеротическая: развивается из-за атеросклероза и утолщения стенок сосудов;
В зависимости от скорости развития процесса выделяют энцефалопатию острую и хроническую. Первая может развиться в течение нескольких дней или часов, чаще возникает на фоне сильной интоксикации, травмы, инфекционного процесса. Хронический процесс может протекать годами и десятилетиями.
Преждевременные роды являются главной причиной младенческой смертности и серьезным фактором утраты человеческого потенциала выживших детей в течение последующей жизни. По данным зарубежных авторов, во всем мире ежегодно рождаются несколько миллионов детей с очень низкой массой тела (ОНМТ) [1]. В США 90% из 65 000 новорожденных младенцев с ОНМТ переживают неонатальный период из-за больших успехов в интенсивной терапии, однако у 5—10% этих детей позже обнаруживают детский церебральный паралич [2].
Внедрение современных медицинских технологий в последнее десятилетие отмечено снижением перинатальной и младенческой смертности. Вместе с тем повышение коэффициента выживаемости детей с ОНМТ и экстремально низкой массой тела (ЭНМТ) при рождении влечет за собой повышение заболеваемости и формирование ранней инвалидности [3]. Среди причин детской инвалидности патология нервной системы занимает первое место, а вклад перинатальных поражений достигает 60—80% всех неврологических заболеваний [4]. В России ежегодно из числа освидетельствованных инвалидов с детства признаются трудоспособными не более 2,5—5% по сравнению с 50% за рубежом [5].
Среди факторов, неблагоприятно влияющих на антенатальный период, большое значение имеет нарушение маточно-плацентарного кровообращения, причиной которого могут быть как экстрагенитальная, так и соматическая патология матери [6]. Нарушения маточно-плацентарного кровотока в свою очередь приводят к развитию гипоксии, являющейся центральным звеном патогенеза антенатального повреждения плода, и в первую очередь центральной нервной системы (ЦНС). В работах многих авторов установлен целый комплекс физиологических приспособительных реакций плода к неблагоприятным условиям развития, в частности к гипоксии [7—10]. Однако информации о биохимическом статусе нервной ткани плода и новорожденного при данной патологии недостаточно. Большой интерес в этом плане представляет изучение метаболизма глюкозы, особенностей свободнорадикального окисления и обмена глутамата, процессов некроза и апоптоза.
Внутриутробно плод находится в состоянии гипоксии, однако эта среда для него является физиологической, более того, на ранних этапах эмбрионального периода она необходима для нормальной дифференцировки клеток. Оксигенация плода зависит от градиентов парциального давления кислорода между материнской и плацентарной кровью, плодной кровью и плодной тканью. Известно, что в первые недели после зачатия в эмбриональном периоде уровень парциального давления кислорода (рО2) чрезвычайно низок и составляет около 18—20 мм рт.ст. Предположительно, это необходимо для защиты эмбриона, который очень чувствителен к повреждающему действию реактивных форм кислорода [11]. Гипоксия в эмбриональном периоде вызывает ангиогенез и является предпосылкой для поддержания плюрипотентности стволовых клеток [12]. Примечательно, что в I триместре беременности эмбриональные стволовые клетки развиваются при уровне рО2 около 10—15 мм рт.ст., тогда как в эндометрии рО2 составляет около 25 мм рт.ст. Стволовые клетки демонстрируют более эффективный рост и дифференцировку при низких давлениях кислорода — 10—15 мм рт.ст. [13]. Длительная гипоксия будет стимулировать ангиогенез посредством транскрипционной и посттранскрипционной регуляции факторов роста: фактор роста эндотелия сосудов, эритропоэтин, фактор роста плаценты и ангиопоэтин1 [14].
Основным регулятором адаптивных ответов клетки на гипоксию является индуцированный гипоксией фактор1 (ИГФ-1), гетеродимерный транскрипционный фактор, включающий субъединицы (ИГФ-1α и ИГФ-1β). ИГФ-1α стабилизируется, когда концентрация кислорода ниже определенного критического порога, таким образом, накапливаясь в гипоксической среде. ИГФ-1β присутствует в ядре клетки, и в условиях гипоксии он димеризуется с ИГФ-1α, улучшая доставку кислорода в ткань [15, 16]. На 14—16-й неделе беременности рО2 поднимается до стабильных значений 45—50 мм рт.ст. и сохраняется таковым до конца беременности. На поздних сроках беременности скорость пролиферации и дифференцировки клеток снижается [17, 18]. Процессы перекисного окисления липидов присутствуют с самого начала беременности, что способствует нормальному развитию плода. В конце I триместра физиологический окислительный стресс вызывает регрессию ворсинок, которые были сформированы на всей поверхности хорионического мешка, чтобы сформировать окончательную дискоидную плаценту [19]. Постнатальное увеличение концентрации кислорода вызывает всплеск образования его активных форм, при этом экспрессия антиоксидантных ферментов, таких как супероксиддисмутаза, каталаза и глутатионпероксидаза, динамически увеличиваются в течение последних недель беременности. Аналогичным образом повышается доступность наиболее важных неферментативных антиоксидантов: глутатиона, гемоксигеназы, витаминов С и Е, β-каротинов и т. д. [20]. Недоношенный ребенок более подвержен риску свободнорадикального повреждения [21]. Считается, что использование высоких концентраций кислорода во время реанимации новорожденных вызывает гипероксемию. При этом была обнаружена значительная корреляция между окисленным глутатионом (GSSG), рО2 и активностью ферментов окислительно-восстановительного цикла глутатиона [22, 23]. Многие заболевания, связанные с недоношенностью, такие как ретинопатия, бронхолегочная дисплазия, внутрижелудочковые кровоизлияния, связаны со свободнорадикальным повреждением в результате незрелости антиоксидантной системы недоношенных детей [24].
Нервная ткань является наиболее уязвимой при воздействии гипоксии. Гипоксия приводит к нарушению обмена кислорода и углекислоты, что в свою очередь вызывает метаболические расстройства и гемодинамические нарушения [25]. Известны следующие механизмы, лежащие в основе церебрального повреждения при гипоксии-ишемии: местные нарушения обмена макроэргических соединений, чрезмерное перекисное окисление липидов и нарушение Na+/K+-АТФазной активности, внеклеточное накопление К+ и внутриклеточное накопление Са2+, внутриклеточный ацидоз, нарушение обмена нейротрансмиттеров [26]. Основные звенья гипоксически-ишемического стресса представлены P. Marro [27].
— Недостаток кислорода. Дефицит кислорода как акцептора электронов в тканях приводит к нарушению транспорта электронов в цикле Кребса и дыхательной цепи, восполнению энергии путем увеличения мозгового кровотока и анаэробного метаболизма [28].
— Глутамат-кальциевый каскад. Повышение концентрации глутамата активирует N-метил-D-аспартат (NMDA)-рецепторы, что сопровождается увеличением внутриклеточного Са2+ [29]. Нарушения в митохондриях и эндоплазматическом ретикулуме могут привести к дальнейшему накоплению внутриклеточного Ca2+. Повышение концентрации Са2+ внутри клетки способствует образованию свободных радикалов, что в свою очередь вызывает перекисное окисление липидов клеточной и внутриклеточной мембран. Наряду с этим накопление внутриклеточного Са2+ закономерно сопровождается повышением его концентрации в ядре клетки. Избыток внутриядерного Са2+ является фактором активации протоапоптотических генов, которые запускают генетически запрограммированную гибель клетки — апоптоз [30].
— Роль свободных радикалов. Гипоксия-ишемия вызывает неадекватное насыщение митохондриальной цитохромоксидазы, нарушение транспорта электронов в митохондриях, что приводит к повышению концентрации супероксид-аниона и поступлению свободных радикалов из митохондрий в цитоплазму [31]. Повышение концентрации внутриклеточного Са2+ активирует NO-синтетазу, циклооксигеназу и липооксигеназу, что способствует образованию свободных радикалов. Их избыток приводит к дополнительному высвобождению возбуждающих аминокислот и активации NMDA-рецепторов [32].
— Факторы воспаления. Действие гипоксии — ишемии на микроглию способствует синтезу цитокинов, интерлейкина-1β (ИЛ-1β), фактора некроза опухоли α (TNFα) [33]. Активность ИЛ-1β сопровождается продукцией специфических протеаз и развитием апоптоза. Избыточное образование TNFα обладает прямым токсическим эффектом и вызывает сосудистую инфильтрацию с высвобождением цитотоксических факторов, активных форм кислорода и цитокинов [34].
— Роль оксида азота (NO). NO-синтетаза содержится в эндотелиальных клетках, астроцитах, нейронах. Существует 3 изоформы NO-синтетазы: нейронная (регулирует синаптогенез и ремоделирование и зависит от Са2+); эндотелиальная (регулирует сосудистый тонус, особенно вазодилатацию, и зависит от Са2+); индуцируемая (присутствует в макрофагах и астроцитах, индуцируется цитокинами, независима от Са2+) [35]. Активация NMDA-рецепторов вызывает продукцию нейронной NO-синтетазы, которая способствует образованию радикала оксида азота (NO.) и повреждению нейрональной ДНК [36].
— Апоптоз. Описанные выше процессы развиваются в первые минуты острой гипоксии, после чего включается механизм апоптоза [37]. Гипоксия через ряд звеньев патогенеза способствует накоплению внутриклеточного Са2+, активации эндонуклеаз, повреждению экспрессии генов. Это приводит к растормаживанию фагоцитарной активности глиальных клеток и нейронов, которые фагоцитируют поврежденный нейрон, вызывая уменьшение его размера и секвестрацию [38].
Наиболее значительные потери клеток нервной ткани развиваются спустя 2—6—48 ч после рождения, вследствие патологического окислительного стресса. В таких условиях в первые часы и сутки жизни после рождения у новорожденных, перенесших гипоксию, развивается выраженный дисбаланс в системе регуляции церебрального кровообращения, который обостряет течение ишемического процесса [39].
Особенностью недоношенных детей является незрелость антиоксидантной системы, поскольку физиологическое увеличение антиоксидантной способности происходит в конце беременности, именно поэтому они более подвержены воздействию окислительного стресса, особенно когда их состояние требует проведения респираторной терапии [40]. В связи с этим возникает необходимость изучения окислительного стресса у этих детей, в частности путем измерения продуктов перекисного окисления липидов и компонентов антиоксидантной системы.
Известно, что антиоксиданты обладают противовоспалительной активностью, а систему глутатиона рассматривают как критический фактор развития воспаления и иммунных ответов [41, 42]. Это подтверждается изменением уровня цитокинов, острофазных белков и глутатиона во время воспаления [43, 44]. Система глутатиона включает его формы, ряд ферментов его синтеза и катаболизма, и механизмы транспорта. Все эти компоненты вносят важный вклад в изменение глутатионового статуса [45].
Изучая классификацию церебральных поражений у новорожденных, необходимо отметить, что наиболее популярной у неонатологов является классификация гипоксической энцефалопатии по H. Sarnat и M. Sarnat [46]. Она объединяет клинические признаки церебральной ишемии и результаты электроэнцефалографии (ЭЭГ). В данной классификации оцениваются основные показатели новорожденного: уровень сознания, нерво-мышечный статус, рефлексы, вегетативная функция, наличие судорог, ЭЭГ. В зависимости от выраженности церебральной дисфункции устанавливают I, II или III стадию энцефалопатии. Канадские неонатологи модифицировали классификацию Sarnat, дополнив ее расстройствами терморегуляции и исключив ЭЭГ и некоторые другие показатели [47]. Неонатологи Великобритании используют классификацию гипоксических церебральных нарушений L. Dubowitz и соавт.[48]. В международной классификации болезней 11-го пересмотра (МКБ-11) гипоксически-ишемические поражения головного мозга у новорожденных относятся к группе «неврологических расстройств, характерных для перинатального и неонатального периодов» [49]. Основным отличием от классификации 10-го пересмотра является то, что в МКБ-11 данная группа дополнена заболеваниями, которые ранее не выделяли отдельно. Например, перинатальный артериальный инсульт и неонатальный церебральный синовенозный тромбоз. В то же время из предложенной классификации была исключена врожденная гидроцефалия. Диагноз асфиксии новорожденного поместили в «группу других нарушений, возникающих в перинатальном периоде». При этом отдельно выделили асфиксию новорожденного с оценкой по шкале Апгар 0—3 балла и асфиксию новорожденного с оценкой по шкале Апгар 4—6 баллов. Что касается церебральных повреждений гипоксически-геморрагического характера, то их отнесли к группе «геморрагических и гематологических нарушений у плода и новорожденного». При этом несколько изменилась классификация внутрижелудочковых кровоизлияний. В МКБ-11 принято выделять 4 степени внутрижелудочковых кровоизлияний, в то время как в МКБ-10 3-я и 4-я степени были объединены.
Симптомы тяжелого повреждения ЦНС могут проявляться не сразу после рождения, а спустя несколько часов. При этом клиническая симптоматика не всегда отражает истинную степень тяжести заболевания. В связи с этим особую актуальность приобретает прижизненная оценка изменений, возникающих в клетках нервной ткани в раннем неонатальном периоде. Ультразвуковое исследование (УЗИ) позволяет выявить структурные изменения головного мозга новорожденных при перинатальном гипоксическом поражении ЦНС. Анализ ультразвуковых и патоморфологических данных свидетельствует о том, что характер ишемического поражения головного мозга зависит не только от тяжести перинатальной гипоксии, но и от зрелости ребенка [50]. У доношенных новорожденных ишемия мозга сопровождается возникновением избирательного нейронального некроза, субкортикальной и мультикистозной энцефаломаляциями, инфарктами мозга [51]. Тяжелая перинатальная гипоксия у недоношенных 34—37-й недель гестации, как правило, приводит к развитию перивентрикулярной лейкомаляции. В связи с выхаживанием глубоко недоношенных детей с ЭНМТ при УЗИ стали чаще выявлять такие формы ишемического повреждения, как диффузная лейкомаляция и перивентрикулярный геморрагический инфаркт. Следует отметить, что в первые 24—48 ч дебюта неонатального артериального ишемического инсульта данный метод не обладает достаточной чувствительностью и специфичностью, так как очаг ишемического поражения начинает появляться только на 2—3-и сутки от начала ишемии, что связано с ходом патогистологических процессов. Выраженность воспалительной реакции, интенсивность некроза и апоптоза достигают своего пика через 48—72 ч после нарушения кровообращения [52]. Это приводит к изменению эхогенности поврежденной мозговой паренхимы. Дальнейшая оценка эволюции ишемического очага не уступает по информативности магнитно-резонансной томографии (МРТ) [53, 54]. Повысить чувствительность УЗИ на ранних сроках церебрального повреждения помогает применение ультразвуковой допплерографии. Дуплексное сканирование позволяет объективно оценить гемодинамические характеристики церебральных сосудов. Ценность ультразвуковой допплерографической методики в остром периоде заболевания — выявление фазы вазодилатации, наиболее раннего признака ишемического повреждения, возникающего уже через 30 мин после развития сосудистой катастрофы и сохраняющегося в течение первых 5—6 сут [55]. Вазодилатация развивается в ответ на действие различных метаболитов и способствует увеличению поступления в ишемизированную ткань глюкозы и кислорода. Ее характерными признаками являются повышение скорости кровотока и снижение индексов периферического сопротивления в поврежденном сосудистом бассейне [56, 57]. МРТ стала наиболее информативным методом диагностики перинатальных повреждении головного мозга. Наличие различных импульсных последовательностей обеспечивает высокую чувствительность и специфичность, даже на ранних сроках развития сосудистой катастрофы [58, 59]. МРТ с получением диффузионно-взвешенных изображений и построением карт измеряемого коэффициента диффузии (ИКД) позволяет выявить ишемический очаг уже через 30 мин от момента его возникновения. ИКД служит количественной характеристикой диффузии в ткани и отражает наличие внутриклеточного отека [60]. Представленные диагностические методы необходимы для выявления, определения локализации, степени тяжести повреждения мозга и прогноза. Недостатками их являются короткий временной диагностический интервал и ограниченная возможность повторного исследования [61]. В течение последних 20 лет для прогнозирования исходов церебрального повреждения у новорожденных изучается диагностическая ценность биомаркеров [62, 63]. Учитывая патофизиологические изменения, происходящие в результате повреждения ткани головного мозга, были подробно изучены нейропротеины, кальций-связывающий белок, вазоактивные вещества, маркеры окислительного стресса, медиаторы воспаления и т. д. [64—67]. Однако, несмотря на перспективность изучения биомаркеров, отсутствуют данные о практическом их применении в медицине.
Лечение гипоксических поражений головного мозга является предметом жарких дискуссий и крайних мнений — от полного отказа в необходимости лечения нейротропными препаратами до агрессивной полипрагмазии [26]. Согласно современным воззрениям гипоксически-ишемическая энцефалопатия возникает при асфиксии, как правило, в структуре полиорганных расстройств, поэтому основной принцип терапии заключается в выведении ребенка из асфиксии и поддержании витальных функций [68]. Специфическое лечение гипоксически-ишемической энцефалопатии — терапия отека головного мозга и нейропротекция, которая подразумевает в первую очередь контроль объема цереброспинальной жидкости (ЦСЖ), церебральной перфузии и объема вещества мозга. Церебральная перфузия зависит от артериального притока, венозного оттока и интенсивности метаболизма нервной ткани. На этом этапе большое значение имеет адекватность проводимой искусственной вентиляции легких и эффективность гипотермии. Необходимо отметить, что гипотермия проводится у новорожденных с гестационным возрастом не менее 36 нед при наличии по крайней мере одного из признаков, изложенных в специальных критериях [69]. Контроль объема жидкости в ЦСЖ-путях осуществляется за счет торможения выработки ЦСЖ и улучшения ее оттока. Контроль объема мозга подразумевает усиление активного транспорта и стабилизацию мембран нейронов. Следует отметить, что на данный момент применение лекарственных препаратов в неонатологии ограничено из-за высокого риска развития побочных эффектов и отсутствия доказательной базы. Однако поиск таких препаратов продолжается по настоящее время. В частности, за последние два десятилетия произошли значительные изменения в понимании роли эритропоэтина в качестве нейропротектора. Доказано, что эритропоэтин участвует в нейрогенезе и ангиогенезе во время эмбрионального развития и активируется после травмы головного мозга [70], а также оказывает цитопротективное действие на эндотелиальные, глиальные клетки и нейроны [71]. Впервые нейропротективная роль эритропоэтина была выявлена в нескольких исследованиях in vitro
и
in vivo
[72]. При этом удалось выяснить, что эритропоэтин обладает антиапоптотическим [73], антиоксидантным [74] и противовоспалительным эффектами [75]. Кроме того, он ослабляет эффекты воспаления, снижая реактивный астроцитоз и подавляя активацию микроглии, и уменьшает количество иммунных клеток в месте воспаления [76]. Известно, что отсутствие эндогенного эритропоэтина увеличивало ишемическое повреждение головного мозга и ухудшало выживаемость нейронов [77]. Установленные защитные эффекты эритропоэтина во время ишемии и реперфузии побудили использовать рекомбинантный эритропоэтин у недоношенных детей с церебральной ишемией, внутрижелудочковыми кровоизлияниями и перивентрикулярной лейкомаляцией [78]. Так, в одном из исследований оценивали эффективность и безопасность применения эритропоэтина при неонатальной гипоксически-ишемической энцефалопатии. В данное исследование были включены 167 новорожденных с умеренным и тяжелым церебральным поражением. Всех детей разделили на две группы. Дети первой группы получали стандартную терапию гипоксически-ишемической энцефалопатии, а детям второй группы к стандартной терапии был добавлен эритропоэтин в дозировке 300 и 500 ЕД/кг. Препарат вводили в первые 48 ч через день в течение 2 нед. Оказалось, что летальность и инвалидность на 19,2% чаще встречалась в группе детей, не получавших эритропоэтин [79].
Таким образом, проблема церебрального повреждения ишемического типа у недоношенных новорожденных является весьма актуальной. Прежде всего это подтверждается высокой частотой встречаемости данной патологии и большим риском летального исхода и инвалидизации детей. Остается открытым вопрос комплексной диагностики церебральных нарушений у недоношенных детей, потому как не существует единого алгоритма, объединяющего данные клинической картины, инструментальных и лабораторных методов исследования. Большой интерес представляет поиск предикторов неблагоприятного исхода с целью оптимизации лечебных подходов.
Авторы заявляют
оботсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Анурьев А.М. — https://orcid.org/0000-0002-6724-5067; e-mail
Горбачев В.И. — https://orcid.org/0000-0001-6278-9332
Как цитировать:
Анурьев А.М., Горбачев В.И. Гипоксически-ишемические поражения головного мозга у недоношенных новорожденных. Журнал неврологии и психиатрии им. С.С. Корсакова.
2019;119(8 вып. 2):63-69. https://doi.org/10.17116/jnevro201911908263
Автор, ответственный за переписку:
— Анурьев Алексей Михайлович — e-mail
Какое лечение назначают при ГИЭ?
Лучшим лечением ГИЭ являются профилактика и ранняя терапия внутриутробной гипоксии и асфиксии новорожденного. Но, несмотря на значительные успехи в профилактике осложнений родов, умеренная и тяжелая гипоксически-ишемическая энцефалопатия по-прежнему встречается с частотой 1–2 на 1000 родившихся детей. До недавнего времени медицина могла предложить таким детям лишь поддерживающую терапию дисфункции органов.
С 2010 года стандартом лечения ГИЭ стала индуцированная гипотермия. Этот метод заключается в том, что начиная с 6 часов после рождения температуру тела ребенка в течение 72 часов поддерживают на уровне 33,5 °С. К сожалению, даже после применения индуцированной гипотермии у значительного числа младенцев с ГИЭ сохраняются неврологические расстройства различной степени тяжести.
Сегодня для лечения новорожденных с ГИЭ ученые предлагают новый метод – регенеративную терапию стволовыми клетками пуповинной крови.