Причины
Эритема может иметь как физиологический, так и нефизиологический характер. В первом варианте, эритема может возникнуть как результат различных психоэмоциональных состояний или кратковременных аномальных явлений. Такого рода покраснение проходит очень быстро само по себе и не является причиной определенных нарушений в организме. Если же эритема имеет нефизиологическое происхождение, то ее можно считать отдельным заболеванием, которое сопровождается долгим покраснением кожи и наличием процесса воспаления.
Эритема может иметь множество причин развития. Это вирусы, инфекции, различные заболевания кожи и соединительных тканей, а также физиотерапевтические процедуры, которые предполагают использование источников теплового или химического действия. Также причины эритемы могут включать в себя нарушение кровообращения, аллергические реакции, регулярное трение кожи, действие холода или химических веществ.
Часто покраснения участков кожи являются следствием болезни Крона, язвенного колита и беременности. Могут спровоцировать эритему и такие медикаменты, как пенициллин, средства гормональной контрацепции (таблетки), нестероидные противовоспалительные препараты, противосудорожные и сульфаниламидные препараты.
Диагностика
Диагностику эритемы проводит врач дерматолог, дерматовенеролог или аллерголог. Диагностика эритемы включает в себя сбор анамнеза пациента, внешний осмотр, взятие соскоба с сыпи, общие анализы мочи и крови, мазок на стрептококковую инфекцию. Если эритема имеет ревматологический характер, требуется консультация врача-ревматолога, проведение рентгенографии, , МРТ.
Симптомы
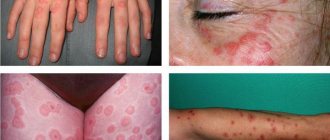
Эритему принято разделять на несколько видов. Каждый из них имеет свои специфичные симптомы, а также общие для эритемы симптомы – сыпь и покраснение.
Эритема делится на две группы – инфекционная и неинфекционная. Первая возникает на фоне различных инфекционных болезней, причинами которых становятся вирусы и другие микроорганизмы.
Инфекционная эритема Розенберга
Преимущественно ей подвержены старшие школьники и люди до 25 лет. Признаки достаточно острые: пациент может ощущать сильную лихорадку, сильную головную боль, страдать бессонницей и болями в суставах. Через несколько дней кожа может покрыться асимметричной пятнистой сыпью красного оттенка. Также эритема поражает слизистую оболочку рта. Сыпь проходит через 5–6 дней после ее появления и оставляет после себя пластинчатое шелушение кожи. Болезнь длится на протяжении 7–13 дней.
Инфекционная эритема Чамера
Возбудителем этого типа принято считать парвовирус. Обычно подвержены ей дети, а протекает она нередко без каких-либо симптомов. Если они все же имеются, то проявляются с первого дня. Это мелкая сыпь на лице, которая со временем сливается в одно крупное пятно. Также высыпания могут возникнуть на коже рук, ног, торса и со временем приобрести бледный оттенок. Нередко происходят рецидивы заболевания. В целом такая эритема проходит легко и длится не более 2-х недель.
Узловатая эритема
Основным ее симптомом является возникновение узловых подкожных воспалений, которые преимущественно находятся на передних частях нижних конечностей, на предплечьях и на бедрах. Их отличает круглая форма и заметняа припухлость, структуру они имеют плотную, а размеры их могут колебаться в рамках 1–10 см в диаметре. Эти воспаленные участки могут быть болезненными, особенно в случае механического воздействия (нажатие и т.д.). Среди прочих симптомов выделяется боль в суставах и чувство усталости.
Узловая эритема может быть симптомом более серьезного заболевания, такого как ревматизм или туберкулез, или носить самостоятельный характер. В последнем случае происхождение заболевания часто остается невыясненным, хотя часто причиной становится стрептококковая инфекция, мононукулеоз или прием противозачаточных и сульфаниламидных препаратов. Болезнь может протекать как две недели, так и полтора месяца. Со временем покраснения и припухлости спадают, а на пораженных участках могут остаться синяки, которые проходят сами по себе.
Многоформная или полиформная экссудативная эритема
Данная форма заболевания проявляется лихорадкой, головной болью, болями в суставах и неприятными ощущениями в мышцах. Через несколько дней кожа тела и конечностей может покрыться сильной сыпью, которая может провоцировать зуд и жжение. Многоформная эритема может сопровождаться образованием пузырей, наполненных экссудатом. После их разрыва может оставаться болезненная эрозия.
Еще более тяжелые формы болезни могут проявляться в виде симптома Стивенса-Джонсона, который характеризуется появлением пузырей на слизистых оболочках рта, глаз, горла, половых органов. Также может возникнуть синдром Лайелла, который сопровождается кожной сыпью, превращающейся в большие пузыри с серозно-геморрагическим содержанием. У половины пациентов при этом не удается выявить точную причину заболевания. В других ситуациях проявления такого вида заболевания, как эритема экссудативная многоформная провоцируют инфекционно-вирусные микроорганизмы – корь, герпес, скарлатина и т.д. либо прием определенных медикаментов.
Внезапная эритема
Как можно судить из названия, развивается данный вид эритемы достаточно быстро. Среди симптомов выделяется резкое повышение температуры тела с увеличением лимфоузлов под челюстью, головная боль, ломота в суставах и общая слабость. В течение четырех дней температура приходит в норму, а после этого кожа лица, конечностей и туловища покрывается пятнистой сыпью. Иногда пятна могут сливаться и превращаться в эритематозные поля.
Мигрирующая эритема
Может быть признаком болезни Лайма, которая преимущественно передается с укусом клеща, при этом причина часто остается невыясненной. Инкубационный период длится на протяжении 1–3 недель. На месте укуса возникает пятно кольцевидной формы. Оно быстро увеличивается и достигает 30 см в диаметре. Далее это кольцо может побледнеть и пропасть вовсе. Болезнь может продолжаться от 2 недель до пары месяцев. Эритема кольцевидная не поддается лечению и со временем проходит самостоятельно. Особую опасность такой вид представляет для беременной женщины и ее малыша.
Если говорить о второй, неинфекционной форме эритем, то сюда относят заболевания, которые появляются как реакция на определенный раздражитель, либо как проявление аллергии. Сюда относят следующие виды патологий:
Рентгентовская эритема
Она проявляется воспалением кожных покровов и характеризуется сыпью в ответ на длительное или многократное действие волн рентгеновского излучения. Данный вид эритемы проявляется на облученном участке кожи ярко выраженным красным пятном, возникающим примерно через 7 дней после облучения. Такое пятно держится 10 дней, после чего темнеет и приобретает коричневатый оттенок. Также на месте поражения может появиться шелушение.
Инфракрасная или тепловая эритема
Проявляется по причине продолжительного либо регулярного влияния тепла, которого недостаточно для полноценного ожога. Проявляется как выступление на покрове кожи сетчатой или пигментной сыпи.
Стойкая возвышающая эритема
Является признаком аллергического васкулита. У болезни есть две формы: симптоматическая, проявляющаяся как побочное действие, то есть как аллергия на прием определенных медикаментов, либо на фоне полиартрита, и идиоматическая, которая связана с наследственной этиологией, и проявляется узелковой сыпью фиолетового тона.
В структуре группы фигурных эритем одно из значимых мест занимает мигрирующая эритема Афцелиуса—Липшютца (МЭ), являющаяся патогномоничным признаком Лайм-боррелиоза, широко распространенного трансмиссивного заболевания практически на всех континентах. В Российской Федерации ежегодно количество заболевших клещевыми боррелиозами колеблется от 7 до 9 тыс. [7, 8]. В 2011 г. частота заболеваемости иксодовым клещевым боррелиозом составила 7,02 на 100 тыс. населения [4]. В последние десятилетия отмечается рост частоты тяжелых, хронических, торпидных форм болезни Лайма (БЛ) [7, 8, 24, 45].
МЭ относится к ранней кожной манифестации БЛ, проявлением воспалительно-аллергической реакции кожи на присасывание клеща, наблюдающейся у 50—80% больных, а при существовании более 4 нед может быть отнесена к хронической. Иксодовый клещевой боррелиоз (БЛ) — природно-очаговое трансмиссивное инфекционное заболевание, которое было впервые описано в Европе, в том числе и в России, еще в конце XIX века [5, 27, 48]. В начале ХХ века (1908) шведский врач-дерматолог Арвид Афзелиус [10] установил взаимосвязь между появлением на коже кольцевидной МЭ («эритема Афзелиуса», «мигрирующий дерматит») и присасыванием клеща. Современное название было дано исследователем Липшютцем в 1913 г. [37]. В 1975 г. в США, в городке Лайм, впервые были описаны случаи клещевого боррелиоза у группы детей в сочетании с кольцевидной МЭ после присасывания клеща [39, 41]. До начала 80-х годов XX века БЛ и хроническая МЭ рассматривались как два самостоятельных заболевания с неясной этиологией. В 1982 г. американский микробиолог Вилли Бургдорфер [19] впервые выделил и идентифицировал неизвестные ранее спирохетоподобные микроорганизмы из клещей Ixodes dammini
(современное название —
Ixodes scapularis
). Позднее эти микроорганизмы были выделены из крови, биоптатов кожи, спинномозговой жидкости больных людей [13, 16, 40]. Возбудители Б.Л. относятся к порядку
Spirochaetales
, семейству
Spirochaetaceae
, роду
Borrelia
. Для Евразии наиболее важное эпидемиологическое значение в развитии БЛ имеют клещи
Ixodesricinus
и
Ixodespersulcatus
, в США —
I.scapularis
. Боррелии попадают в организм человека со слюной клеща. На коже в месте его присасывания развивается кольцевидная МЭ. С током лимфы и крови возбудитель попадает во внутренние органы. Под воздействием факторов неспецифической защиты макроорганизма часть боррелий погибает, выделяя эндотоксин, который запускает каскад иммунопатологических реакций [34]. В настоящее время доказана патогенность 3 видов
B.burgdorferisensulato:B.burgdorferisensustricto,B.garinii
и
B.afzelii
. Патогенные для человека виды боррелий комплекса
B. burgdorferi sensu lato
адаптировались в процессе эволюции к выживанию в различных биологических объектах окружающей среды: в клещах и их «прокормителях» — позвоночных животных, что достигается за счет функционирования различных регуляторных генов, изменяющих уровень экспрессии ряда белков на протяжении жизненного цикла [12, 29, 48]. Боррелии имеют группы антигенов: поверхностные (OspA, OspB, OspD, OspE и OspF), жгутиковый и цитоплазматический. Поверхностные антигены характеризуются вариабельностью. Белки внешней оболочки определяют видовую принадлежность возбудителя и являются основными иммуногенами.
Инкубационный период составляет 3—30 дней (в среднем 7 дней). Способность боррелий к самостоятельным поступательным движениям в тканях находит свое отражение в особенностях местного воспаления. В центре эритемы (в месте первоначального накопления возбудителя) боррелии подвергаются активному воздействию факторов воспаления, они теряют свою подвижность и их количество уменьшается, результатом чего является формирование в центре эритемы зоны просветления. Появление новых колец гиперемии связано с новыми генерациями боррелий и обычно приводит к развитию характерной МЭ.
Патогистологическая картина в ранние сроки развития МЭ (первые 15 сут) характеризуется признаками экссудативно-продуктивного воспаления и представлена субэпидермальными и подроговыми пузырями, характерными для центральных участков эритемы. В эпидермисе отмечается гиперкератоз, гидропическая дистрофия эпителиоцитов базального слоя, редко — койлоцитоз. В сосочковом слое дермы наблюдают выраженный отек, перикапилляриты и интерстициальные полосовидные клеточные инфильтраты, состоящие из лимфоидных и небольшого количества плазматических клеток, гистиоцитов, эозинофилов, редко нейтрофилов. В капиллярах выявляется стаз, редко — эритроцитарные тромбы. В периферических участках эритемы обнаруживаются гидропическая дистрофия эпителия шиповатого слоя и перикапилляриты в сосочковом слое дермы. Там же выявляются разной степени выраженности диффузные или очаговые клеточные инфильтраты. В центральных участках эритемы в более поздние сроки (15—40 дней) выявляют наличие перикапилляритов и фиброзирование стенок сосудов, редко — гидропическую дистрофию эпителиоцитов [9, 23].
Дифференциальную диагностику МЭ необходимо проводить прежде всего с другими фигурными эритемами: кольцевидной центробежной эритемой Дарье, ревматической эритемой Лендорфа—Лейнера, фигурной персистирующей эритемой, нейтрофильной эритемой, эозинофильной кольцевидной эритемой, извилистой ползучей эритемой Гаммела. Проблема дифференциальной диагностики МЭ также обусловлена многообразием неспецифических экзантематозных высыпаний фигурных очертаний, чаще вызванных вирусными инфекциями. Дифференциальный диагноз МЭ в виде гомогенного очага следует проводить с эритемной формой рожистого воспаления, пятнистой формой токсидермии, в том числе с фиксированной эритемой, с реакцией на укусы насекомых, кольцевидной гранулемой, микробной экземой и другими дерматозами, проявляющимися очагами кольцевидной формы.
Прогноз при МЭ обычно благоприятный. МЭ регрессирует спонтанно (как правило, в течение 1—2 мес), но может длительно персистировать от 6 до 12 мес [30]. Терапия Б.Л. наиболее эффективна на ранних стадиях инфекции, благоприятный исход заболевания и выздоровление зависят от своевременности начатого этиотропного лечения. Поэтому М.Э. требует проведения этиотропной терапии. Терапия М.Э., как и других проявлений БЛ, включает назначение антибиотиков. Препаратом первой линии являются доксициклин и цефуроксим, может применяться амоксициллин и эритромицин. Амоксициллин может стать препаратом выбора при лечении детей и беременных. Длительность антибактериальной терапии составляет обычно 14—21 день. Однако исследование показало одинаковую высокую эффективность применения 10- и 20-дневного курса терапии доксициклином М.Э. Эффективность антимикробной профилактики с использованием доксициклина в дозе 200 мг однократно в первые 72 ч после присасывания клеща спорна [33]. Хороший эффект был получен в результате применения в терапии МЭ азитромицина по схеме 1000 мг в 1-й день и по 500 мг ежедневно в течение последующих 4 дней [15]. Парентеральное введение цефтриаксона в суточной дозе 2 г или пенициллина G IV по 18—24 млн МЕ ежедневно в течение 10—14 дней может применяться в случаях множественной МЭ и у пациентов с иммунодефицитом [31]. Антибактериальная терапия на I стадии инфекции значительно снижает вероятность развития неврологических, кардиальных и артралгических осложнений, способствует исчезновению эритемы в более короткий срок, а главное, предотвращает развитие поздних стадий БЛ [20, 47].
С целью профилактики БЛ применяют вакцины, содержащие антитела против поверхностного липопротеина, А спирохет — OspA (Lymerix), эффективность которых составляет 70—80% [42]. Однако накопились данные о неблагоприятном воздействии вакцинации и наличии поствакцинальных осложнений, обусловленных артритогенным потенциалом липопротеина OspA. В настоящее время исследователи [44] акцентируют внимание на потенциальных антигенах для второй генерации вакцин (OspC, DbpA, OspB, p35, p37, p66).
Несмотря на мощную антибиотикотерапию МЭ с длительным курсом и относительно большими разовыми дозами, формирование хронических форм инфекции наступает у 3,5—30% больных. При лечении хронических форм БЛ эффективность этиотропной терапии снижается и составляет 43,2—48,7% [6].
При изучении патогенеза заболевания у больных Лайм-боррелиозом были получены данные о том, что липопротеины боррелий, в частности OspA, являются потенциальными активаторами воспалительной реакции за счет связывания с CD14 и TLR2 на макрофагах [11]. Активация рецепторов TLR2, TLR6, TLR½, TLR5, TLR9 приводит к секреции провоспалительных цитокинов [46]. Димеры рецепторов TLR2/TLR6, TLR2/TLR1 через распознавание триацилированных липопротеинов, таких как Borrelia
burgdorferi
OspA, флагеллина, пептидогликанов и зимозана, участвуют в активации ядерного транскрипционного фактора NfkB [25, 28, 35]. J. Salazar и соавт. [36] в ходе исследования периферической крови и аспиратов у пациентов с МЭ также обнаружили высокую экспрессию TLR2, TLR1 и TLR4 на поверхности моноцитов, макрофагов, дендритных клетках. При развитии МЭ продукция флагеллина способствует выраженной экспрессии TLR5 и усилению функциональной активности TLR5 на человеческих кератиноцитах. Выявлено, что мононуклеарные лейкоциты периферической крови по действием
Borrelia
снижают уровни TLR2 и TLR4 мРНК, в то время как экспрессия соответствующих белков на моноцитах не снижается [22]. В результате проведения экспериментальных работ выявлено, что у мышей, дефицитных по TLR2 или TLR1, отмечались низкие уровни антител к OspA после вакцинации, что указывает на нарушение кооперации и функционирования эффекторов адаптивного иммунитета [17]. В ходе экспериментальной работы на мышиной модели иксодового клещевого боррелиоза выявлено, что с 14-го дня развития инфекции стимуляция антигеном DbpA увеличивала количество Т-лимфоцитов, несущих TLR2-рецепторы: количество CD4+ увеличивалось в 2,3—7 раз, CD8+ — в 2,2—5,6 раза. В 1-ю неделю после заражения доля CD4+, синтезирующих IFN-γ клеток, увеличивалась в 2,5 раза, но через 14 дней снижалась до нормального уровня. Субпопуляция CD4+ продуцирующих TNF-α увеличивалась на 7-е сутки, однако нормализация их уровня происходила к 30-м суткам. В ходе развития заболевания отмечалось увеличение субпопуляции Тh2, синтезирующих IL-4, и уменьшение субпопуляции Тh1, синтезирующих IFN-γ [3].
Получены данные о высокой спонтанной и антиген-стимулированной продукции IL-2, повышении спонтанной и угнетении индуцированной продукции IFN-γ у больных хронической БЛ, при высоком уровне спонтанной продукции IL-4 и индуцированной продукции TGF-β, что свидетельствует о вовлечении в иммунную регуляцию механизмов, ограничивающих функциональную активность Thl-клеток. По мнению авторов [4, 34], полученные данные могут указывать на формирование хронического специфического воспаления по типу гиперчувствительности замедленного типа (ГЗТ), характерного для хронического инфекционного процесса с внутриклеточной локализацией. При Б.Л. развивается Th1-опосредованный иммунный ответ с высоким уровнем продукции IFN-γ. При изучении фагоцитоза у больных БЛ выявили повышение фагоцитарного индекса при острой форме заболевания по сравнению с хронической формой [1]. В ряде исследований показано, что при хроническом течении БЛ отмечаются снижение функциональной активности нейтрофилов по сравнению с группой здоровых лиц, снижение количества CD3+, CD4+, CD22+ клеток, NK-клеток CD16+, на фоне повышения CD8+, сывороточных иммуноглобулинов классов IgG, IgM, IgA, циркулирующих иммунных комплексов (ЦИК). Выявленные нарушения в системе иммунитета у больных хроническим БЛ свидетельствуют, по мнению авторов, о снижении активности механизмов неспецифической резистентности организма, что может создавать условия для длительной персистенции возбудителя. Недостаточность CD22+ клеток и повышение уровня ЦИК создает условия к развитию аутоиммунной патологии [2, 4]. Клетки крови больных персистирующим БЛ высвобождают низкие уровни провоспалительных цитокинов TNF-α и IFN-γ. Однако мнения авторов по этому вопросу неоднозначны. Имеются исследования, в которых приведены противоположные результаты. Липопротеины боррелий, в частности, OspA, являются потенциальными активаторами воспалительной реакции за счет связывания с CD14+ и Toll-подобным рецептором-2 (TLR2) на макрофагах. В результате этого усиливается секреция провоспалительных цитокинов (IL-1b, IL-6, IL-10, IL-12) и TNF-α [22, 36, 46].
При изучении влияния B. burgdorferi
на моноциты человека показана индукция экспрессии TLRs и продукция про- и противовоспалительных цитокинов (TNF-α, IL-6, IL-10 и IL-1β), эпителиального IL-8, а также IFN-β. В свою очередь TGF-β в комбинации с IL-6 индуцирует синтез провоспалительных цитокинов IL-1β и TNF-α [18, 43]. Предполагают, что OspA
B. burgdorferi
может участвовать в запуске аутоиммунного воспаления и провоцировать развитие Лайм-артрита через дифференциацию Th-клеток, которые экспрессируют IL-17. В эксперименте на
B. burgdorferi
-вакцинированных мышах также было показано, что ключевую роль в развитии артрита играет IL-17. Более того, IL-17 может стимулировать фибробласты и синовиоциты к продукции провоспалительных цитокинов, включая IL-6 [21]. Индукция IL-17 в зоне МЭ приводит к уменьшению количества положительных эпидермальных клеток Лангерганса (CD1a), обеспечивающих «захват» боррелий на ранних стадиях инфекции, способствуя тем самым хронизации инфекционного процесса [14]. В развитии Лайм-артрита ведущую роль традиционно ранее приписывали Th1-цитокинам, таким как IFN-γ, однако в ходе недавно проведенных исследований было выявлено, что OspA
B. burgdorferi
может участвовать в запуске аутоиммунного воспаления и провоцировать развитие артрита через дифференциацию Th-клеток, экспрессирующих IL-17 [26, 38]. Кроме того, в исследовании показано, что IFN-γ не только не индуцирует синтез анти-OspA антител, но и играет важную роль в супрессии продукции антиборрелиозных антител, что может стать обоснованием разработки высокоэффективных вакцин [32].
По субпопуляционному составу лимфоцитов периферической крови при острой и хронической формах БЛ различий не было выявлено [1]. При Лайм-боррелиозе гуморальный иммунитет характеризуется преимущественным синтезом IgG1 и IgG3 субклассов антител, участвующих в активации комплемента и процессе опсонизации боррелий. Продукция иммуноглобулинов подкласса IgG2 незначительна, а IgG4 — отсутствует [8].
Таким образом, на современном этапе МЭ, являясь наиболее распространенной нозологической формой в группе фигурных эритем и патогномоничным признаком ранней стадии часто встречаемого трансмиссивного заболевания — БЛ, характеризуется торпидным хроническим течением и сопровождается нарушениями в системе врожденного и адаптивного иммунитета. Развитие М.Э. при БЛ происходит на фоне недостаточности клеточных и/или гуморальных факторов неспецифической резистентности организма, что определяет необходимость своевременного проведения этиотропной терапии и направленность патогенетической терапии ранней стадии БЛ с целью предотвращения развития тяжелых торпидных форм.
Конфликт интересов отсутствует.
Лечение
Курс лечения при эритеме зависит от степени поражения кожи и индивидуальных особенностей кожи пациента. Прежде всего, необходима санация очагов инфекций, отказ от физического воздействия, которое может поразить кожу (массаж, солнечные ванны и т.д.), устранение контактов покрова кожи и химических раздражителей.
При заболевании эритема лечение должно включать в себя примем антибиотиков, кортикостероидных препаратов, йодистых щелочей, агниопротекторов, которые улучшают реологические свойства и микроциркуляцию крови, а также дезагрегантов, гемокинаторов, адаптогенов и специальных препаратов, которые укрепляют стенки сосудов. При местной терапии используются окклюзионные повязки с кортикостероидной и бутадиеновой мазью и аппликациями димексида.
Больному эритемой нужно соблюдать постельный режим, особенно тогда, когда эритематозные очаги сосредоточены на ногах. Также очень полезна гимнастика, которая помогает улучшить кровообращение. Специалисты советуют придерживаться здорового рациона, в который не входит жареная, соленая и копченая пища, консерванты, алкоголь, крепкий кофе и чай, шоколад. Также лучше исключить факторы, которые могут стать причиной рецидива: длительная ходьба или стояние, курение, воздействие низких температур, подъемы тяжестей.