Специализация: эндокринология
Л. П. Слепцова, эндокринолог высшей категории, клиника лечения бесплодия OXY-center, Краснодар
Вагинальная атрофия – симптом постменопаузы, характеризующийся эстрогендефицитным состоянием у женщин. Урогенитальный тракт особенно чувствителен к снижению уровня эстрогенов. 27–55% всех женщин в постменопаузе испытывают симптомы, связанные с урогенитальной атрофией (уга), затрагивающей половую функцию и качество жизни.
В клинической картине урогенитальных расстройств в климактерическом периоде выделяют симптомы, связанные с вагинальной атрофией, а также расстройства с мочеиспусканием (цистоуретральная атрофия). Если вазомоторные симптомы проходят со временем, признаки вагинальной атрофии прогрессируют. У 40–57% женщин отмечается сухость влагалища, жжение и зуд, диспареуния, кровотечения, недержание мочи, инфекции органов малого таза.
Стенки влагалища состоят из трех слоев: внутреннего, среднего мышечного и наружного соединительнотканного. Атрофические процессы захватывают мышечные и соединительнотканные структуры, а также мышцы тазового дна, уретры, мочевого пузыря. Особенно выражены они в слизистой влагалища, которая состоит из 4 основных слоев эпителиальных клеток: базального, парабазального (митотически активного), промежуточного гликогенсодержащего и поверхностного слущивающегося. Эстрогеновые рецепторы в основном располагаются в базальном и парабазальном слоях и практически отсутствуют в промежуточном и поверхностном. Дефицит эстрогенов блокирует митотическую активность базального и парабазального слоев эпителия, пролиферацию влагалищного эпителия. Следствием прекращения пролиферативных процессов являются исчезновение гликогена – питательной среды для лактобактерий, полное выведение лактобацилл, которые играют ключевую роль в предотвращении заболеваний урогенитального тракта. Вследствие расщепления гликогена при условии достаточного количества эстрогенов образуется молочная кислота, обеспечивающая кислую среду в пределах колебаний РН от 3,8 до 4,4. Подобный механизм приводит к подавлению роста патогенных и условно-патогенных бактерий. В период постменопаузы слизистая оболочка утрачивает защитные свойства, истончается, легко травмируется с последующим инфицированием.
Атрофия слизистой вульвы и влагалища характеризуется истончением, уменьшением вагинальной складчатости, побледнением, наличием петехиальных кровоизлияний, признаков воспаления, а также происходит потеря упругости тканей, подкожно-жировой клетчатки, выпадение лобковых волос, снижение секреторной активности бартолиниевых желез. Как правило, врачи диагностируют вагинальную атрофию на основании сочетания клинических симптомов, визуального осмотра и субъективных жалоб пациентки.
Для диагностики и оценки эффективности лечения вагинальной атрофии необходимо: РН и подсчет вагинального индекса созревания (ВИС, преобладание клеток базального и парабазального слоев), мультистероидный профиль крови.
1.Общие сведения
Вульвовагинальная дистрофия (ВВА) – процесс возрастного гистоморфологического перерождения тканей влагалища и гениталий, вследствие чего эти отделы женской репродуктивной системы постепенно утрачивают свои природные свойства и функции: иссушаются, сокращаются в размерах, меняются в пропорциях и т.п.
Неоднократно проводились масштабные, в т.ч. международные, опросы и исследования данной проблемы. Результаты свидетельствуют о том, что ВВА в той или иной степени (как клинически сформированный синдром или как отдельные проявления) распространена с частотой 45-60% среди женщин в постменопаузальном периоде.
Практически все респондентки отмечают в этой связи существенное снижение качества жизни, – особенно в психосексуальной сфере, семейных отношениях, самооценке, области субъективного физиологического комфорта. При этом до 80% женщин стесняются, считают ненужным или бесполезным обсуждать проблему со своим гинекологом; менее 40% обладают достаточной информацией о сути происходящих изменений.
Таким образом, проблема вульвовагинальной дистрофии является острой и актуальной даже в наиболее развитых странах мира.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
Вагинальная атрофия: этиологические аспекты и современные подходы к терапии
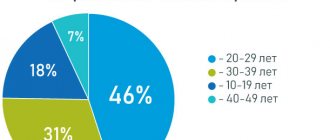
Постменопауза характеризуется эстрогендефицитным состоянием у женщин, обусловленным возрастным снижением, а затем и прекращением функции яичников [1]. Как известно, любые эпителиальные ткани реагируют на изменение окружающей их гормональной среды сходным образом, но ни одна из них не может сравниться с эпителием свода влагалища и шейки матки по скорости и отчетливости реакции на гормоны, в первую очередь на половые стероиды [2]. Таким образом, урогенитальный тракт особенно чувствителен к снижению уровня эстрогенов и около половины всех женщин в постменопаузе испытывают симптомы, связанные с урогенитальной атрофией (УГА), затрагивающие половую функцию и качество жизни [3]. В клинической картине урогенитальных расстройств в климактерическом периоде выделяют симптомы, связанные с атрофией влагалища (вагинальная атрофия (ВА)), и расстройства мочеиспускания (цистоуретральная атрофия). В отличие от вазомоторных симптомов, которые обычно проходят со временем, симптомы вагинальной атрофии, как правило, возникают в пременопаузе и прогрессируют в постменопаузальном периоде, приводя к функциональным и анатомическим изменениям [4]. У 15% женщин в пременопаузе и 40–57% женщин в постменопаузе отмечаются симптомы ВА [5], такие как сухость влагалища 27–55%, жжение и зуд 18%, диспареуния 33–41%, а также повышенная восприимчивость к инфекционным заболеваниям органов малого таза 6–8% [4], что значительно ухудшает состояние здоровья, негативно влияет на общее и сексуальное качество жизни [6]. У 41% женщин в возрасте 50–79 лет есть хотя бы один из симптомов ВА [10].
Стенки влагалища состоят из трех слоев: внутреннего слоя, который выстлан многослойным плоским эпителием; среднего мышечного и наружного соединительнотканного слоев (или волокнистого слоя). Атрофические процессы, захватывающие соединительнотканные и мышечные структуры влагалища, а также мышцы тазового дна, уретры, мочевого пузыря, особенно выражены в слизистой влагалища. Известно, что у женщин слизистая оболочка влагалища состоит из четырех основных слоев эпителиальных клеток: базальный слой; парабазальный слой (или митотически-активный); промежуточный гликогенсодержащий слой; поверхностный (слущивающийся) [11]. Эстрогеновые рецепторы располагаются в основном в базальном и парабазальном слоях влагалища и практически отсутствуют в промежуточном и поверхностном [10]. Дефицит эстрогенов блокирует митотическую активность базального и парабазального слоев эпителия влагалищной стенки, а следовательно, и пролиферацию влагалищного эпителия [12]. Следствием прекращения пролиферативных процессов во влагалищном эпителии является исчезновение гликогена — питательной среды для лактобактерий, таким образом из влагалищного биотопа полностью элиминируется его основной компонент — лактобациллы [3, 12].
Известно, что перекись-продуцирующие лактобациллы, преобладающие в микробиоцинозе влагалища у женщин репродуктивного возраста, играют ключевую роль в предотвращении появления заболеваний урогенитального тракта [10, 11]. Вследствие расщепления гликогена, который образуется в эпителии влагалища при условии наличия достаточного количества эстрогенов, образуется молочная кислота, обеспечивающая кислую среду влагалища (в пределах колебаний рН от 3,8 до 4,4). Подобный защитный механизм приводит к подавлению роста патогенных и условно-патогенных бактерий. В период постменопаузы слизистая оболочка влагалища утрачивает эти защитные свойства, истончается, легко травмируется с последующим инфицированием не только патогенными, но и условно-патогенными микроорганизмами.
Эстрогены являются главными регуляторами физиологических процессов во влагалище. Эстрогеновые рецепторы α присутствует во влагалище в пременопаузе и постменопаузе, в то время как эстрогеновые рецепторы β полностью отсутствуют или имеют низкую экспрессию в вагинальной стенке у женщин в постменопаузе. Наиболее высокая плотность эстрогеновых рецепторов наблюдается во влагалище и уменьшается по направлению от внутренних половых органов к коже. Плотность андрогеновых рецепторов, наоборот, низкая во влагалище и более высокая в области наружных половых органов. Рецепторы прогестерона встречаются только во влагалище и эпителии вульвовагинального перехода [10]. Поскольку в клетках стромы влагалища содержатся рецепторы к эстрогенам, то коллаген, входящий в состав соединительной ткани влагалищной стенки, является эстроген-чувствительной структурой, содержание которого уменьшается по мере прогрессирования эстрогенного дефицита. Так как рецепторы к эстрогенам располагаются не только в эпителии и строме влагалищной стенки, но и в эндотелии сосудов, в постменопаузе отмечается снижение кровообращения во влагалище до уровня различной степени ишемии. К тому же эстрогены являются вазоактивными гормонами, которые увеличивают приток крови, стимулируя высвобождение эндотелиальных медиаторов, таких как оксид азота, простагландины и фактор гиперполяризации эндотелия. Подобное прогрессирующее снижение кровотока в слизистой влагалища приводит к гиалинизации коллагеновых и фрагментации эластических волокон, увеличивая количество соединительной ткани [12].
Эстрогеновые рецепторы были также обнаружены на вегетативных и сенсорных нейронах во влагалище и вульве. В исследовании T. L. Griebling, Z. Liao, P. G. Smith было выявлено уменьшение плотности сенсорных ноцицептивных нейронов во влагалище на фоне лечения эстрогенами. Эта особенность может быть полезна в целях устранения дискомфорта, связанного с ВА, а именно в облегчении симптомов, таких как жжение, зуд и диспареуния, с которыми сталкиваются многие женщины в постменопаузе [5, 10].
Атрофия слизистой вульвы и влагалища характеризуется истончением эпителия, уменьшением вагинальной складчатости, побледнением, наличием петехиальных кровоизлияний, признаков воспаления. Также вследствие инволютивных изменений происходит потеря упругости тканей, подкожно-жировой клетчатки и выпадение лобковых волос, снижение секреторной активности бартолиниевых желез [3, 13, 14]. Как правило, врачи диагностируют атрофию вульвы и влагалища на основании сочетания клинических симптомов и визуального осмотра. Исследователи все чаще настаивают на более объективных и воспроизводимых способах диагностики, не исключая субъективные жалобы пациента [13]. Исторически сложилось, что для диагностики ВА необходимы два основных объективных способа диагностики и оценки эффективности лечения: рН влагалища, а также подсчет вагинального индекса созревания (ВИС, преобладание клеток базального и парабазального слоев) [12, 13]. Интересно, что степень атрофических изменений, измеряемая индексом созревания, не всегда коррелирует с симптомами [15]. В исследовании, проведенном среди 135 менопаузальных женщин-добровольцев, которые прошли оценку симптомов, а затем рейтинг «вагинального здоровья» (оценка цвета влагалища, выделений, целостности и толщины эпителия, рН) и измерение индекса созревания, исследователи обнаружили слабую корреляцию между физическими проявлениями и индексом созревания.
Гормональные изменения, происходящие в течение жизненного цикла, оказывают влияние на вагинальную флору начиная от момента рождения до периода постменопаузы. Снижение эстрогенов в перименопаузе и постменопаузе приводит к уменьшению количества лактобактерий и изменению флоры в целом. Согласно данным S. L. Hillier, R. J. Lau, при детальном анализе микрофлоры влагалища 73 женщин в постменопаузе, не принимавших гормональную терапию, в 49% случаев не было выявлено лактобацилл. А среди тех, у которых они обнаруживались, концентрация последних была в 10–100 раз меньше, чем у женщин в пременопаузе [15]. В постменопаузе наиболее распространенными микроорганизмами являлись анаэробные грамотрицательные палочки и грамположительные кокки.
Несмотря на вышесказанное, у некоторых женщин симптомы атрофии прогрессируют вскоре после наступления менопаузы, а у других они не возникают даже в более поздние годы. Среди факторов, которые могут увеличить риск развития урогенитальной атрофии, курение является одним из наиболее изученных. Курение оказывает прямое воздействие на плоскоклеточный эпителий влагалища, снижает биодоступность эстрогена и уменьшает перфузию крови. Другими гормональными факторами, которые, как правило, имеют значение, являются уровни различных андрогенов, таких как тестостерон и андростендион. Предполагают, что после менопаузы у женщин с более высоким уровнем андрогенов, которые поддерживают сексуальную активность, отмечено меньше изменений, связанных с атрофией [12]. Кроме того, ВА наблюдается чаще у женщин, которые никогда не рожали через естественные половые пути [16].
Принимая во внимание патогенез заболевания, терапия эстрогенами является золотым стандартом лечения. Все клинические рекомендации по лечению УГА сходятся во мнении, что наиболее распространенным и эффективным методом лечения является системная или локальная гормональная терапия эстрогенами в различных формах, так как она достаточно быстро улучшает индекс созревания и толщину слизистой оболочки влагалища, снижает рН влагалища и устраняет симптомы ВА [3, 11–13]. Для лечения УГА, сочетающейся с симптомами климактерия, используют системную гормональную терапию. В остальных случаях отдают предпочтение местному лечению, которое позволяет избежать большинства системных побочных эффектов [12, 13]. Исследования показали, что системная заместительная гормональная терапия устраняет симптомы ВА в 75% случаев, в то время как локальная терапия — в 80–90%.
Эстрогенсодержащие препараты для локального применения, представленные в форме крема, таблеток, пессариев/суппозиториев, вагинального кольца, могут содержать эстриол, конъюгированные эквинэстрогены, эстрадиол или эстрон. Из трех природных эстрогенов человеческого организма эстриол имеет самый короткий период полувыведения и наименьшую биологическую активность. В России имеется многолетний опыт локального применения эстриолсодержащих препаратов, обладающих выраженным кольпотропным эффектом. Учитывая слабое пролиферативное действие на эндометрий при использовании эстриола, дополнительное введение прогестагена не требуется. Многочисленные исследования показали, что ежедневное применение эстриола в дозе 0,5 мг оказывает заметный пролиферативный эффект на эпителий влагалища. Локальное применение эстриолсодержащих препаратов является безопасным и эффективным подходом к предотвращению и лечению ВА, не имеющим ограничений по возрастному аспекту и длительности лечения. В настоящее время в европейских странах отмечается тенденция к локальному использованию низких доз для эстрогенов эстриола и эстрадиола.
В 2006 г. в Кокрановском систематическом обзоре были проанализированы 19 клинических испытаний, в которых приняли участие 4162 женщины в постменопаузе, распределенные по группам, в зависимости от принимаемого вагинально препарата с эстрогенами, а конечной точкой в исследовании была оценка эффективности, безопасности и приемлемости терапии. Четырнадцать исследований сравнивали безопасность различных препаратов, семь акцентировали внимание на побочных эффектах и четыре на безопасности лечения и воздействии на эндометрий. Семь исследований включали плацебо-группы, и во всех показано улучшение состояния пациентов, принимающих гормональную терапию (табл.).
Результаты анализа показывают, что вагинальные таблетки с эстрадиолом более эффективны по сравнению с вагинальным кольцом и что оба варианта лечения превосходят плацебо в устранении диспареунии, сухости и зуда во влагалище. Вагинальный крем с конъюгированными лошадиными эстрогенами (КЛЭ) превосходит увлажняющие кремы в устранении сухости, повышении эластичности и объема кровотока во влагалище. Однако не было обнаружено никаких различий между тремя проанализированными препаратами терапии (крем с КЛЭ, таблетки с эстрадиолом и эстрадиол-рилизинг-кольцо) по отношению к количеству парабазальных клеток, кариопикнотическому индексу, индексу созревания и вагинальному индексу здоровья. К тому же также сообщаются данные об отсутствии значительных различий в толщине эндометрия, гиперплазии и количестве побочных эффектов между вагинальным кольцом, кремом или таблетками. Тем не менее, незначительный риск вагинальных кровотечений был описан во всех исследованиях, в которых применялись различные методы местной терапии эстрогенами, а также возможное увеличение риска развития кандидоза [16].
В результате метаанализа, проведенного Cardozo и соавт., показано, что вагинальный путь введения эстрогенов является эффективным методом лечения ВА. Комбинация местной и системной терапии позволяет достичь результатов в более сжатые сроки. Кроме того, низкие дозы местных эстрогенов: эстрадиола или эстриола так же эффективны, как и при системном введении. Было показано, что трансдермальный пластырь с ежедневной дозой в 14 мкг эстрадиола обладает аналогичным воздействием на рН влагалища и на индекс созревания, как и вагинальное кольцо с 7,5 мкг эстрадиола [17].
Положительный терапевтический эффект местной гормональной терапии был также отмечен в ситуациях, выходящих за рамки лечения ВА, а именно таких, как снижение риска рецидивирующих инфекций мочевыводящих путей и развития гиперактивного мочевого пузыря. С учетом вышеизложенного, эстрадиол-рилизинг-кольцо было одобрено в качестве лечения дизурии и ургентного недержания мочи. В то время как системная гормональная терапия, наоборот, увеличивает процент возникновения стрессового недержания мочи и почечных камней [10].
Таким образом, местная терапия имеет ряд преимуществ по сравнения с системным введением препаратов. Она позволяет избежать первичный метаболизм в печени, минимально воздействует на эндометрий, имеет низкую гормональную нагрузку, минимальные побочные эффекты, не требует добавления прогестагенов, оказывает в основном локальный эффект.
С практической точки зрения и в связи с аналогичной эффективностью и безопасностью всех местных препаратов с эстрогенами, пациентка должна иметь возможность выбрать препарат, который она считает наиболее подходящим для нее. Она должна быть проинформирована о том, что эффект достигается после одного-трех месяцев лечения. Дополнительное назначение прогестагенов не является обязательным при использовании локальных форм эстрогенов [18]. В обзоре за 2009 г., посвященном местной гормональной терапии, говорится, что ни в одном исследовании не наблюдали пролиферацию эндометрия после 6–24 месяцев использования эстрогенов, так что литература, таким образом, дает уверенность относительно безопасности малых доз вагинальных препаратов с эстрогенами и не поддерживает одновременное применение системных прогестагенов для защиты эндометрия [13].
Помимо перечисленных выше методов лечения ВА на сегодняшний момент существуют такие, как терапия с использованием дегидроэпиандростерона, селективных тканевых эстрогеновых комплексов, селективных модуляторов эстрогеновых рецепторов и негормональные методы лечения, а также комбинированные препараты, содержащие ультранизкодозированный эстриол и лактобактерии.
В работе U. Jaisamrarn и соавт. впервые оценивалась эффективность и переносимость ультранизких доз эстриола (0,03 мг) в сочетании с жизнеспособными Lactobacillus acidophilus в краткосрочной и долгосрочной перспективе лечения симптомов ВА. Было выявлено, что комбинация эстриола и лактобактерий в течение 12 недель была достаточна для достижения статистически и клинически значимых результатов, включающих улучшение объективных параметров (ВИС, рН, доля латобактерий в микрофлоре влагалища), а также качество жизни женщин [19].
Большое количество публикаций посвящается использованию интравагинального геля дегидроэпиандростерона (DHEA) для лечения ВА [8]. DHEA является предшественником половых гормонов, который в дополнение к тестостерону и эстрогенам производится надпочечниками и яичниками. В дальнейшем он подвергается биотрансформации в периферических тканях: в головном мозге, костях, молочных железах и яичниках. На сегодняшний день специфические рецепторы DHEA не найдены, в связи с чем существует предположение, что его действие происходит путем конвертации в андрогены и/или эстрогены и взаимодействия с их рецепторами соответственно. На сегодняшний день большая часть данных благотворного влияния DHEA, введенного вагинально, приведенных в пяти публикациях, взяты из одного рандомизированного исследования, проведенного Labrie и его коллегами. DHEA использовали вагинально 218 женщин в постменопаузе в течение 12 недель. Женщины были распределены по группам: плацебо, принимающие 0,25% (3,25 мг), 0,5% (6,5 мг) или 1,0% (13 мг) вагинальный крем ежедневно. У пациенток, получавших терапию DHEA, вагинальная атрофия исчезла, в то время как наблюдались минимальные изменения уровней стероидных гормонов в сыворотке крови, которые оставались в пределах нормального диапазона, характерного для постменопаузы. Также в данном исследовании было отмечено положительное влияние на четыре аспекта сексуальной функции: желание/интерес, возбуждение, оргазм и диспареуния. Крем с 0,5%-м (6,5 мг) DHEA оказался оптимальным для лечения вагинальной атрофии и существенно не повлиял на сывороточный уровень эстрогенов [20].
Среди селективных модуляторов эстрогеновых рецепторов (SERM) оспемифен является наиболее современным лекарственным средством. В 12-недельном трехфазном рандомизированном исследовании с участием 826 женщин в постменопаузе изучали эффективность данного препарата в дозе 30 мг, 60 мг по сравнению с плацебо. К 4-й и 12-й неделям оспемифен в указанных ранее дозах показал статистически значимое увеличение количества поверхностных клеток, снижение парабазальных клеток и рН во влагалище по сравнению с плацебо. Сухость влагалища значительно снизилась как в группах с 30 мг и 60 мг по сравнению с плацебо к 12-й неделе, в то время как диспареуния уменьшилась только в группе, получавшей препарат в дозе 60 мг. В ходе исследования было выявлено, что побочный эффект препарата, проявляющийся в виде приливов, наблюдался у 9,6%, 8,3% и 3,4% участников в группах, получавших оспемифен в дозе 30 мг, 60 мг и плацебо соответственно. Толщина эндометрия от исходного уровня к 12-й неделе в среднем изменилась на 0,42 мм, 0,72 мм и 0,02 мм у участниц выше представленных групп соответственно [21].
Комбинация конъюгированных эстрогенов и базедоксифена — селективного модулятора эстрогеновых рецепторов, известная как тканевой селективный эстрогенный комплекс (TSEC), изучалась в исследовании 3-й фазы, где 601 женщина была распределена по группам в зависимости от ежедневной получаемой терапии: 20 мг базедоксифена плюс конъюгированные эстрогены 0,45 мг (BZA/CE), или базедоксифен 20 мг плюс 0,625 мг конъюгированные эстрогены, или 20 мг базедоксифена и плацебо. В ходе исследования было выявлено увеличение доли поверхностных клеток и уменьшение доли парабазальных от исходного уровня к 12-й неделе в большей степени в группе BZA/CE по сравнению с плацебо и только BZA. РН влагалища существенно не изменился по сравнению с исходным к окончанию исследования в группе BZA или плацебо, но значительно уменьшились в обеих группах BZA/CE. Тем не менее, снижение рН влагалища было значимо ниже в группе BZA/CE 20 мг/0,625 мг, чем в плацебо-группе. Самые «назойливые» симптомы значительно уменьшились к 12-й неделе по сравнению с плацебо в группе BZA/СЕ 20 мг/0,625 мг, но не в группе BZA/СЕ 20 мг/0,45 мг. Не отмечено каких-либо существенных различий в побочных эффектах или случаях прекращения участия в исследовании между группами. Однако была отмечена более высокая заболеваемость вагинитами в группах лечения (BZA/CE) по сравнению с плацебо [22]. Таким образом TSEC, а именно базедоксифен в сочетании с конъюгированными эстрогенами представляет собой альтернативу терапии прогестинами для защиты эндометрия от стимуляции эстрогенами, при сохранении благоприятного воздействия эстрогенов на симптомы, связанные с менопаузой.
Несмотря на перечисленные методы лечения ВА, не стоит забывать о профилактике заболевания. Сохранение регулярной половой жизни рекомендуется, в общем, всем женщинам и, в частности, женщинам в менопаузе. Это связано с тем, что половой акт улучшает циркуляцию крови во влагалище, и семенная жидкость также содержит половые стероиды, простагландины и незаменимые жирные кислоты, которые способствуют сохранению вагинальной ткани [12].
Хотя официальная распространенность атрофии влагалища меняется в зависимости от численности и индивидуальных особенностей изучаемого населения, все большее число женщин страдают от этого состояния по мере старения населения. Одно из исследований, проведенное зарубежными коллегами, показало, что более 60% женщин испытывают симптомы ВА спустя 4 года после наступления постменопаузы. При этом всего лишь 4% женщин в возрасте 55–65 лет связывают вышеуказанные жалобы с атрофией влагалища, 37% знают, что это симптомы обратимы, и 75% женщин считают, что симптомы ВА негативно влияют на их жизнь. Учитывая деликатный характер этих симптомов, пациентки не решаются обратиться за медицинской помощью и, следовательно, страдают от прогрессирующих симптомов [10, 23]. Лишь 25% женщин с симптомами вагинальной атрофии обращаются за медицинской помощью. ВА является хроническим и прогрессирующим состоянием [10]. Значительное число женщин с симптомами ВА даже не представляют, что существует возможность эффективного лечения. Своевременное информирование пациентов о причинах возникновения вышеуказанных симптомов и возможностях их устранения может позволить в короткие сроки улучшить состояние женщин, возвратить им интерес к жизни и ее качество. Таким образом, проблема сохранения здоровья и профилактики заболеваний, обусловленных старением, приобрела в последние годы особое значение. В связи с ее актуальностью в настоящее время проводится разработка и внедрение новых лекарственных препаратов для лечения ВА, что позволит индивидуализировать подход к лечению пациентов.
Литература
- Вихляева Е. М. Руководство по гинекологической эндокринологии. М.: Медицинское информационное агентство, 1997. С. 227–360.
- Урогенитальные расстройства в климактерии (клиника, диагностика, заместительная гормонотерапия). Дис. д-ра мед. наук. М., 1998.
- Santiago Palacios. Managing urogenital atrophy // Maturitas. 2009; 63: 315–318.
- Sinha A., Ewies A. A. A. Non-hormonal topical treatment of vulvovaginal atrophy: an up-to-date overview // Climacteric. 2013; 16: 305–312.
- Griebling T. L., Liao Z., Smith P. G. Systemic and topical hormone therapies reduce vaginal innervation density in postmenopausal women // Menopause. 2012; 19: 630–635.
- Frank S. M., Ziegler C., Kokot-Kierepa M., Maamari R., Nappi R. E. Vaginal Health: Insights, Views & Attitudes (VIVA) survey — Canadian cohort // Menopause Int. 2012.
- Rosano G. M. C., Vitale C., Silvestri A., Fini M. Metabolic and vascular effect of progestins in postmenopause // Maturitas. 2003; 46: 17–29.
- Hextall E. Esrogens in the funtion uretral tract // Maturitas. 2000; 36: 83–92.
- Манухин И. Б., Тумилович Л. Г., Геворкян М. А. Клинические лекции по гинекологической эндокринологии. М., 2003.
- Management of symptomatic vulvovaginal atrophy: 2013 position statement of The North American Menopause Society // The North American Menopause Society. 2013; 20 (9): 888–902.
- James H. Pickar. Emerging therapies for postmenopausal vaginal atrophy // Maturitas. 2013; 75: 3–6.
- Camil Castelo-Branco, Maria Jes´us Cancelo, Jose Villero, Francisco Nohales, Maria Dolores Juli´a. Management of post-menopausal vaginal atrophy and atrophic vaginitis // Maturitas. 2005; 52: 46–52.
- Sturdee D. W., Panay N. Recommendations for the management of postmenopausal vaginal atrophy // Climacteric. 2010; 13: 509–522.
- Basaran M., Kosif R., Bayar U., Civelek B. Characteristics of external genitalia in pre-and postmenopausal women // Climacteric. 2008; 11: 416–421.
- Paul Nyirjesy. Postmenopausal Vaginitis. Current Infectious Disease Reports. 2007; 9: 480–484.
- Suckling J., Lethaby A., Kennedy R. Local oestrogen for vaginal atrophy in postmenopausal women // Cochrane Database Syst Rev. 2006.
- Gupta P., Ozel B., Stanczyk F. Z., Felix J. C., Mishell Jr. D. R. The effect of transdermal and vaginal estrogen therapy on markers of postmenopausal estrogen status // Menopause. 2008; 15 (1)): 94–97.
- Pitkin J., Rees M. British Menopause Society Council. Urogenital atrophy // Menopause Int. 2008; 136–137.
- Jaisamrarn U., Triratanachat S., Chaikittisilpa S., Grob P., Prasauskas V., Taechakraichana N.. Ultra-low-dose estriol and lactobacilli in the local treatment of postmenopausal vaginal atrophy // Climacteric. 2013; 16: 347–355.
- Labrie F., Archer D. F., Bouchard C. et al. Intravaginal dehydroepiandrosterone (prasterone), a highly efficient treatment of dyspareunia // Climacteric. 2011; 14: 282–288.
- Bachmann G. A., Komi J. O. The Ospemifene Study Group. Ospemifene effectively treats vulvovaginal atrophy in postmenopausal women: results from a pivotal phase 3 study // Menopause. 2010; 17 (3): 480–486.
- Kagan R., Williams R. S., Pan K., Mirkin S., Pickar J. H. A randomized, placebo-and active-controlled trial of bazedoxifene/conjugated estrogens for treat-ment of moderate to severe vulvar/vaginal atrophy in postmenopausal women // Menopause. 2010; 17 (2): 281–289.
- Kingsberg S. A., Krychman M. L. Resistance and barriers to local estrogen therapy in women with atrophic vaginitis // J Sex Med. 2013; 1567–1574.
А. В. Глазунова С. В. Юренева1, доктор медицинских наук, профессор
ФГБУ НЦ АГиП им. В. И. Кулакова МЗ РФ, Москва
1 Контактная информация
Abstract. According to forecasts to 2030 there will be 1,2 bln women in postmenopause. The state of oestrogen deficit in climacterical period cause vaginal atrophy with 15–57% of women. The latest data on the problem of pathogenesis, clinical manifestations and therapy of this state are provided in review.
2.Причины
Главной причиной запуска и прогрессирования ВВА считается дефицит эстрогенных гормонов, активирующих и регулирующих деятельность органов женской репродуктивной системы. Следствием недостатка эстрогенов выступают нарушения клеточного питания и состава влагалищного микробиома, дисбаланс между компонентами соединительной ткани (коллаген и эластин), постепенное снижение микроциркуляции и кровоснабжения слизистых оболочек и подслизистого слоя (что, в свою очередь, ведет к сокращению секреторной активности влагалищных экзокринных желез).
Посетите нашу страницу Гинекология
Диагностика атрофического (сенильного) кольпита
- Гинекологический осмотр на кресле.
- Мазки из влагалища (цитология), в том числе на скрытые инфекции.
- Кольпоскопия.
- Определение рН влагалища.
В гинекологии во время осмотра при помощи зеркал заметна атрофия слизистой, которая имеет бледный цвет, усеяна микротрещинами и участками, лишенными эпителия, они начинают кровоточить после прикосновения. При вторичном инфицировании обнаруживают очаговую или диффузную гиперемию влагалища с сероватым налетом, гнойными выделениями.
На осмотре у женщин менопаузального периода могут выявить атрофию шейки и тела матки с соотношением по размеру 2:1, которые характерны для детского возраста. Выраженные дегенеративные процессы могут сопровождаться полным или частичным сращением сводов влагалища.
Во время кольпоскопии обращают внимание на присутствие на бледной истонченной слизистой петехий, расширенных капилляров. При выполнении пробы Шиллера получают неравномерное слабое окрашивание.
Исследование на рН влагалища в менопаузе показывает индекс в пределах 5,5–7 (для детородного возраста — 3,5–5,5).
Цитология мазка у пожилых женщин помогает обнаружить преобладание клеток базального и парабазального слоев. При проведении микроскопии влагалищного мазка обнаруживают резкое уменьшение титра влагалищных палочек, повышение количества лейкоцитов, присутствие разнообразной условно-патогенной микрофлоры.
Для исключения специфических вагинитов у возрастных пациенток проводят ПЦР-диагностику влагалищных соскобов. При обнаружении ИППП дают направление к венерологу.
3.Симптомы и диагностика
Обусловленное атрофическим процессом истончение и ишемия слизистых влечет за собой прогрессирующий дефицит увлажнения влагалища. Сухость является наиболее частой жалобой, – ее предъявляют практически все пациентки, обратившиеся по поводу вульвовагинальных дегенеративно-дистрофических явлений. К прочим типичным жалобам относятся зуд, жжение, раздражение, общая диспареуния (отсутствие удовлетворенности половой жизнью, часто болезненность полового акта, ослабление интенсивности коитальных ощущений и т.д.), стойкое снижение эмоционального фона по депрессивному типу, резко заниженные представления о собственной привлекательности, гиполибидемия и избегание половых контактов (что в ряде случаев становится причиной серьезной семейно-сексуальной дисгармонии). Отдельную проблему составляют атрофические вульвовагиниты – воспаления, обусловленные травматизацией слизистых при недостаточной их эластичности, объеме, тургоре и увлажнении. Многие больные отмечают появление аномальных выделений, нередко с обильными кровянистыми примесями.
В совокупности такие проявления неизбежно сказываются на качестве повседневной жизни, социальной и сексуальной активности, общем психологическом состоянии женщины. Вразрез с заблуждением многих (если не большинства) женщин, страдающих ВВА, подобное состояние отнюдь не рассматривается современной гинекологией как нормальное и не нуждающееся в лечении следствие инволюционных (возрастных) процессов.
Диагностика вульвовагинальной атрофии начинается сбором подробного анамнеза (возраст, число выношенных и прерванных беременностей, наличие/отсутствие половой жизни, ее характер и частота, менструальный статус и мн.др.). Производится стандартный гинекологический осмотр, оценивается состояние слизистых и кожи гениталий (истончение, бледность, наличие петехий, кровянистый выпот и пр.). Назначаются лабораторные исследования – рН-метрия, бакпосев или серологический анализ, гистологический анализ образца ткани, анализы крови (общеклинический, гормональный и другие по показаниям), а также инструментальные исследования органов малого таза по мере необходимости (трансвагинальное УЗИ, рентгенконтрастная урография и др.). Важной задачей является дифференциальная диагностика с симптоматически сходными состояниями.
О нашей клинике м. Чистые пруды Страница Мединтерком!
Причины возникновения постменопаузного атрофического кольпита (вагинита)
Развивается заболевание из-за того, что на фоне дефицита эстрогенов возникает и остановка пролиферации слизистой влагалища. Секреция желёз, вырабатывающих смазку, также снижается. На фоне этого развивается атрофия слизистой и повышение её чувствительности. Также из-за пересыхания ткани становятся более ранимыми, что и вызывает периодические кровотечения мажущего характера.
Одновременно происходит и изменение микрофлоры влагалища, при котором начинают активироваться условно-патогенные микроорганизмы. Они не могут полноценно защитить ткани от проникновения инфекций, заносимых при гинекологических манипуляциях и половом акте, из-за чего через микротравмы проникают возбудители воспалений.
Особый риск появления атрофического (возрастного) кольпита отмечается у женщин, столкнувшихся со следующими явлениями:
- ранний климакс;
- сахарный диабет;
- гипотиреоз;
- полная утрата функции обоих яичников;
- недостаточная гигиена в интимной зоне;
- ношение некачественного белья;
- применение ароматизированных моющих средств для подмывания.
При выявлении проявлений болезни женщине необходимо посетить гинеколога для прохождения полноценной терапии.
4.Лечение
Существующие в настоящее время подходы к лечению вульвовагинальной атрофии носят, в основном, паллиативный, симптоматический характер. Во многих случаях для эффективного купирования дискомфортных явлений достаточно местного применения увлажняющих вагинальных средств (любрикантов), предпочтительно негормональных.
Эстрогенсодержащие мази, гели, свечи и т.д. применяются с осторожностью и должны быть отменены сразу же по достижению удовлетворительного и надежного эффекта.
В более серьезных случаях могут назначаться системные заместительные гормональные средства в пероральном приеме.
Большое значение имеет гимнастика тазовой мускулатуры, нормализация рациона и образа жизни. В некоторых случаях эффективным средством является комплекс мер по осторожному и постепенному растяжению влагалища; в других – обязательными являются рациональная витаминотерапия, эрадикация присоединившихся урогенитальных инфекций, восстановления естественного микробиома и т.д. Вообще, схема лечения во всех случаях строго индивидуальна, и одним из главных факторов терапевтического успеха выступает своевременное обращение за помощью.
Симптомы атрофического кольпита
У многих женщин патология имеет вялое течение и не вызывает сильного дискомфорта, из-за чего её игнорируют до момента обострения. У ряда больных симптоматика заболевания с самого начала проявляется остро и не позволяет не обращать на себя внимание. Большинство пациенток при патологии имеют такие жалобы:
- жгучая боль во влагалище;
- интенсивный зуд;
- болезненность при сексе;
- выделение сукровицы после секса, а также дефекации или взятия мазка из влагалища.
Если после того, как произошло инфицирование ранок влагалища, не было проведено полноценное лечение, к атрофии слизистой добавляется вторичная инфекция, которая затрагивает мочевой пузырь, из-за чего у женщины развиваются такие симптомы:
- недержание мочи при физической нагрузке или смехе;
- невозможность сдерживать позывы на мочеиспускание в течение длительного времени.
В такой ситуации терапия будет несколько сложнее, так как потребуется ещё и лечение мочевого пузыря.
Лечение атрофического (возрастного) кольпита
Лечение при сенильном (старческом) кольпите в постменопаузе направлено на восстановление полноценной трофики тканей влагалища. Для этого проводится гормональная заместительная терапия. При ней назначают препараты для орального применения или в форме пластырей, а также мази и свечи для местного использования.
При слабой выраженности атрофического вагинита применяются фитоэстрогены, которые в силу своего растительного происхождения оказывают на организм более мягкое воздействие. Заместительная гормонотерапия рассчитана на непрерывное использование в период до 5 лет.
Негормональное лечение старческого кольпита в случае невозможности применения эстрогенов включает в себя спринцевания или ванночки с растворами лекарственных трав, обладающих местными антисептическими, противовоспалительными, репаративными свойствами. При выявлении воспаления со специфическим возбудителем проводят этиотропную локальную терапию.
Для контроля эффективности терапии проводят динамическую кольпоскопию, цитологию, влагалищную рН-метрию.
При правильном лечении сенильного кольпита все неприятные проявления полностью устраняются, и женщина не испытывает дискомфорта. Промедление с лечением становится причиной его большей сложности и не всегда полного устранения симптомов патологии.
Профилактика и прогноз при сенильном кольпите
Условием предупреждения развития заболевания является постоянное наблюдение у гинеколога с регулярными осмотрами и назначением гормонозаместительной терапии в климактерическом периоде. Помимо улучшения состояния слизистой влагалища, гормональные препараты снижают симптомы климакса, уменьшают риск развития остеопороза, заболеваний сердца.
Неспецифическая профилактика постменопаузного атрофического вагинита сводится к предотвращению наступления раннего климакса. Для этого советуют отказаться от курения, рационально питаться, выполнять дозированные физические нагрузки, избегать стрессов. Пациенткам, склонным к развитию такого заболевания, важно укреплять иммунитет, тщательно заботиться о личной гигиене, носить хлопчатобумажное белье.
Прогноз при кольпите благоприятный с точки зрения продолжительности жизни, однако вследствие склонности заболевания к рецидивам может снижаться её качество.
Консультативно-Диагностический (ранее НДЦ) в СПб оказывает диагностическую и терапевтическую помощь пациенткам с гинекологическими заболеваниями различной этиологии. Запишитесь на прием к гинекологу у операторов нашего кол-центра и приходите на лечение и прохождение диагностики заболеваний женской половой сферы.
Как проводится лечение лазером атрофии влагалища?
Процедура лазерного лечения атрофии влагалища предусматривает курс из 3-х процедур с интервалом в 4 недели. Продолжительность одной процедуры не превышает 15-20 минут.
Подготовка к лазерному лечению должна быть такой же как к обычному визиту к гинекологу.
Наркоз не требуется. Вмешательство проводится под местной анестезией кремом или спреем с Лидокаином.
После осмотра и антисептической обработки влагалища и наружных половых органов, во влагалище заводится специальная насадка и проводится лазерная обработка его стенок. Сканирование проводится циркулярно и последовательно, захватывая все стенки.
Вторым этапом проводится обработка задней стенки вульвы и половых губ. При необходимости для удаления пигментации возможна одновременная обработка внутренней поверхности бедер.
Восстановление после лазерного лечения легкое и занимает менее недели. Специального лечения не требуется.