Лимфогранулематоз — это злокачественное новообразование лимфатической системы, отличительной чертой которого является наличие в пораженных опухолью лимфатических узлах особых гигантских клеток, происходящих из В-лимфоцитов, которые называются клетками Березовского-Штернберга-Рид.
- Причины лимфогранулематоза
- Классификация лимфогранулематоза
- Симптомы лимфогранулематоза
- Диагностика лимфогранулематоза
- Лечение лимфогранулематоза
- Прогноз при лимфогранулематозе
Болезнь характеризуется поражением лимфатических узлов, которое возникает уницентрически в какой-то одной группе лимфатических узлов (чаще это надключичные, шейные и медиастинальные лимфоузлы), распространяется от одной группе к другой. Постепенно в процесс вовлекаются внутренние органы и костный мозг.
Эпидемиологи выделяют два пика заболеваемости. Один приходится на возраст 15-35 лет, а второй — на возраст старше 50 лет. Благоприятнее заболевание протекает у молодых людей ввиду отсутствия сопутствующих тяжелых патологий и больших возможностей в применяемых методах лечения.
Причины лимфогранулематоза
Причины развития лимфогранулематоза продолжают исследоваться. В числе основных рассматриваются 3 причины:
- Вирусные заболевания, в частности вирус Эпштейна-Барр, который вызывает мононуклеоз. В пользу этой теории свидетельствует то, что приблизительно в 20% случаев в биоптате опухоли выделяют генетический материал данного возбудителя. Также есть некоторая корреляция с ВИЧ, который приводит к нарушению работы иммунной системы.
- Иммунодефицитные состояния. Есть ряд исследований, которые свидетельствуют о том, что лимфогранулематоз развивается на фоне Т-клеточного иммунодефицита. В пользу этого фактора свидетельствует нарушение соотношения Т-хелперов и Т-супрессоров.
- Наследственная предрасположенность. В пользу этой теории свидетельствуют семейные случаи лимфогранулематоза и обнаружение характерных генетических маркеров данной патологии. Предполагается, что лимфоциты матери могут проникать через плацентарный барьер, вызывая иммунопатологические реакции у плода. Также заболевание может развиваться в результате специфических мутаций, которые могут быть спровоцированы лекарственными препаратами, ионизирующим излучением и другими факторами.
Классификация лимфогранулематоза
Выделяют 2 вида лимфогранулематоза:
- Классическая лимфома Ходжкина.
- Нодулярная лимфома Ходжкина с лимфоидным преобладанием.
Классическая лимфома Ходжкина включает несколько гистологических вариантов новообразования, но все они характеризуются единым иммунофенотипом. Опухолевые клетки экспрессируют CD 30, CD 15, PAX 5. В ряде случаев может отмечаться экспрессия CD 20 (это обязательно отмечается при описании молекулярно-генетического профиля опухоли, поскольку эти данные влияют на лечение). Экспрессия CD 45 и CD 3 не характерна.
Нодулярная лимфома отличается от классического лимфогранулематоза как клинически, так и иммуноморфологически. Опухолевые клетки интенсивно экспрессируют CD 20 и CD 45. CD 30 и CD 15 не обнаруживаются.
В зависимости от степени распространения опухоли, выделяют 4 стадии лимфогранулематоза:
- 1 локальная стадия — поражается либо одна группа лимфатический узлов, либо один внутренний орган.
- 2 регионарная стадия — поражается более одной группы лимфатических узлов, но по одну сторону диафрагмы. Либо имеется поражение одного внутреннего органа, с вовлечением в процесс регионарных лимфоузлов.
- 3 генерализованная стадия — поражены группы лимфоузлов по обе стороны диафрагмы, в процесс может вовлекаться селезенка или другие внутренние органы.
- 4 диссеминированная стадия — в процесс вовлекаются внутренние органы (легкие, почки и др)
Какие бывают лимфомы?
Первично лимфомы принято делить на две большие группы:
- Лимфомы Ходжкина / лимфогранулематоз (болезнь Ходжкина, ходжинские лимфомы),
- Неходжскинские лимфомы (лимфосаркомы, НХЛ).
По данным НМИЦ онкологии им. Н.Н. Блохина, в России заболеваемость неходжкинскими лимфомами в 1,5-3 раза превышает заболеваемость лимфогранулематозом.
Разница между этими лимфомами становится ясна после морфологического исследования образца ткани (биопсии). При болезни Ходжкина в пораженных лимфоузлах обнаруживаются крупные мутировавшие клетки Березовского — Штернберга — Рида. Ходжкинские лимфомы отличаются более агрессивным течением с ярко выраженной симптоматикой, но они легко поддаются лечению.
Пораженные Ходжкинской болезнью лимфоузлы чаще всего расположены над ключицами, в области шеи, подмышечных впадин, средостения.
Неходжкинские лимфомы помимо B-лимфоцитов, поражают еще и T-лимфоциты. Заболевание обычно протекает без выраженной симптоматики и тяжело лечится. Но сначала необходимо правильно определить разновидность неходжкинской лимфомы — актуальная классификация состоит из 30 наименований, включая:
- хронический лимфолейкоз;
- Т-клеточный лейкоз;
- фолликулярная лимфома;
- диффузная В-крупноклеточная лимфома;
- грибовидный микоз Сезари и др.
Симптомы лимфогранулематоза
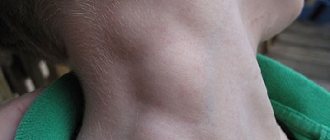
На начальных стадиях лимфогранулематоз может проявляться увеличением лимфатических узлов. Они обычно не болят, при пальпации подвижны, не спаяны с окружающими тканями, могут тянуться в виде цепочки. Наружные лимфоузлы пациенты могут обнаруживать сами. А увеличение внутренних проявляется нарушением работы рядом расположенных органов. Например, при увеличении лимфоузлов средостения может возникать одышка, сухой кашель, нарушение глотания, отечность верхней половины тела. Если увеличенные ЛУ находятся в брюшной полости, могут возникать боли в животе и отеки ног.
При вовлечении в процесс внутренних органов и костей, могут возникать следующие проблемы:
- Пневмонии и плевриты.
- Боли в костях с патологическими переломами.
- Кишечные кровотечения, перфорации стенки органов ЖКТ с развитием перитонита.
- При вовлечении в процесс костного мозга, отмечается анемия, кровоточивость и снижение иммунитета.
Из системных проявлений отмечается повышение температуры, ночная потливость и снижение веса. Повышение температуры носит периодический характер и может давать пики до 39 градусов. Эти признаки получили название В-симптомы и их наличие учитывается при определении стадии заболевания и выборе метода лечения.
Диагностика лимфогранулематоза
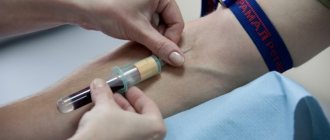
Заподозрить лимфогранулематоз можно на основании клинических симптомов — увеличение лимфоузлов, ночные поты, снижение веса и повышение температуры. Для подтверждения диагноза производится биопсия или удаление увеличенных лимфатических узлов с последующим морфологическим, иммунофенотипическим и молекулярно-генетическим исследованием. Полученные данные используются для определения вида лимфомы.
Для обнаружения увеличения внутренних лимфоузлов и определения стадии заболевания, применяются различные методы медицинской визуализации:
- УЗИ.
- Рентгенография органов грудной клетки. О поражении медиастинальных лимфоузлов свидетельствует расширение тени средостения.
- КТ.
- МРТ.
Также проводится дополнительное обследование для общей оценки состояния пациента:
- Общий анализ крови. Специфических изменений нет. Может наблюдаться увеличение СОЭ (это неблагоприятный признак), а при поражении костного мозга — анемия, а также снижение уровня тромбоцитов и лейкоцитов.
- Биохимический анализ крови. В нем тоже нет специфических проявлений, но могут возникать нарушения при вовлечении в процесс внутренних органов, например, при поражении печени может отмечаться повышение уровня трансаминаз.
- Пункция костного мозга проводится при подозрении на появление костномозговых очагов поражения.
- При планировании использования определенных препаратов, обладающих кардиотоксичностью, проводят обследование сердечно-сосудистой и дыхательной систем с оценкой фракции сердечного выброса и функции внешнего дыхания.
После комплексного обследования, больного лимфогранулематозом относят к одной из трех прогностических групп:
- Ранняя стадия с благоприятным прогнозом.
- Ранняя стадия с неблагоприятным прогнозом.
- Распространенная стадия.
В зависимости от группы, будет определяться тактика лечения. Определение группы проводится по критериям GHSG или EORTC/GELA. Факторами неблагоприятного прогноза являются:
- Массивное средостение — состояние, при котором на рентгенограмме в прямой проекции максимальный диаметр опухоли составляет более трети диаметра грудной летки.
- Вовлечение в процесс нелимфатических органов.
- Возраст старше 50 лет.
- СОЭ более 30 мм/ч.
- Поражение 3 и более лимфатических коллекторов.
Стадии
По одной из популярных и распространенных классификаций выделяют четыре стадии лимфомы Ходжкина (и нулевую). Мы опишем не их признаки, а то, как чувствует себя больной на каждой стадии:
- 0-я. Человек чувствует и ведет себя так, как будто он абсолютно здоров.
- I-я. Пациент может вести вполне адекватный образ жизни, но он немного ослаблен, поэтому физический труд ограничен.
- II-я. Уже заметна сильная утомляемость, человек не может сам себя обслуживать, ему трудно передвигаться. Около половины дня больной может проводить в постели.
- III-я. При этой стадии пациент много лежит (более половины суток) и нуждается в постоянном уходе. Ему тяжело активничать и выполнять даже привычные действия.
- IV-я. На этом этапе пациенты наиболее тяжелые. Они постоянно лежат или сидят, крайне быстро устают и даже общаться могут с трудом и недолго.
Какие процессы происходят в организме на каждой стадии лимфомы Ходжкина, пациенту объяснит врач — проявлений и их деталей существует немало. Все начинается с поражения лимфоузлов или некоторых органов (например, селезенки) — и дальше опухоль начинает распространяться, постепенно захватывая организм.
Лечение лимфогранулематоза
Для лечения лимфогранулематоза применяется химиотерапия и лучевая терапия.
Лечение ранней стадии лимфогранулематоза (благоприятный прогноз)
Для лечения такой формы гранулематоза применяют 2-4 цикла химиотерапии с последующей лучевой терапией (ЛТ). Для ХТ используется четырехкомпонентная схема ABVD, включающая адриамицин, блеомицин, винбластин, дакарбазин. ЛТ проводится на зоны первичного поражения в суммарной очаговой дозе 30 Гр. Используется фракционирование дозы, при котором проводятся ежедневные сеансы (5 дней в неделю) облучения в разовой очаговой дозе 2 Гр до достижения суммарной очаговой дозы в 30 Гр.
Кроме того, рассматриваются варианты облегченного лечения. Например, если имеется не более 2 зон поражения, нет конгломератов лимфатических узлов и нормальное СОЭ, возможно ограничиться двумя циклами химии. В некоторых случаях можно ставить вопрос об отмене лучевой терапии для некоторых категорий пациентов на основании данных ПЭТ-КТ, но он пока остается открытым.
Лечение ранних стадий лимфогранулематоза с неблагоприятным прогнозом
Лечение лимфогранулематоза в этом случае предполагает проведение 4-6 циклов химиотерапии по режиму ABVD с лучевой терапией зон первичной локализации опухоли в суммарной очаговой дозе 30 Гр.
Для пациентов младше 50 лет, имеющих хорошие показатели общего здоровья, возможно усиление терапии двумя курсами химиотерапии по протоколу BEACOPP, после которых проводится 2 цикла ABVD с облучением в стандартной дозе. При такой программе увеличивается вероятность 3-летней бессобытийной выживаемости, но остается открытым вопрос о поздней токсичности.
Лечение распространенных стадий лимфогранулематоза
При лечении распространенных стадий лимфогранулематоза применяется химиотерапия и облучение зон с наибольшими опухолевыми массивами, которые остаются после химии (резидуальные очаги). Главной задачей на этом этапе является достижение полной стойкой ремиссии уже на первой линии терапии. Выбор тактики лечения зависит от возраста пациента и его общего состояния.
Больным младше 50 лет рекомендована схема ВЕАСОРР-14 с облучением резидуальных очагов размером более 2,5 см. Но такой режим химиотерапии отличается высокой токсичностью, в том числе и для костного мозга, поэтому требуется плановое назначение гранулоцитарных колониестимулирующих факторов.
Для того, чтобы избежать синдрома лизиса опухоли, который также отличается высокой токсичностью, проводится подготовительная фаза (префаза) винкоалкалоидами за 10-14 дней до начала плановой ХТ.
У пациентов 50-60 лет схема ВЕАСОРР-14 может спровоцировать развитие тяжелых жизнеугрожающих осложнений, поэтому стандартом лечения является схема ABVD. Применяется курс из 6-8 циклов, в зависимости от опухолевого ответа. После окончания ХТ проводится облучение по стандартной схеме. Допускается применение протокола ВЕАСОРР-14 у сохранных больных 50-60 лет в количестве 6-8 циклов. Поддерживающей терапии больным с лимфогранулематозом не требуется.
Лечение рецидивов и рефрактерных форм лимфогранулематоза
Пациентам с рецидивами лимфогранулематоза или устойчивыми формами заболевания, не поддающимися терапии первой линии, рекомендовано выполнение высокодозной полихимиотерапии с последующей трансплантацией гемопоэтических стволовых клеток. Такое лечение проводят сохранным пациентам младше 50 лет. В остальных случаях используются различные щадящие режимы ХТ или облучение, которые хоть и не позволяют добиться полного излечения, но позволяют получить достаточно продолжительную ремиссию. Выбор схемы лечения определяется индивидуально с учетом химиочувствительности лимфогранулематоза и общего состояния пациента.
Радиотерапия при лимфогранулематозе
Радиотерапия при лимфогранулематозе на протяжении многих лет занимала важную роль в лечении. Но в настоящее время рассматриваются вопросы об уменьшении объемов облучаемых тканей и общей очаговой дозы. В целом облучение проводится через 2-4 недели после окончания химиотерапии. Максимальный интервал не должен превышать 6 недель.
При планировании полей облучения производится подробное описание очагов поражения — их локализация, размер, топографические ориентиры. После окончания лучевой терапии, пациенты должны проходить регулярное обследование с целью своевременного выявления заболеваний, потенциально вызываемых ионизирующим излучением. Например, при облучении лимфоузлов шеи необходимо регулярно обследовать щитовидную железу (УЗИ+ТТГ). При облучении медиастинальных лимфоузлов, необходим скрининг рака молочной железы и др.
Понятие «лимфома» объединяет множество заболеваний, различных по своим клиническим проявлениям, течению и прогнозу. Все лимфомы делятся на две большие группы: лимфома Ходжкина (ЛХ) и неходжкинские лимфомы. Первая названа в честь ученого Томаса Ходжкина, который впервые описал ее в 1832 году (а само название введено ВОЗ в 2001-м). Синонимы — лимфогранулематоз, болезнь Ходжкина. ЛХ стала первой клинически и морфологически распознаваемой злокачественной опухолью и первым злокачественным заболеванием, при котором больные имели шанс на полное излечение при наличии в арсенале врача-онколога только лучевой терапии. Сегодня успехи в лечении ЛХ относятся к ярким победам онкологии.
Алеся Марковец, научный сотрудник лаборатории клинических исследований РНПЦ детской онкологии, гематологии и иммунологии.Статистика
По данным республиканского канцер-регистра, заболеваемость лимфомой Ходжкина у детей в Беларуси составляет 1,34:100 000. Заболевание встречается во всех возрастах за исключением детей до одного года, крайне редко — до 5 лет, наиболее часто — среди подростков от 15 до 19 лет. Ежегодно в нашей стране насчитывается около 30 случаев ЛХ среди детей и подростков.
Причины и факторы риска
Конкретная причина возникновения ЛХ в большинстве случаев остается неизвестной. В настоящее время изучается роль вирусов в этиологии злокачественных лимфом (Эпштейна — Барр, цитомегаловирус, вирус герпеса 6-го типа), однако бесспорных доказательств вирусной теории не получено. Кроме того, к факторам, предрасполагающим к развитию ЛХ, относятся различные иммунодефицитные состояния (прием лекарств, подавляющих иммунитет, ВИЧ-инфекция, врожденные иммунодефициты), воздействие ионизирующего излучения и генетические факторы.
Клиническая картина
При ЛХ опухоль представлена злокачественными клетками Рид — Штернберга и клетками Ходжкина. Могут поражаться различные внутренние органы, вызывая нарушение их нормальной работы.
Опухолевый конгломерат шейных лимфоузлов при лимфоме Ходжкина.Как правило, первым признаком заболевания является безболезненное увеличение одного или нескольких лимфатических узлов, чаще на шее, реже — в подмышечной, паховой области. Иногда опухолевый процесс начинается в недоступных для осмотра местах — грудной клетке (средостении) или брюшной полости. Тогда увеличивающиеся лимфоузлы могут сдавливать соседние органы, вызывая сухой кашель, одышку, боли в животе. Опухоль может распространяться на внутренние органы (легкие, печень, почки и др.).
Кроме увеличения лимфатических узлов могут наблюдаться такие симптомы, как повышение температуры, слабость, ночная потливость, зуд кожи, снижение веса. Эти симптомы учитываются при определении стадии заболевания.
Диагностика
Для диагностики ЛХ необходимо проведение биопсии пораженного лимфатического узла или его конгломерата с последующими гистологическим и иммуногистохимическим исследованиями. Опухолевый субстрат ЛХ — это клетки Рид — Штернберга (крупные двухъядерные клетки) и клетки Ходжкина, вытесняющие нормальные клетки лимфатического узла любой области организма. Злокачественные клетки окружены клеточным инфильтратом, состоящим из гистиоцитов, лимфоцитов, моноцитов, плазматических клеток и эозинофилов. Гистологический вариант ЛХ зависит от структуры реактивного микроокружения опухолевых клеток (клеточного состава).
Для определения распространенности опухолевого процесса перед началом лечения необходимо адекватное стадирование заболевания. До недавнего времени стандартными методами считались данные УЗИ периферических лимфатических узлов, органов брюшной полости и малого таза, КТ или МРТ. При необходимости выполнялась трепанобиопсия костного мозга и сцинтиграфия скелета.
В настоящее время стандартом обследования при ЛХ является позитронно-эмиссионная томография с 18F-флюородезокси-глюкозой, совмещенная с КТ (ПЭТ-КТ).
ПЭТ-КТ позволяет точнее определить вовлеченные в опухолевый процесс лимфатические узлы и области организма, определить стадию и объем лечения. В нашей стране данный метод стал доступен для всех пациентов с ЛХ с 2021 года.Определение стадии заболевания проводится по системе Энн-Арбор (Котсуолдский пересмотр стадирования, принятый на конференции в Энн-Арбор, США). Эта система стадирования учитывает количество вовлеченных в опухолевый процесс лимфатических зон и областей, расположение пораженных лимфатических узлов по одну либо по обе стороны диафрагмы, наличие либо отсутствие экстралимфатического распространения опухоли (Е), локализованный или диссиминированный процесс, а также наличие или отсутствие системных симптомом (А или В).
По Международной клинической классификации выделяют 4 стадии ЛХ.
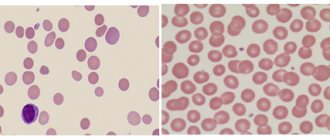
Диагностические клетки лимфомы Ходжкина
Клетка Рид — Штернберга.
Клетка Ходжкина.
Прогноз
У детей и подростков ЛХ является одной из наиболее хорошо излечиваемых опухолей. Около 85–90 % пациентов с классической ЛХ излечиваются на ранних стадиях заболевания (в сравнении с 75–80 % пациентов с запущенной стадией). К сожалению, ежегодно от 15 % до 20 % первичных случаев ЛХ у детей и подростков в Беларуси выявляется в запущенной форме (4-я стадия).
Лечение
Лечение пациентов с ЛХ — длительный процесс, занимает от 3 до 12 месяцев и проводится по специальным протоколам. В зависимости от стадии заболевания пациенты делятся на 3 группы (со своей интенсивностью и длительностью терапии).
Терапия болезни Ходжкина состоит из двух этапов: полихимиотерапии, направленной на максимальное уничтожение злокачественных клеток и достижение ремиссии с помощью химиопрепаратов, и лучевой терапии, направленной на закрепление и длительное сохранение ремиссии путем уничтожения остаточных опухолевых клеток, которые могут в последующем стать причиной рецидива.
Результаты лечения ЛХ в РНПЦ ДОГИ
В течение последнего десятилетия в РНПЦ детской онкологии, гематологии и иммунологии используется протокол лечения ЛХ, разработанный немецкими детскими онкогематологами, показавший свою высокую эффективность. Пятилетняя общая выживаемость составляет 98 %, бессобытийная выживаемость 90 %, однако у пациентов с распространенным процессом (4-я стадия заболевания) она значительно ниже (89 % и 74 % соответственно). Наиболее значимым фактором, влияющим на эффективность лечения, является объем исходной опухоли, оцениваемый по размерам конгломератов лимфатических узлов (особенно лимфатических узлов средостения) и числу зон поражения. В последние десятилетия доля пациентов с отсутствием полного эффекта или рецидивом заболевания практически не меняется и составляет 25 % для взрослых. Среди детей и подростков с ЛХ в Беларуси таких пациентов 10 %.
В Европе и США были предприняты попытки проведения терапии у этой категории пациентов более интенсивными схемами полихимиотерапии (ПХТ). В РНПЦ ДОГИ с 2021 года также введен в практику новый протокол для лечения пациентов с ЛХ высокой группы риска. Интенсификация терапии у таких пациентов показала высокую эффективность и приемлемую токсичность.
В первые протоколы лечения ЛХ была обязательно включена лучевая терапия (ЛТ) в высоких дозах (35–40 Гр). Со временем стало очевидно, что доза облучения при комбинированном лечении может быть ниже. Кроме того, именно отсроченные эффекты ЛТ являются определяющими в развитии неблагоприятных отдаленных эффектов после проведения лечения ЛХ (вторичные опухоли, сердечно-сосудистые заболевания, нарушения функции легких).
С активным внедрением ПЭТ-КТ в диагностику лимфом началась новая эра в лечении детей с ЛХ. ПЭТ-КТ стала активно применяться не только для стадирования, но и для оценки статуса ремиссии и раннего ответа на терапию. Быстрое достижение ПЭТ-негативности является маркером чувствительности опухоли к химиотерапии. Появился способ выявлять пациентов, для которых возможно отказаться от ЛТ. С 2017 года ЛТ отменяют пациентам с ранними стадиями, достигшим полной ремиссии по данным ПЭТ-КТ после завершения этапа ПХТ.
Несмотря на существенные успехи терапии ЛХ у детей, сохраняется определенное количество терапевтических неудач, 5 % пациентов с ЛХ оказываются рефрактерными к терапии первой линии и 5 % пациентов имеют рецидив заболевания, причем в 90 % случаев он происходит в течение первых двух лет. Значительно чаще возврат заболевания наблюдается у пациентов с распространенными стадиями. Если у ребенка рецидив произошел поздно (после окончания лечения прошло больше года), то второй курс ХТ и ЛТ дают очень хорошие результаты (10-летняя выживаемость у более 90 % пациентов). Если у ребенка ранний рецидив (после окончания лечения прошло от 3 до 12 месяцев), требуется очень интенсивная терапия (высокодозная ХТ с аутологичной трансплантацией гемопоэтических стволовых клеток (аутоТГСК), чтобы иметь хорошие шансы на выздоровление. Применение стандартной ХТ второй линии у этих пациентов позволяет достичь ответа в 50 % случаев.
По мере развития знаний в области биологии, патологии и иммунологии появилась возможность находить терапевтические мишени и разрабатывать новые препараты, которые должны быть не только эффективными, но и менее токсичными. Особенно это актуально для пациентов детского и молодого возраста. Такой мишенью стал CD30-рецептор на клетках опухоли ЛХ. С 2011 года стало возможным использование схем с включением таргетного препарата (моноклональное антитело брентуксимаб ведотин для лечения пациентов с рефрактерными и рецидивными ЛХ), которое приводит к выраженному и устойчивому ответу на терапию. В РНПЦ ДОГИ с 2015 года данный препарат включен в противорецидивные схемы лечения, что позволило достичь полной ремиссии у 85 % больных с рефрактерной ЛХ.
В настоящее время продолжается разработка методов лечения, снижающих вероятность возникновения осложнений и отдаленных последствий у перенесших заболевание.
Клинический случай
Пациент М., 17 лет. Считает себя больным с июня 2016 года, когда появилась потеря в весе около 5 кг за 2 месяца, зуд кожи голеней и стоп, по вечерам подъем температуры до субфебрильных значений (макс. 37,9 °С), боли в коленных суставах и поясничной области. По месту жительства осмотрен ревматологом. Клинически при осмотре выявлено увеличение шейно-надключичных и подмышечных лимфатических узлов, в общем анализе крови отмечено повышение СОЭ до 62 мм/ч, лейкоцитоз до 12,4ґ109/л. Проведена антибактериальная терапия (амоксиклав в течение 7 дней), без эффекта. По данным УЗИ ОБП — очаговые изменения в структуре селезенки. Проконсультирован гематологом в диагностическом центре, с подозрением на лимфопролиферативное заболевание направлен в РНПЦ ДОГИ.
На момент поступления в центр (30.08.16): состояние средней тяжести. Температура 37,6 °С. Кожа и слизистые нормальной окраски, чистые. Периферические лимфатические узлы: пальпируются множественные шейные лимфоузлы с обеих сторон до 2,5 см, плотные, в надключичной области множественные плотные до 1,5 см с обеих сторон, подмышечные с двух сторон до 2,5 см, плотные, подвижные, в конгломератах. Другие группы периферических лимфоузлов не увеличены. Тоны сердца ясные, ритмичные, ЧСС — 80 в минуту. Дыхание везикулярное, хрипы не выслушиваются, ЧД — 18 в минуту. Живот мягкий, безболезненный. Печень, селезенка не увеличены.
ОАК: Нb 119 г/л, эритроциты 4,29ґ1012/л, тромбоциты 329ґ109/л, лейкоциты — 13,02ґ109/л, э — 1 %, с — 87 %, л — 7 %, м — 3 %, СОЭ — 62 мм/ч.
БАК: ЩФ — 107 МЕ/л, ЛДГ 248 МЕ/л, билирубин —17,8 мкмоль/л, АЛТ — 30, АСТ — 23, СРБ — 3,4 г/л (норма до 0,5), мочевина — 6,5 ммоль/л, креатинин — 72 ммоль/л, белок — 86,2 г/л.
УЗИ ОБП: подвздошные лимфоузлы достоверно не увеличены; структура селезенки неоднородная, единичные очаги до 10 мм в структуре селезенки; лимфоузлы у ворот печени до 14 мм.
УЗИ периферических лимфоузлов: гиперплазия нижнешейных, надключичных, подключичных и подмышечных л/узлов с обеих сторон с патологическими изменениями структуры (УЗ-картина лимфопролиферативного заболевания).
Выполнена открытая биопсия подмышечного лимфоузла слева, морфологически — участки ткани лимфоузла с наличием стертой структуры, формированием фиброзных септ и скоплений лакунарных, диагностических и клеток Ходжкина. ИГХ: CD3(+фоновые клетки), CD30(+++), CD15(++), pax5(++), CD20(-), EBV(-).
Лимфома Ходжкина, вариант нодулярный склероз, смешанноклеточный состав, grade 1. БДУ (9663/3).
ПЭТ-КТ: в переднем средостении верхнего этажа срединно с акцентом вправо опухолевая масса; 36ґ73ґ60 мм. Изолированно лежащие увеличенные лимфоузлы: паратрахеальные и бифуркационные, до 15 мм; парастернально справа, до 18 мм. По данным ПЭТ: накопление РФП помимо вышеописанных узлов — в правом корне (бронхопульмональные л/узлы), в л/узлах — прекардиально справа, в кардиодиафрагмальной области слева, параэзофагеально (на КТ узел, 14 мм).
Очагов патологической плотности в легочной паренхиме не выявлено. Легочной рисунок не изменен. Долевые и сегментарные бронхи проходимы. Корни легких не расширены, структурны. Подмышечные л/узлы не увеличены. Плевральные полости свободны. Мягкие и костные ткани грудной клетки без структурных изменений. Отмечается увеличение забрюшинных л/узлов, до 23 мм; общих подвздошных до 15 мм. На ПЭТ патологическое накопление РФП помимо вышеописанных узлов — в воротах печени, в наружных подвздошных л/узлах, в селезенке.
Патологических объемных образований в брюшной полости и забрюшинном пространстве не выявлено. Печень не увеличена, однородной структуры. Поджелудочная железа гомогенна, обычных размеров и положения. Почки без видимых изменений.
В левой подвздошной кости определяется очаг гиперденсивной плотности с мелкобугристыми контурами, размером 10,5ґ6,6 мм. На ПЭТ также отмечается повышенное накопление РФП в телах позвонков С6, Тн4, L5, S1; ребрах; костях таза.
Заключение: лимфопролиферативное заболевание с поражением лимфоузлов по обе стороны диафрагмы, селезенки, костей.
МРТ костей таза, пояснично-крестцового отдела позвоночника, бедренных костей: определяются множественные разновеликие очаги патологического сигнала в костях таза (лонных, подвздошных, седалищных с обеих сторон), бедренных костях с обеих сторон, крестце (теле с переходом на поперечный отросток слева тела L5 позвонка, а также небольшие в теле L4 (до 9–10 мм) и L2 (до 5 мм).
Заключение: МР-картина многоочагового поражения костей таза, бедренных с обеих сторон, крестца, L5, L4, L2 позвонков.
Диагноз: классическая лимфома Ходжкина (вариант нодулярный склероз) с поражением шейно-надключичных лимфоузлов с двух сторон, подключичных лимфоузлов с двух сторон, лимфоузлов средостения, корня правого легкого, подмышечных лимфоузлов с двух сторон, лимфоузлов ворот печени, парааортальных лимфоузлов, селезенки, подвздошных лимфоузлов с двух сторон, множественное поражение костей скелета. Стадия IVB.
Пациенту проведено 6 блоков ПХТ по схемам BEACOPP-escalated.
Получен полный метаболический ответ по данным ПЭТ-КТ после этапа ПХТ. С целью консолидации ремиссии проведена лучевая терапия на зоны инициального поражения в СОД=20 Гр.
Специальное лечение закончено 21.03.17. Пациент до настоящего времени находится в стойкой ремиссии, наблюдается у онколога по месту жительства.