Менактра
5 200 руб.
Производитель США, АО Санофи Пастер
ВозрастДети от 9 месяцев, взрослые до 55 лет
Фасовка1 флакон / 1 доза / 0,5 мл №1
Производство США, АО Санофи Пастер.
Менактра — первая менигококковая конъюгированная вакцина, которая зарегистрирована в России. Вакцина производится одним из мировых лидеров в сфере разработки и производства вакцин . Таким образом, в 2014 голу Российская федерация вошла в число стран, где стала доступной современная и эффективная вакцина для профилактики тяжелейшего заболевания — менингококковой инфекции.
Менактра — четырехвалентная (тип A, C, Y, W) конъюгированная менингококковая вакцина, которая позволяет проводить профилактику всех форм менингококковой инфекции, уже начиная с возраста 9-ти месяцев и до 55 лет. При наличии медицинских показаний вакцина может использоваться и в более старшем возрасте.
Ранее в России для профилактики менингококковой инфекции были доступны только полисахаридные вакцины, при использовании которых формировался непродолжительный иммунитет длительностью не более 5 лет, поэтому часто данные вакцины применялись только при наличии «вспышек» менингококковой инфекции. Конъюгированная менингококковая вакцина Менктра рекомендована для плановой профилактики, так как вызывает формирование длительной защиты и формирование иммунологической памяти у привитых.
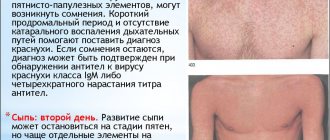
Менингококковая инфекция — очень актуальная проблема. Данная чрезвычайно бактериальная инфекция может иметь различные клинические формы. Самыми опасными из них являются менингококковый сепсис и менингококковый менингит. Для этих форм менингококковй инфекции характерно стремительное развитие и прогрессирование, отсутствие каких-либо специфических проявлений на начальных стадиях заболевания, которые позволили бы поставить диагноз менингококковой инфекции и начать специфическое лечении. По этой причине летальный исход развивается у каждого 6 ребенка с менингококковым сепсисом и менингококковым менингитом Тяжелая форма менингококковой инфекции может унести жизнь ребенка всего за 24 часа. У 15 % перенесших развиваются тяжелые необратимые последствия в виде ампутаций конечности, потери слуха и зрения, других неврологических нарушений. Среди заболевших 83% составляют дети первых 5 лет жизни, поэтому возможность провести вакцинацию, как можно раньше очень важна.
В настоящее время мы можем проводить плановую профилактику этой опасной болезни, используя современную и эффективную вакцину «Менактра».
Менингит: причины и признаки
Возбудителями инфекционных менингитов чаще всего становятся микробы, реже – вирусы или грибки. Первые признаки менингита возникают внезапно, через 3-10 суток после контакта с носителем инфекции. Возникают:
- сильная головная боль;
- лихорадка;
- тошнота и рвота;
- отсутствие аппетита;
- общая слабость, нарушения сознания;
- боль в мышцах, суставах, шее (ребенок не может нагнуть голову вперед);
- повышена чувствительность к звукам и свету (дети вскрикивают);
- выражена одышка и сердцебиение;
- кожа бледная, пальцы и носогубный треугольник с синюшным оттенком.
У малышей признаки менингита заподозрить сложнее. Типично беспокойство и постоянный крик, отказ от еды и сна, выбухание родничка, усиление плача при попытках родителей взять ребенка на руки, согнуть ноги или пошевелить головой. Дети срыгивают фонтаном, прижимают руки и ноги к телу, принимают позу с выгибанием спины.
Кому рекомендована вакцинация
Менингит особенно опасен для детей до 2-3 лет, у которых иммунная система еще не до конца сформировалась. Кроме того, заболевание опасно для малышей с иммунодефицитом, тяжелыми соматическими заболеваниями, врожденными пороками развития.
Вакцинация против менингита не включена в график обязательных прививок, бесплатно ее проводят по показаниям, если возникает вспышка инфекции или у групп риска. Родители могут провести вакцинацию платно в случаях:
- детям до двух лет, посещающим детские коллективы (развивающие занятия, ясли или садик);
- если планируется выезд в страны или регионы с высокой заболеваемостью менингитом;
- часто болеющим детям младшего, дошкольного возраста.
Педиатр может посоветовать вакцинацию при наличии дополнительных факторов индивидуально.
Особые указания
Вакцинальный препарат Менактра рекомендуется использовать особенно лицам из групп риска, которые имеют повышенную вероятность развития менингококковой инфекции:
- люди, непосредственно контактирующие с инфицированными;
- подтвержденный дефицит пропердина, компонентов комплемента;
- туристы и те люди, которые собираются посетить неблагоприятные по менингококковой инфекции зоны, находящиеся преимущественно в Африке;
- врожденное или приобретенное отсутствие селезенки;
- проживание в общежитиях, гостиницах квартирного типа;
- люди, которые планируют службу в армии или уже являются новобранцами.
Запрещено комбинировать вакцинальный препарат Менактра с любыми другими средствами в одном шприце. Также нельзя использовать подкожный, внутривенный или внутрикожный способы введения вакцины. Проведенные исследования не касались использования препарата у людей, которые имеют проблемы с нарушением свертываемости крови и страдают тромбоцитопенией.
Вакцину не используют в качестве профилактического средства от менингитов, которые могут быть вызваны другими микроорганизмами или менингококками серогруппы В. Отмечены случаи развития синдрома Гийена-Барре, который может прогрессировать после введения вакцины. Поэтому люди, ранее страдающие от этого состояния, могут быть внесены в группу риска по рецидивированию в будущем. Решение о применении вакцинального препарата Менактра должен принимать врач, оценив возможные риски развития синдрома Сийена-Барре.
Пациенты, которые страдают от нарушений иммунного статуса, проходят лечение с помощью иммуносупрессивной терапии, могут иметь сниженный иммунный ответ после использования вакцины.
Препарат Менактра не исследовался на способность оказывать влияние на управление автотранспортом.
Особенности вакцинации
Сегодня доступны прививки от трех вариантов менингита – пневмококкового, вызванного гемофильной палочкой или менингококкового. Для каждой инфекции существуют свои особенности иммунизации.
Гемофильная инфекция. Некоторые случаи гемофильной инфекции приводят к развитию менингита, особенно в возрасте с рождения до 6-7 лет, когда иммунная система еще несовершенна и может не так эффективно бороться с микробом. Эффективность прививки против менингита, вызванного гемофильной палочкой, достигает 95 %. Повторные ревакцинации повышают иммунную защиту.
Пневмококковая инфекция. Особенно важна прививка от менингита, вызванного пневмококком, детям до двух лет. Микробы, попадая в организм детей, могут провоцировать различные проявления – от простудных до поражения легких (пневмония) и оболочек мозга. Вакцинация снижает риск заболевания на 80 %. Если же малыш болеет, инфекция протекает легче. Источник: А.А. Баранов, Л.С. Намазова-Баранова, Н.И. Брико, Ю.В. Лобзин, Р.С. Козлов, М.П. Костинов, И.С. Королёва, А.В. Рудакова, С.В. Сидоренко, В.К. Таточенко, С.Р. Харит, М.В. Федосеенко, Е.А. Вишнёва, Л.Р. Селимзянова. Вакцинопрофилактика пневмококковой инфекции у детей // Педиатрическая фармакология, 2021, т.15, №3, с.200-211.
Менингококковая инфекция. Наиболее часто менингиты этой природы бывают у детей на первом году жизни. Кроме того, инфекция опасна для ослабленных и часто болеющих детей. Перенесенный менингит может привести к инвалидности, поэтому важно вакцинировать малыша. Когда делают прививку, риски снижаются более чем на 90 %. Источник: А.А. Ергалиева, Л.Б. Сейдулаева, Р.Ж. Байхожаева, Л.А. Умешова. Менингокковый менингит // Национальные приоритеты России, 2013, №2(9), специальный выпуск, с.154-156
График прививок
Важно уточнить у педиатра, в каком возрасте нужно прививать ребенка от той или иной инфекции. Так, прививки против менингококка в зависимости от конкретного препарата можно вводить с 9 месяцев, полутора или 2 лет.
Вакцину против гемофильной инфекции вводят одновременно с АКДС, и, соответственно, сколько раз делают прививку против столбняка, дифтерии и коклюша, столько же вводится и антигемофильный компонент. Возможно проведение отдельной вакцинации по индивидуальному графику.
Часто болеющих детей, особенно с рецидивирующими бронхитами, с двух месяцев прививают от пневмококковой инфекции. Вакцину допустимо вводить до 5-летнего возраста, после 4 последовательных уколов обеспечивается пожизненная защита. Есть препараты, которые вводят с 2 лет, они дают защиту от менингитов с другими осложнениями. Важно помнить, сколько действует прививка. Она защищает на срок до 10 лет.
Иммунологическая эффективность
Иммунологические свойства препарата Менактра были изучены специалистами в ходе проведения клинических исследований у детей и взрослых из разных возрастных групп:
- 9-18 месяцев — 3 исследования;
- от 2 до 10 лет — 4 исследования;
- с 11 до 55 лет — 6 клинических исследований.
Первичный иммунологический профиль был изучен в рамках проведения клинических испытаний на детях в возрасте от 2 до 10 лет. Иммунный ответ изучали перед однократным введением вакцины вакцинального препарата и через 28 дней после этого. В результате специалисты обнаружили значительное повышение средних показателей геометрических титров антител. Во всех группах участников была выявлена сероконверсия. Титры антител повышались в 4 раза и более через 28 дней после проведения вакцинации.
Возможные реакции и осложнения
Педиатр подробно расскажет, как переносится каждая из прививок, какие побочные эффекты возможны, как действовать родителям. Наиболее часто возникает температура после прививки. Это вполне допустимая реакция, так как в организм вводится чужеродное вещество, необходима выработка антител. Обычно лихорадка невысокая и проходит за 2-3 дня.
Возможные последствия и осложнения редки, так как препараты хорошо переносятся. Они включают в себя аллергические реакции, сильное покраснение в месте инъекции, резкую слабость в течение двух суток.
Менактра
Торговое наименование:
Менактра® [вакцина менингококковая полисахаридная (серогрупп А, С, Y и W-135), конъюгированная с дифтерийным анатоксином]
Группировочное наименование:
Вакцина для профилактики менингококковых инфекций серогрупп А, С, W, Y, полисахаридная, конъюгированная
Лекарственная форма:
Раствор для внутримышечного введения Вакцина Менактра® представляет собой раствор очищенных капсульных полисахаридов Neisseria meningitidis групп A, C, Y и W-135, индивидуально конъюгированных с белком-носителем (очищенным анатоксином Corynebacterium diphtheriae).
Состав
Одна доза (0,5 мл) содержит:
Действующие вещества: Моновалентные менингококковые конъюгаты (полисахарид + белок-носитель): Полисахарид серогруппы A — 4 мкг Полисахарид серогруппы С — 4 мкг Полисахарид серогруппы Y — 4 мкг Полисахарид серогруппы W-135 — 4 мкг Дифтерийный анатоксин ~ 48 мкг
Вспомогательные вещества: Натрия хлорид 4,35 мг, натрия гидрофосфат 0,348 мг, натрия дигидрофосфата моногидрат 0,352 мг, вода для инъекций — до 0,5 мл.
Описание
Бесцветный прозрачный или слегка мутноватый раствор.
Фармакотерапевтическая группа
МИБП-вакцина.
Код ATX
J07AH08
Фармакологические свойства
Возбудителем менингококковой инфекции, включая менингит и септицемию, является бактерия N. meningitidis; выделяют ряд серогрупп возбудителя. Введение вакцины Менактра® индуцирует выработку специфических антител, обладающих бактерицидной активностью в отношении капсулярных полисахаридов серогрупп возбудителя менингококковой инфекции, входящих в состав вакцины (А, С, Y и W-135).
Иммунологическая эффективность Клинические исследования по изучению эффективности не проводились, поскольку выработка сывороточных бактерицидных антител (СБА) считается показателем эффективности менингококковых вакцин.
Иммунологические свойства вакцины Менактра® изучали в 3 клинических исследованиях у детей в возрасте 9-18 мес, в 4 клинических исследованиях у детей в возрасте 2-10 лет и в 6 клинических исследованиях у лиц в возрасте 11-55 лет. Иммуногенность оценивали по уровню функциональных антител, определяемого с помощью анализа СБА.
Первичный иммунологический профиль вакцины изучали в рамках клинических исследований у участников в возрасте 2-10 лет. Иммунный ответ оценивали спустя 28 дней после введения вакцины Менактра® (в сравнении с исходным уровнем антител до вакцинации). У участников исследования наблюдали значительное повышение средних геометрических титров СБА. У 86-100 % участников при исходно неопределяемых значениях титра СБА (<1:8) была отмечена сероконверсия по антигенам всех серогрупп возбудителя, определяемая как 4-х кратное (или более) увеличение титров антител спустя 28 дней после вакцинации в сравнении с титром антител до вакцинации.
Способность вакцины Менактра® вызывать развитие иммунологической памяти после первичной вакцинации подтверждена данными клинических исследований у детей и у взрослых.
Результаты 3 клинических исследований, проведенных у детей в возрасте 9-18 мес с однократным или двукратным введением вакцины Менактра® отдельно или одновременно с другими педиатрическими вакцинами (пневмококковой конъюгированной вакциной (ПКВ) или вакциной для профилактики кори, паротита, краснухи и ветряной оспы (КПКВ)), подтвердили, что у большинства участников в группах с двукратным введением вакцины Менактра®, при ее применении отдельно или одновременно с другими педиатрическими вакцинами, наблюдалось увеличение титра СБА ≥1:8 ко всем серогруппам вакцины. У ≥91 % и ≥86 % участников в группе с отдельным двукратным введением вакцины Менактра® наблюдалось увеличение титра СБА ≥1:8 к серогруппам А, С, Y и к серогруппе W-135, соответственно. После введения второй дозы вакцины Менактра® одновременно с ПКВ или с КПКВ (или КПКВ + вакцина для профилактики инфекций, вызываемых Haemophilus influenzae тип b), у большинства участников исследования наблюдалось нарастание титра СБА ≥1:8 (у >90 % участников исследования к серогруппам А, С и Y, у >81 % участников к серогруппе W-135). Значения средних геометрических титров СБА после вакцинации ко всем четырем серогруппам менингококков, входящим в состав вакцины, были высокими.
Результаты исследований, проведенных у участников от 11 до 18 лет, подтвердили выраженный иммунный ответ на однократное введение вакцины Менактра®. Значения средних геометрических титров СБА на 28-й день после вакцинации оказались значительно выше исходных. Кроме того, у 98-100 % подростков, у которых первоначально титр антител не определялся (<1:8), к 28-му дню наблюдалось 4-х кратное (или более) увеличение титра СБА ко всем серогруппам возбудителя, входящим в состав вакцины. Полученные результаты свидетельствуют о высокой иммуногенности вакцины у подростков.
При анализе по серогруппам выявлено, что у 93-100 % взрослых участников клинических исследований с исходно неопределяемыми титрами антител (<1:8) к 28-му дню наблюдалось 4-х кратное (или более) увеличение титра СБА ко всем серогруппам возбудителя, входящим в состав вакцины. В каждом из 3 исследований иммунологический ответ, индуцированный введением вакцины Менактра®, оказался сходным при оценке групп по полу, возрасту и расовой принадлежности.
Кинетика иммунного ответа: отсутствуют данные о кинетике первоначального ответа на введение вакцины Менактра®, однако, как и в случае других полисахаридных и конъюгированных вакцин, иммунная защита обычно формируется через 7-10 дней после вакцинации.
Продолжительность защиты: способность вакцины Менактра® индуцировать формирование иммунной памяти после первичной вакцинации была доказана в ходе клинических исследований. В одном из исследований было продемонстрировано, что персистенция бактерицидных антител в крови через 3 года после однократного введения вакцины Менактра® была выше по сравнению с группой привитых, получивших однократную иммунизацию неконъюгированной 4-х валентной полисахаридной менингококковой вакциной против серогрупп A, C, Y и W-135. В группе привитых вакциной Менактра® наблюдались более высокая концентрация СБА, а также более высокая доля лиц, имевших специфические высокоавидные антитела, что говорит о формировании иммунной памяти.
Иммуногенность у подростков и взрослых после ревакцинации В клиническом исследовании, проведенном в США, 834 человека были однократно ревакцинированы вакциной Менактра® через 4-6 лет после вакцинации. До ревакцинации доля участников с титром СБА <1:8 составляла 64,5 %, 44,2 %, 38,7 % и 68,5 % для серогрупп A, C, Y и W-135, соответственно. В подгруппе участников исследования, у которых оценивался ответ на 6-й день после ревакцинации (n=112), 86,6 %, 91,1 %, 94,6 % 92,0 % пациентов достигли ≥4-х кратного увеличения титра СБА для серогрупп A, C, Y и W-135, соответственно. Доли участников исследования (n=781), достигших ≥4-х кратного увеличения титра СБА на 28-й день после ревакцинации, составили 95,0 %, 95,3 %, 97,1 % и 96 % для серогрупп A, C, Y и W-135, соответственно. Доля участников исследования, достигших титра СБА ≥1:8 на 28-й день, составила >99 % для каждой из 4-х серогрупп.
Показания к применению
Профилактика инвазивной менингококковой инфекции, вызываемой N. meningitidis серогрупп A, C, Y и W-135, у лиц в возрасте от 9 мес до 55 лет.
Противопоказания
— Известная гиперчувствительность с системными проявлениями к любому компоненту вакцины, включая дифтерийный анатоксин, или на предыдущее введение других вакцин, включающих те же компоненты. — Острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний (в этих случаях вакцинацию проводят после выздоровления или в стадии ремиссии).
Применение при беременности и в период грудного вскармливания
Исследования на животных не выявили отрицательного действия вакцины Менактра® на течение беременности и эмбриофетальное развитие, процесс родов и постнатальное развитие. В связи с тем, что исследований вакцинации беременных женщин не проводилось, а пострегистрационный опыт ее применения у беременных женщин ограничен, введение вакцины беременным женщинам рекомендуется только в случае крайней необходимости, как например, во время вспышки менингококковой инфекции, перед поездкой в эндемичный район, и только после оценки соотношения пользы и риска вакцинации.
В настоящее время неизвестно, способны ли действующие вещества, входящие в состав вакцины, проникать в грудное молоко. Однако ранее было показано, что антитела к полисахаридам обнаруживаются у молодых мышей, находившихся на грудном вскармливании.
В исследованиях у мышей не было продемонстрировано неблагоприятное влияние на постнатальное развитие потомства, получавшего с материнским молоком антитела, выработка которых была индуцирована введением вакцины Менактра®. В то же время эффекты у детей первого года жизни, матери которых были иммунизированы вакциной Менактра® в период грудного вскармливания, не исследовались. Перед принятием решения об иммунизации кормящей женщины необходимо оценить риски и пользу данной иммунизации.
Способ применения и дозы
Вакцинация проводится одной дозой 0,5 мл.
Вакцину следует вводить внутримышечно, принимая во внимание возраст прививаемого: детям в возрасте от 9 до 12 мес — в передне-боковую область бедра; детям от 12 мес и старше и взрослым — в дельтовидную мышцу плеча.
Не вводить вакцину внутрисосудисто. Перед введением необходимо убедиться, что игла не попала в кровеносный сосуд.
У детей в возрасте от 9 до 23 мес курс вакцинации вакциной Менактра® состоит из 2 инъекций по одной дозе вакцины (0,5 мл) с интервалом не менее 3 мес.
У лиц в возрасте от 2 до 55 лет вакцинация проводится однократно дозой 0,5 мл.
При сохраняющемся риске менингококковой инфекции однократная ревакцинация может быть проведена в соответствии с национальными рекомендациями, если с момента введения предыдущей дозы прошло не менее 4 лет.
Побочное действие
Характер и частота выявленных в исследованиях побочных эффектов различались в зависимости от возраста прививаемых.
В ходе клинических исследований у детей в возрасте от 9 до 18 мес, в течение 7 дней после вакцинации, наиболее часто отмечались чувствительность в месте инъекции и болезненность. В ходе клинических исследований у детей в возрасте от 2 до 10 лет наиболее часто отмечались болезненность и покраснение в месте инъекции, раздражительность, диарея, сонливость, анорексия; у подростков в возрасте от 11 до 18 лет и у взрослых лиц от 18 до 55 лет наиболее часто отмечались болезненность в месте инъекции, головная боль и повышенная утомляемость.
Частота развития приведенных ниже побочных эффектов классифицирована согласно рекомендациям Всемирной организации здравоохранения (ВОЗ) и включает следующие категории:
- Очень часто: ≥ 10 %
- Часто: ≥ 1 % и < 10 %
- Нечасто: ≥ 0,1 % и < 1 %
- Редко: ≥ 0,01 % и < 0,1 %
- Очень редко: < 0,01 %
- Частота неизвестна: не может быть определена согласно имеющимся данным.
Дети в возрасте от 9 до 18 мес Большая часть зарегистрированных местных и общих реакций, наблюдавшихся в течение 7 дней после вакцинации, были легкими и продолжались менее 3 суток. Кроме этого, отмечены следующие побочные эффекты:
Со стороны обмена веществ и питания Очень часто: потеря аппетита
Со стороны нервной системы Очень часто: сонливость
Со стороны желудочно-кишечного тракта Очень часто или часто: рвота
Общие расстройства и нарушения в месте введения Очень часто: болезненность, эритема в месте инъекции, отек в месте инъекции, раздражительность, аномальный плач, лихорадка
Дети в возрасте от 2 до 10 лет Большая часть зарегистрированных местных и общих реакций, наблюдавшихся в течение 7 дней после вакцинации, были легкими. Кроме этого, отмечены следующие нарушения:
Со стороны обмена веществ и питания Очень часто или часто: снижение аппетита
Со стороны нервной системы Очень часто или часто: сонливость
Со стороны желудочно-кишечного тракта Очень часто: диарея Часто: рвота
Со стороны кожи и подкожных тканей Часто: сыпь, крапивница
Со стороны скелетно-мышечной и соединительной ткани Часто: артралгия
Общие расстройства и нарушения в месте введения Очень часто: болезненность и уплотнение в месте инъекции Очень часто или часто: раздражительность, покраснение в месте инъекции, отек в месте инъекции, лихорадка
Лица в возрасте 11-55 лет Большая часть зарегистрированных местных и общих реакций, наблюдавшихся в течение 7 дней после вакцинации, были легкими. Кроме этого, отмечены следующие нарушения:
Со стороны обмена веществ и питания Очень часто или часто: снижение аппетита
Со стороны нервной системы Очень часто: головная боль
Со стороны желудочно-кишечного тракта Очень часто или часто: диарея Часто: рвота
Со стороны кожи и подкожных тканей Часто: сыпь
Со стороны скелетно-мышечной и соединительной ткани Очень часто: артралгия
Общие расстройства и нарушения в месте введения Очень часто: боль, уплотнение, покраснение и отек в месте инъекции, повышенная утомляемость, общее недомогание Часто: озноб, лихорадка
Ревакцинация У подростков и взрослых серьезные нежелательные явления встречались в 1,3 % случаев после ревакцинации вакциной Менактра®.
Наиболее распространенными местными и системными реакциями, зарегистрированными в течение 7 дней после вакцинации, были болезненность в месте инъекции (60,2 %) и миалгия (42,8 %). Средняя частота местных и общих реакций у подростков и взрослых после однократной первичной иммунизации и после ревакцинации вакциной Менактра® не различалась. Большинство зарегистрированных реакций были слабой или средней степени выраженности, которые проходили в течение 3 дней.
В пострегистрационный период дополнительно получена информация о следующих нежелательных явлениях после введения препарата (в настоящее время частота развития данных явлений и их причинно-следственная связь с применением вакцины Менактра® не может быть определена):
Со стороны крови и лимфатической системы Лимфоаденопатия
Со стороны иммунной системы Реакции гиперчувствительности, такие как анафилактический шок, анафилактоидные реакции, стридорозное дыхание, затруднение при дыхании, отек верхних дыхательных путей, крапивница, покраснение кожи, кожный зуд, снижение артериального давления.
Со стороны нервной системы Синдром Гийена-Барре (СГБ), парестезии, потеря сознания (обусловленная нарушениями регуляции со стороны вегетативной нервной системы), головокружение, судороги, паралич лицевого нерва, острый рассеянный энцефаломиелит, поперечный миелит.
Со стороны скелетно-мышечной и соединительной ткани Миалгия
Общие расстройства и нарушения в месте введения Обширная реакция в месте введения, проявляющаяся выраженным отеком конечности, может сопровождаться покраснением, чувством жара в месте инъекции, повышенной чувствительностью, или болезненностью в месте инъекции.
Пострегистрационное исследование безопасности Риск СГБ после введения вакцины Менактра® оценивался в рамках ретроспективного когортного исследования (США). По результатам медицинского обследования 1 431 906 пациентов, получивших вакцину Менактра®, сообщалось о 72 случаях СГБ. Во всех случаях вакцина Менактра® была введена пациентам не ранее 42 дней до начала развития симптомов. Еще 129 случаев СГБ не подтверждены или были исключены из анализа из-за отсутствия или недостаточности медицинской информации. На основании результатов анализа был оценен дополнительный риск СГБ, который варьировался от 0 до 5 дополнительных случаев СГБ на 1 000 000 привитых в течение 6 недель после вакцинации.
Передозировка
О случаях передозировки не сообщалось.
Взаимодействие с другими лекарственными средствами
Вакцину Менактра® применяли у лиц в возрасте 18-55 лет одновременно с полисахаридной вакциной для профилактики брюшного тифа и у лиц в возрасте 11-17 лет одновременно с адсорбированной вакциной против дифтерии (с уменьшенным содержанием антигена) и столбняка, предназначенной для применения у детей старшего возраста, подростков и взрослых.
В клинических исследованиях у детей в возрасте от 4 до 6 лет включительно вакцину Менактра® применяли совместно с вакциной для профилактики дифтерии, столбняка, коклюша (бесклеточной). В клинических исследованиях у детей младше 2 лет вакцину Менактра® применяли совместно с одной или несколькими из следующих вакцин во время введения второй дозы в возрасте 12 месяцев: пневмококковой 7-ми валентной конъюгированной вакциной (ПКВ7), вакциной для профилактики кори, паротита, краснухи (с компонентом против ветряной оспы или без него), вакциной для профилактики ветряной оспы, вакциной для профилактики вирусного гепатита А или вакциной для профилактики инфекции, вызываемой Haemophilus influenzae тип b.
При совместном применении вакцины Менактра® и вакцины против дифтерии, столбняка и коклюша (бесклеточной) у детей в возрасте от 4 до 6 лет включительно предпочтительно вводить одновременно обе указанные вакцины, или следует вводить вакцину Менактра® перед применением вакцины против дифтерии, столбняка и коклюша (бесклеточной). Снижение иммунного ответа на вакцину Менактра® было продемонстрировано при ее введении через месяц после введения вакцины против дифтерии, столбняка и коклюша (бесклеточной). Отсутствуют данные по оценке иммунного ответа на введение вакцины Менактра® после введения вакцины против дифтерии, столбняка и коклюша (бесклеточной) у детей до 4 лет или на введение вакцины Менактра® лицам младше 11 лет после введения других вакцин, содержащих дифтерийный анатоксин.
Титры пневмококковых антител против некоторых серотипов, содержащихся в ПКВ7, были снижены после одновременного введения вакцины Менактра® и вакцины ПКВ7.
БЦЖ вакцина не должна применяться одновременно с вакциной Менактра®.
Вводить вакцины необходимо всегда в разные участки тела, используя отдельные шприцы для каждой из них.
Особые указания
Вакцинация особенно показана следующим группам с высоким риском заболевания менингококковой инфекцией:
— лицам, которые имели непосредственный контакт с пациентами, инфицированными менингококками серогрупп A, C, Y или W-135 (в семье или в учреждениях закрытого типа); — лицам с дефицитом пропердина и компонентов комплемента; — лицам с функциональной или анатомической аспленией; — туристам и лицам, выезжающим в гиперэндемичные по менингококковой инфекции зоны, такие как страны Африки, расположенные к югу от Сахары; — сотрудникам исследовательских, промышленных и клинических лабораторий, регулярно подвергающимся воздействию N. meningitidis, находящейся в растворах, способных образовывать аэрозоль; — студентам различных вузов, и, особенно, проживающим в общежитиях или в гостиницах квартирного типа; — призывникам и новобранцам.
Запрещено вводить вакцину Менактра® подкожно или внутрикожно, поскольку данные о безопасности и эффективности вакцины при подкожном и внутрикожном введении отсутствуют.
Запрещается смешивать вакцину Менактра® в одном шприце с другими вакцинами или препаратами.
Применение вакцины у лиц с тромбоцитопенией или нарушениями свертываемости крови не изучалось. Как и в случае других вакцин, вводимых внутримышечно, следует оценить соотношение пользы и риска применения вакцины у лиц с повышенным риском развития кровотечения при внутримышечной инъекции.
Риск развития синдрома Гийена-Барре (СГБ) после введения вакцины Менактра® оценивался в рамках пострегистрационного ретроспективного когортного исследования. Описаны случаи развития СГБ, характеризовавшиеся наличием связи по времени с введением вакцины Менактра®. Лица, которым ранее был установлен диагноз СГБ, могут составлять группу повышенного риска развития данного состояния после введения вакцины Менактра®. Решение об использовании вакцины Менактра® в данной ситуации должно приниматься после оценки потенциальных пользы и рисков.
Вакцина не предназначена для профилактики менингитов, вызванных другими микроорганизмами, или для профилактики инвазивной менингококковой инфекции, вызванной менингококками серогруппы В.
Хотя после введения вакцины Менактра® может наблюдаться гуморальный иммунный ответ к дифтерийному анатоксину, данная вакцина не может считаться иммунизирующим агентом против дифтерии. Не рекомендуется изменять график вакцинации стандартными вакцинами против дифтерии в связи с введением вакцины Менактра®.
У лиц с нарушенным иммунным статусом, а также на фоне иммуносупрессивной терапии, может наблюдаться сниженный иммунный ответ на введение вакцины Менактра®.
Как при любой вакцинации, защитный иммунитет может вырабатываться не у всех 100 % привитых.
Перед применением вакцины медицинский работник или лечащий врач должен информировать пациента, его родителей, опекунов или других ответственных взрослых лиц о возможных пользе и риске для пациента, связанных с введением вакцины.
Перед введением вакцины следует принять необходимые меры предосторожности, направленные на профилактику тяжелых побочных реакций, а именно: изучить прививочный анамнез пациента, выяснить наличие противопоказаний к иммунизации и провести оценку текущего состояния здоровья пациента.
Введение вакцины проводится под контролем медицинского работника, а в кабинете, где проводят вакцинацию, должны быть доступны необходимые средства противошоковой терапии (например, растворы эпинефрина гидрохлорида (1:1000) и глюкокортикостероидов для инъекций).
После введения вакцины Менактра® отмечались случаи обморока. Необходимо предусмотреть меры для предотвращения травм, связанных с падением в обморок, а также возможность оказания медицинской помощи в случае обморока.
Влияние на способность управлять транспортными средствами, механизмами
Исследований по изучению влияния вакцины на способность к управлению автомобилем и другими механизмами не проводилось.
Форма выпуска
Раствор для внутримышечного введения 0,5 мл/доза. По 1 дозе (0,5 мл) препарата во флаконы из прозрачного боросиликатного стекла (тип I) вместимостью 3 мл, которые укупоривают пробкой, изготовленной из смеси хлорбутила (не содержащего латекса) и синтетического полиизопрена, и закатывают алюминиевым колпачком, снабженным отрывной пластиковой крышечкой по типу «flip-off». По 1 или 5 флаконов вместе с инструкцией по медицинскому применению в пачку картонную.
Срок годности
2 года. Не использовать по истечении срока годности, указанного на упаковке. Датой окончания срока годности является последнее число месяца, указанного на упаковке.
Условия хранения
При температуре от 2 до 8 °С. Не замораживать. Хранить в недоступном для детей месте. Препарат, подвергшийся замораживанию, использованию не подлежит.
Условия транспортирования
При температуре от 2 до 8 °С. Не замораживать.
Условия отпуска
Отпускают по рецепту.
Производитель
Санофи Пастер Инк., США