Людям с сахарным диабетом требуется периодическое исследование анализа мочи, во-первых, для определения наличия сахара в моче, во-вторых, для исключения инфекций мочевыводящих путей, которые часто встречаются у пациентов с сахарным диабетом и должны быть обязательно пролечены.
Анализ мочи неинвазивен, и люди часто проводят его дома. Тем не менее, медицинские работники могут использовать анализ мочи, если они не могут получить доступ к вене для анализа крови, или если у человека есть беспокойство или страх перед иглами.
В этой статье мы рассмотрим типы анализов мочи на диабет и то, как понять результаты.
Типы анализов
Анализ мочи может обнаружить различные вещества, включая глюкозу, кетоны, белок, бактерии и билирубин.
Глюкоза
В анализе мочи можно определить уровень глюкозы, кетонов и других веществ.
Как правило, глюкоза не присутствует в моче. Однако, когда у человека сахарный диабет, она может определяться в моче. Некоторые заболевания почек также могут сопровождаться появлением сахара в моче.
Беременность:
Во время беременности почти у половины женщин может определяться глюкоза в моче, даже при отсутствии у них сахарного диабета.
Женщина, у которой наблюдается глюкоза в моче во время беременности, должна обследоваться на наличие у нее гестационного сахарного диабета.
Это тип диабета, который встречается во время беременности и обычно он проходит после родов, но может оказывать негативное влияние на плод, привести к осложнениям во время родов и к более высокому риску развития сахарного диабета 2 типа в дальнейшей жизни.
Глюкозурия — это определение глюкозы в моче.
Механизм образования кетоновых тел
Наибольшую информативность при диагностировании нарушений представляют три соединения этой группы веществ: β-гидроксибутират, ацетоуксусная кислота и ацетон. Они являются производными ацетил-коэнзима А, образуются в процессе катаболизма в печени. Их роль – обеспечение энергией клеток мозга, а также тканей и внутренних органов в экстренных случаях. К ним относятся усиленные физические нагрузки, длительное голодание, обезвоживание.
При этом катаболизм идет по жировому пути с образованием продуктов жирового обмена – кетосоединений. Они присутствуют в плазме крови, а также в других жидкостных системах организма, но в минимальных концентрациях. В моче их содержание колеблется, но суточное выведение при стабильном функционировании не превышает 50 мг/л. Обнаружить такую незначительную молярность при обычном анализе невозможно. Если все же результаты выдают их присутствие – это свидетельствует о нарушениях в метаболизме.
Кетоны
Когда у человека диабет, глюкоза в его крови не может проникнуть в клетки организма, и она остается в крови. Когда это происходит, клеткам не хватает глюкозы для получения энергии.
В результате организм начинает расщеплять жир, чтобы использовать его вместо энергии. Это производит токсичные кетоны. Если уровень кетонов поднимется слишком высоко, они могут привести к тому, что кровь станет слишком кислой. У человека с сахарным диабетом это может привести к диабетическому кетоацидозу (ДКА), требующему неотложного лечения.
Кетоны также могут попадать в мочу, поэтому врач может использовать анализ мочи для выявления ДКА. Люди с диабетом могут сделать анализ мочи дома, если они начинают испытывать признаки и симптомы ДКА.
Симптомы DKA включают в себя:
- «фруктовый» или запах ацетона при дыхании
- частое мочеиспускание
- жажда
- сухая или покрасневшая кожа
- затрудненное дыхание
- путаница
- боль в животе
- тошнота и рвота
- высокий уровень сахара в крови
- В тяжелых случаях человек может испытывать: o потерю сознания
- o кому
Любой, кто думает, что у них может быть ДКА, должен сначала проверить уровень сахара в крови. Если они превышают 240 миллиграммов на децилитр (мг / дл), ADA рекомендует тестировать на кетоны.
Если уровень кетонов высок, немедленно обратитесь за медицинской помощью, чтобы предотвратить развитие диабетической комы. Это касается пациентов с сахарным диабетом 1 типа.
Риск ДКА выше, когда человек, страдающий сахарным диабетом, заболевает ОРВИ или гриппом. В это время, согласно рекомендациям ADA, они должны проверять уровень кетонов каждые 4–6 часов.
Знание о самотестировании на глюкозу и кетоны может позволить человеку с диабетом лучше контролировать свое состояние.
Почему и при каких условиях необходимо контролировать уровень кетонов
Отклонение от нормы содержания кетосоединений – само по себе тревожный признак. Нормальный показатель составляет 0,5 ммоль/л. Превышение указывает на патологические состояния:
1. Истощение в связи с жесткой диетой со значительным либо полным ограничением потребления углеводов на фоне переизбытка белково-жировой пищи. 2. Сахарный диабет первого или второго типа на различных стадиях: декомпенсации, субкомпенсации, гиперосмоляции. 3. Инфекционные заболевания, сопровождающиеся сильной лихорадкой, а также резкими перепадами температуры тела. Особенно часто встречается такое явление при малярии. 4. Новообразования в органах эндокринной системы (надпочечники, поджелудочная, щитовидная железы). 5. Острые кишечные интоксикации. 6. Тяжелые травмы, обширные повреждения мышц, операции, мозговые травмы.
При этих условиях требуется контроль уровня ацетоуксусной кислоты и β-гидроксибутирата в урине. Особую важность анализ изменения представляет для диабетиков, поскольку может сигнализировать об ухудшении состояния (например, диабетическую кому). В таких ситуациях необходим жесткий и постоянный контроль, который могут обеспечить только экспресс-методы – тест-полоски на кетоны в моче.
Превышения стандартных показателей могут быть выявлены и в связи с безобидными физиологическими особенностями. Так, они часто выявляются у новорожденных детей до месяца, у малышей на фоне переутомления. Практически всегда – у беременных, кормящих женщин, а также у пожилых людей старше семидесяти лет. Тяжелые физические нагрузки – тоже приводят к закономерному увеличению этих соединений.
Чего ожидать
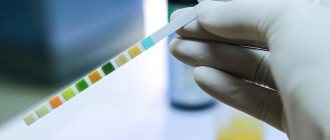
Иногда анализ мочи называют тестом на щуп, потому что он включает погружение полосок в мочу и считывание результатов с использованием цветовой шкалы. Домашние тесты похожи на это.
В кабинете врача
Если тест-полоска меняет цвет, могут присутствовать кетоны, глюкоза или другое вещество.
В кабинете врача медицинский работник даст Вам чистую и прозрачную тару и попросит сделать следующее:
- сначала немного помочитесь перед наполнением контейнера, так как образец в среднем потоке дает наиболее точные показания
- заполните три четверти контейнера и закрепите крышку
- верните образец врачу или поместите его в определенное место
Врач окунет полоску в мочу, которая изменит цвет в соответствии с уровнем различных веществ в моче.
Врач сравнит полоску с цветовой шкалой, чтобы определить уровень глюкозы, кетонов и белка в моче.
Если рН мочи высокий, это может указывать на присутствие определенных бактерий. Тем не менее, врачу также может понадобиться отправить образец в лабораторию для культивирования, если они тестируют на ИМП. Это может выявить тип присутствующих бактерий и дать представление о том, какое лечение назначать.
Домашнее тестирование
Процедура немного отличается, если у Вас уже имеется диагноз диабета и Вы проводите анализ мочи в домашних условиях.
Дома Вы должны следовать инструкциям в наборе для тестирования, так как они могут различаться. Однако для проверки уровня кетонов, белков или глюкозы в моче, вероятно, потребуется цветная полоска и справочная таблица.
Вы должны сделать тест утром перед завтраком.
Важно отметить, что анализы мочи не показывают, являются ли уровни глюкозы в крови слишком низкими. Это может быть важно для людей, которые подвержены риску гипогликемии (низкий уровень глюкозы в крови). Те, кто использует инсулин или другие лекарства, возможно, должны следить за низким уровнем сахара в крови.
Причины патологического состояния
Кетоацидоз появляется в таких случаях:
- При введении очень низкой дозы инсулина.
- Употреблении большого объема углеводов.
- Пропуске введения дозы инсулина.
- Чрезмерной физической нагрузке.
- Сильном стрессе.
- Избыточном употребления алкоголя.
- Наличии инфекционного заболевания.
- Употреблении экстази или кокаина.
При значительно превышающем норму уровне сахара крови в организме возникает гипергликемия, растет количество кетоновых тел.
Результаты
Результаты теста позволят определить уровень глюкозы, кетонов и белка в моче.
Глюкоза
Врач может предложить скорректировать лечение в зависимости от результатов.
Если в анализе мочи определяют глюкозу, врач обычно проводит анализ крови на глюкозу и уровень гликированного гемоглобина (HbA1c), чтобы определить, есть ли у человека диабет. В спорных случаях может потребоваться проведение теста на толерантность к глюкозе (GTT), чтобы выявить более ранние нарушения углеводного обмена и заняться профилактикой сахарного диабета.
Если у человека высокий уровень глюкозы в моче, это может быть связано с диабетом. Если это так, у них также будет высокий уровень глюкозы в крови (гипергликемия).
В краткосрочной перспективе неконтролируемый высокий уровень сахара в крови может привести к таким симптомам, как жажда, учащенное мочеиспускание и повышенный риск развития ДКА. В долгосрочной перспективе это может привести к развитию микро- и макрососудистых осложнений сахарного диабета — поражению почек, глаз, развитию сердечно-сосудистых заболеваний — инфаркт миокарда, инсульт.
Если у человека диагностирован диабет 1 типа, ему потребуется инсулин для контроля уровня сахара в крови. Диабет 1 типа обычно развивается в детстве или юности, но может произойти в любое время. Это может также появиться быстро, через несколько недель.
Диабет 2 типа обычно появляется в более позднем возрасте и развивается годами. Диагноз преддиабета позволит человеку внести изменения в образ жизни, которые могут замедлить или обратить вспять прогрессирование состояния.
ADA рекомендует проводить скрининг на диабет 2 типа в возрасте от 45 лет или ранее, если у человека есть факторы риска, такие как ожирение.
Кетоны
Человек с сахарным диабетом, который обнаруживает кетоны в своей моче, должен обратиться к врачу, чтобы предотвратить усугубление проблемы.
Если уровень кетонов высок, им может потребоваться лечение в больнице с использованием препаратов инсулина, введения электролитов и жидкости.
Некоторые низкоуглеводные диеты могут привести к расщеплению жира и образованию кетонов для топлива. Низкоуглеводная диета сама по себе не вызывает кетоацидоз и отличается от ДКА.
Тем не менее, человек с диабетом должен обсудить свой план питания с врачом и проконсультироваться о любых изменениях питания, которые он желает внести.
Белки
Белок в моче может быть признаком заболевания почек.
Человек с диабетом должен поговорить со своим врачом, если он заметит следующие симптомы:
- отек из-за задержки жидкости
- проблемы со сном
- низкий аппетит
- слабость
- сложность фокусировки
Люди с заболеванием почек часто не замечают никаких симптомов до более поздних стадий, когда почки перестают работать эффективно. Это может привести к серьезным осложнениям.
Врач может предложить регулярный скрининг белка в моче, поскольку это может помочь выявить проблемы с почками на ранних стадиях, в то время как еще есть время для принятия профилактических мер.
Люди имеют более высокий риск заболевания почек, если у них:
- определенные генетические факторы
- постоянный высокий уровень сахара в крови
- высокое кровяное давление
Решение проблемы высокого уровня глюкозы и артериального давления может снизить риск.
Вторичный ацетонемический синдром в практике врача гастроэнтеролога
ГУ «Институт терапии имени Л.Т. Малой АМН Украины», г. Харьков
В практике врача гастроэнтеролога особую актуальность имеют заболевания, сопровождающиеся клиникой ацетонемического синдрома. Этиологическая структура заболеваний, в клинической картине которых в определенный период преобладают явления кетонемии и ацетонурии, чрезвычайно разнообразна. В то же время, на догоспитальном этапе идентифицировать причину кетонемии трудно, а нередко – невозможно, так как для установления генеза гиперпродукции кетоновых тел необходимо воспользоваться данными лабораторно-инструментальных методов исследования. В этих условиях необходимо иметь четкое представление о возможных причинах развития вторичного ацетонемического синдрома, методах коррекции этого неотложного состояния и предотвращения развития кетоацидотической комы.
Краткие биохимические сведения
К ацетоновым (кетоновым) телам относят три соединения: ацетоуксусную кислоту (ацетоацетат), β-оксимасляную кислоту (β-оксибутират) и ацетон. Кетоновые тела – это продукты метаболизма ацетил-коэнзима А (КоА), который, в свою очередь, образуется из собственных белков организма, а при условии дефицита пищи – из жиров [6, 10, 11].
В условиях дефицита энергии в организме восстановление энергетических запасов возможно за счет активации глюконеогенеза или синтеза кетоновых тел (кетогенез). Процессы глюконеогенеза протекают только при условии наличия незаменимой аминокислоты аланина, которую в условиях дефицита пищи организм может получить только за счет разрушения собственных белков, в то время как кетогенез не требует распада белков. Таким образом, кетоновые тела играют важную роль в поддержании энергетического баланса организма, а активация кетогенеза является более целесообразной и оптимальной для организма в условиях дефицита энергии [6, 10, 11].
Кетоновые тела образуются преимущественно в ткани печени. В случае чрезмерной активации синтеза кетоновых тел, когда кетогенез увеличивается до такой степени, что процессы кетолизиса в тканях не в состоянии обеспечить распад образующихся кетоновых тел, последние начинают накапливаться в крови (кетонемия) и фильтроваться в мочу (кетонурия). Накапливаясь в крови, кетокислоты подавляют секрецию и активность глюкокортикоидов, препятствуя тем самым разрушению структурных белков организма (протеолизу) [6, 10, 11].
Кетоновые тела не только сохраняют структурные белки организма, угнетая секрецию и действие глюкагона – мощного стимулятора глюконеогенеза, но и по механизму обратной связи регулируют и ограничивают интенсивность кетогенеза.
Однако несмотря на компенсаторно-приспособительный характер кетогенеза, существует множество клинических ситуаций, которые могут сопровождаться развитием кетоза и кетоацидоза. Длительная стимуляция кетогенеза или нарушение процессов кетолизиса приводят к изменению буферной емкости крови, а при содержании в чрезмерно высоких концентрациях кетоновых тел – к снижению рН крови и возникновению кетоацидоза [4–6, 8, 10, 11].
Первоначально компенсация кетоацидоза осуществляется за счет гипервентиляции, что ведет к гипокапнии и вазоконстрикции, в том числе сосудов головного мозга. Избыток кетоновых тел оказывает наркотическое действие на центральную нервную систему, что клинически проявляется вялостью, заторможенностью, вплоть до потери сознания и развития кетоацидотической комы.
Патогенетические особенности вторичных кетозов
Наиболее частой причиной развития кетоза, а впоследствии – и кетонурии, является сахарный диабет. При сахарном диабете 1-го типа, с одной стороны, имеет место дефицит инсулина, с другой – избыток контринсулярных гормонов (глюкагона, катехоламинов, кортизола). В условиях недостатка инсулина активируются процессы гликолиза, гликогенолиза, липолиза. Массивный липолиз приводит к быстрому увеличению концентрации свободных жирных кислот в крови, из которых в печени под действием глюкагона синтезируются кетоновые кислоты. Торможение всех анаболических процессов в условиях дефицита инсулина приводит к замедлению процессов кетолизиса и развитию кетоацидоза [6, 8, 11]. При сахарном диабете 2-го типа имеет место относительная инсулиновая недостаточность, поэтому в случае декомпенсации этого заболевания наблюдается рост гликемии, а интенсивность процессов липолиза и кетогенеза значительно не изменяется [6, 8].
Интенсивное образование кетокислот происходит также при приеме с пищей так называемых кетогенных аминокислот (лейцина, тирозина, фенилаланина, изолейцина), некоторых белков и большого количества жиров. Щелочные соли также проявляют кетогенный эффект, который обусловлен нарушением функционирования цикла трикарбоновых кислот [6, 8, 11].
При поддержании кетогенной диеты происходят определенные метаболические изменения, провоцирующие синтез кетоновых тел: на 1–2-й день голодания активируются процессы гликогенолиза в печени и мышцах, на 3–4-й день продукция кетокислот значительно возрастает и достигает максимума к окончанию 2-й недели, на 1-й неделе усиливаются процессы глюконеогенеза, а со 2-й недели активность глюконеогенеза снижается и увеличивается использование кетонов головным мозгом. Таким образом, за счет преимущественного использования жиров в качестве источника энергии сохраняются жизненно важные запасы белка [6, 8, 11].
Голодание, лихорадка, тяжелая мышечная работа приводят к быстрому расходованию углеводов, сокращению запаса гликогена в печени. При дефиците углеводов тормозится использование КоА в цикле трикарбоновых кислот, что приводит к развитию кетоза.
Подобный механизм гиперпродукции кетоновых тел отмечается на фоне эмоционального стресса, при котором вследствие активации симпатической нервной системы истощаются углеводные резервы организма и развивается кетоз. Кроме того, при стрессе в результате повышения продукции глюкокортикоидов идет усиленный распад белков и происходит образование кетоновых тел из кетогенных аминокислот [6, 8, 11].
Еще одной причиной гиперпродукции кетокислот является хроническая алкогольная интоксикация. Метаболизм этанола в печени под воздействием фермента алкогольдегидрогеназы сопровождается стимуляцией синтеза кетокислот, а также торможением глюконеогенеза и развитием гипогликемии, которая, в свою очередь, стимулирует процессы липолиза, следовательно – и кетогенеза [9].
Стимуляция кетогенеза при дефиците пищи, голодании, длительной рвоте является компенсаторным процессом, в ходе которого восполняется энергетический дефицит за счет кетокислот.
При токсикозе беременных, при неукротимой рвоте возникает тяжелая дегидратация, которая нарушает естественный процесс саморегуляции синтеза кетокислот, что приводит к развитию кетонемии и кетоацидоза [8].
Патогенетические особенности кетогенеза при тиреотоксикозе, избытке глюкокортикоидов, дефиците ферментов глюконеогенеза аналогичны рассмотренным выше механизмам гиперпродукции кетокислот.
Клиника
Клиническая картина вторичного ацетонемического синдрома включает в себя непосредственно явления кетоза, признаки основного заболевания, на фоне которого развился кетоз, а также проявления того состояния, которое запустило патологический процесс (стресс, чрезмерная физическая нагрузка, инфекция и т.д.). Ярким клиническим проявлением ацетонемии является картина ацетонемического криза, который может возникать внезапно или после появления его предвестников – анорексии, вялости или возбуждения, головной боли по типу мигрени. Клинически кетоз проявляется многократной или неукротимой рвотой, возобновляющейся при попытке принять пищу или жидкость, появлением в выдыхаемом воздухе, рвотных массах, моче запаха ацетона (от едва уловимого до чрезвычайно интенсивного). Во время ацетонемического криза возможно повышение температуры тела пациента до 37,5 – 38,5°С, появление схваткообразной боли в животе. Длительная рвота, потеря значительного количества жидкости и электролитов приводят к развитию дегидратации и интоксикации: при объективном осмотре отмечается сухость кожи, тахипноэ, тахикардия, мышечная гипотония, выраженная слабость. При проведении рутинного лабораторного обследования диагностируются явления относительного лейкоцитоза со сдвигом формулы влево, увеличение скорости оседания эритроцитов, гиперхолестеринемия, гипокалиемия, повышение гематокрита.
Диагностика
Содержание кетоновых тел в сыворотке крови здорового человека варьирует от 34,4 до 430,5 мкмоль/л в пересчете на ацетон, в моче – 20–54 мг в течение суток. Такие концентрации кетоновых тел не определяются при помощи рутинных методов в клинической практике, поэтому принято считать, что в норме кетоновые тела в крови и в моче отсутствуют [5, 12]. Подавляющее большинство лабораторных тестов, диагностирующих кетонурию, основаны на реакциях с ацетоацетатом и ацетоном, они не реагируют с β-гидроксибутиратом. Так как уровень ацетона в моче по сравнению с уровнем ацетоацетата является незначительным, можно считать, что обычные лабораторные тесты определяют практически только ацетоуксусную кислоту.
В клинической практике для обнаружения кетоновых тел используют преимущественно качественные и полу-количественные пробы, которые позволяют быстро определить патологическое увеличение концентрации кетоновых тел в моче. В соответствии с этими методиками наличие ацетоацетата в клиническом анализе мочи может измеряться от «одного плюса» (+) до «четырех плюсов» (++++). Определение кетоновых тел в моче – это косвенный показатель кетонемии, так как выраженность ацетонурии в «+++» соответствует повышению уровня кетоновых тел в крови в 400 раз, а «++++» – в 600 раз [5, 12]. Кроме того, полученный результат отражает уровень кетонов в организме за 2–4 часа до проведения исследования, т.е. на момент поступления результатов из лаборатории истинная выраженность кетоза может превышать установленные значения. Метод определения ацетоацетата в моче имеет еще один недостаток: результат исследования зависит от количества жидкости, принятой пациентом (прием большого количества жидкости дает ложноотрицательный результат, малого количества – ложноположительный). Для определения уровня кетоновых тел в моче в амбулаторных условиях существуют специальные диагностические тесты, проведение которых не требует предварительной подготовки и специальных медицинских знаний – появление фиолетового окрашивания «тест-полоски» свидетельствует о наличии ацетонемии [4, 5, 12].
Более точным методом определения кетоновых тел является индикация β-кетонов в крови. Этот вариант исследования является более усовершенствованной технологией, так как представляет точные количественные данные об уровне кетонов, показывает уровень β-кетонов в крови на момент исследования, а результат анализа не зависит от питьевого режима. Нормативному содержанию кетоновых тел в крови соответствует уровень β-кетонов менее 0,5 ммоль/л, повышенному – 0,5–1,0 ммоль/л, кетоацидоз диагностируют при концентрации β-кетонов выше 3 ммоль/л [5, 12].
Дифференциальная диагностика
Выявление у больного явлений кетоза требует проведения всесторонней дифференциальной диагностики для уточнения причины, обусловившей его появление. Вторичный ацетонемический синдром может осложнять течение многих заболеваний, среди которых – сахарный диабет, инсулинома (гиперинсулинизм), хронический алкоголизм, болезнь и синдром Иценко–Кушинга, тиреотоксикоз, опухоли мозга в области турецкого седла, гепатиты, токсикоз беременных, болезнь Аддисона, лейкемия, гемолитическая анемия, миотоническая дистрофия, хорея Гентингтона, черепно-мозговая травма, гликогеноз I типа, голодание, лихорадочные состояния, некоторые инфекционные заболевания, тяжелые интоксикации, а также употребление пищи, богатой жирами (так называемая кетогенная диета) [6–11].
Сахарный диабет.
Положительный кетоновый тест в большинстве случаев диагностируется при декомпенсации сахарного диабета 1-го типа, в редких случаях – у больных сахарным диабетом 2-го типа, склонных к кетозу. Характерной чертой вторичного ацетонемического синдрома на фоне сахарного диабета является наличие глюкозурии, высокий уровень гликемии. Такие особенности, как острое, внезапное начало болезни у молодых лиц с превалированием в клинической картине заболевания полидипсии, полиурии, позволяют заподозрить правильный диагноз на догоспитальном этапе.
Беременность.
Появление рвоты, слюнотечения, запаха ацетона изо рта, непереносимость пищевых продуктов у женщин детородного возраста является показанием к проведению диагностических тестов для установления токсикоза беременности раннего срока. С этой целью в амбулаторных условиях может быть использован экспресс тест для определения хорионического гонадотропина в моче, а в специализированных медицинских учреждениях – гинекологический осмотр, иммуноферментный анализ для установления концентрации хорионического гонадотропина в крови, ультразвуковое исследование органов малого таза.
Синдром тиреотоксикоза.
Стойкое повышение уровня тиреоидных гормонов и обусловленная этим чрезвычайная активность процессов кетогенеза может привести к развитию кетоза и появлению клиники ацетонемического синдрома. Явления тиреотоксикоза, как правило, доминируют в клинике таких заболеваний, как диффузный токсический зоб, токсическая аденома щитовидной железы, аутоиммунный тиреоидит. Более редкими причинами тиреотоксикоза могут быть неопластические образования: опухоль гипофиза, секретирующая тиреотропный гормон, гормонально-активная опухоль, синтезирующая Т3, Т4 (тератома яичников, метастазы фолликулярного рака щитовидной железы) или хорионический гонадотропин (хорионэпителиома, пузырный занос). Необходимо учесть, что признаки тиреотоксикоза могут возникнуть на фоне передозировки йодсодержащих лекарственных средств, биодобавок, йодированной соли, тиреоидных препаратов. Неконтролируемый прием тироксина с целью снижения массы тела также может явиться причиной развития тиреотоксикоза. На первом этапе диагностики вторичного ацетонемического синдрома проводится скрининговое определение сывороточных концентраций тиреотропного гормона, Т3, Т4, ультразвуковое исследование щитовидной железы. Дальнейшее исследование осуществляется при наличии показаний с применением специфических методов исследования – иммуноферментного анализа (хорионический гонадотропин), рентгенографии, компьютерной (КТ) или магнитно-резонансной томографии (МРТ).
Гепатиты.
Печень является основным и практически единственным органом, где образуются кетоновые (ацетоновые) тела из жирных кислот. Практически любой патологический процесс, поражающий паренхиму печени, приводит к нарушению жирового обмена, интенсификации процессов кетогенеза и увеличению концентрации кетоновых тел в крови. Развитие ацетонемического синдрома может сопровождать как острое поражение ткани печени, так и хроническое течение гепатита. Клиническая картина заболевания в момент выявления признаков кетоза варьирует от малосимптомной, латентной до наличия явных, развернутых проявлений (гепато- и спленомегалия, признаки холестатического, отечно-асцитического синдромов, белково-синтетической недостаточности и др.). Обнаружение измененных лабораторных показателей (уровней аминотрансфераз, билирубина, щелочной фосфатазы, γ-глютамилтранспептидазы, белковых фракций, тимоловой пробы) и инструментальных данных (ультразвуковое исследование органов брюшной полости) дает основание предположить диагноз острого или хронического гепатита. Дальнейший диагностический поиск, направленный на верификацию причины поражения ткани печени, позволит установить генез гепатита и быстро купировать явления кетонемии.
Инсулинома.
Стимуляция кетогенеза в условиях гипер-инсулинизма обусловлена активацией процессов липолиза на фоне длительной гипогликемии. Особенности клинической картины заболевания (возникновение приступа гипогликемии в утренние часы, при пропуске очередного приема пищи, физическом или психическом напряжении), положительная голодовая проба (развитие приступа гипогликемии с резким снижением уровня глюкозы в крови), высокий уровень инсулина, изменение коэффициента соотношения инсулин/глюкоза (более 1), выявление новообразования в ткани поджелудочной железы при проведении КТ свидетельствуют в пользу инсулиномы, что подтверждает вторичный генез ацетонемического синдрома.
Болезнь и синдром Иценко–Кушинга.
Вторичный ацетонемический синдром может быть первым клиническим проявлением гиперкортицизма, когда явные «кушингоидные» признаки заболевания еще не сформировались. В таком случае обязательным является определение гиперпродукции глюкокортикоидов: повышение уровня адренокортикотропного гормона (АКТГ), увеличение концентрации кортизола в крови или его метаболитов в моче (17-оксикортикостероидов в моче или нейтральных 17-кетостероидов – дегидроэпиандростерона в крови).
Необходимо отметить, что определение дегидроэпиандростерона в крови заменяет определение 17-кетостероидов в суточной моче. При этом исключаются погрешности, связанные с неполным сбором образца мочи, нарушением работы почек, исключается интерференция многих лекарств с 17-кетостероидами. Рентгенологическое исследование головы в большинстве случаев бывает неинформативным по причине наличия микроаденом гипофиза. МРТ головы и КТ органов брюшной полости в большинстве случаев позволяют верифицировать диагноз болезни/синдрома Иценко–Кушинга.
Аденома гипофиза.
Клиническая картина аденомы гипофиза полиморфна и представлена разными группами симптомов. Опухоли с ярко выраженными эндокринными симптомами могут встречаться при болезни Иценко–Кушинга, акромегалии, тиреотоксикозе, которые чаще диагностируют на стадии микроаденом или небольших эндоселлярных опухолей. Пролактинсекретирующие аденомы гипофиза также могут быть причиной развития вторичного ацетонемического синдрома. Клинически пролактиномы на «эндокринной» стадии развития у женщин проявляются нарушениями менструального цикла, лактореей, бесплодием, у мужчин имеет место снижение либидо и потенции, гинекомастия. МРТ головного мозга занимает лидирующие позиции в диагностике аденом гипофиза, также могут быть использованы КТ и рентгенография черепа, информативность которых ниже, чем у указанного «золотого» стандарта диагностики новообразований в области турецкого седла.
Болезнь Аддисона.
В некоторых случаях манифестация заболевания может совпадать с развитием острой надпочечниковой недостаточности (надпочечниковый криз), клиника которой включает в себя проявления вторичного ацетонемического синдрома: боль в животе, понос, тошнота, рвота, запах ацетона изо рта, ацетонурия, в редких случаях на фоне выраженного обезвоживания – возникновение клонических судорог и появление менингеальных симптомов. Гиперпигментация кожи, длительная депрессия в анамнезе могут натолкнуть врача на проведение диагностического поиска в правильном направлении.
В диагностике болезни Аддисона основополагающим является определение уровня АКТГ (повышение концентрации, иногда в 7–8 раз), кортизола и его метаболитов — 17-кетостероидов, 17-оксикетостероидов (снижение показателей). Данные дополнительных биохимических и инструментальных исследований (гиперкалиемия, гипонатриемия, гипогликемия, изменение размеров надпочечников) являются неотъемлемыми критериями в диагностике заболевания. Диагностика недостаточности коры надпочечников требует дальнейшей дифференциации диагноза и исключения двустороннего кровоизлияния в надпочечники, эмболии надпочечниковых артерий или тромбоза надпочечниковых вен (при проведении рентгеноконтрастных исследований), туберкулезного поражения коры надпочечников, саркоидоза, синдрома приобретенного иммунодефицита (СПИД).
Хронический алкоголизм.
Алкогольная этиология вторичного ацетонемического синдрома может быть установлена на основании сбора анамнеза в отношении количества, вида и длительности употребления алкогольных напитков, наличия маркеров (стигм) хронического алкоголизма: характерный внешний облик (одутловатое багрово-синюшное лицо с сетью расширенных капилляров в области крыльев носа, щек, ушных раковин, венозное полнокровие глазных яблок), тремор пальцев рук, изменение поведения и эмоционального статуса (развязность, фамильярность, депрессия, эмоциональная неустойчивость), контрактура Дюпюитрена, признаки гипогонадизма. Выявление спутников хронического алкоголизма – сопутствующих заболеваний внутренних органов и нервной системы, а также характерные лабораторные данные (выраженная активность трансаминаз, β-глютамилтранспептидазы и щелочной фосфатазы) могут подтвердить правильность установления диагноза хронического алкоголизма и объяснить причину гиперпродукции кетоновых тел.
Черепно-мозговая травма.
Механическое повреждение целостности черепа и внутричерепных образований (головного мозга, сосудов, мозговых оболочек) может сопровождаться внезапным усилением кетогенеза и появлением кетоновых тел в моче. Наличие в анамнезе болезни сведений о дорожно-транспортном происшествии, падении, производственной, спортивной или бытовой травме, характерные изменения неврологического статуса, нарушение целостности костных структур головного мозга, наличие менингеальных симптомов, изменение уровня сознания дают возможность быстро установить генез кетоза.
Кетогенная диета (диета Аткинса).
Желание иметь идеальную массу тела заставляет многих пациентов следовать различным диетам, исключая из суточного рациона углеводы и дополнительно насыщая его жирами. Отсутствие информации о побочных эффектах выбранной диеты приводит к появлению клинических проявлений кетоза. Накопление кетоновых тел способствует снижению чувства голода и жажды, содействует усилению экскреции кальция и фосфора, накоплению мочевой кислоты. Таким образом, появление признаков ацетонемии на фоне быстрого снижения массы тела при отсутствии каких-либо иных патологических изменений может быть обусловлено преобладанием жиров в суточном рационе пациента. Правильно собранный анамнез, установление факта соблюдения кетогенной диеты не исключают необходимости проведения детального лабораторно-инструментального обследования с целью диагностики возможной сопутствующей патологии, провоцирующей интенсивность кетогенеза.
Хорея Гентингтона, миотоническая дистрофия.
Течение этих наследственных нейродегенеративных заболеваний может сопровождаться деструкцией β-клеток поджелудочной железы и развитием вторичной кетонемии, ацетонурии. Преобладание в клинической картине нарушений мышечного тонуса, гиперкинезов, психопатоподобных расстройств является показанием к проведению консультации невропатолога для исключения возможной генетической причины патологии нервной системы.
Гликогеноз 1-го типа (болезнь Гирке).
Как правило, болезнь Гирке диагностируют в раннем детском возрасте. Однако при легком течении гликогеноза состояние пациентов несколько стабилизируется в пубертатный период, и при дальнейшем прогрессировании заболевания может развиться вторичный ацетонемический синдром.
Наличие гипогликемии, гиперлактатцидемии, гиперлипемии, явлений кетоза на фоне гепатомегалии и нефромегалии может свидетельствовать в пользу наследственной патологии, обусловленной нехваткой ферментов, участвующих в обмене гликогена. Проведение биопсии печени, мышц с последующим гистохимическим определением гликогена в тканях и определением активности фермента глюкозо-6-фосфатазы является основополагающим методом в подтверждении диагноза болезни Гирке.
Наследственные нарушения метаболизма.
Клинические проявления вторичного ацетонемического синдрома могут наблюдаться при наследственных нарушениях метаболизма – патологии митохондрий, органических аминоацидуриях. Хроническая интермиттирующая форма органических ацидурий может манифестировать в любом возрасте в виде приступов «кетотических гипогликемий», протекающих с выраженными в разной степени преходящими неврологическими расстройствами. Аминоацидопатии диагностируются путем анализа концентрации аминокислот в сыворотке крови или в моче при помощи газовой хроматографии и масс-спектрометрии. Во время метаболического криза, спровоцированного приемом «банкетной еды» или инфекционным началом, при обследовании пациента могут быть обнаружены кетонемия, кетонурия, гипогликемия, возможно наличие гиперглицинемии, гиперлактатемии, гипертриглицеридемии, умеренного повышения уровня аммиака в крови. В некоторых случаях течение глютеновой энтеропатии также может осложнять вторичный ацетонемический синдром.
Лечение
Максимально эффективная коррекция вторичного ацетонемического синдрома возможна только при проведении комбинированной терапии, направленной на нивелирование проявлений основного заболевания, приведшего к гиперпродукции кетоновых тел, и симптоматического лечения кетоза. Однако проведение этиологической терапии в большинстве случаев отсрочено по причине проведения лабораторно-инструментального обследования больного, поэтому неотложная терапия ацетонемического синдрома начинается с симптоматического лечения (немедикаментозного и фармакологического).
Необходимым условием лечения ацетонемического синдрома является коррекция пищевого рациона в соответствии с принципом акетогенности (отсутствие жиров, пуриновых оснований, экстрактивных веществ). Пациенты должны употреблять значительное количество жидкости с превалированием щелочных напитков (негазированная слабоминерализованная щелочная вода, лимонные напитки, зеленый чай, неконцентрированный компот из сухофруктов) [4]. Диетологи советуют исключить из рациона концентрированные мясные, костные, рыбные и грибные бульоны, мясо молодых животных и птиц, жирные сорта мяса, субпродукты, сметану и ряженку, помидоры, баклажаны, цветную капусту в вареном виде, бобовые, шоколад, апельсины, напитки, содержащие кофеин, холодные и газированные напитки, а также модифицированные продукты (сублимированные и трансгенные). В рационе больного с кетозом должны преобладать гречневая, геркулесовая, манная каши, сваренные на воде, овощной (крупяной) суп, картофельное пюре, печеные яблоки, галетное печенье, молоко и молочные продукты [4].
Медикаментозная терапия направлена на торможение кетогенеза и ускорение выведение кетоновых тел. Восполнение патологических потерь жидкости проводят с использованием пероральной регидратации растворами электролитов (регидрон, оралит), а также – инфузионной терапии. С целью быстрого восстановления дефицита жидкости, восполнения объема циркулирующей крови, улучшения микроциркуляции рекомендуется использовать Pеосорбилакт
из расчета 10 мл/кг массы тела [3]. Входящий в состав препарата сорбитол быстро включается в метаболизм, утилизируется в печени и накапливается в гепатоцитах в виде гликогена. Возобновление запаса гликогена в печени тормозит процессы кетогенеза и способствует уменьшению выраженности кетонемии. Еще один компонент
Pеосорбилакта
– натрия лактат – способствует коррекции метаболического ацидоза путем восполнения бикарбонатного буфера и увеличения щелочного резерва крови.
Антикетогенными свойствами обладает 5–10% раствор глюкозы, введение которого необходимо совмещать с добавлением необходимого количества инсулина, исходя из показателей гликемического профиля, а также раствор Рингера.
Относительно новым препаратом, обладающим наиболее выраженными антикетогенными свойствами по сравнению с другими углеводами (глюкозой, сахароспиртами), является препарат ксилат [2], двумя основными составляющими которого являются пятиатомный спирт ксилитол и натрия ацетат. Метаболизм ксилитола не зависит от уровня инсулина и активности фермента фруктозо-1,6-дифосфатазы. Ксилитол тормозит процессы кетогенеза благодаря быстрому усвоению его в печени и восстановлению запасов гликогена, энергии. Коррекция метаболического ацидоза за счет наличия в препарате натрия ацетата происходит медленнее по сравнению с растворами натрия гидрокарбоната и не сопровождается резкими колебаниями рН крови. В литературе встречаются различные рекомендации относительно дозировки ксилата: от 10 до 20 мл/кг массы тела в сутки [1, 2].
В качестве абортивной терапии вторичного ацетонемического криза и для торможения рвотного центра могут быть использованы антагонисты 5-HT3 рецепторов и агонисты 5-HT1D рецепторов. С этой целью используется внутривенное введение гранисетрона из расчета 10 мг/кг или ондасетрона в дозе 0,3–0,4 мг/кг каждые 4–6 часов, а также суматриптана до 20 мг в сутки.
С целью нормализации работы печени и косвенного торможения кетогенеза рекомендуется применение гепатопротекторов (урсодезоксихолевая кислота, комбинация аргинина и бетаина) в стандартных дозировках.
Многие авторы рекомендуют применять панкреатические ферменты, кофакторы углеводного обмена (кокарбоксилаза, тиамин, пиродоксин) для повышения толерантности к энтеральному питанию и нормализации всасывания питательных веществ.
Из возможных методов детоксикации, основанных на естественных физиологических процессах, для коррекции вторичного ацетонемического синдрома в клинической практике может применяться промывание желудка и кишечника. Использование растворов натрия бикарбоната в целях детоксикации у больных с ацетонемическим синдромом ограничено из-за отсутствия влияния этого препарата на интенсивность кетогенеза, а также высокой вероятности развития метаболического алкалоза и гипернатриемии.
Проведение экстракорпоральных методов дезинтоксикации может быть показано при уточнении генеза вторичного ацетонемического синдрома, а именно – при абстинентном синдроме, хроническом гепатите и циррозе печени, патологии щитовидной железы, миастенических синдромах, токсикозах беременных, декомпенсированном течении сахарного диабета.
Понимание механизмов развития вторичного ацетонемического синдрома, выделение наиболее вероятных причин формирования кетоза позволит определить генез заболевания, предотвратить развитие ацетонемического криза и кетоацидотической комы, нормализовать состояние больного и предупредить рецидив гиперпродукции кетоновых тел.
Резюме
Если человек обнаруживает кетоны в своей моче, ему следует обратиться к врачу за советом. Если врач обнаружит высокий уровень глюкозы, кетонов или белка в моче человека, он может назначить дальнейшие анализы.
В зависимости от результатов могут потребоваться дополнительные исследования.
Зачастую образ жизни, такой как здоровое питание и физические упражнения, являются ключом к снижению риска дальнейших осложнений. Тем не менее, врач может также назначить лечение или рекомендовать госпитализацию в некоторых случаях.
Эффективные способы нормализации метаболизма
При выявлении кетоацидоза или кетонурии необходимо выявить, устранить причину, и принять меры:
1. Диабетикам нужно нормализовать уровень глюкозы. 2. При интоксикации и пищевых отравлениях показаны абсорбенты, очищающие кишечник клизмы, а также восстанавливающие водный баланс солевые растворы (регидрон, орсоль). 3. При сильном истощении понадобится внутривенное вливание глюкозы. 4. Если причина – инфекционное заболевание и лихорадка, нужно применить препараты против возбудителя, а также стабилизировать температуру.
Общие рекомендации – не допустить перегрузок и обезвоживания. В первом случае поможет специальная диета, во втором — обильное потребление жидкости.
Источник: Pharmindex.ru для газеты «Аптека»
Механизм развития диабетического кетоацидоза
При нехватке инсулина организм не может превратить глюкозу в необходимую энергию. Начинается потребление жиров. При их использовании в организме накапливаются кетоновые тела, содержание которых стремительно возрастает. Кетоновые тела не могут попасть в кровь из-за отсутствия инсулина. Через почки они проникают в мочу. Высокое содержание побочных продуктов быстро отравляет организм, приводит к осложнениям.
Пациент, знающий о причинах, симптоматике, способах профилактики и лечения, может избежать возникновения диабетического кетоацидоза.
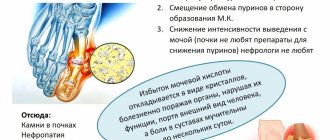
Какой анализ мочи нужен при цистите
При подозрении на цистит сначала обязательно нужно сдать общий анализ мочи (ОАМ). В результатах ОАМ при цистите будет выявлено повышенное содержание лейкоцитов, бактерий, может встречаться повышенное содержание эритроцитов и белка.
Дополнительно лечащий врач может рекомендовать провести бактериальный посев мочи с определением антибиотикочувствительности к выявленным патогенным микроорганизмам, ПЦР диагностику на заболевания, передающиеся половым путем, ряд исследований на диагностику вирусных инфекций (так как не всегда причиной цистита являются бактерии).
Из инструментальных исследований врач может направить пациента на УЗИ почек, КТ/МРТ малого таза для исключения опухолей и камней в мочевыделительной системе, заболеваний почек и предстательной железы у мужчин.
Профилактика обострений цистита
- Регулярно проводить тщательный туалет наружных половых органов
- Использовать барьерные способы контрацепции
- Своевременно проводить лечение гинекологических и урологических заболеваний
- В течение ближайшего времени после полового акта помочиться
Как правильно собирать анализ мочи при цистите
В стерильный контейнер собирается средняя порция мочи при первом утреннем мочеиспускании (первая и последние порции сливаются в унитаз).
Возможен сбор мочи в любое время в течение дня по предварительному согласованию с лечащим врачом.
Во время сбора мочи желательно не касаться контейнером тела.
Перед началом мочеиспускания женщинам нужно развести пальцами половые губы пальцами, чтобы с кожи наружных половых органов в мочу не попали посторонние примеси.
Объем мочи для исследования должен составлять ¾ объема контейнера. Минимальный объем мочи для исследования составляет 30 мл.
Доставить контейнер с мочой в медицинский офис желательно в течение 2-х часов после сбора биоматериала.