Фармакологические свойства препарата Финастерид
Синтетическое 4-азастероидное соединение, специфический ингибитор 5-α-редуктазы, внутриклеточного фермента, превращающего тестостерон в более активный андроген — дигидротестостерон (ДГТ). При доброкачественной гиперплазии предстательной железы (ДГПЖ) ее увеличение обусловлено превращением тестостерона в ДГТ в тканях предстательной железы. Финастерид является высокоэффективным средством, снижающим содержание ДГТ в крови и предстательной железе. Финастерид не обладает сродством к рецепторам андрогенов. Лечение финастеридом вызывает регрессию гипертрофии предстательной железы, устойчиво повышает максимальную скорость тока мочи и улучшает клиническую симптоматику.
Финастерид (Пропеция/Проскар)
Тестостерон у мужчин производится в основном в яичках, а также в надпочечниках. Большая часть тестостерона в организме связана с глобулином, связывающим половые гормоны (ГСПГ), белком, вырабатываемым в печени, который транспортирует тестостерон через кровь, предотвращает его метаболизм, и продлевает срок его полураспада. При освобождении от связи с ГСПГ, свободный тестостерон может проникать в клетки по всему телу. В некоторых тканях, в частности, в тканях кожи головы, кожи и предстательной железы, тестостерон, под действием фермента 5альфа-редуктазы, превращается в 5альфа-дигидротестостерон (ДГТ). ДГТ является более мощным андрогеном, чем тестостерон (обладая приблизительно в 3-10 раз большей активностью в отношении андрогенного рецептора, участка действия андрогенных гормонов), поэтому 5альфа-редуктаза может рассматриваться для усиления андрогенного действия тестостерона в тех тканях, где он находится. Финастерид, 4-азастероид и аналог тестостерона, действует как мощный и конкретный, конкурентный ингибитор одного из двух подтипов 5альфа-редуктазы, в частности, изофермента типа II. Иначе говоря, он связывается ферментом и предотвращает метаболизм эндогенных субстратов, таких как тестостерон. 5альфа-редуктазы типа I и II являются причиной примерно одной трети и двух третей системного производства ДГТ, соответственно. Другие субстраты 5a-редуктазы включают прогестерон, андростендион, эпи-тестостерон, кортизол, альдостерон и дезоксикортикостерон. Неизвестен полный физиологический эффект от их восстановления, однако он, вероятно, связан с их выделением или сам по себе является физиологическим. Помимо того, что препарат действует как катализатор в ограничении скорости реакции восстановления тестостерона, изоформы I и II фермента 5альфа-редуктазы восстанавливают прогестерон до дигидропрогестерона (ДГП) и дезоксикортикостерон до дигидродеоксикортикостенора (ДГДОК). In vitro и животные модели показывают, что последующее 3альфа восстановление ДГТ, ДГП и ДГДОК приводит к созданию стероидных метаболитов, воздействующих на функционирование мозга за счет повышения ГАМК-ингибирования гамма-аминомасляной кислоты. Эти нейроактивные стероидные производные увеличивают уровень ГАМК на ГАМК (А) рецепторах и оказывают противосудорожное, антидепрессивное и анксиолитическое действие, а также воздействуют на поведение, связанное с сексом и алкоголем. 5альфа-дигидрокортизол из внутриглазной жидкости синтезируется в хрусталиках, и сам может участвовать в производстве внутриглазной жидкости. Аллопрегнанолон и ДГДОК являются нейростероидами, причем последний может влиять на восприимчивость животных к эпилепсии. 5альфа-дигидроальдостерон является мощным антидиуретическим средством, хотя он и отличается от альдостерона. Его формирование в почках повышается за счет ограничения пищевой соли, что предполагает, что натрий можно сохранить следующим образом:
Субстрат + НАДФН + Н + → 5альфа -подложка + NADP +
5альфа-ДГП является одним из основных гормонов в кровотоке у женщин с нормальным циклом и у беременных женщин. При ингибировании 5-альфа-редуктазы Финастерид предотвращает образование тестостерона в ДГТ при помощи изофермента типа II, что приводит к снижению уровней ДГТ в сыворотке крови примерно на 65-70%, и к повышению уровней ДГТ в простате до 85-90%, где доминирует экспрессия изофермента типа II. В отличие от двойных ингибиторов обоих изоферментов 5альфа-редуктазы, которые могут снижать уровни ДГТ во всем организме более чем на 99%, Финастерид не способен полностью подавлять производство ДГТ, поскольку он не может оказывать значительного ингибирующего действия на изофермент типа I 5альфа-редуктазы, обладая в 100 раз меньшим сродством к I по сравнению с II. В дополнение к блокированию изофермента типа II, Финастерид конкурентно ингибирует изофермент 5бета-редуктазы типа II, однако не считается, что это влияет на метаболизм андрогенов. Блокируя производство ДГТ, Финастерид снижает активность андрогенов в коже головы. В предстательной железе ингибирование 5альфа-редуктазы уменьшает объем предстательной железы, снижая развитие доброкачественной гиперплазии предстательной железы (ДГПЖ) и риск рака простаты. Ингибирование 5альфа-редуктазы также уменьшает вес придатка яичка, снижает подвижность и изменяет нормальное расположение сперматозоидов в придатках. Причина возникновения связанных с настроением и сексуальных побочных эффектов ДГТ и нейроактивные стероиды (НАС), такие как аллопрегнанолон (АЛЛО) и тетрагидродеоксиортикостерон (ТГДОК), являются мощными положительными аллостерическими модуляторами ГАМК-рецептора (воздействуя на те же участки, что и вещества, вызывающие эйфорию и анксиолитические препараты, такие как бензодиазепины и алкоголь), и представляют собой важные эндогенные нейрорегуляторы, обладающие мощным антидепрессивным и анксиолитическим действием, а также играющие положительную роль в половом функционировании. Их биосинтез зависит от обеих изоформ 5альфа-редуктазы. Финастерид снижает их образование в организме. Этот эффект Финастерида является вероятной причиной эмоциональных и сексуальных побочных эффектов, связанных с препаратом. Кроме того, поскольку сюда вовлечен не только ДГТ, но и НАС, потенциально можно также объяснить тот факт, что эффекты, связанные с настроением и тревожностью, наблюдаются не только у мужчин, но и у женщин.
Особые указания по применению препарата Финастерид
При большом объеме остаточной мочи и/или при резко сниженном оттоке мочи необходимо осуществлять строгий контроль за состоянием пациента, так как возможно развитие обструктивной уропатии. До сих пор не было обнаружено клинически благоприятного эффекта от лечения финастеридом больных раком предстательной железы. Пациентов с ДГПЖ и повышенным содержанием ПСА наблюдали в контролированных клинических исследованиях с серийным определением ПСА и биопсией предстательной железы. В этих исследованиях финастерид не повлиял на степень выявляемости рака предстательной железы. Общая частота рака предстательной железы достоверно не отличалась у больных, получавших финастерид или плацебо. До начала и периодически во время лечения финастеридом рекомендуется проводить ректальное пальцевое обследование, а также другие виды исследований, позволяющие исключить наличие рака предстательной железы. Определение уровня ПСА также используется в медицинской практике для выявления рака предстательной железы. Как правило, уровень ПСА выше 10 нг/мл свидетельствует о необходимости проведения как дальнейших лабораторных исследований, так, возможно, и биопсии; дальнейшие лабораторные исследования показаны также при уровнях ПСА 4–10 нг/мл. Отмечено существенное сходство уровней ПСА у мужчин с диагностированным раком предстательной железы или без такового. Поэтому у мужчин с ДГПЖ уровни ПСА в нормальном диапазоне не исключают наличие рака предстательной железы, независимо от лечения финастеридом. Уровень ПСА, превышающий 4 нг/мл, не исключает наличия рака предстательной железы. Финастерид снижает концентрацию ПСА приблизительно на 50% у пациентов с ДГПЖ, даже при наличии злокачественной опухоли предстательной железы. Следует принимать во внимание, что у больных с ДГПЖ, принимающих финастерид, сниженный уровень сывороточного ПСА не исключает одновременного наличия злокачественной опухоли. Данное снижение уровня ПСА можно предсказать с достаточной степенью достоверности в довольно широком диапазоне значений, хотя в отдельных случаях оно может варьировать. По данным клинических исследований при определении ПСА у пациентов, принимающих финастерид, полученные значения следует удваивать по сравнению с нормальными показателями у мужчин. Эта коррекция позволяет сохранить чувствительность и специфичность метода и его диагностическую ценность для выявления рака предстательной железы. При устойчивом повышении уровня ПСА у больных, которым был ранее назначен финастерид, следует тщательно проанализировать данный показатель, не исключая вероятности того, что пациент не принимал финастерид. Концентрация ПСА в плазме крови зависит от возраста больного и размеров предстательной железы; в свою очередь объем предстательной железы зависит от возраста пациента. При интерпретации результатов лабораторных исследований ПСА следует принять во внимание, что, как правило, у больных, принимающих финастерид, уровень ПСА обычно снижен. У большинства больных быстрое снижение уровня ПСА наблюдается уже в течение первых месяцев лечения, после чего уровень ПСА стабилизируется до нового исходного значения, которое в 2 раза меньше такового до начала лечения. Таким образом, при лечении финастеридом в течение 6 мес и более уровень ПСА должен быть удвоен для сравнения с нормальными показателями у мужчин. Из-за способности ингибиторов 5-α-редуктазы подавлять превращение тестостерона в ДГТ такие препараты (включая финастерид) могут вызвать нарушения в развитии наружных половых органов у плода мужского пола, в связи с чем беременные или женщины, которые могут забеременеть, должны избегать контакта с финастеридом. Не предназначен для применения в педиатрии.
Финастерид в лечении больных гиперплазией простаты
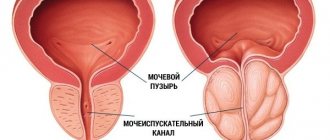
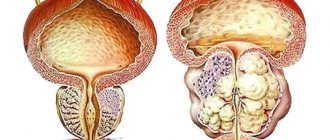
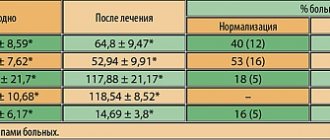
Клинические проявления заболевания определяются степенью нарушения оттока мочи. Симптомокомплекс заболевания включает обструктивные (затрудненное, вялой струей, с натуживанием мочеиспускание, ощущение неполного опорожнения мочевого пузыря) и ирритативные (учащенные позывы на мочеиспускание в дневное и ночное время, императивные позывы на мочеиспускание, которые могут сопровождаться неудержанием мочи) симптомы, которые объединяют в симптомы нижних мочевых путей (СНМП). Хотя симптомы нарушения оттока мочи (слабая струя, прерывистое мочеиспускание) встречаются значительно реже, чем ирритативные симптомы (учащенное мочеиспускание малыми порциями, никтурия, императивные позывы, недержание мочи), они являются доминирующими среди симптомов, снижающих качество жизни пациентов [2]. Около 25% мужчин после 50 лет имеют симптомы нижних мочевых путей (СНМП), выраженность которых обычно определяется суммой баллов Международной шкалы симптомов предстательной железы (IPSS), которая была разработана для объективизации клинических проявлений ДГПЖ [6,7]. Клинические исследования показывают, что СНМП преобладают и прогрессивно нарастают с возрастом (4,8). На сегодняшний день ожидаемая средняя продолжительность жизни мужчины в Европе и Северной Америке составляет 72 года и продолжает расти [8]. Динамика роста такова, что с 1980 по 2050 г. население в возрасте более 65 лет должно удвоиться и достигнуть 15% от всей человеческой популяции. Как следствие, можно ожидать и увеличения количества потенциальных больных, страдающих гиперплазией предстательной железы. В связи с этим диагностика и лечение ДГПЖ представляют собой не только серьезную медицинскую, но и большую социальную проблему, что подчеркивает значение своевременного лечения ДГПЖ [2]. В настоящее время применяются медикаментозные и хирургические методы лечения ДГПЖ, которые являются достаточно эффективными. В результате применения медикаментозной терапии существенно снизилось количество оперативных вмешательств по поводу гиперплазии простаты. Так, к примеру, в США число трансуретральных и открытых аденомэктомий уменьшилось с 250000 в 1987 г. до 88000 в 2000 году, и это при том, что общее число пациентов, страдающих ДГПЖ, в результате старения населения увеличилось [5]. Аналогичные тенденции прослеживаются и в других странах, в том числе и в России. Основными направлениями консервативной терапии ДГПЖ являются: • снижение выраженности симптомов, • улучшение качества жизни, • предотвращение прогрессии заболевания (в частности, предотвращение такого тяжелого осложнения, как острая задержка мочи, и необходимости оперативного лечения) [9]. На сегодняшний день, как известно, существует 3 группы препаратов, используемых в терапии больных гиперплазией простаты: ?1–адреноблокаторы, ингибиторы 5?–редуктазы и растительные экстракты [2]. Одним из наиболее широко применяемых и изученных препаратов является финастерид (Простерид и др.) – синтетический ингибитор 5a–редуктазы. Одно из центральных положений теории патогенеза ДГПЖ касается роли фермента 5a–редуктазы и дигидротестостерона (ДГТ). Основанием для развития этой концепции стало наблюдение случаев псевдогермафродитизма, обусловленного врожденным отсутствием 5a–редуктазы. При нормальных показателях тестостерона сыворотки крови у этих мужчин было зарегистрировано значительное снижение уровня ДГТ, сопровождавшееся недоразвитием или практически отсутствием предстательной железы. В последующем у них не отмечалось возникновения аденомы и рака предстательной железы (РПЖ). По химическому строению финастерид относится к 4–азастероидам и является мощным конкурентным ингибитором 5a–редуктазы, преимущественно типа 2. Препарат блокирует превращение тестостерона в более активный андроген – 5a–ДГТ на уровне предстательной железы. При терапии финастеридом (Простерид) уменьшается объем предстательной железы, уровень ДГТ сыворотки крови снижается на 70–75%, а показатель ПСА – примерно на 50%. Установлен механизм воздействия финастерида на патогенез ДГПЖ через факторы роста: специфическое влияние препарата на сигнальную систему TGFb, которая оказывает ингибирующее действие на пролиферацию ткани предстательной железы, приводит к железистой атрофии и стимулирует процесс клеточной смерти (апоптоз), а также достоверное снижение внутрипростатических уровней ДГТ и EGF (преимущественно в периуретральной зоне) и уменьшение присутствия bFGF в строме предстательной железы больных ДГПЖ [F. Sciarra и соавт., 1997; F. Torruba и соавт., 1997; С. Saez и соавт., 1999]. Серией морфологических исследований было продемонстрировано, что у мужчин финастерид приводит к атрофическим процессам в железистой и стромальной тканях предстательной железы, причем в первом случае изменения обнаруживаются уже через 3, а во втором – через 6 месяцев лечения [M. El–Demiry, E. Ishak, 1997]. По данным L. Marks и соавт. (1997 г.) и M. Feneley и соавт. (1997 г.), терапия финастеридом примерно на 50% уменьшает долю эпителиальной ткани в предстательной железе и эпителиально–стромальное соотношение, преимущественно в транзиторной зоне. Финастерид используется в клинической практике с конца 80–х – начала 90–х годов XX века. Клиника урологии ММА имени И.М. Сеченова имеет опыт длительного использования финастерида, впервые апробированного в рамках двухгодичного многоцентрового плацебо–контролированного двойного слепого исследования в 1992–1994 гг. Нами проведен анализ собственного опыта продолжительного лечения больных гиперплазией предстательной железы финастеридом в урологической клинике Московской медицинской академии в период с 1995 по 2004 год. В основу анализируемых данных легли результаты 5–летнего лечения финастеридом 56 пациентов, страдающих ДГПЖ. Средний возраст больных составил 63,8 года (от 59 до 81 года). Пациенты принимали финастерид по 5 мг 1 раз в сутки. Контрольные обследования проводились у больных через 2, 6, 12, 24 месяца, 3, 4 года и 5 лет. Количественную оценку жалоб больных гиперплазией предстательной железы мы проводили, используя опросник IPSS. Исходное среднее значение общего балла IPSS составило 14,6 баллов. Статистически достоверное снижение среднего значения балла IPSS было отмечено после 6 месяцев лечения и составило 13%. Еще более выраженное (22%) снижение среднего значения IPSS зарегистрировано через 12 месяцев терапии. В последующие 4 года эффект от лечения сохранялся: средний балл IPSS медленно снижался и к концу пятого года лечения составил 10,65 (–27% от исходного). Оценка качества жизни пациентов проводилась по результатам ответа на вопрос о степени беспокойства (BS), причиняемого симптомами нарушенного мочеиспускания, содержащийся в опроснике IPSS–BS. Анализ значений показателя BS показал достоверное его снижение уже через 6 месяцев лечения, что свидетельствовало об улучшении качества жизни больных и, соответственно, о субъективной эффективности лечения. Среднее значение индекса качества жизни BS исходно составило 3,8 баллов – в основном неудовлетворительно, а после 60 месяцев лечения – 1,9 – в основном удовлетворительно. Стойкое улучшение показателя качества жизни на протяжении 5 лет лечения финастеридом зарегистрировано у 73,2 % пациентов. В качестве критериев объективной оценки эффективности медикаментозного лечения финастеридом мы использовали изменение максимальной объемной скорости мочеиспускания (Qmax) по данным урофлоуметрии и объема гиперплазированной предстательной железы по данным трансректальной ультрасонографии до, в процессе и после окончания терапии. Исходное среднее значение Qmax составило 9,4 мл/с. Статистически значимо среднее значение Qmax увеличилось уже после шести месяцев терапии финастеридом и составило 11,4 (+2) мл/с. Наиболее существенный рост показателя отмечен к концу 12 месяца лечения (12,5 мл/с; +3,1 мл/с). К окончанию пятилетнего периода средний показатель Qmax еще несколько повысился и составил 12,7 (+3,3 мл/с), что объективно свидетельствовало о сохраняющейся эффективности финастерида при длительном использовании. По данным трансректальной ультрасонографии среднее значение исходного объема гиперплазированного объема предстательной железы составило 51,8 см3. В течение первых 6 месяцев лечения финастеридом произошло уменьшение увеличенной предстательной железы в среднем на 9%, после 12 месяцев терапии отмечено наиболее значительное уменьшение среднего объема простаты до 40,7 см3 (–23%), в течение следующих четырех лет лечения происходило дальнейшее уменьшение объема гиперплазированной предстательной железы, в результате чего среднее значение объема простаты уменьшилось до 37,9 см3 (– 26,7% от исходного). Степень уменьшения объема гиперплазированной простаты была более выражена у больных с исходным объемом более 40 см3, что, вероятно, обусловлено преобладанием железистого компонента при гиперплазии больших размеров. Медикаментозное лечение финастеридом привело к достоверному уменьшению среднего объема гиперплазированной предстательной железы, с сохранением данной тенденции на протяжении всех 60 месяцев наблюдения. Таким образом, лечение финастеридом на протяжении 5 лет было эффективным как по данным субъективной оценки (IPSS–BS), так и по объективным параметрам (Qmax, объем простаты) [1]. Безопасность длительного лечения финастеридом оценивали на основе частоты и выраженности побочных реакций и изменений в анализах крови и мочи. Оценку изменений сексуальной функции регистрировали с помощью краткого опросника для оценки половой (Brief Sexual Function Inventory) – BSFI. Из 56 больных, принимавших финастерид, у 6 (10,7%) пациентов было диагностировано 7 нежелательных явлений. Большинство неблагоприятных явлений было обусловлено воздействием финастерида на сексуальную функцию – у 8,9% наших пациентов имели место расстройства эрекции и/или снижение полового влечения. В течение 60 месяцев применения финастерида прекратили лечение 13 (23,2%) из 56 больных. В связи с побочными явлениями завершили прием препарата 4 (7,1%) пациента: у 3–х пациентов возникли сексуальные нарушения, а у одного больного после 3 лет непрерывного приема финастерида развилась гинекомастия. Все трое больных с сексуальными нарушениями, отказавшиеся от дальнейшего лечения финастеридом, были моложе 65 лет, и для них была важна сохранная сексуальная активность. После прекращения приема финастерида у всех 3 пациентов произошло восстановление сексуальной функции. 8 (14,3%) из 56 больных отказались от дальнейшего лечения в связи с отсутствием эффекта. Лишь у 1 (1,8%) больного в процессе лечения возникла острая задержка мочеиспускания, потребовавшая оперативного лечения. В ходе лечения финастеридом не было отмечено клинически значимых изменений лабораторных показателей. Полученные нами результаты свидетельствуют об относительно небольшой частоте нежелательных явлений и о безопасности длительного применения финастерида у больных гиперплазией простаты [1]. Эффективность и безопасность продолжительной терапии финастеридом была также установлена в ходе нескольких больших исследований, в том числе плацебо–контролируемых. Данные исследований эффективности препарата представлены в таблице 1. По данным всех представленных исследований, в процессе непрерывного лечения сроком до 4 лет финастерид позволял статистически значимо по сравнению с плацебо уменьшать степень выраженности расстройств мочеиспускания (снижать суммарный балл IPSS), повышать качество жизни больных (снижать показатель BS) и уменьшать объем предстательной железы (по данным трансректального УЗИ). Таким образом, исследования свидетельствуют о продолжительном эффекте и о безопасности длительного лечения больных ДГПЖ финастеридом. Интересными и важными представляются и данные об эффективности финастерида в качестве средства химиопрофилактики рака предстательной железы (РПЖ). Влияние на обмен тестостерона в предстательной железе давно привлекало внимание специалистов к финастериду, как к потенциальному средству химиопрофилактики рака [I.Thompson и соавт., 1995]. Оценить подобные возможности препарата удалось только после завершения масштабного исследования, проведенного под патронажем Национального института рака США и получившего название PCPT. В нем участвовали 18882 мужчины старше 50 лет, с отсутствием изменений, подозрительных в отношении РПЖ при осмотре per rectum, уровнем ПСА менее 3 нг/мл и показателем IPSS менее 20 баллов. Всем пациентам на начальном этапе исследования была произведена биопсия предстательной железы, по результатам которой исключили случаи РПЖ и дисплазии высокой степени (простатическая интраэпителиальная неоплазия – ПИН). В течение 3 месяцев все участники исследования получали плацебо, после чего были рандомизированы на две примерно равные группы, одна из которых (n=9423) получала финастерид 5 мг/сут., а другая (n=9459) – плацебо. Контрольные биопсии выполняли в ходе программы «по показаниям» (при превышении уровня ПСА в 4 нг/мл) и всем пациентам по ее завершении. Исследование продолжалось 7 лет. В итоге РПЖ был диагностирован у 18,4% пациентов, принимавших финастерид, и у 24,4% – плацебо, т.е. относительный риск развития заболевания снизился на 24,8% (p<0,001). У подавляющего числа пациентов диагностирована локализованная опухоль T1–2 (97,7–98,4%). В то же время при лечении финастеридом по сравнению с плацебо достоверно чаще обнаруживались опухоли высокой градации по Глисону (G 7–10) – 37 и 22,2% соответственно. По результатам исследования PCPT были сделаны следующие выводы: 1) финастерид предотвращает или замедляет развитие РПЖ; 2) зарегистрировано достоверное уменьшение частоты возникновения РПЖ (примерно на 25%) в группе финастерида по сравнению с плацебо; 3) снижение риска развития РПЖ продемонстрировано по результатам биопсии в конце исследования и по результатам биопсии «по показаниям»; 4) данный результат получен во всех группах пациентов вне зависимости от возраста, расы, уровня ПСА, семейного анамнеза РПЖ. Обращаясь к результатам PCPT, необходимо отметить, что исследование оперировало только пациентами с «чистой» ДГПЖ и не ответило на вопрос о характере влияния финастерида при уже существующей дисплазии простатического эпителия (ПИН). А.В. Сивковым и соавт. было проведено пилотное исследование действия финастерида на ткань предстательной железы у пациентов с ДГПЖ и ПИН. Всем участникам программы до и после применения препарата в течение не менее 6 месяцев была выполнена мультифокальная биопсия предстательной железы [A. Sivkov и соавт., 2004]. В результате выявлено достоверное уменьшение пролиферативной активности эпителия у 95% пациентов, частоты эпителиальных форм ДГПЖ у 76%, а также статистически значимое увеличение частоты стромальных форм ДГПЖ и стромально–эпителиального соотношения примерно в 2 раза (с 2,21 до 4,75). РПЖ был диагностирован лишь у 6,7% больных и имел градацию по Глисону G 6–8. При этом зарегистрировано достоверное снижение частоты случаев метаплазии эпителия с 67 до 15%, частоты обнаружения ПИН высокой степени с 73 до 13% и уменьшение площади, занимаемой воспалительной реакцией. Последний факт также имеет значение для химиопрофилактики РПЖ в свете данных о влиянии хронического воспаления на развитие опухоли [M. Lucia, K. Torkko, 2004]. Кроме того, препарат может быть рекомендован пациентам с упорным течением хронического простатита [А.В. Сивков и соавт., 2004] [3]. До настоящего времени наиболее полным и актуальным исследованием, посвященным лечению ДГПЖ, остается исследование MTOPS (Medical Treatment of Prostatic Symptoms). Это двойное слепое плацебо–контролируемое, рандомизированное исследование, целью которого стало изучение эффективности терапии доксазозином, финастеридом или их комбинации в предотвращении и замедлении прогрессирования гиперплазии простаты, включавшее обследование 3047 пациентов (средний период наблюдения – 4,5 года). В результате было показано, что и доксазозин, и финастерид, и их комбинация достоверно эффективны в отношении симптомов нижних мочевых путей. Риск клинического прогрессирования заболевания при приеме доксазозина достоверно снижается на 39% (p<0,001), на 34% при приеме финастерида (p<0,002) и на 66% при использовании комбинации доксазозин и финастерид (p<0,002) по сравнению с плацебо [11]. Рядом авторов [G. Crea, G. Sanfilippo, G. Anastasi, C. Magno, C. Vizzini, A. Inferrera] была изучена возможность применения финастерида при подготовке к эндоскопическому лечению доброкачественной гиперплазии предстательной железы. 30 пациентов основной группы в качестве предоперационного профилактического лечения принимали финастерид в дозе 5 мг/сут. в течение 8–10 нед. В результате было отмечено, что в группе пациентов, получавших в предоперационном периоде финастерид (средний возраст 69 лет), объем кровопотери, определяемый по разнице уровня гемоглобина до и после операции, был минимальным. Пациентам этой группы проведения гемотрансфузии не потребовалось. Снижение уровня гемоглобина через 24 ч после операции в основной группе в среднем составило 0,9%. В контрольной группе (средний возраст 67 лет) 4 (12%) пациентам была проведена гемотрансфузия. Снижение гемоглобина в среднем составило 2,36%. Пациенты обеих групп наблюдались в течение 3 месяцев после операции. У двоих (6,6%) пациентов из контрольной группы через неделю после выписки развилась острая задержка мочеиспускания, обусловленная скоплением кровяных сгустков. Результаты исследования были статистически достоверными (р<0,001) [12]. Таким образом, использование финастерида (Простерид и др.) при лечении доброкачественной гиперплазии простаты позволяет эффективно влиять на симптомы нижних мочевых путей как при использовании в качестве монотерапии, так и в сочетании с a–адреноблокаторами. Одновременно данные, полученные в последние годы, делают целесообразным назначение финастерида в качестве средства профилактики развития рака простаты.
Литература 1. Аляев Ю.Г., Винаров А.З., Локшин К.Л., Спивак Л.Г. Выбор метода лечения больных гиперплазией предстательной железы, Кострома, 2005. 2. Лопаткин Н.А. Доброкачественная гиперплазия предстательной железы. Под ред. Н.А. Лопаткина, Москва, 1999. 3. А.В.Сивков, В.Н.Ощепков. Финастерид: 20 лет клинической практики лечения больных аденомой предстательной железы // Consillium Medicum Том 08/N 4/2006 4. Berry S.J., Coffey D.S., Walsh P.C., et al. The development or human benign prostatic hyperplasia with age // J.Urol. 1984. 132. 474–79. 5. Health Care Finansing Administration: B.E.S.S. Data, Washington, DC, 2000. 6. Girman C.J, Chute C.G., Panser L.A., et al. The prevalence of prostatism: a population–based survey of urinary symptoms // J. Urol. 1993. 150. P. 85–9. 7. Garraway W.M., Collins G.N., Lee R.J. High prevalence of benign prostatic hypertrophy in the community // Lancet 1991. 338. Р. 469–71. 8. Logie J.W., Clifford G.M. et al. Lower urinary tract symptoms suggestive of benign prostatic obstruction – Triumph: the role of general practice databases // Eur. Urol. 2001; Vol. 39. (SBppl 3). P.42–7. 9. F. Montorsi, I. Moncada, Safety and tolerability of treatment for BPH // Eur. Urol. Sappl. 2006. 5. P. 1005. 10. Novara G.,Galfanoa.,Gardi M.,Ficcara V.,Boccon Gibonl.,Artibani W. Critical review of guidelines for BPH diagnosis and treatment strategy.Eur Urol Suppl 2006;5: 418–29. 11. McConnell JD, Roehrborn CG, Bautista OM, Andriole GL Jr ed. The long–term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. J Urol, 2006 Jan; 175 (1):217–20. 12. G.Sanfilippo, G.Crea, G.Anastasi, C.Magno, C.Vizzini, A.Inferrera, Применение финастерида при подготовке к эндоскопическому лечению доброкачественной гиперплазии предстательной железы // Consillium Medicum Том 09/N 4/2007.
Взаимодействия препарата Финастерид
Клинически значимые взаимодействия с другими лекарственными средствами не отмечены. По-видимому, финастерид не оказывает заметного действия на связанную с цитохромом Р450 ферментную систему, участвующую в метаболизме некоторых препаратов. В ходе клинических исследований изучены комбинации с пропранололом, дигоксином, глибуридом, варфарином, теофиллином и антипирином. В клинических исследованиях финастерид также использовали совместно с ингибиторами АПФ, блокаторами α- и β-адренорецепторов, блокаторами кальциевых каналов, нитратами, диуретиками, антагонистами Н2-гистаминовых рецепторов, ингибиторами ГМГ-КоА редуктазы, НПВП, хинолонами и бензодиазепинами. При этом клинически значимых отрицательных реакций не обнаружено.