Какие заболевания вызывают стафилококки
Содержание статьи
Основными возбудителями гнойно-септических заболеваний являются стафилококки (от греческого «стафили» — гроздья, «коккос» — ядра, шарики, что соответствует виду этих микробов под микроскопом) и стрептококки (от греческого «стрептос» — цепь).
Этим микроорганизмам мы обязаны такими заболеваниями, как фурункулы, карбункулы, пиодермии, абсцессы, флегмоны, панариции и другие нагноения кожных покровов. При поражении слизистых развиваются конъюнктивиты, стоматиты, отиты, энтериты.
Тяжелыми формами болезни являются пневмонии, остеомиелиты (поражения костной ткани) и особенно опасны септические — генерализованные воспалительные процессы во внутренних органах, когда стафилококки и другие микроорганизмы циркулируют в крови (заражение крови).
После гнойных инфекций возникают различные осложнения, в том числе такие, которые могут приводить к хроническому течению болезни, инвалидности (миокардиты, пороки сердца, тромбофлебиты, перитониты — воспаления брюшины).
Потери, связанные с утратой трудоспособности только от стафилококовых заболеваний, превышают показатели, обусловленные всеми инфекционными болезнями, за исключением гриппа. Число новорожденных и взрослых, гибнущих от стафилококковых инфекций, более чем в два раза превышает число погибших от других заразных болезней.
Причины стафилококка
Причиной развития практически всех стафилококковых болезней является нарушение целостности кожи или слизистых оболочек, а также употребление зараженных продуктов питания. Уровень вреда также зависит от штамма бактерии, а также функционирования иммунной системы. Чем иммунитет крепче, тем меньше вреда стафилококки способны нанести здоровью человека. Таким образом, можно сделать заключение, что в большинстве случаев, для заболевания стафилококком необходимо сочетание 2х факторов – попадание инфекции внутрь и нарушение нормального функционирования иммунной системы.
Как передается стафилококк? Рассмотрим наиболее популярные пути заражения стафилококковой инфекцией.
Как стафилококк может попасть в организм?
Воздушно-капельный путь. В сезон респираторных заболеваний, частое пребывание в местах большого скопления людей также повышает риск заражения, причем не только стафилококковой, но и многими другими видами инфекции, в т.ч. вирусной, грибковой. Чиханье, кашель – подобные симптомы служат своего рода маячками, от которых здоровым людям, по возможности, нужно держаться подальше.
Воздушно-пылевой путь. Домашняя и уличная пыль содержит в себе большое количество различных микроскопических частичек – пыльцы растений, слущенных частичек кожи, шерсть различных животных, пылевых клещей, частички различных материалов (ткань, бумага), и все это обычно приправлено различной инфекцией – вирусами, бактериями, грибками. Стафилококк, стрептококк и другие виды инфекции очень часто находятся в пыли, и когда мы дышим подобным воздухом, это не лучшим образом сказывается на нашем здоровье.
Контактно-бытовой путь. Обычно заражение происходит при совместном использовании предметов личной гигиены, постельного белья, особенно если один из членов семьи приболел. Риск заражения повышается при травмировании кожных покровов, слизистой оболочки.
Фекально-оральный (алиментарный) путь. Инфицирование происходит при употреблении пищи грязными руками, т.е. — при несоблюдении правил личной гигиены. Тут стоит также отметить, что заражение алиментарным путем также является частой причиной заболевания таким болезнями, как — ботулизм, гепатит и другими сложными инфекционными болезнями.
Медицинский путь. Заражение стафилококком происходит при контакте недостаточно чистыми медицинскими инструментами, как при хирургических вмешательствах, так и при некоторых видах диагностики, которые подразумевают под собой нарушение целостности кожного покрова или слизистых оболочек. Это обычно обусловлено обработкой инструментов средством, к которому стафилококк выработал стойкость.
Как стафилококк может серьезно навредить здоровью человека, или что ослабляет иммунную систему?
Наличие хронических болезней. Большинство болезней свидетельствуют об ослабленной иммунной системе. Если патологические процессы уже происходят в организме, ему сложнее защищаться от других болезней. Поэтому, любое заболевание повышает риск присоединения к нему вторичной инфекции, и стафилококковая одна из них.
Наиболее распространенными заболеваниями и патологическими состояниями, при которых стафилококк часто атакует больного, являются: переохлаждение организма, ОРЗ, ОРВИ, грипп, ангина, фарингит, ларингит, трахеит, бронхит, пневмония, сахарный диабет, ВИЧ-инфекция, туберкулез, заболевания эндокринной и других систем, а также другие хронические болезни.
Кроме того, риск заражения стафилококком повышают:
- Вредные привычки: курение, употребление алкогольных напитков, употребление наркотических средств;
- Стрессы, отсутствие здорового сна;
- Малоподвижный образ жизни;
- Употребление малополезной и вредной пищи;
- Гиповитаминозы (недостаточность витаминов);
- Злоупотребление некоторыми лекарственными препаратами – сосудосуживающие средства (нарушают целостность слизистой носа), антибиотики;
- Нарушения целостности кожных покровов, слизистых оболочек полости носа и рта.
- Недостаточное проветривание помещений, в которых человек часто пребывает (работа, дом);
- Работа на предприятиях с большой загрязненностью воздуха, особенно без защитных средств (маски).
Устойчивость стафилококков к антибиотикам
Чем больше мы атакуем, например, антибиотиками возбудителей гнойносептических инфекций, тем чаще появляются антибиотикоустойчивые микроорганизмы.
Под влиянием антибиотиков нарушается тормозящее действие на стафилококки других микробов — обычных обитателей нашего организма. Более того, иногда антибиотики просто стимулируют развитие стафилококков и стрептококков. Поэтому без врачебного назначения самостоятельное применение антибиотиков (да и других противобактериальных средств) при возникновении гнойных поражений кожи должно быть исключено.
Любое лечение стафилококковых кожных патологий должен назначать дерматолог! Заболевания других органов лечат соответствующие специалисты — гинекологи, урологи, терапевты.
Чем опасна стафилококковая инфекция
Особенно опасен стафилококк в ассоциации с вирусами и грибами, а также при сопутствующих детских капельных инфекциях, снижающих общую реактивность организма. Недаром при многих заболеваниях наблюдаются местные или общие осложнения, вызванные стафилококками.
Так, в период гриппозных эпидемий нередки стафилококковые пневмонии, которые чаще всего и оказываются причиной длительной болезни ребенка и являются наиболее частой предпосылкой к смертельному исходу.
Стафилококковый и стрептококковый токсины обладают выраженными сенсибилизирующими свойствами, вызывая аллергии и токсические поражения сердечной мышцы, почек и других важных органов. В отличие от ряда возбудителей детских инфекций, место действия которых ограничено определенными участками тканей организма, стафилококк и стрептококк «всеядны».
Они могут быть причиной воспаления желчного пузыря (холецистит), токсической диспепсии и гастроэнтеритов, воспалений суставов (артриты), мочеполовой сферы (уретриты и эндометриты). У новорожденных стафилококковые и другие гнойные воспалительные явления начинаются с пупочной ранки или других, незаметных на первый взгляд повреждений кожи (царапины, ссадины).
Нужно подчеркнуть, что до 90% случаев возникновения сепсиса у детей раннего возраста связано со стафилококком.
Лечение заболевания
Стафилококковая инфекция тяжело поддается лечению, особенно у детей. Чем раньше обнаружено заболевание, тем больше вероятность, что ребенок скоро станет здоров.
Терапия включает в себя следующие мероприятия:
- Местное лечение. Это обработка высыпаний и гнойничков.
- Антибиотики. Стафилококк очень хорошо приспособляем и трудно поддается антибиотикотерапии. Тем не менее часто назначаются препараты пенициллинового ряда.
- Смазывания, полоскания — такое лечение эффективно для стафилококка в носу и горле.
- Витаминно-минеральные комплексы.
- Иммуномодуляторы.
- Переливания крови или плазмы. Назначаются в тяжелых случаях, при сепсисе.
- Операция. В случае тяжелой хронической ангины удаляются миндалины. Операция также назначается при множественных поражениях кожи с обильным воспалением и экссудатом.
Стафилококк у беременных — угроза жизни новорожденных
Источником стафилококковой инфекции в родильных домах, детских больницах и в домашних условиях могут быть гнойные поражения кожи и слизистых у взрослых — матери, окружающих, обслуживающего персонала. Поэтому отделять заразные болезни кожи от прочих инфекционных заболеваний человека нельзя.
В нормальных условиях кожа обладает защитными свойствами в борьбе с микробами, в частности, в ее выделениях содержатся антибактериальные вещества. Однако нарушения питания, общие заболевания, микротравмы кожи могут способствовать развитию патогенной микрофлоры на коже ребенка.
Активная иммунизация беременных женщин стафилококковым анатоксином, как показала практика, не оказывает вредного влияния ни на течение беременности, ни на развитие плода, снижая в то же самое время заболеваемость гнойными инфекциями матерей и новорожденных в 3—5 раз.
При этом у матери вырабатывается активный, а у ребенка — пассивный иммунитет к возбудителям таких инфекций, как отит, пневмония, кожные нагноения, ангины (тонзиллиты), ларинготрахеиты, гаймориты и другие воспалительные заболевания носоглотки.
Степени стафилококка
Для определения точной схемы лечения, врачи разделили течение стафилококковой болезни на 4 условных степени. Это связано с тем, что различные виды инфекции, а также их патологическая активность в различное время и при различных условиях различаются. Кроме того, такой подход при диагностике различает стафилококковую инфекцию, к какой группе она принадлежит – полностью патогенное влияние на организм, условно-патогенное и сапрофиты, которые практически не наносят человеку никакого вреда.
Степени стафилококка
Стафилококк 1 степени. Локализация инфекции для забора на диагностику – носо- и ротоглотка, кожный покров, мочеполовая система. Клинические проявления отсутствуют или минимальные. При здоровой иммунной системе, медикаментозная терапия не требуется.
Стафилококк 2 степени. Клинические проявления (симптомы) минимальны или отсутствуют. При наличии жалоб проводится тщательная диагностика на наличие других видов инфекции. Если установлено, что в организме присутствует и другой вид бактерии, в частном порядке назначается антибактериальная терапия.
Стафилококк 3 степени. У пациента присутствуют жалобы. В большинстве случаев необходима антибактериальная терапия, за исключением ситуации, в которой лечащий врач посчитает, что применение антибиотиков неоправданно. Лечение стафилококка 3 степени обычно направлено, прежде всего, на укрепление иммунной системы. Если в течение 2х месяцев, выздоровление силами организма не происходит, разрабатывается индивидуальная схема лечения инфекции, в т.ч. с применением антибактериальных средств.
Стафилококк 4 степени. Терапия направлена на укрепление иммунитета, устранения гиповитаминозов, дисбактериоза кишечника. Перед применением антибактериальной терапии, проводится тщательная диагностика на реакцию конкретного вида стафилококка на препарат.
Стафилококковые болезни у молодых людей и детей
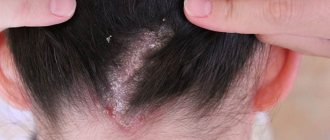
Гнойничковые заболевания кожи называют пиодермитами, которые в зависимости от причины возникновения подразделяются на стрепто и стафилодермии. Часто наблюдается их смешанная форма — стрептостафилодермия.
Стрептодермия чаще поражает детей и юношей и локализуется обычно вокруг естественных отверстий — нос, рот, ушные раковины, то есть на участках, подвергающихся раздражению отделяемым этих полостей (слюна, слизь). Эти поражения очень контагиозны и быстро перебрасываются на здоровые участки кожных покровов. Стрептодермия передается через игрушки, пеленки, одежду, белье.
Довольно частым стрептококковым поражением кожи новорожденных является импетиго (от латинского «импетус»— внезапный, нападающий). При этом заболевании образуются плоские с дряблым складчатым покрытием полости, наполненные серозно-гнойным содержимым, — фликтены.
Сливаясь, они образуют сплошные очаги с извилистыми воспалительными очертаниями. Преимущественно поражаются открытые части тела, особенно кожа лица. Нередко припухают близлежащие лимфатические узлы, а при распространении инфекции наблюдаются явления общей интоксикации.
Другой формой гнойных поражений является пемфигуспузырчатка новорожденных. Этот вид пиодермии отличается образованием крупных пузырей, достигающих голубиного яйца и наполненных гнойным содержимым. При их разрыве образуется обнаженная ярко-красная поверхность (эрозия), легко подвергающаяся дополнительному инфицированию, в результате чего резко нарушается состояние ребенка.
Стрептококковый пемфигус крайне контагиозен, заразен и при отсутствии должных мер профилактики может вызвать массовые вспышки пиодермий в родильных домах и детских больницах.
При переезде ребенка из роддома домой нередко возникает везикулопустулезная форма пиодермии в местах, чаще всего раздражаемых потом (на затылке, шее, лбу, в паху). Появляются мелкие пузырьки с прозрачным содержимым (везикулы) величиной с булавочную головку. Затем содержимое пузырьков становится гнойным (пустула) и окружается венчиком гиперемии.
Через два-три дня пустулы лопаются или подвергаются обратному развитию и на их месте образуются поверхностные корочки. Несмотря на относительную легкость течения этой инфекции, ее осложнения бывают весьма коварны. Они выражаются в распространенных и тяжелых флегмонах, протекающих со значительной отечностью и последующим некрозом (расплавлением) подкожной клетчатки.
У грудных детей с пониженным питанием, у неправильно искусственно вскармливаемых детей, а также у более старших детей со слабыми защитными реакциями (вследствие туберкулезной или другого рода интоксикации) стрептококковая инфекция не ограничивается поверхностным поражением кожи, а захватывает глубже лежащие ткани, образуя глубокие язвы — эктимы.
Они возникают на наиболее часто травмируемых частях тела (поясница, голени) и отличаются вялым, длительным течением. После их излечения остаются рубцы.
Говоря о стрептококковых пиодермиях у детей, нельзя обойти молчанием рожистое воспаление, особенно часто поражающее лицо (отсюда и название — «рожа»). Кожа лица становится красной, отечной. Заболевание сопровождается повышением температуры, иногда тяжелым общим состоянием, требующим принятия экстренных лечебных мер.
Известна также так называемая «заеда» — стрептококковая фликтена (разновидность импетиго) в углах рта, которая вскрывается и образует длительно незаживающую ранку, постоянно возобновляющуюся в связи с мимическими движениями мышц лица и приемом пищи. При недостаточном санитарном контроле заеда может вызывать настоящие вспышки в детских коллективах.
Пузырчатка новорожденных может вызываться и стафилококками. При наиболее тяжелой форме этого заболевания под роговым слоем кожи на значительных участках скапливается серозная жидкость и происходит отслоение кожного покрова в таких размерах, что ребенок производит впечатление «ошпаренного».
При стафилодермиях часто поражаются волосяные фолликулы, например на голове, что приводит к мелкой гнойничковой сыпи, которая после лечения бесследно исчезает.
Стафилококки вызывают не только местные, ограниченные поражения кожи, но и ангину, тяжелые пневмонии, воспалительные очаги в различных органах и тканях (в печени, селезенке, почках), возникающие в результате распространения микробов по кровеносным и лимфатическим путям. Смертельную угрозу несет с собой генерализованная стафилокковая инфекция — сепсис.
Стафилококки могут вызывать настоящие эпидемические вспышки в родильных домах и детских больницах. За счет их возникает подавляющая часть кожных и септических поражений новорожденных и гнойных заболеваний у матерей. Послеродовой сепсис, маститы, пневмонии, менингиты, воспаление родовых путей, конъюнктивиты являются настоящим бедствием. Конечно, они особенно опасны для рожениц и новорожденных детей.
Как происходит заражение
Передача возбудителей гнойно-септических инфекций происходит с воздухом (аэрогенно), например, при встряхивании постельного белья. Параллельно этому осуществляется передача через предметы быта, а также через пищу и воду. В последних случаях возникают пищевые токсикоинфекции.
В отношении же внутрибольничных случаев заражения наиболее опасны так называемые «госпитальные» штаммы золотистого стафилококка, устойчивые к внешним воздействиям и антибиотикам.
Стафилококки, будучи постоянными обитателями тела и жилья человека, естественно, концентрируются там, где повышена плотность размещения людей, где меньше вентиляция воздуха и больше возможностей для размножения и распространения микробов.
Именно такие условия нередко создаются в больничных палатах, где стафилококк распространяется с бельем, при встряхивании постелей, с пылью, при разговоре и кашле людей, находящихся в близком соседстве. Поэтому такие простые меры, как проветривание помещений, влажная уборка с дезинфицирующими средствами, пользование чистым бельем, своевременная смена постельных принадлежностей, облучение воздуха ультрафиолетом или просто доступ солнечного света значительно снижают концентрацию микробов и возможности их рассеивания.
Необходима тщательная санация — обследование и лечение людей с признаками стафилококковых и других подобных заболеваний. Кроме описанных выше гнойных поражений, у детей могут встречаться специфические инфекционные кожные заболевания, в том числе грибковой природы.
ОНЛАЙН-ЗАПИСЬ в клинику ДИАНА
Вы можете записаться по бесплатному номеру телефона 8-800-707-15-60 или заполнить контактную форму. В этом случае мы свяжемся с вами сами.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter
Staphylococcus intermedius — коагулазоположительный стафилококк, преобладающий представитель микрофлоры кожи и слизистых оболочек собак и самый распространенный возбудитель стафилококковых инфекций в ветеринарии мелких животных за последние 35 лет.
Хотя микробиологические исследования показали вариабельность биохимических свойств разных штаммов S. intermedius, выделенных у животных, обычное фенотипическое тестирование дает приемлемый уровень диагностической точности для клинических целей. Тем не менее три последние разработки изменили наше понимание S. intermedius, и ветеринарные микробиологи столкнулись с проблемой правильности идентификации патогенных стафилококков мелких животных. Во-первых, растущее распространение устойчивых к метициллину штаммов Staphylococcus aureus в ветеринарной практике мелких животных и в медицине требует точной идентификации видов. Во-вторых, применение молекулярных методов для анализа выделенных штаммов стафилококков привело к пересмотру таксономии, и выделенные от собак штаммы, ранее относившиеся к S. intermedius, были отнесены к S. pseudintermedius. В-третьих, быстрое появление штаммов Staphylococcus pseudintermedius, устойчивых к метициллину и нескольким антибиотикам (MRSP), представляет большую проблему в ветеринарной практике всего мира, в том числе в Великобритании. В данной статье обсуждаются основы недавних изменений таксономии рода Staphylococcus, рассматриваются его ключевые особенности и значение для лабораторной диагностики и ветеринарии мелких домашних животных.
СТАФИЛОКОККИ. ВВЕДЕНИЕ
Большинство ветеринарных врачей, специализирующихся на мелких животных, ежедневно встречаются со стафилококковыми инфекциями кожи и ран [34]. Большинство стафилококков — факультативные анаэробы, каталазоотрицательные, неподвижные грамполо-жительные микроорганизмы с клеточными стенками, содержащими тейхоевую кислоту и пептидогликаны, а также 30-40 % гуанина и цитозина, видимых под микроскопом в форме глыбок [54]. Основной патогенный вид образует коагулазу — фермент, коагулирующий плазму за счет превращения фибриногена в фибрин. Роль коагулазоотрицательных стафилококков как патогенных микроорганизмов относительно мала; это преимущественно возбудители больничных инфекций у ослабленных животных.
Описано 54 видов и 24 подвида, из которых наибольшее значение в ветеринарной медицине имеют Staphylococcus aureus и Staphylococcus intermedius. Однако после недавних таксономических изменений, описанных ниже, все штаммы, выделенные от собак (и, возможно, от кошек), ранее относившиеся к S. intermedius, в настоящее время следует относить к Staphylococcus pseudintermedius. В настоящем обзоре термин “S. pseudintermedius» относится к штаммам, в более старых источниках классифицируемых как S. intermedius (это относится к штаммам, выделенным от собак и кошек).
ЭКОЛОГИЯ
Стафилококки, коагулазоположительные (Ко+) и ко-агулазоотрицательные (Ко-), являются нормальными обитателями кожи и слизистых оболочек животных и человека. Отмечена тенденция к предпочтительному заселению кожи и слизистых оболочек млекопитающих и птиц определенными видами стафилококков. Стафилококки, попавшие в окружающую среду с кожи и шерсти, способны сохранять жизнеспособность в течение нескольких месяцев [53, 79]. У людей более 80 % больничных инфекций S. aureus вызываются эндогенными штаммами, обитающими в носовой полости пациента [78]. Сходным образом Pinchbeck and others [58] показали, что более 94 % штаммов S. pseudinterme-dius, выделенных из пораженных участков кожи собак с пиодермой, были генетически идентичны штаммам, обитающим на нормальных покровах этой же собаки.
У собак преобладающим видом является S. pseudin-termedius, который выделяется с кожи и слизистых оболочек здоровых собак в 20-90 % случаев [2, 14, 17, 28, 32]. Частота выделения отдельных Ко+ стафилококков с кожи и шерсти здоровых кошек составляет приблизительно 10 % для S. aureus и 45 % для S. pse-udintermedius [1, 12, 41].
ПОСЛЕДНИЙ ПЕРЕСМОТР ТАКСОНОМИЧЕСКОЙ КЛАССИФИКАЦИИ “S. INTERMEDIUM
В обзоре таксономической классификации от 1992 г. Noble ссылается на работу 1962 г. под названием “An introduction to chaos: or the classification of micrococci and staphylococci» (Введение в хаос: классификация микрококков и стафилококков); на момент написания этой работы было известно всего три вида стафилококков, а именно S. aureus, S. epidermidis и Staphylococcus saprop-hyticus. Появление молекулярно-биологических методов стало основой для обширного пересмотра классификации стафилококков. В настоящее время род включает 45 видов и 24 подвида, которые можно отнести к 11 кластерам по результатам секвенирования гена 16S РНК и 4 кластерам по результатам секвенирования gap-гена [24].
С точки зрения ветеринарной дерматологии можно констатировать, что хаос никуда не делся, а лишь немного изменил свою форму ввиду фенотипической внутри- и межвидовой вариабельности среди микроорганизмов, родственных S. intermedius. Staphylococcus inter-medius был впервые описан Hajek [30], который выделил стафилококков, по биохимическим свойствам находящихся «между» S. aureus и S. epidermidis (промежуточные штаммы — intermedius), от голубей, собак, норок и лошадей. Вскоре стало очевидно, что большинство штаммов Ко+ стафилококков, выделенных от собак, фактически принадлежат к S. intermedius, а не S. aureus, как в предыдущей классификации. Однако позднее было показано, что значительная фенотипическая вариабельность среди S. intermedius, отмеченная Hajek [30] и через некоторое время — Devriese и van de Kerckove [18], отражает значительную генотипическую вариабельность [4, 10, 49]. Staphylococcus pse-udintermedius был впервые описан в 2005 г. после молекулярного анализа штаммов, выделенных от кошек, собак, лошадей и попугаев. Фенотипические свойства были сходны с таковыми у S. intermedius и Staphylococcus delphini, видов, впервые выделенных у дельфинов в 1988 г. [19, 77]. В 2007 г. две научные группы опубликовали результаты подробного филогенетического анализа коллекций штаммов “S. intermedius» из Японии [65] и Европы [4], которые были очень сходны; авторы показали, что все их штаммы от собак, кошек и людей относились к виду S. pseudintermedius. Большинство штаммов, выделенных от диких голубей, относились к S. intermedius, а большинство штаммов от лошадей и домашних голубей принадлежали к виду S. delphini. В то время как подробное биохимическое исследование позволяет дифференцировать S. intermedius от S. pseudintermedius и S. delphini, единственным достоверным способом дифференциации двух последних видов является исследование молекулярными методами, например секвенирование гена термонуклеазы (nuc), или белка теплового шока (hsp60) [65], или рестрикция эндонуклеазой MboI фрагмента гена pta [5, 67]. Результаты этих молекулярных исследований подтверждают правильность введения термина “группа S. intermedius», которая включает по меньшей мере три близкородственных вида: S. intermedias, S. delphini и S. pseudintermedius [4, 24, 67, 70].
Все эти наблюдения указывают, что штаммы с традиционными фенотипическими характеристиками “S. intermedius» должны идентифицироваться как S. pseudintermedius, если они выделены от собак. Штаммы с такими свойствами, выделенные от других видов, лучше всего идентифицировать как «бактерии группы S. intermedius», если нет результатов оценки молекулярно-биологическими методами [33]. Хотя молекулярнобиологические методы позволили прояснить таксономию бактерий группы S. intermedius, фенотипическая классификация в диагностических лабораториях все еще пребывает в состоянии хаоса из-за различий в экспрессии биохимических свойств как в пределах одного вида, так и между видами, относящимися к группе S. intermedius. Например, сообщается, что S. pseudintermedius в культуре образует ацетоин (реакция Фогеса-Проскауэра) при анализе с помощью набора API STAPH (Био Мерье) [19]. В противоположность этому, по данным Sasaki and others [65], 28 из 83 штаммов S. pseudintermedius, идентифицированные молекулярно-биологическими методами, не образуют ацетоин при исследовании стандартными методами, и исследование с помощью набора API STAPH не показывает образование ацетоина. Кроме того, сообщается, что данная культура не образует фактор агглютинации при исследовании с плазмой кролика, в то время как, по данным Cox and others [13], 55 из 105 выделенных от собак штаммов “S. intermedius» (и, вероятно, S. pseudinterme-dius) экспрессировали фактор агглютинации, что согласуется с общепринятым представлением, которого придерживаются многие ветеринарные микробиологи. Описанные ранее данные, касающиеся S. intermedius, нуждаются в переоценке, так как некоторые штаммы, ранее классифицировавшиеся как S. intermedius, могут с высокой вероятностью принадлежать к S. pseudin-termedius или S. delphini [20].
УСТОЙЧИВОСТЬ К АНТИБИОТИКАМ
В прошлом большинство инфекций собак, вызываемых 5. pseudintermedius, удавалось успешно лечить антибиотиками, назначавшимися эмпирически или по результатам оценки антибиотикочувствительности, поскольку полирезистентность, т. е. устойчивость к по меньшей мере трем классам антимикробных препаратов, в дополнение к р-лактамам [11], в то время встречалась крайне редко, по крайней мере — в Европе [27,29, 43, 56, 60]. В Великобритании исследование более 1200 штаммов стафилококков, выделенных в клинических условиях за период с 1987 по 1995 гг, не показало устойчивости к цефалексину, амоксиклаву, окса-циллину/метициллину и энрофлоксацину [43]. Фактически резистентность к любому из цефалоспоринов первого поколения не была достоверно подтверждена. В Европе резистентность к цефалексину была впервые описана у S. pseudintermedius, выделенного от собак в специализированной дерматологической ветеринарной клинике в Германии в 2005 г.; одновременно была обнаружена резистентность к метициллину и нескольким другим антибактериальным препаратам [45].
ШТАММЫ S. PSEUDINTERMEDIUS, УСТОЙЧИВЫЕ К МЕТИЦИЛЛИНУ (MRSP)
Метициллин, полусинтетический антибиотик из группы пенициллинов, был введен в 1959 г. для борьбы со стафилококками, образующими р-лактамазу и устойчивыми к пенициллину. Вскоре после этого были выделены штаммы S. aureus, устойчивые к метициллину (MRSA), преимущественно в условиях стационара. В основе устойчивости к метициллину лежит экспрессия гена mecA, кодирующего модифицированный белок клеточной стенки, связывающий пенициллин (PBP2a), низкое сродство которого к р-лактамным антибиотикам делает пенициллины и цефалоспорины неэффективными. Ген mecA располагается в стафилококковой хромосомной кассете mec (SCCmec), крупном мобильном генетическом элементе, при этом дополнительные генетические детерминанты часто придают микроорганизму дополнительную устойчивость к другим антибиотикам, использующимся в клинической практике.
Встраивание элемента SCCmec в геном штаммов S. pseudintermedius привело к резкому росту распространенности устойчивых к метициллину штаммов по Европе, главным образом в период с 2005 по 2006 г [45, 57, 62, 66]. В отчете об исследовании S. intermedius в Северной Америке сообщается, что в период с 2003 по 2004 г. устойчивостью к метициллину обладали 57 из 336 выделенных штаммов (17 %) [50], в то время как за период с 1995 по 1998 г. лишь один штамм стафилококков из 25 обладал устойчивостью к метициллину [26]. В Европе устойчивостью к метициллину обладало 23 % штаммов S. pseudintermedius, выделенных в дерматологической клинике на севере Германии за 2006 г [45]. Частота выделения устойчивых к метициллину стафилококков (n = 61, 7,4 % MRSP) была более чем в 4 раза выше, чем MRSA (n = 15, 18,75 % выделенных штаммов S. aureus), по данным обзора, 901 Ко+ штамма стафилококков, выделенных от собак в Германии за 2007 г [62]. По результатам обзора 590 образцов от собак, представленных в диагностическую ветеринарную лабораторию в Италии за двухмесячный период в 2008 г., на MRSP приходилось 10 из 48 выделенных штаммов из группы 5. intermedius (21 %); все эти штаммы, устойчивые к метициллину, были также устойчивы к фторхинолонам, гентамицину, линкозамидам, тетрациклинам и потенцированы [15], что отражает приобретение дополнительных генов, обусловливающих устойчивость.
По-видимому, данные о распространенности в Великобритании не публиковались в реферируемых журналах, хотя коммерческая лаборатория в Девоне, Великобритания, недавно сообщила, что на MRSP приходится 14 % из 125 Ко+ штаммов, выделенных за 12-месячный период вплоть до июля 2008 г. [68]. Эти штаммы были устойчивы к большему числу антибиотиков, чем штаммы MRSA, выделенные за этот же период.
МЕТОДЫ МОЛЕКУЛЯРНОГО ТИПИРОВАНИЯ ДЛЯ ИССЛЕДОВАНИЯ ЭПИЗООТОЛОГИИ MRSP
Для эффективного и точного типирования клонов S. pseudintermedius был разработан ряд молекулярных методов. Эти методы показали выраженное генетическое разнообразие среди штаммов S. pseudintermedius, чувствительных к метициллину [63]. Метод муль-тилокусного секвенирования-типирования позволяет типировать выделенные штаммы путем секвенирова-ния внутренних фрагментов многочисленных конститутивных генов (пять в случае S. pseudintermedius в настоящее время). При исследовании каждого конституционного гена разные последовательности, имеющиеся у бактерий определенных видов, относятся к определенным аллелям, и аллели в каждом из пяти локусов каждого штамма определяют аллельный профиль типа последовательности (ТП); профили легко сравнить с хранящимися в интернет-базах данных. Типирование белка А S. aureus включает амплификацию, секвени-рование и анализ различных областей Х гена белка А. Метод импульсного гель-электрофореза заключается в гидролизе геномной ДНК эндонуклеазой SmaI и последующем электрофоретическом разделении фрагментов ДНК в агарозном геле. Вставка элемента SCCmec в хромосому чувствительных видов является причиной возникновения линий стафилококков, устойчивых к метициллину При типировании SCCmec определяются типы генов рекомбиназы (ссг) вместе с классом гена :таес и связанные регуляторные последовательности. В отличие от наблюдаемой генетической вариабельности MSSP исследование штаммов MRSP показало, что у собак и кошек в Европе преобладает один клон, в частности с типом последовательности ST71 (MLST)-J(PGFE)-t02(spa)-II-III(SCCmec). Этот клон был выделен в Германии, Швейцарии, Нидерландах, Дании, Швеции и Италии и, спорадически, в Северной Америке и Гонконге [4, 7, 37, 57, 63]. В Северной Америке также обнаружен один преобладающий клон, в частности ST68-C-t06-V [57, 63]. Наблюдающееся в настоящее время отсутствие штаммов ST71 5. pseudinterme-dius, чувствительных к метициллину, не подтверждает одновременное и быстрое приобретение SCCmec широко распространенной и успешно развивающейся линией 5. pseudintermedius, а скорее свидетельствует о быстром распространении этого конкретного клона. Эти молекулярные эпизоотологические данные позволяют предположить, что при выделении микроорганизмов и обнаружении инфекции у животных необходимы тщательные гигиенические меры, чтобы ограничить дальнейшее распространение.
ЗООАНТРОПОНОЗНЫЙ ПОТЕНЦИАЛ.
Staphylococcus pseudintermedius редко обнаруживается на коже человека, хотя частота его передачи среди людей, регулярно соприкасающихся с собаками, растет [25, 29, 32]. Из 3397 штаммов, выделенных от пациентов больниц общего профиля, 3357 относились к S. aureus, и только два принадлежали к S. pseudinter-medius [48], хотя описаны случаи ошибочной идентификации S. pseudintermedius как S. aureus в медицинских лабораториях, для которых последний вид был привычнее [39, 59, 67, 72, 76]. Исследование на 56 здоровых добровольцах не показало наличия S. pseudinter-medius на слизистой оболочке носа, хотя у 89 % этот микроорганизм был обнаружен в слюне и зубном налете [55]. В исследовании персонала ветеринарного колледжа частота выделения микроорганизма со слизистой оболочки ротоглотки составила менее 1,5 % [44, 71], однако результаты более поздних исследований владельцев собак показывают большие цифры. Исследование наружных носовых ходов 16 владельцев собак с атопическим дерматитом и 13 сотрудников ветеринарной клиники, постоянно контактирующих с собаками, на стафилококков выявило одного постоянного и четырех временных носителей Staphylococcus “interme-dius» [32]; штаммы, выделенные от людей, обычно соответствовали штаммам, выделенным от собак, с которыми они контактировали [25]. В исследовании 242 владельцев собак и кошек в Онтарио S. pseudintermedius был выделен от девяти людей, а неотличимые от него штаммы выделены от собак в четырех из девяти случаев носительства [31]. Guardabassi and others [29] показали, что носительство S. pseudintermedius на слизистой оболочке носовой полости среди владельцев собак с глубокой пиодермой встречалось чаще (7 из 13), чем у людей без ежедневного контакта с собаками (1 из 13), и что у 6 из 13 владельцев обнаружены штаммы, идентичные выделенным от их собак по результатам электрофореза.
Появление штаммов MRSP привело к выяснению но-сительства у людей, контактирующх с собаками, а также спорадических случаев инфекции у людей [8, 23, 39, 69]. MRSP были выделены от пяти собак и одной кошки с инфицированными хирургическими ранами в лаборатории в Нидерландах [74]. В ходе дальнейших исследований из носовой полости ветеринарного врача и 3 из 6 ассистентов, из 4 из 22 образцов из среды, а также из носовой полости здоровой собаки, принадлежащей сотруднику, регулярно присутствовавшему в клинике, были выделены MRSP с такой же картиной устойчивости. MRSP и MRSA были выделены из 3 и 8 из 34 образцов соответственно, взятых у ветеринарных врачей из университетской ветеринарной клиники в Японии, при этом все 36 образцов от сотрудников неклинических лабораторий оказались отрицательными [36]. Обзор по результатам исследования 171 сотрудника ветеринарных дерматологических клиник и их животных в Северной Америке показал наличие MRSP у девяти человек и MRSA у шести [51]. Соответствующие штаммы MRSP были выделены от животных, содержащихся в доме, где жили три человека-носите-ля. По данным другого исследования в Северной Америке, носительство MRSP на слизистой оболочке носовой полости было обнаружено у 2 из 15 владельцев собак, инфицированных MRSP с тем же типом SCCmec и картиной восприимчивости к антибиотикам; при повторном отборе проб через два месяца после лечения эти штаммы отсутствовали, что позволяет предположить временное носительство MRSP людьми [21]. В сходном исследовании, проведенном в Нидерландах, результат анализа проб со слизистой оболочки носа людей оказался положительным в 2 из 45 случаев, в то время как MRSP были выделены из примерно трети образцов от собак и кошек, находившихся в контакте, и 44 % образцов из окружающей среды [75]. Эти наблюдения очевидно свидетельствуют о возможности передачи стафилококков от людей к собакам и наоборот. Хотя контакт человека с 5. pseudintermedíus от собаки, скорее всего, приведет лишь к временному неочевидному носительству, в редких случаях возможно развитие инфекции, сложно поддающейся лечению в случае MRSP [69]. Кроме того, собачьи штаммы MRSP должны рассматриваться как потенциальный источник переноса SCCmec и, возможно, других мобильных детерминант устойчивости стафилококков, обитающих на коже и слизистых оболочках человека, к антибиотикам [29].
ЗНАЧЕНИЕ ДЛЯ ЛАБОРАТОРНОЙ ИДЕНТИФИКАЦИИ
Видовая дифференциация патогенных стафилококков сложнее, чем предполагают стандартные микробиологические тесты [59, 73]. Перед появлением MRSA как патогена собак видовая идентификация Ко+ стафилококков, выделенных от собак, имела минимальное клиническое значение. Однако в настоящее время точная видовая идентификация и дифференциация MRSA и MRSP необходима в связи со значительным различием в зооантропонозном потенциале этих двух видов, и пограничные значения при исследовании восприимчивости in vitro могут различаться. Начальная идентификация стафилококков с точностью до рода возможна по морфологии колоний (гладкие, выпуклые, слегка блестящие, от белого до желтого цвета, диаметром от 1 до 2 мм после 24-часовой инкубации на кровяном или другом питательном агаре при 37 °C [6]); результатам микроскопии (грамположительные кокки) и образованию каталазы (этот признак позволяет дифференцировать их от стрептококков и энтерококков; обзор Freney and others [22]).
Образование ДНКазы и коагулазы — важные показатели патогенности стафилококков. Экспрессию коагулазы тремя штаммами Ко+, часто выделяемыми от мелких животных (S. pseudintermedius, S. aureus и S. schleiferi ssp. coagulans), можно обнаружить путем пробирочной реакции (свободная коагулаза) или реакции на стекле (связанная коагулаза или фактор агглютинации) [6]. Хотя пробирочный метод с кроличьей плазмой считается «золотым стандартом», реакция на стекле быстрее, легче и дешевле. Однако даже этот базовый метод не дает однородных результатов. Исследование стандартными методами показывает, что только 11-89 % штаммов S. intermedius дает положительную реакцию в противоположность 100 % в пробирочном методе [22, 40], и некоторые Ко+ штаммы могут ошибочно классифицироваться как Ко- из-за недостаточной чувствительности метода [12, 13].
Дифференциация между членами группы S. inter-medius в настоящее время требует молекулярно-биологических методов (например, мультилокусное сек-венирование или рестрикция MboI фрагмента гена pta) [5, 65, 67], однако дифференциация MRSA и MRSP возможна на основании точно подобранного ряда фенотипических параметров. Биохимические свойства, особенно способность к сбраживанию сахаров, помогают дифференцировать Ко+ штаммы. Биохимические свойства S. aureus, “S. intermedius” и S. schleiferi spp. coagulans кратко описаны в стандартных учебниках микробиологии [6, 40, 46], а S. pseudintermedius — в более новых публикациях [19, 65]; методы, используемые в лаборатории авторов, представлены в таблице.
Однако хорошо известно, что ни один из этих методов не является точным на 100 %, поэтому желательно использовать несколько методов параллельно [47, 61]. 21 % из 133 штаммов MRSA, выделенных авторами от животных, не обладали классической золотистой пигментацией (см. рисунок). Реакция Фоге-са-Проскауэра — экономически эффективный и не требующий больших затрат времени метод, хотя при его использовании отмечена некоторая вариабельность [65]; этот метод должен давать положительную реакцию с S. aureus и отрицательную с группой S. intermedius [6]. Основанием для подозрений на MRSP является типичная картина чувствительности к антибиотикам. В Великобритании эти штаммы обычно устойчивы к антимикробным препаратам, часто использующимся для лечения пиодермы у собак (потенцированные сульфонамиды, линкомицин, клинда-мицин, ко-амоксиклав, цефалексин, энрофлоксацин, марбофлоксацин), в то время как штаммы MRSA, выделенные от мелких животных, чаще всего чувствительны к потенцированным сульфонамидам, тетра-циклинам и иногда — клиндамицину. Обнаружение гена mecA методом полимеразной цепной реакции или его продукта (PBP2a) методом латексной агглютинации часто практикуется в медицинских лабораториях, но не в ветеринарных. Методы молекулярного типирования, описанные выше в разделе о таксономии, пока не получили широкого распространения в коммерческих ветеринарных микробиологических лабораториях, хотя по описанным ниже причинам они необходимы для точной дифференциации MRSP и MRSA.
Таблица.
ЛЕЧЕНИЕ ИНФЕКЦИЙ, ВЫЗВАННЫХ MRSP
Хотя устойчивость стафилококков к метициллину не всегда связана с полирезистентностью, большинство штаммов MRSP, описанных в литературе, устойчивы к большинству препаратов, использующихся в ветеринарии. Клон MRSP, преобладающий в Европе, обычно устойчив к р-лактамным антибиотикам, ами-ногликозидам, макролидам, линкозамидам, тетрацик-линам, хлорамфениколу, триметоприму и фторхино-лонам и чувствителен только к амикацину, фусидовой кислоте, рифампицину, ванкомицину, тейкопланину и линезолиду, однако ни один из этих последних препаратов не лицензирован для системного лечения мелких домашних животных [16, 57]. В 2009 г. консультативная группа Всемирной организации здравоохранения по объединенному надзору за резистентностью к антибиотикам (AGISAR) выпустила стандартный документ, призванный помочь сформулировать и определить приоритеты оценки риска и стратегий управления рисками, связанными с устойчивостью к антибиотикам. Согласно их классификации антимикробные препараты делятся на критически важные, очень важные и важные на основании их роли как единственного лечебного средства или одной из немногих альтернатив для лечения серьезных заболеваний у человека, или заболеваний, вызванных микроорганизмами, передающимися из других источников (не от человека), или микроорганизмами, способными приобретать детерминанты устойчивости из других источников [81].
Амикацин и рифампицин входят в список препаратов критической важности для лечения микобак-териальных инфекций у человека, в то время как ван-комицин, тейкопланин и линезолид относятся к препаратам, имеющим критическую важность для лечения инфекций, вызванных полирезистентными MRSA и энтерококками. Фусидовая кислота — единственный антибиотик, который может оказаться эффективным против европейских штаммов MRSP, выделенных от собак, который не входит в категорию критически важных; она входит в список очень важных препаратов для лечения MRSA.
Иногда поверхностные кожные инфекции и некоторые раневые инфекции хорошо поддаются лечению местными средствами в сочетании с коррекцией первопричины либо после удаления инородного материала, например швов или имплантатов. Loeffler and others [45] описали разрешение поверхностной пио-дермы, вызванной MRSP, у пяти из семи собак после местного применения препаратов фусидовой кислоты и хлоргексидина, а также шампуня, содержащего этиллактат.
Для лечения глубокой пиодермы или других серьезных инфекций может потребоваться назначение системных антибактериальных препаратов, не соответствующее утвержденным показаниям, хотя данных об оптимальной дозировке и частоте применения та-
ких препаратов часто недостаточно. Амикацин не всасывается из пищеварительного тракта и должен вводиться в инъекционной форме. Рифампицин можно давать внутрь, однако при этом существует риск развития устойчивости, особенно при применении в форме монотерапии [38], а риск гепатотоксичности требует регулярного контрольного биохимического исследования крови. Описаны отдельные штаммы MRSP с устойчивостью к рифампицину [57]. В то время как 54 из 57 штаммов MRSP из Северной Америки были чувствительными [50], среди 25 европейских штаммов чувствительностью обладали всего 30-40 % [15, 16]. Такое географическое различие подчеркивает важность выбора препарата для лечения MRSP по результатам определения чувствительности отдельных штаммов in vitro.
Случаи устойчивости MRSP к ванкомицину, тей-копланину и линезолиду до настоящего времени неизвестны [57, 62], хотя Perreten and others высказали сомнения в целесообразности применения этих антибиотиков для лечения животных. Ввиду статуса этих препаратов в медицине в качестве резервных для лечения бактериемии, вызванной MRSA, и активного изучения использования антибиотиков в ветеринарии Европейским агентством по лекарственным средствам (ЕМЕА) авторы придерживаются мнения, что применение ванкомицина, тейкопланина и линезолида в ветеринарии не оправдано.
В медицинской литературе в качестве дополнения к терапии инфекции MRSA рекомендуют местную обработку для уничтожения микроорганизма, хотя данные о ее эффективности противоречивы. Местные формы антибиотиков, таких как мупироцин, фу-сидовая кислота или хлоргексидин, наносятся на поверхности обитания микроорганизмов для уничтожения MRSA, чтобы их место заняли менее устойчивые стафилококки. Результаты исследований с применением такой обработки слизистой оболочки носовой полости / анальной области у собак с MRSP пока не описаны, хотя показано, что местное нанесение фу-сидовой кислоты на слизистую оболочку носа и анус уменьшает носительство S. pseudintermedius на коже здоровых собак породы бигль [64]. По опубликованным данным, системная антибиотикотерапия с цефподоксимом не приводит к удалению чувствительных Ко+ стафилококков из зон носительства [35]; кроме того, цефалоспорины третьего поколения являются критически важными антибиотиками в медицине.
ПРОФИЛАКТИКА И КОНТРОЛЬ СТАФИЛОКОККОВЫХ ИНФЕКЦИЙ, ВЫЗВАННЫХ ПОЛИРЕЗИСТЕНТНЫМИ ШТАММАМИ
Распространение 5. pseudintermedius с кожи собак и кошек ответственно за частое обнаружение этого микроорганизма в среде ветеринарных клиник [74]. При обнаружении или подозрении на инфекцию или
носительство MRSP у животных необходимо принять тщательные меры предосторожности во избежание больничных инфекций и дальнейшего распространения этой полирезистентной бактерии [42]. Эти меры должны включать личную гигиену (мытье рук, использование масок, халатов и перчаток при хирургических вмешательствах) и гигиену окружающей среды (регулярную очистку и дезинфекцию всех поверхностей в клинике для уничтожения MRSA [52] и других контагиозных микроорганизмов [9] согласно рекомендациям).
До настоящего времени среди полирезистентных стафилококков не было обнаружено штаммов, устойчивых к моющим средствам и дезинфектантам; показано, что распространенные в ветеринарной практике дезинфицирующие средства обладают ингибирующим действием MRSP даже в низких концентрациях [3].
ВЫВОДЫ
Выделенные от собак штаммы, ранее классифицировавшиеся как S. intermedins, в настоящее время следует относить к S. psendintermedins. Термин “группа S. intermedins” следует использовать для обозначения штаммов, выделенных от других хозяев, при отсутствии результатов молекулярного исследования. Быстрое появление и широкое распространение MRSP в Европе и Северной Америке, как прогнозировал Waller [80], представляет значительную проблему как для ветеринарии, так и для медицины. Ввиду распространенности стафилококковой инфекции у собак MRSP способны значительно ухудшить возможности эффективного лечения распространенных инфекций кожи и мягких тканей у животных. Фенотипическая вариабельность группы S. intermedins и необходимость точной дифференциации между MRSP и MRSA представляет собой сложную задачу для ветеринарных диагностических лабораторий, для решения которой может потребоваться пересмотр и обновление повседневных лабораторных методик. Ветеринарным клиникам следует внедрить меры строгого контроля инфекций, рекомендуемые при обнаружении MRSA, для предотвращения дальнейшего распространения MRSP, играющего большую роль патогена для животных и являющегося потенциально зооантропонозным микроорганизмом и новым резервуаром генов устойчивости. Возникновение MRSP подчеркивает важность благоразумного использования антибиотиков в ветеринарной практике.
Текст научной работы на тему «Что произошло со Staphylococcus intermedius? Пересмотр таксономической классификации и развитие лекарственной полирезистентности». Авторы: R. Bond, A. Loeffler
Статья с сайта cyberleninka.ru