Что такое вертеброгенная цервикалгия?
Термин «цервикалгия» означает боль в области шеи, а слово «вертеброгенная» указывает на связь с позвоночником. По длительности этот синдром бывает острым и хроническим.
Информация для специалистов: по Международной классификации болезней вертеброгенная цервикалгия записана с кодом М 54.2. Поставленный диагноз обязан включать выраженность симптомов, стадию заболевания и схему лечения. Желательно также указать изменения в позвоночнике (спондилопатия или остеохондроз).
Характер боли при цервикалгии зависит от причин ее возникновения
Боль вертеброгенной природы в шейном отделе разделяют:
| На спондилогенную или позвонковую цервикалгию: | На дискогенную или истинную цервикалгию: |
| В этом случае поражённая костная ткань раздражает нервы, что вызывает боль и тоническое спазмирование мышц шеи. Обычно причиной является инфекционный процесс, новообразования или остеопороз. | Это следствие разрушения межпозвоночного диска. Болезнь чревата ущемлением нервных окончаний и утратой эластичности хрящевой прослойки. |
По проявленям протекания выделяют:
- Вертеброгенная цервикалгия в острой форме. Характеризуется сильным болевым синдромом и выраженными сопутствующими симптомами. Обычно является осложнением дорсопатий и травм. В основном, симптоматика длится около 10 дней
- Хроническая. При этом виде вертеброгенной цервикалгии отмечается постоянная слабая болезненность, которая продолжается свыше 3 месяцев. Механизмом пуска являются любые опухоли, вялые инфекции и патологии, затрагивающие сонную артерию.
В зависимости от локализации, заболевание протекает в следующих формах:
- Цервикобрахиалгия. Нарушениям подвергаются сосуды рук, что вызывает потерю чувствительности этих конечностей.
- Цервикокраниалгия. В патологии присутствуют негативные изменения сосудов, что опасно ухудшением местного кровотока.
В международной классификации МКБ-10 болезнь имеет код M54.2.
Боль в шее: цервикалгия или цервикальная дорсопатия?
Боль в спине в тот или иной период жизни отмечается у 80–100% жителей планеты. Причем 70% из них, по крайне мере однократно, утрачивают по этой причине трудоспособность. Очевидно, что боль в спине возникает в соответствии с локализацией дорсопатии (окципито–атланто–аксиальная, шейная, шейно–грудная, грудная, пояснично–грудная, поясничная, пояснично–крестцовая, крестцовая и крестцово–копчиковая), нередко распространяясь на несколько регионов или не имея определенной зоны распространения. Согласно международной терминологии, локальную боль в шее, представляющую собой один из вариантов боли в спине, называют цервикалгией, при вовлечении мышечно–связочного аппарата и иррадиации боли в голову – цервикокраниалгией, при иррадиации в руку – цервикобрахиалгией. При компрессии или раздражении корешков шейного отдела спинного мозга развивается радикулопатия, изменения структуры спинного мозга на шейном уровне приводят к развитию шейной миелопатии [4,14]. Среди болевых синдромов в спине боль в шее (включая цервикалгию, цервикокраниалгию и цервикобрахиалгию) занимает второе место (30,2%) после боли в нижней части спины (42,0%), и в подавляющем большинстве случаев приводит к временной утрате трудоспособности у людей моложе 45 лет, что является серьезной социально–экономической проблемой во всем мире. В среднем длительность боли составляет около 10 дней, у 70% пациентов болевой синдром регрессирует в течение 1 мес., а в 10% случаев боль носит хронический характер и длится более 3 мес. [1,18]. В ряде случаев боль в шее может быть единственным проявлением цервикальной дорсопатии, но чаще она сочетается с другими симптомами, а также с признаками дорсопатии иной локализации. По аналогии с устойчиво используемым в литературе термином «боль в нижней части спины», который нашел отражение в МКБ–10, в ряде публикаций, в основном научно–популярных, упоминается «боль в верхней части спины», что вполне оправданно. Боль в шее считается одним из проявлений «офисного синдрома» – сложного симптомокомплекса, включающего в себя нарушения, проявляющиеся в различных органах и системах, и развивающегося у офисных служащих в связи с воздействием на них различных факторов окружающей рабочей среды, которым страдают до 60–70% лиц трудоспособного возраста [8]. Причины боли в шее весьма разнообразны. Выделяют вертеброгенные и невертеброгенные этиологические факторы. Вертеброгенный болевой синдром в большинстве случаев обусловлен дегенеративно–дистрофическими изменениями элементов позвонково–двигательного сегмента (ПДС). Следует отметить анатомические особенности шейных позвонков, тела которых имеют крючковидные отростки и унковертебральные сочленения (сустав Luschka). Отличительной чертой шейных позвонков является наличие поперечных отростков, которые образуют канал, где проходит позвоночная артерия. Тела верхних шейных позвонков соединены дополнительным суставом (сустав Cruveilhier), который образован зубом второго позвонка и передней дугой атланта [14]. При радикулопатии боль в шее возникает вследствие механической компрессии корешков и асептического воспаления в корешковой зоне и периневральных структурах. При этом развиваются отек, ишемия, микроциркуляторные расстройства, обусловленные высвобождением провоспалительных цитокинов из пульпозного ядра диска в эпидуральное пространство, таких как фосфолипаза А2, лейкотриен В4, тромбоксан В2, фактор некроза опухоли–α [12,23]. В этих условиях повышается возбудимость ноцицепторов, появляются очаги патологической эктопической импульсации, что приводит к сенситизации спинальных и супраспинальных ноцицептивных нейронов. Боль носит смешанный характер, помимо ноцицептивного присутствует и нейропатический компонент. Возникновение нейропатической боли связано с явлением центральной сенситизации. Снижение порога возбуждения нейронов задних рогов спинного мозга обусловливает восприятие различных неболевых периферических импульсов как болевых раздражителей. При хронизации болевого синдрома длительный дисбаланс ноцицептивной и антиноцицептивной систем приводит к генерации болевых ощущений даже при отсутствии болевых стимулов [11]. В связи с анатомическими и биомеханическими особенностями шейного отдела позвоночника наиболее часто патологические изменения наблюдаются в нижних шейных позвонках и окружающих структурах, на которые приходится наибольшая нагрузка. Как правило, при радикулопатии страдают корешки С5–С7. Радикулярный болевой синдром характеризуется наличием острых простреливающих болей, парестезий и других сенсорных нарушений, иррадирующих по ходу дерматома и сочетающихся с двигательными нарушениями в зоне пораженного корешка [3,32]. Развитие рефлекторного мышечно–тонического синдрома связано с артрозом фасеточных суставов, гипертрофией связочного аппарата, вовлечением в патологический процесс краниальной мускулатуры и мышц верхнего плечевого пояса. Провоцирующими факторами являются неадекватная длительная статическая или динамическая нагрузка, переохлаждение, что приводит к рефлекторному напряжению мышц, которые сами становятся источником боли. Рефлекторные болевые синдромы в области шеи, как правило, характеризуются острым течением и односторонней локализацией. Боль усиливается при растяжении шейных мышц, носит ноющий, тянущий характер. Имеется ограничение движений в шейном отделе позвоночника, объективно выявляются напряжение мышц, участки локального уплотнения. Симптомы «выпадения» отсутствуют. Возникновение мышечно–тонических синдромов зачастую связано с напряжением определенных мышц. Синдром передней лестничной мышцы, описанный Н.С. Naffziger, характеризуется сдавлением сосудисто–нервного пучка в пространстве лестничных мышц или между передней лестничной мышцей и первым или добавочным шейным ребром. Клиническая картина представлена болью в шее, незначительным ограничением движений в шейном отделе позвоночника. При осмотре обращают на себя внимание вынужденное положение головы, которая при этом наклонена вперед и чуть в сторону напряженной мышцы, отечность руки, двигательные и чувствительные расстройства, преимущественно в зоне иннервации локтевого нерва. При синдроме малой грудной мышцы, описанном I.S. Wright, наблюдается компрессия сосудисто–нервных образований между малой грудной мышцей и клювовидным отростком лопатки. Возникновение этого синдрома может быть вызвано сильным отведением руки. У пациентов отмечается боль в шее, руке, в области грудной клетки. Объективно выявляются сенсорные расстройства в области иннервации локтевого нерва, двигательные нарушения преобладают в мышцах, иннервируемых срединным нервом. В диагностике синдрома помогают проба Wright и возникновение систолического шума в области подкрыльцовой артерии при отведении и поднимании руки. Синдром плечелопаточного периартроза обусловлен различными причинами, среди которых рефлекторные и нейродистрофические процессы при остеохондрозе позвоночника, вариант миофасциального болевого синдрома, длительная иммобилизация плечевого сустава. Некоторые авторы рассматривают плечелопаточный периартроз в рамках комплексного регионального болевого синдрома. В клинической картине имеет место интенсивный болевой синдром в области плечевого сустава, определяется ограничение движений в суставе, вследствие чего иногда используется термин «замороженное плечо», отмечается болезненность при пальпации окружающих плечо мышц. Нередко на фоне мышечно–тонического синдрома формируется миофасциальный болевой синдром. Значимыми факторами, приводящими к развитию миофасциального болевого синдрома на шейном уровне, являются антифизиологические позы, положение головы, патология плечевых суставов, переохлаждение, заболевания системы кровообращения [1]. При этом варианте во время пальпации удается определить в спазмированных мышцах триггерные точки, давление на которые вызывает локальную и отраженную боль. Следует помнить, что невертеброгенными причинами боли в шее могут быть болезни внутренних органов, спондилиты, реже метастатические опухоли, опухоли грудной и брюшной полостей, психогенные расстройства [1,12,14]. Сужение межпозвонковых отверстий вследствие дегенеративно–дистрофических изменений ПДС обусловливает компрессию не только корешков, но и позвоночных артерий, что влечет развитие синдрома позвоночной артерии. Часто он встречается у людей молодого и среднего возраста. Термин «синдром позвоночной артерии» является собирательным и объединяет комплекс церебральных, сосудистых, вегетативных симптомов. Основными патогенетическими механизмами синдрома позвоночной артерии являются компрессия ствола артерии, вегетативного сплетения и сужение просвета сосуда в связи с рефлекторным спазмом, способствующие снижению притока крови к задним отделам головного мозга с последующей недостаточностью мозгового кровообращения [9]. Клиническая картина его весьма вариабельна, что позволило выделить несколько различных клинических вариантов. Наиболее часто встречается вестибуло–атактический синдром. Возможны преходящие нарушения мозгового кровообращения в вертебрально–базилярном сосудистом бассейне в виде дроп–атак, синдрома Unterharnscheidt, зрительных, двигательных и чувствительных расстройств, бульбарных нарушений. При раздражении симпатического сплетения позвоночной артерии отмечается задний шейный симпатический синдром, при котором имеются кохлеовестибулярные, зрительные и вегетативные нарушения. Сбор анамнеза, определение характеристик болевого синдрома и провоцирующих факторов, психологического состояния пациента, выявление рефлекторных синдромов и очаговой неврологической симптоматики – залог правильного выбора дальнейшей тактики ведения больного. Важным инструментальным методом является рентгенография шейного отдела позвоночника, при которой можно выявить дегенеративно–дистрофические изменения и определить степень их выраженности. Следует помнить, что главная цель проведения данного исследования – это исключение объемных образований позвонков, остеопороза, спондилита. При наличии необходимых показаний пациента направляют на рентгеновскую компьютерную томографию (РКТ) и магнитно–резонансную томографию (МРТ), с помощью которых детально можно установить выраженность патологических изменений со стороны межпозвонкового диска, позвонков, мышечно–связочного аппарата, вещества спинного мозга. Выявление у пациента клинических признаков синдрома позвоночной артерии требует исследования состояния экстра– и интракраниального отдела позвоночной артерии, оценки функции кровотока вертебрально–базилярного сосудистого бассейна. Для этого применяются ультразвуковая допплерография и дуплексное сканирование сосудов. При подозрении на опухоль, метастатическое или воспалительное поражение позвонков используется радиоизотопная сцинтиграфия, позволяющая выявить локальное накопление радиофармпрепарата в очагах поражения костной ткани. Наличие и выраженность остеопороза помогает установить денситометрия. Для определения уровня поражения структур спинного мозга и периферической нервной системы, в том числе для уточнения характера радикулопатии, проводят электронейромиографию (ЭНМГ). Лечение пациентов с болью в шее требует особенно тщательного и индивидуального подхода. С учетом многокомпонентности болевого синдрома (ноцицептивный, нейропатический, психогенный компоненты боли) и варианта течения заболевания терапия должна быть комплексной и включать в себя как медикаментозные, так и немедикаментозные методы. Определение верного алгоритма ведения пациента с болью является залогом успешного лечения. Формирование правильного двигательного стереотипа, ограничение нагрузки в острый период, использование временной иммобилизации, поддержание эмоционального фона пациента, адекватная лечебная гимнастика препятствуют хронизации болевого синдрома, формированию болевого поведения и способствуют скорейшему выздоровлению. В первую очередь необходимо принять меры к уменьшению или купированию болевого синдрома. При выборе медикаментозного лечения следует учитывать возраст пациента, сопутствующую патологию и ее медикаментозную коррекцию в настоящее время, эффективность и безопасность препарата, наличие побочных эффектов, стоимость лекарственного средства. На первый план среди препаратов для купирования боли выступают нестероидные противовоспалительные препараты (НПВП). Используются неселективные НПВП, умеренно селективные НПВП и специфические ингибиторы ЦОГ–2. Одним из известных НПВП, служащих для быстрого купирования болевого синдрома, является лорноксикам (Ксефокам). Выбор нами препарата Ксефокам основывался на том, что его анальгетические свойства обусловлены сбалансированным ингибированием как ЦОГ–1, так и ЦОГ–2 с комплексным подавлением продукции провоспалительных простагландинов. Значимым в механизме действия препарата является угнетение высвобождения свободных радикалов кислорода из активированных лейкоцитов, что усиливает его анальгетическую и противовоспалительную активность. Ценным свойством лорноксикама при лечении болевого синдрома с многокомпонентным механизмом, включающим нейропатический компонент, является его влияние на центральную нервную систему (ЦНС), выражающееся в активации системы нейропептидных опиоидов, повышении уровня эндогенных морфинов (динорфина и В–эндорфина), что клинически проявляется улучшением состояния пациентов. По силе анальгетического эффекта препарат Ксефокам в терапевтической дозе приравнивают к 20 мг морфина, 40 мг кеторолака или 100 мг трамадола, при этом он не оказывает опиатоподобного действия на ЦНС, не вызывает сонливости и нарушения характера дыхания, а также возникновения лекарственной зависимости. Важными особенностями лорноксикама являются стимуляция синтеза протеогликанов и предотвращение дегенерации суставного хряща. Ксефокам на 99% связывается с белками плазмы, однако препарат активно проникает в суставные полости, где длительное время (10–12 ч) сохраняется в достаточной терапевтической концентрации, что позволяет принимать препарат всего лишь 2 раза/ сут. Короткий период полувыведения из плазмы крови (примерно 4 ч) лорноксикама обеспечивает восстановление протекторных физиологических уровней простагландинов между приемами препарата, необходимых для защиты слизистой желудка и поддержания нормального кровотока в почках, что значительно уменьшает выраженность побочных эффектов, не вызывая кумулятивного эффекта после повторных приемов. Ксефокам полностью метаболизируется в печени, при этом одна треть его неактивных метаболитов выводится почками, а две трети – печенью и кишечником, что снижает нагрузку на данные органы и улучшает переносимость лекарственного средства. Фармакокинетика лорноксикама практически одинакова у пожилых людей и лиц молодого или зрелого возраста, что не требует какой–либо коррекции дозы препарата у пожилых. Для лечения болевого синдрома используется доза Ксефокама 8–16 мг/сут., назначаемая в 2 приема. Длительность применения зависит от динамики клинических проявлений заболевания. Существуют таблетированные и инъекционные формы препарата Ксефокам, содержащие 4 и 8 мг действующего вещества. Особый интерес представляет таблетированный препарат Ксефокам Рапид, который предназначен для быстрого и эффективного купирования острой боли. Фармакокинетика Ксефокама Рапид соответствует внутримышечному пути введения лорноксикама. Обезболивающее действие препарата проявляется спустя 10–15 мин., что достигается благодаря уникальному составу и конструкции таблетки. Действующее вещество помещено в микрогранулы, покрытые буферным веществом. Последнее, вступая в реакцию с желудочным соком, создает слабощелочную среду, в которой лорноксикам быстро растворяется и всасывается в кровь. Такая форма лекарственного средства удобна в применении, поскольку позволяет избежать парентерального пути введения, что выгодно отличает Ксефокам Рапид от других НПВП. Многочисленные отечественные и зарубежные клинические исследования, проведенные с использованием различных шкал оценки боли, свидетельствуют о том, что препарат Ксефокам по силе анальгезирующего и противовоспалительного воздействия превосходит ряд других НПВП, а время начала действия препарата Ксефокам Рапид при пероральном приеме действительно сравнимо с таковым при парентеральном введении НПВП. Известен опыт применения Ксефокама в хирургии [24,25]. Применение в течение первых послеоперационных суток лорноксикама и морфина методом «контролируемое пациентом обезболивание» (КПО) выявило практически их одинаковое потребление (20 и 22 мг соответственно). При сравнении лорноксикама в дозе 8 мг и петидина в дозе 50 мг выявлено, что при одинаковой эффективности анальгетиков переносимость первого была значительно лучше. По данным W. Frenzel и F.W. Kursten, частота развития нежелательных явлений в целом по группе составляет 24,9%, при этом прослеживается их дозозависимый характер. К наиболее частым нежелательным явлениям относятся желудочно–кишечные осложнения в виде диспепсии, болей в животе, тошноты, диареи, рвоты. Исследования, выполненные на добровольцах с применением лорноксикама в течение 2 нед. в дозе 4 и 8 мг/сут., не выявили достоверных изменений показателей гемостаза [22]. Хорошая переносимость препарата отмечена в исследованиях, проведенных в Германии, Норвегии, России и других странах [10,17,31]. Препарат хорошо зарекомендовал себя и при лечении боли в спине. В исследовании F. Rainer и др. было показано, что лорноксикам в дозе 16 мг, вводимый перорально при острой боли в нижней части спины, оказывал обезболивающий эффект у 94% пациентов через 1 ч после приема препарата, а средняя продолжительность данного эффекта составила 8–9 ч [16]. В исследовании W. Kullich и G. Klein после внутривенного введения Ксефокама в дозе 4 или 8 мг/сут. пациентам с острой болью в пояснице отмечалось клиническое улучшение. При этом удалось зарегистрировать повышение уровня эндогенных опиоидов, динорфина и β–эндорфина, что свидетельствует о том, что Ксефокам действительно активирует центральные механизмы анальгезии [28]. Эффективность при длительном применении Ксефокама была продемонстрирована в двух параллельных рандомизированных двойных слепых исследованиях. Ксефокам в дозе 8 мг/сут. и диклофенак в дозе 100 мг/сут., назначаемые в 2 приема в течение 14 дней, были более эффективными, чем плацебо, и оказывали сопоставимый обезболивающий эффект [15]. Уникальное сочетание действия лорноксикама, проявляющееся в виде выраженного ингибирования ЦОГ с простагландин–депрессивным воздействием с одномоментной активной стимуляцией выработки физиологического эндорфина, делает препарат одним из наиболее эффективных и безопасных современных анальгетиков, что подтверждено при проведении многочисленных клинических, в том числе плацебо–контролируемых, исследований [21,26,30]. При наличии у пациента стойкого интенсивного болевого синдрома, очаговой неврологической симптоматики в начале терапии целесообразно назначение кортикостероидов на протяжении 3–5 дней с последующей быстрой отменой. Проведение блокад мышечных групп или триггерных точек введением лекарственных средств является эффективным методом купирования болевого синдрома, но требует достаточно высокой квалификации специалиста. Широко используются препараты, позволяющие уменьшить выраженность локального мышечно–тонического синдрома – миорелаксанты (баклофен, тизанидин, толперизон). Помимо НПВП и миорелаксантов, выступающих на первый план в лечении боли в шее, в дальнейшем с целью купирования болевого синдрома используют мануальную терапию, лечебную физкультуру, массаж и вытяжение. При хроническом болевом синдроме, нейропатической боли на первый план в лечении пациентов выступают препараты, подавляющие периферическую и центральную сенситизацию и активирующие антиноцицептивную систему. К таковым относятся антидепрессанты, предпочтение отдается селективным ингибиторам обратного захвата серотонина и норадреналина, и антиконвульсанты. Лечение этими препаратами обычно длительное, эффект наблюдается через несколько недель [1,5,7,20]. В комплексном лечении острой вертеброгенной боли традиционно используют витамины группы В, особенно высока их эффективность в сочетании с НПВП [7]. Проведенные исследования подтверждают эффективность применения витаминов группы В при ноцицептивной и нейропатической боли. Описан не только метаболический, но и нейротрофический эффект витамина В1 (тиамина) – важнейшего компонента физиологической системы проведения нервных импульсов. Установлено, что витамины В6 и В12 (пиридоксин и цианокобаламин) играют важную роль в процессах миелинизации нервных волокон. Пиридоксин участвует в синтезе медиаторов не только периферической нервной системы, но и ЦНС [2,6,19,27,29]. Одним из препаратов, содержащих комплекс витаминов группы В, является Нейробион, лечение которым следует начинать с внутримышечного введения, а через 10 дней продолжать перорально в дозе 2 табл./сут. на протяжении 1–2 мес. в зависимости от эффективности терапии. Включение Нейробиона в комплексную терапию болевого синдрома позволяет достичь более выраженного действия при одновременном применении с НПВП, уменьшить длительность эпизода боли, продолжительность терапии, частоту возникновения рецидива. Известно, что основная масса людей страдает вертеброгенной болью, которая не может быть отнесена ни к одной из известных нозологических единиц. В большинстве случаев боль существует не более нескольких недель, и в течение 1 мес. большинство пациентов трудоспособного возраста приступают к работе, даже если и испытывают некоторую боль [13]. Именно поэтому актуальным является своевременное и эффективное купирование острой боли, поскольку в противном случае она может трансформироваться в хроническую, и восстановление прежнего качества жизни пациентов потребует значительно больших усилий. Литература 1. Болевые синдромы в неврологической практике / Под ред. В.Л. Голубева. М.: МЕДпресс–информ, 2010. 330 с. 2. Бурчинский С.Г. Возможности комплексной нейротропной фармакотерапии при нейропатических и невралгических синдромах // Здоровье Украины. 2009. № 4. С. 14–15. 3. Вейн А.М. Болевые синдромы в неврологической практике. М.: МЕДпресс, 1999. 365 с. 4. Веселовский В.П. Клиническая классификация вертебро–неврологических синдромов. Казань, 1995. 144 с. 5. Данилов А.Б. Алгоритм диагностики и лечения боли в нижней части спины с точки зрения доказательной медицины // Атмосфера. Нервные болезни. 2010. № 4. С. 11–18. 6. Данилов А.Б. Лечение острой боли в спине: витамины группы В или НПВП? // РМЖ. 2010. Специальный выпуск «Болевой синдром». С. 35–39. 7. Данилов А.Б. Применение витаминов группы В при болях в спине: новые анальгетики? // РМЖ. 2008. Специальный выпуск «Болевой синдром». С. 35–39. 8. Данилов А.Б., Курганова Ю.М. Офисный синдром // РМЖ. 2011. № 30. С. 1902–1908. 9. Калашников В.И. Синдром позвоночной артерии: клинические варианты, классификация, принципы диагностики и лечения // Международный неврологический журнал. 2010. № 1 (31). С. 93–99. 10. Ковальчук В.В., Ефимов М.А. Сравнительная характеристика эффективности и переносимости кратких курсов терапии различными нестероидными противовоспалительными препаратами при лечении пациентов с дорсалгиями // Журн. неврол. и психиатр. им. С.С. Корсакова. 2010. № 1. С. 55–58. 11. Кукушкин М.А. Механизмы развития и принципы этиопатогенетической терапии хронической боли // Журн. неврол. и психиатр. им. С.С. Корсакова. 2012. № 2. С. 89–94. 12. Левин О.С., Макотрова Т.А. Вертеброгенная шейная радикулопатия // РМЖ. 2012. № 12. С. 621–627. 13. Подчуфарова Е.В. Боль в пояснично–крестцовой области: диагностика, лечение // РМЖ. 2004. № 10. С. 581–584. 14. Попелянский Я.Ю. Заболевания периферической нервной системы: Руководство для врачей. М.: Медицина, 1989. 464 с. 15. Mayrhofer F., Siegmeth W., Kolarz G. et al. A multicentre, randomised, double–blind study comparing Lornoxicam with conventional diclofenac in patients with chronic low back pain // Annals of Experimental and Clinical Medicine. 1994. Vol. 1. № 5–6. P. 283–290. 16. Rainer F., Klein G., Mayrhofer F. et al. A prospective, multicentre, open–label, uncontrolled Phase II study of the local tolerability, safety and efficacy of intramuscular chlortenoxicam in patients with acute low back pain // Eur. J. Clin. Res. 1996. Vol. 8. P. 1–13. 17. Aabakken L., Osnes M., Frenzel W. Gastrointestinal tolerability of lornoxicam compared to that of naproxen in healthy male volunteers // Aliment. Pharmacol. Ther. 1996. Vol. 10. № 2. P. 151–156. 18. Adams R., Victor M., Ropper A. Pain in the back, neck and extremities // Principies of neurology. 1997. P. 194–225. 19. Hosseinzadeh H., Moallem S.A., Moshiri M., Sarnavazi M.S. et al. Anti–nociceptive and anti–inflammatory effects of cyanocobalamin (vitamin B12) against acute and chronic pain and inflammation in mice // Arzneimittelforschung. 2012. Vol. 62, №7. P. 324–329. 20. Carey T., Evans A., Hadler N. et al. Acute severe low back pain. A population–based study of prevalence and care–seeking // Spine. 1996. Vol.21. P. 339–344. 21. Bolukbasi N., Ersanli S., Basegmez C. et al. Efficacy of quick–release lornoxicam versus placebo for acute pain management after dental implant surgery: a randomised placebo–controlled triple–blind trial // Eur. J. Oral Implantol. 2012. Vol. 5, №2. P. 165–173. 22. Frensel W., Kursten F.W. Lornoxicam. A novel highly potent anti–inflammatory and analgesic agent. Clinical investigator’s brochure. Hafslund Nycomed Pharma, 1995. 23. Gatchel R.J., Gardea M.A. Lower back pain: psychosocial issues. Their importance in predicting disability, response to treatment and search for compensation // Neurol. Clin. 1999. Vol. 17. P. 149–166. 24. Ilias W., Jansen M. Pain control after hysterectomy: an observer–blind, randomised trial of lornoxicam versus tramadol // Br. J. Clin. Pract. 1996. Vol. 50, № 4. P. 197–202. 25. Rosenow D.E., van Krieken I., Stolke D. et al. Intravenous administration of lornoxicam, a new NSAID, and pethidine for postoperative pain: a placebo controlled comparison // Clin. Drug. Invest. 1996. Vol. 11. P. 11–19. 26. Kidd B., Frenzel W. A multicenter, randomized, double blind study comparing lornoxicam with diclofenac in osteoarthritis // J. Rheumatol. 1996. Vol. 23, № 9. P. 1605–1611. 27. Kopruszinski C.M., Reis R.C., Chichorro J.G. B vitamins relieve neuropathic pain behaviors induced by infraorbital nerve constriction in rats // Life Sci. 2012. Aug 24. [Epub. ahead of print]. 28. Kullich W. and Klein G. Influence of the nonsteroidal antiinflammatory drug lornoxicam i.v. on the secretion of the endogenous opiate peptides dynorphin and beta–endorphin. Aktuelle Rheumatol. 1992. Vol. 17, № 4. P. 128–132. 29. Reyes–Garcia G., Castillo–Henkel C., Medina–Santillan R. et al. Mechanisms of analgesic action of B vitamins in formalin–induced inflammatory pain // Proc. West. Pharmacol. Soc. 2002. Vol. 45. P. 144–146. 30. Ravic M., Johnston A., Turner P. Clinical pharmacological studies of some possible interactions of lornoxicam with other drugs // Postgrad. Med. J. 1990. Vol. 66. P. 30–34. 31. Rose P., Steinhauser C. Comparison of lornoxicam and rofecoxib in patients with activated osteoarthritis (COLOR Study) // Clin. Drug. Investig. 2004. Vol. 24. № 4. P. 227–236. 32. Rowe L.J. Imaging of mechanical and degenerative syndromes of the lumbar spine // Clinical anatomy and management of low back pain. Oxford: Butterworth–Heinemann. 1997. P. 275–313.
Причины, провоцирующие заболевание
Вертеброгенная цервикалгия довольно распространённое заболевание. Факторов, провоцирующих эту проблему, можно выделить большое количество.
Основными причинами являются:
- Чрезмерные физические нагрузки.
- Длительная неудобная поза.
- Малоактивный образ жизни.
- Сидячая работа за компьютером.
- Депрессивные состояния и стрессы.
- Скудное питание.
- Заболевания шейного отдела.
- Нарушение метаболизма.
- Психические расстройства.
Необходимо учитывать, что через шею проходит масса нервных окончаний и сосудов. Поэтому все проблемы в шейном отделе отзываются острой болью, а иногда и сбоем функционирования внутренних органов.
Причинами могут быть и осложнения предшествующих заболеваний:
- Остеопороз изменяет костную ткань.
- Ревматоидный артрит поражает суставы.
- Межпозвоночная грыжа разрушает конструкцию позвонков.
- Спондилёз изменяет все структуры позвоночника.
Как правило причинами болей в шее являются дегенеративные изменения в хрящах позвоночника
Боль при вертеброгенной цервикалгии нередко обусловлена функциональным нарушением позвонков шейного отдела сопутствующими патологиями.
Видео: «Боли в шее на фоне остеохондроза: что делать?»
Возможные последствия
Отсутствие лечения может привести к серьёзным нарушениям функционирования мозга. Это объясняется тем, что повреждённые позвонки в шейном отделе ухудшают кровоснабжение головы.
Естественно, стеноз артерий вызывает следующие проблемы:
- Мучительные головные боли.
- Частые обмороки.
- Нарушается координация движений.
- Может парализовать конечности.
Чтобы избежать осложнений следует своевременно начать лечение.
Диагностика вертеброгенной головной боли
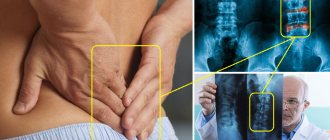
Для установления правильного диагноза врач должен внимательно опросить пациента и провести тщательный осмотр. При подозрении на цервикокраниалгию назначаются дополнительные методы исследования:
- рентгенография шейного отдела позвоночного столба. На снимках отчётливо проступают патологические процессы, которые объясняют имеющиеся жалобы и проявления болезни;
- компьютерная томография. Проводится в менее ясных случаях для более точного определения патологических зон;
- МРТ. Информативный метод, показанный пациентам, которые имеют какие-либо противопоказания к рентгенологическому исследованию;
- Ангиография сосудов, питающих головной мозг (рентгенисследование с применением контрастных веществ);
- доплерография, позволяющая оценить свойства прохождения крови по сосудам и найти участки с нарушенным гемодинамическим процессом.
Симптомы
У этого заболевания основным проявлением является болевой синдром. Цервикалгия сопровождается массой признаков, но чаще наблюдается мышечно-тонический синдром. В этом случае шейные мышцы уплотняются, а если на них нажать, то боль усиливается.
Среди других симптомов следует выделить:
- Движение головы сопровождается специфическим хрустом.
- Пульсирующая головная боль, а также головокружения.
- Ограничение подвижности шеи.
- При наклоне головы назад возникают обмороки.
- Частичная потеря зрения и слуха.
- Боль распространяется на одну из рук и плечо.
- Походка становится шаткой.
- Слабеют верхние конечности.
- Покалывание, а также онемение лица, рук и затылка.
- Тошнота, но без рвоты.
- При кашле или чихании боль обостряется.
Такая симптоматика характерна для любого человека, независимо от пола и возраста. У хронической цервикалгии симптомы менее выражены, в отличие от острого заболевания. При переохлаждении или травме позвоночника боль интенсивная и сильно сковывает движения. Когда заболевание возникает на фоне сопутствующего заболевания, боль обычно выражена слабо.
Видео: «Все причины болей в шее»
Лечение
А знаете ли вы, что…
Следующий факт
Терапия назначается после тщательного обследования. Следует учесть, что некоторые препараты и физиопроцедуры имеют строгие противопоказания. Прогноз на выздоровление весьма благоприятный.
Препараты
Для устранения болей в шее назначают комплекс из нескольких групп препаратовОбязательно применяются обезболивающие средства, обладающие противовоспалительным действием: Целебрекс, Ксефокам, Ибупрофен. Лекарства используют в форме таблеток, инъекций и мазей.
В стационаре проводят эпидуральные блокады и вводят в мышцы ботулинический токсин. При наличии сильных болей прибегают к новокаиновым блокадам. Иногда используется лидокаин. При остром болевом синдроме иногда назначают гормональные препараты (глюкокортикостероиды), которые обладают мощным противовоспалительным воздействием.
Чтобы тонизировать сосуды и улучшить микроциркуляцию назначают Сермион и Трентал. Лечение не обходится без миорелаксантов, снимающих мышечные спазмы и уменьшающих боль.
При наличии остеопороза применяются средства, активизирующие регенерацию костной ткани ‒ фториды и анаболические стероиды. Необходимы также препараты, предотвращающие разрушение костей ‒ Миокальцик, эстрогены.
Иногда возникает потребность в приёме антидепрессантов: Сертралин, Диазепам.
Физиотерапия
- Электрофорез.
- Ультрафиолетовое облучение.
- Электронейростимуляция.
- Диодинамические токи.
- Бальнеолечение.
- Электроакупунктура.
Хирургическое
Любые операции в области шеи довольно рискованные из-за повышенной концентрации в этой области сосудов и нервов.
Показаниями для хирургического вмешательства считаются:
- Острое поражение, когда отмечаются поражения внутренних органов.
- Нарастание пареза с угрозой некроза нервных окончаний. При этом болевой синдром снижается, но увеличивается слабость
Решение о проведении операции, обязано быть мотивированным, а также трезво взвешенным.
ЛФК и массаж
При вертеброгенной патологии необходима лечебная гимнастика, которая содержит комплекс движений с мышечными напряжениями. Целью упражнений является устранение нарушений регуляции мышц.
Специальный комплекс обладает общим стержнем из физических упражнений, восстанавливающих двигательный стереотип. Они также способствуют постизометрической релаксации, растягивают мышцы и активизирую самомобилизацию отделов позвоночника.
Упражнения комплекса лечат определёнными движениями, которые направлены на исправления изменений в определённых мышечных группах позвоночника.
Следует учесть, что ЛФК используется обычно для профилактики или в период ремиссии, чтобы предотвратить обострение.
Основные упражнения:
- Положение, сидя на стуле. Спина ровная, руки опущены. Делается около 15 наклонов головы в разные стороны.
- Исходное положение прежнее. Откинуть голову назад и задержаться на несколько секунд. Движение повторяется до 10 раз.
- В положении сидя, максимально поднимать вверх плечи с небольшой задержкой.
- Медленно крутить головой с постепенным увеличением амплитуды.
Такие упражнения можно делать в любое время и в любых условиях. Особенно они рекомендуются для людей, ведущих малоактивный образ жизни.
Очень полезен самомассаж при данном заболевании. Он позволяет уменьшить боль и снять сосудистый спазм.
Методика выполнения движений:
- Лёгкое поглаживание головы от темечка к затылку.
- Поглаживание боковых шейных отделов подушечками пальцев. Обязательно сверху вниз и одновременно с двух сторон.
- Лёгкое массажирование надплечий ладонями.
- Растирание и разминание трапециевидной мышцы шеи до плеча.
- Штриховые движения в направлении остистого отростка 7 шейного позвонка.
- Поглаживания затылка, шейной области и надплечий.
В момент воздействия на болезненные участки может возникнуть боль, тепло и чувство рези. Главное, не допускать сильной боли и следить за ощущениями. Самомассаж лучше освоить с помощью специалиста-вертебролога.
Терапия в домашних условиях
В домашних условиях можно лишь уменьшить симптоматику при цервикалгииСамостоятельно можно использовать некоторые народные средства, которые достаточно эффективные и проверены временем.
Самые популярные из них: ванны с определёнными травяными сборами, растирки отваром корня барбариса.
Эти 2 метода не навредят, но и не устранят причину заболевания. Самое главное, что они уберут дискомфорт в шее. Травяные ванны разогревают и снижают боль. Растирки расслабляют шейный отдел, так как оказывается мягкое воздействие компонентами барбариса.
Естественно, при появлении симптомов защемления нервного окончания в области шеи, нужно незамедлительно нанести на болезненный участок противоболевую мазь. Можно принять таблетку Диклофенака или Ибупрофена.
Следует обязательно исключить сквозняки и ограничить движения шеи. Уменьшить дискомфорт поможет укутывание шеи шерстяной тканью.
Что касается питания, то при данном синдроме не выделяют особых диет.