О том, что представляет собой патология
Лейкоз крови у детей представляет собой злокачественное заболевание лейкоцитов, т.е. белых кровяных телец. Проблема в том, что при данной патологии костным мозгом вырабатываются аномальные (мутировавшие) клетки, которые не способны выполнять свои защитные функции. Вместо этого больные лейкоциты бесконтрольно делятся, препятствуя выработке необходимых организму эритроцитов (красных кровяных телец) и тромбоцитов (безъядерных, плоских клеток, отвечающих за свёртываемость крови).
На основании продолжительности болезни описывают две её формы:
- острую (менее двух лет);
- хроническую (свыше двух лет).
В детском организме преимущественно протекает первый вид, на его долю отводится 97% случаев.
По морфологическому типу выделяют:
- лимфобластный лейкоз у детей (в данном случае мутации подвергаются молодые, незрелые лейкоциты – лимфобласты);
- нелимфобластный.
Ко второму типу относят злокачественное поражение миелоидного ростка крови (его также называют острый миелобластный лейкоз у детей).
Острая форма отличается динамичным развитием, в результате данного заболевания появляется анемия, ослабляется иммунитет, происходят внутренние кровоизлияния, наблюдается повышенная кровоточивость. Все это сопровождается чувствительностью к инфекциям (дети очень часто болеют).
На заметку
Достижения отечественной онкогематологии, прежде всего детской, стали возможны благодаря вниманию государства к этой отрасли медицины.
41% средств, выделяемых на финансирование государственной программы «7 нозологий» (а это 1,16 млрд долл.), направляется на лечение пациентов с гемобластозами (злокачественные заболевания крови, к которым относятся и детские лейкозы).
В России программы неродственного донорства костного мозга только зарождаются — такие пересадки стали делать всего лет 10 назад. В масштабах страны их ничтожно мало — не более 70–80 в год. Всего в стране 13 клиник имеют лицензии на трансплантацию, и есть 70–75 сертифицированных врачей-гематологов, онкологов и трансфузиологов, которые могут проводить эту процедуру. Одно из самых крупных отделений трансплантации — открывшийся в 2011 году в Москве Научно-клинический центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачёва.
Почему развивается данное заболевание
Точные причины лейкоза у детей на сегодняшний день не установлены, лишь выделен ряд опасных факторов, которые способны привести к заболеванию.
В первую очередь называют генетический фактор. Сама болезнь не передается, речь идет о склонности клеток к мутации. Замечено, что чаще болеют те, у кого близкие родственники перенесли такую же патологию. Также следует отметить связь с некоторыми врожденными заболеваниями (например, при синдроме Дауна риск развития в крови злокачественного процесса в 15 раз выше, чем у здоровых малышей).
Вызвать развитие и признаки лейкоза у детей может радиационное излучение, некоторые химические факторы, а также эндогенные проблемы (иммунодефицит, гормональное нарушение).
Причины
Причины возникновения онкологических болезней крови точно не установлены. Это может быть:
- генетический сбой;
- аномалия развития клеток крови;
- воздействие радиации;
- наследственный фактор;
- плохая экологическая остановка;
- употребление канцерогенов и т. д.
Сказать точно, по какой причине у малыша, который еще не имеет негативных привычек и не употребляет в пищу вредные продукты, возникла болезнь, вряд ли сможет даже светило медицины.
Основные симптомы, указывающие на патологию
Характерными симптомами лейкоз у детей не проявляется, данное заболевание имеет только общие признаки, которые могут указывать на развитие любой болезни. Поэтому часто этот диагноз выявляют во время обследования с подозрением на иной недуг.
При этом заподозрить первые признаки лейкоза у детей можно, если обратить внимание на такие отклонения, как:
- повышенная утомляемость (что несвойственно в детском возрасте, когда, наоборот, должна наблюдаться гиперактивность);
- появление одышки во время игр;
- нарушения сна;
- плохой аппетит;
- бледность кожных покровов (часто они имеют землистый оттенок);
- высокая склонность к образованию синяков;
- частые кровотечения (носовые, десенные);
- головные боли;
- необоснованно повышающуюся температуру.
Самыми яркими симптомами острого лейкоза у детей становятся долгое время кровоточащие ранки после падений или порезов (это говорит о плохой свёртываемости) и частые болезни.
Сбой в иммунной системе
Можно ли предугадать риск развития лейкоза? К сожалению, нет. «99% лейкозов — абсолютно случайные события, — рассказывает заместитель генерального директора по научной работе ФНКЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачёва, директор Института гематологии, иммунологии и клеточных технологий (ИГИКТ), доктор медицинских наук, профессор Алексей Масчан. — У детей самая бурно развивающаяся система — иммунная, и сбой в её работе у кого-то приводит к развитию лейкоза. Каждый год на 100 тысяч детей регистрируется 4 случая острого лейкоза».
Куда обратиться Трансплантации костного мозга детям и подросткам проводятся в 13 российских медицинских центрах.Ведущие расположены в Москве – ФНКЦ ДГОИ им. Дмитрия Рогачёва, РДКБ, Онкоцентр им. Н. Н. Блохина.В Санкт-Петербурге – СПбГМУ им. академика И. П. Павлова, Институт детской гематологии и трансплантологии имени Раисы Горбачёвой. Есть центры в Екатеринбурге, Нижнем Новгороде.
Специалисты рекомендуют обращать внимание на следующие симптомы и изменения в самочувствии ребёнка:
- беспричинное появление синячков, мелкой геморрагической сыпи — не от того, что ребёнок ударился, а просто так;
- бледность, увеличение размеров живота;
- появление непонятных образований на теле, увеличение лимфоузлов;
- изменения в анализах крови;
- могут быть различные боли — головные, в животе, но это необязательный симптом.
Первый, к кому должны обратиться за консультацией родители, — участковый педиатр, он решит, нужна ли ребёнку консультация гематолога.
«Если опасения небезосновательны, ребёнок передаётся в областную детскую клиническую больницу, к гематологам. Областные больницы решают, могут ли они своими силами справиться с данным недугом: есть ли у них необходимое оборудование и кадры, — рассказывает заведующая отделением трансплантации костного мозга ФГБУ “Российская детская клиническая больница” Минздрава России, доктор медицинских наук Елена Скоробогатова. — Если на месте не справиться, регион обращается в одну из федеральных клиник, где есть отделение трансплантации костного мозга. Мой совет: если вашему ребёнку поставлен диагноз “острый лейкоз”, не обращайтесь в частные клиники, пользуйтесь государственной сетью. Не теряйте время и деньги!»
Как диагностируют данную патологию
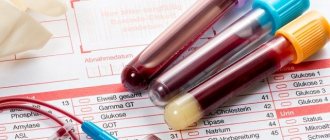
После первичного осмотра первое, что назначит врач – это анализ крови при лейкозе у детей (сюда входит расширенное исследование и биохимия). Лабораторное исследование покажет наличие анемии, тромбоцитопению, будет повышен СОЭ. В качестве наиболее характерных показателей крови при лейкозе у детей отмечается такая аномалия, как «лейкемический провал». Суть её в том, что между незрелыми лейкоцитами и зрелыми отсутствуют обязательные переходные формы (юные, сегментоядерные).
В программу детской диагностики непременно включают:
- стернальную пункцию;
- биопсию костного мозга;
- трепанобиопсию.
Кроме того, необходимым является осмотр детского невропатолога, офтальмолога. Дополнительными являются УЗИ лимфоузлов, и при необходимости – печени, слюнных желез и других органов (необходимость определяет врач на основании результатов проведенного обследования).
Надежда на спасение
«Цель любого детского гематолога-онколога — вылечить всех своих пациентов, — говорит Алексей Масчан, — но 10–20% больных лейкозом детей мы вылечить пока не можем. Для их лечения нужны принципиально новые подходы, и они лежат уже не в области обычной химиотерапии, какой бы интенсивной она ни была. Врачи связывают большие надежды с биотехнологиями и развитием нового направления — иммуноонкологии».
Время милосердия. Что каждый может сделать для детей из онкоцентра?
Подробнее
Первые исследования в области создания иммуноонкологических препаратов начались лет 15 назад в США и странах Европы. Сегодня иммунотерапия лейкозов, в том числе у детей, успешно применяется в европейских и американских клиниках, когда химиотерапия неэффективна. При новом методе лечения 70% безнадёжных пациентов достигают ремиссии. Препараты пока не зарегистрированы, но уже доступны в России. По программе индивидуального доступа курс терапии проходят несколько пациентов Рогачёвского , — подводит итог Алексей Масчан.
Статья по теме
Валерий Савченко: «Благодаря прогрессу в химиотерапии удалось спасти тысячи жизней»
Какие методики терапии применяются
Основным методом лечения лейкоза у детей является комплексная химиотерапия. Она состоит из комбинации нескольких специальных противоопухолевых лекарственных средств и глюкокортикоидных гормонов в больших дозах. После курса в обязательном порядке проводится иммунотерапия (интерфероном или другими препаратами).
В лечении особенно важным является поэтапный подход, который направлен на то, чтобы:
- достичь стойкой ремиссии;
- закрепить её;
- провести поддерживающую терапию;
- выполнить профилактику возможных осложнений.
В сложных случаях может понадобиться проведение трансплантации стволовых клеток, пересадка костного мозга от донора, переливание тромбоцитарной и эритроцитарной масс.
Цена вопроса
Стоимость одной операции по трансплантации костного мозга превышает 2 млн рублей (согласно Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2015 год и на плановый период 2021 и 2021 годов).
Статья по теме
Спасение от рака: Испания – одно из лучших мест для лечения детской онкологии
«С 2015 года на трансплантацию государство выделяет 2 млн 300 тысяч рублей на каждого пациента на всё лечение, эта сумма позволяет закрыть многие позиции, которые раньше оплачивались благотворительными фондами, — говорит Елена Скоробогатова. — Но всё равно вклад благотворителей существенен, он составляет 20 и более процентов в лечении наших пациентов. Фонды решают вопросы не только обеспечения медикаментами, расходными материалами, но и в ряде случаев оплачивают поиск донора, транспортные расходы по доставке донорского костного мозга и многое другое. Каждый центр работает со своими фондами, мы — с фондом «Подари жизнь».
О рецидивах и прогнозах после лечения
Как правило, рецидив именно этого заболевания, если он есть, то проявляется прямо в период курса лечения или сразу после его окончания. После того, как удалось достичь ремиссии, и проведена её консолидация (закрепление), через пять лет рецидивы – крайне редкое явление. Через семь лет можно смело говорить о полном выздоровлении.
Современные методики лечения позволяют говорить о благоприятном прогнозе на острый лимфобластный лейкоз у детей в 60-80% случаев. На показатель влияет адекватная программа терапии (включая возможности специализированной клиники) и общее состояние организма.
Острый миелоидный лейкоз у детей
Если при ОЛЛ у детей достигнуты значительные успехи в лечении, то результаты лечения ОМЛ остаются недостаточно удовлетворительными. В связи с этим проблема диагностики и лечения ОМЛ у детей является актуальной.
ОМЛ — гетерогенная группа заболевания. Основой для разделения его на различные варианты является морфологическая идентификация лейкозных клеток, которая помимо цитологических данных использует цитохимические показатели.
В 1976 г. была принята Франко-американо-британская (FAB) классификация, которая выделяет среди ОМЛ несколько вариантов: М0 — острый недифференцированный лейкоз, М1 — острый миелобластный лейкоз без признаков созревания, М2 — острый миелобластный лейкоз с признаками созревания, М3 — острый промиелоцитарный лейкоз, М4 — острый миеломонобластный лейкоз, М5 — острый монобластный лейкоз, М6 — острый эритроцитарный лейкоз, М7 — острый мегакариоцитарный лейкоз.
Диагностика
Диагноз ОМЛ устанавливается в более 30% случаев определения бластов в костном мозгу. Бласты должны иметь морфологическую и цитохимическую характеристику одного из FAB вариантов ОМЛ.
Цитохимические данные, направленные на диагностику вариантов заболевания, — положительная реакция на миелопероксидазу, с суданом черным Б и неспецифическую эстеразу, ингибируемую фтористым натрием. При этом совокупность данных показателей различается при разных вариантах ОМЛ. Так, наличие положительной реакции на миелопероксидазу характерно для вариантов М1, М2, М3 и М4, а неспецифическая эстераза, ингибируемая фтористым натрием, специфична для вариантов М4 и М5.
Существенным дополнением для диагностики ОМЛ являются иммунофенотипические исследования, уточняющие стандартную морфологическую диагностику и варианты ОМЛ.
Наиболее распространенными и широко применяемыми для подтверждения нелимфоидной природы лейкоза являются антигены CD13 и CD33, несколько реже используется CD65. Оценка этих трех маркеров позволяет подтвердить миелоидную природу опухолевых клеток в 98% случаев ОМЛ у детей.
Хромосомный анализ необходим для прогнозирования результатов лечения ОМЛ. Приблизительно у 75% детей, больных ОМЛ, можно выявить ту или иную хромосомную аберрацию, среди которых есть аномалии, характерные лишь для определенных вариантов ОМЛ. Так, t(8;21) ассоциируется с М2-вариантом, t(15;17) — с М3-вариантом, inv(16) — с М4-вариантом с эозинофилией. Аномалия 11q23 встречается при вариантах М4 и М5 и t(1;22) при М7-варианте. С помощью методов молекулярно-биологической диагностики — полимеразной цепной реакции (ПЦР) и FISH (fluorescent in situ hybridization) — можно определить хромосомную аберрацию, не выявленную при стандартном цитогенетическом исследовании. Это особенно важно для выбора определенного вида лечения в случае подтверждения М3-варианта. Кроме того, благодаря внедрению методов молекулярной диагностики ОМЛ в настоящее время у больных можно констатировать не только клинико-гематологическую, но и молекулярную ремиссию с последующим слежением за минимальной остаточной болезнью и определением молекулярного рецидива.
Клиника
Клиническая картина ОМЛ достаточно хорошо известна и проявляется следующими синдромами: анемическим, геморрагическим и токсическим, которые характеризуются бледностью кожных покровов, выраженной слабостью, головокружением, снижением аппетита, повышенной утомляемостью, лихорадкой без проявлений катаральных явлений.
Лимфатические узлы у большинства больных — небольших размеров, безболезненные, не спаяны с кожей и друг с другом. В редких случаях наблюдаются увеличенные лимфатические узлы размером от 2,5 до 5 см с образованием конгломератов в шейно-надключичной области. Изменения в костно-суставной системе в некоторых случаях проявляются выраженными оссалгиями в нижних конечностях и в области позвоночного столба, что сопровождается нарушением движений и походки. На рентгенограммах костной системы отмечаются деструктивные изменения различной локализации, периостальные реакции, явления остеопороза. У большинства детей наблюдается небольшое увеличение печени и селезенки (выступают из-под края реберной дуги на 2-3 см).
Экстрамедуллярные опухолевые поражения чаще проявляются гингивитом и экзофтальмом, в том числе двусторонним; в редких случаях бывают опухолевая инфильтрация мягких тканей, гипертрофия нёбных миндалин, поражение носоглотки и лицевого нерва, а также лейкемиды на коже.
Экстрамедуллярные локализации ОМЛ объединяет термин «гранулоцитарная (миелобластная) саркома», включающая классическую хлорому и непигментированные опухоли.
По данным аутопсии, гранулоцитарная (миелобластная) саркома диагностируется в 3-8% случаев у больных ОМЛ. Она может предшествовать или сочетаться с признаками ОМЛ, характеризующимися бластной инфильтрацией костного мозга и наличием бластов в периферической крови, а также наблюдаться при рецидиве заболевания. Наиболее частой локализацией опухолевого роста является орбита (поражаются орбитальная ткань и внутренние структуры черепа). Бластные клетки чаще представлены М2-типом, имеющими транслокацию t(8;21). Ряд авторов указывают на более плохой прогноз у этих больных, чем при типичном ОМЛ.
Факторы прогноза у больных ОМЛ менее изучены, чем у больных с ОЛЛ. Было проведено большое количество одно- и многофакторных исследований, с помощью которых появилась возможность определения благоприятных и неблагоприятных признаков заболевания для назначения рационального лечения. Факторы, от которых зависит прогноз ОМЛ у детей, разделяют на клинические и лабораторные. К клиническим можно отнести возраст, пол, анамнез, размеры паренхиматозных органов, выраженность геморрагического синдрома, инициальное поражение ЦНС, время наступления ремиссии, количество курсов химиотерапии. Среди лабораторных прогностических факторов выделяют чувствительность бластных клеток к химиопрепаратам in vitro, количество лейкоцитов в анализе периферической крови, FAB-вариант ОМЛ, уровень фибриногена, уровень лактатдегидрогеназы, наличие палочек Ауэра в бластах.
Прогноз при ОМЛ зависит от FAB-морфологического варианта, данных генетического исследования и иммунофенотипа бластных клеток. Так, наиболее благоприятную группу составляют больные с морфологическими вариантами М1, М2 и t(8;21), t(9;11), М3 и t(15;17) или М4 и inv(16). В неблагоприятную для прогноза группу входят больные с вариантами М4 без inv(16), М5, М6 и М7, а также пациенты, при исследовании кариотипа опухолевых клеток которых были выявлены следующие хромосомные аномалии: t(9;22), t(6;11), t(10;11), del5q-, del7q-, моносомии -5, -7. Кроме того, нашими исследованиями удалось доказать, что на прогноз ОМЛ неблагоприятно влияет экспрессия эритроитных и В-линейных антигенов на поверхности бластов.
Лечение
Лечение больных ОМЛ основано на принципе максимального уничтожения лейкозного клона клеток. Основным методом лечения заболевания является полихимиотерапия. В настоящее время существует несколько направлений в лечении ОМЛ, включающих в себя как применение новых цитостатиков, так и увеличение доз уже известных химиопрепаратов. Кроме этих уже достаточно изученных и ставших традиционными методов воздействия на лейкозный процесс существуют экспериментальные подходы с использованием естественных биологически активных препаратов, которые тем или иным способом влияют на процесс кроветворения (все ростковые факторы, интерлейкины). Наряду с цитостатическими агентами также пытаются применять лекарственные препараты, которые обладают мощным моделирующим воздействием на иммунную систему (циклоспорин, антилейкоцитарный иммуноглобулин). Использование ростковых факторов при ОМЛ в настоящее время дискутируется в связи с данными о том, что они могут способствовать пролиферации опухолевого клона клеток. В настоящее время некоторыми исследователями доказывается возможность применения колониестимулирующих факторов (граноцит и др.) у больных с ОМЛ.
В последние годы в программы лечения острого нелимфобластного лейкоза (ОНЛЛ) широко внедряется трансплантация костного мозга (ТКМ) — как аллогенная (при наличии HLA-совместимого донора), так и аутологичная трансплантация периферических стволовых клеток или костного мозга.
Современные программы лечения ОМЛ состоят из разных этапов — индукции, консолидации, интенсификации и поддерживающего лечения в период ремиссии (продолжающегося, как правило, не менее 2 лет). Одновременно проводится профилактика нейролейкоза с помощью эндолюмбального введения химиопрепаратов (цитозинарабинозид). В последние годы более широко стала использоваться профилактическая дистанционная гамма-терапия на область головного мозга.
При проведении индуктивного и консолидирующего курсов химиотерапии необходима максимальная интенсификация, что приводит к наиболее быстрому достижению полных ремиссий. Следствием такой терапии является аплазия костного мозга, во время которой резко возрастает вероятность возникновения инфекционных и геморрагических осложнений, в связи с чем больные нуждаются в комплексном сопроводительном лечении, включающем в себя заместительную, антибактериальную и дезинтоксикационную терапию.
Основными препаратами, входящими в используемые программы полихимиотерапии, являются сочетания цитозинарабинозида и антрациклиновых антибиотиков. До 80-х годов применялись схемы ДАТ и «7+3». С середины 80-х в программы лечения стал внедряться этопозид, что привело к более высокому числу полных ремиссий и увеличению безрецидивной выживаемости больных. Наиболее эффективными программами лечения, включающими этопозид, являются программы BFM-83 и BFM-87. Индукция ремиссии состоит из цитозинарабинозида, даунорубицина и этопозида, а консолидация — из винкристина, даунорубицина, цитозинарабинозида, 6-тиогуанина, преднизолона, циклофосфана с последующей поддерживающей терапией (цитозинарабинозид и 6-тиогуанин до 104 недель с момента наступления ремиссии). По данным исследования BFM-87, пятилетняя бессобытийная выживаемость составила 47%.
Одним из путей интенсификации химиотерапии и достижения более длительных ремиссий является увеличение доз цитозинарабинозида (до 3000 мг/м2 каждые 12 часов).
В последнее время появились работы о применении митоксантрона для лечения ОМЛ у детей, особенно у больных с плохим прогнозом (М5, М7, М6, М4 без эозинофилии и inv(16), М2 с лейкоцитозом более 50х109/л) и при рецидиве заболевания. Наиболее эффективной терапией оказалось сочетание высоких доз цитозара, митоксантрона, этопозида. Данная терапия приводит к выраженной миелодепрессии, без которой невозможно достичь полной ремиссии при ОМЛ, особенно у больных с неблагоприятным прогнозом и рецидивами заболевания. Применение митоксантрона (12 мг/м2) у больных с неблагоприятным прогнозом не привело к увеличению числа осложнений при достижении большего количества полных ремиссий у больных с резистентными к терапии формами ОНЛЛ.
Имеющиеся на сегодняшний день данные говорят о том, что, с одной стороны, интенсификация химиотерапии значительно повысила эффективность лечения, с другой — увеличилось число побочных реакций и осложнений, в некоторых случаях являющихся причиной гибели больных.
Направление лечения, связанное с использованием дифференцирующих агентов, таких как изомеры ретиноевой кислоты, достигло наибольшего результата при терапии острого промиелоцитарного лейкоза (М3). При хромосомной аберрации t(15;17), соответствующей М3 FAB, точка разрыва хромосомы 17 вовлекает ген, соответствующий ядерному рецептору альфаретиноевой кислоты, что дает возможность восстановления пораженного гена и способствует апоптозу опухолевых клеток при сокращении количества эпизодов геморрагических осложнений.
Опыт последних 20 лет показал, что совершенствование технологии сопроводительного лечения, главным образом методов контроля инфекций у больного с индуцированной гранулоцитопенией, и появление методик получения тромбоконцентрата позволили достичь 80% полных ремиссий, несмотря на значительное ужесточение режимов полихимиотерапии. Именно поэтому основными направлениями современных протоколов являются различные варианты интенсификации химиотерапии, которая может осуществляться с помощью ряда вариантов: введение в уже известные протоколы дополнительных цитостатических средств; использование новых цитостатических препаратов в качестве альтернативы изученным, например более активных антрациклинов второго поколения (идарубицина и митоксантрона); цикловая интенсивная химиотерапия на протяжении 1,5-2 лет после достижения ремиссии; модификация стандартных программ химиотерапии на основании кинетических параметров бластных клеток в ходе терапии и характерных особенностей восстановления кроветворения после цитостатического воздействия; применение ростковых факторов для ускорения выхода из постхимиотерапевтической аплазии; раннее применение аутологичной и аллогенной трансплантации костного мозга. Принцип ранней интенсификации в настоящее время является основным в терапии ОМЛ и, по данным многих исследований, имеет преимущество перед стандартным. Он позволяет уменьшить число больных с резистентными формами ОМЛ за счет увеличения мощности цитостатического воздействия на первых, ранних этапах терапии.
При анализе данных разных исследовательских групп становится очевидно, что примерно у половины больных, достигших ремиссии, ОМЛ рецидивируют. Причем 75% рецидивов выявляется в течение первого года от начала терапии, еще 15% — в течение второго года и 10% рецидивов регистрируются позже 2 лет от начала терапии. В связи с этим целью постремиссионной терапии является искоренение остаточного лейкозного клона. Постремиссионная терапия обычно классифицируется следующим образом: 1) терапия консолидации — постремиссионная терапия, сходная по интенсивности с индукцией, с использованием многократно повторяющихся препаратов с неперекрестной резистентностью; 2) терапия интенсификации: постремиссионная терапия, целью которой является преодоление лекарственной резистентности (обычно это препараты, ранее используемые в индукции); 3) поддерживающая терапия: значительно менее интенсивная постремиссионная терапия (в некоторых исследованиях до 3 лет).
В настоящее время доказано, что результаты лечения больных ОМЛ, получавших все этапы полихимиотерапии (индукцию ремиссии и постремиссионную терапию) в полном объеме, значительно выше.
В большинстве протоколов лечения ОМЛ наибольшее распространение получила поддерживающая рекомендуемая BFM- группой терапия, которая состоит из ежедневного приема 6-тиогуанина в дозе 40 мг/м2 в комбинации с подкожным введением цитозинарабинозида (40 мг/м2 х 4) каждые 4 недели. Проводится она сроком до 18 месяцев от начала лечения. Однако с повышением интенсивности постремиссионной терапии длительность поддерживающего лечения сокращается.
Профилактика нейролейкоза состоит из эндолюмбального введения цитозинарабинозида, метотрексата или комбинации этих препаратов с гидрокортизоном, с или без краниального облучения. Ряд авторов считают краниальное облучение больных ОМЛ необходимым компонентом терапии, другие придерживаются мнения, что краниальное облучение необходимо только для детей с первичным поражением нервной системы, а также для больных с вариантом М4, с хромосомными нарушениями inv (16). Предпочтение в проведении краниального облучения высказывают исследователи из группы BFM, которые показали снижение частоты не только нейролейкоза, но и костномозговых рецидивов при ее проведении.
Вопрос о роли аллогенной ТКМ (алло-ТКМ) у детей с ОМЛ в первой клинико-гематологической ремиссии в настоящее время активно дискутируется. Хотя алло-ТКМ является эффективным средством терапии ОМЛ, вопросы наличия донора и токсичности процесса ограничивают ее использование. Ключевым вопросом применения алло-ТКМ у детей с ОМЛ в первой ремиссии является выявление соотношения антилейкозного эффекта, увеличения уровня выживаемости больных с дальнейшим приемлемым качеством жизни.
В настоящее время кандидатами для алло-ТКМ являются пациенты высокой группы риска, имеющие HLA-идентичного донора костного мозга. Проблема аутологичной ТКМ (ауто-ТКМ) или периферических стволовых клеток (ПСК) в настоящее время изучается. В НИИ детской онкологии и гематологии РОНЦ им. Н.Н.Блохина РАМН разработаны протоколы лечения больных, использующие ауто-ТКМ и ПСК у больных ОМЛ с высокой группой риска в первой ремиссии и при рецидивах заболевания. Уже на сегодняшний день получены обнадеживающие результаты лечения.
В связи с тем что ОМЛ представлен группой неоднородных заболеваний, основным планом оптимизации лечения является индивидуализация терапии, дополненная предупреждением риска развития рецидивов, знаниями о биологии отдельных подвариантах ОМЛ.
Новыми препаратами, введенными в лечебные протоколы ОМЛ у детей в последнее десятилетие, являются 2-хлордеоксиаденозин (2-CDA) и флюдарабин. Применение в терапии новых агентов, включая иммунотерапию интерлейкином-2, лимфокинактивированными киллерами (LAK), генерированных из мононуклеарных клеток периферической крови, позволяет надеяться на значительные успехи в лечении ОМЛ в будущем.
В отделении химиотерапии лейкозов НИИ детской онкологии и гематологии, организованном 25 лет назад, проведено лечение 200 больным ОМЛ в возрасте от 1,5 месяца до 16 лет. За последние 10 лет благодаря применению новых подходов к лечению детей с ОМЛ с включением новых химиотерапевтических агентов и ТКМ удалось увеличить выживаемость больных до 50%, что в два раза превышает результаты терапии с использованием программы лечения «7+3» (цитозинарабинозид и рубомицин).
Благодаря внедрению в диагностику и программную терапию ОМЛ новых технологий удалось достичь значительного прогресса в результатах лечения рецидивов ОМЛ у детей.
Светлана МАЯКОВА, заведующая отделением химиотерапии лейкозов, доктор медицинских наук. Александр ПОПА, старший научный сотрудник отделения химиотерапии лейкозов, кандидат медицинских наук. НИИ детской онкологии и гематологии РОНЦ им.Н.Н.Блохина РАМН.
Первые признаки лейкемии у взрослых
Симптомы неспецифичны и имеют общие черты для многих заболеваний. Проявления зависят от массивности поражения и его локализации.
Первые признаки лейкемии у взрослых:
- беспричинная субфебрильная температура, обильное потоотделение в ночное время;
- слабость, повышенная утомляемость;
- увеличение лимфатических узлов;
- увеличение селезенки и печени;
- боль в суставах;
- постоянные головные боли;
- внешние проявления, связанные с нарушением свертываемости крови: кровоточивость десен, синяки, носовые кровотечения, наличие красных точек под кожей.