Фармакодинамика
Пимекролимус является производным макролактама аскомицина и обладает противоспалительным действием. Пимекролимус селективно ингибирует продукцию и высвобождение цитокинов и медиаторов воспаления из Т-лимфоцитов и тучных клеток.
Пимекролимус специфично связывается с цитозольным рецептором макрофилином-12 и ингибирует кальцийзависимую фосфатазу — кальциневрин. Ингибирование кальциневрина приводит к подавлению пролиферации Т-лимфоцитов и предотвращает транскрипцию и выработку в Т-хелперах типов 1 и 2 ранних цитокинов, таких как ИЛ-2, γ-интерферон, ИЛ-4, ИЛ-5, ИЛ-10, фактор некроза опухоли (ФНОα) и гранулоцитарно-макрофагальный колониестимулирующий фактор. Пимекролимус и такролимус в равной степени подавляют вторичный иммунный ответ в изолированных клеточных колониях Т-хелперов кожи, полученных у больных с атопическим дерматитом.
Кроме того, in vitro после взаимодействия с комплексом антиген/IgE пимекролимус предотвращает антиген/IgE-опосредованное высвобождение цитокинов и медиаторов воспаления из тучных клеток. Пимекролимус не влияет на рост кератиноцитов, фибробластов и эндотелиальных клеток и, в отличие от кортикостероидов, оказывает селективное действие на клетки иммунной системы и не вызывает нарушений функции, жизнеспособности, процессов дифференциации, созревания клеток Лангерганса мышей и дендритных клеток моноцитарного происхождения у человека. Препарат не оказывает влияния на дифференцировку «наивных» Т-лимфоцитов в Т-эффекторные клетки под действием клеток Лангерганса и дендритных клеток, являющуюся одним из основных механизмов специфического иммунного ответа.
На экспериментальных моделях кожного воспаления была продемонстрирована высокая противовоспалительная активность пимекролимуса после его местного и системного применения. При местном применении на экспериментальных моделях аллергического контактного дерматита (АКД) пимекролимус сопоставим по эффективности с высокоактивными кортикостероидами: клобетазолом-17-пропионатом и флутиказоном, ингибирует воспалительную реакцию в ответ на воздействие кожных раздражителей, не вызывая изменения консистенции и атрофии кожи.
Кроме того, при местном и пероральном применении пимекролимус на экспериментальных моделях АКД эффективно уменьшает кожное воспаление, зуд и выраженность гистопатологических изменений. При местном применении степень проникновения в кожу такролимуса и пимекролимуса одинаково хорошая. Однако способность пимекролимуса проникать через кожу меньше, чем у такролимуса и ГКС. Таким образом, пимекролимус обладает селективным действием на кожу.
Уникальность механизма действия пимекролимуса состоит в сочетании селективного противовоспалительного действия на кожу с незначительным влиянием на системный иммунный ответ.
При применении в течение 6 нед у детей в возрасте от 3 мес до 17 лет пимекролимус эффективно уменьшает зуд и кожное воспаление (эритему, инфильтрацию, экскориацию и лихенизацию). При длительном применении в течение 12 мес пимекролимус эффективно снижает частоту возникновения внезапных обострений АКД, не вызывая атрофии, раздражения и повышения чувствительности кожи, не обладая фототоксическим или фотосенсибилизирующим действием.
Опыт применения крема Элидел в терапии атопического дерматита у детей и взрослых
А
топический дерматит (АД) остается важной медико–социальной проблемой, значимость которой определяется неуклонным ростом заболеваемости дерматозом, его хроническим, рецидивирующим течением и сложностью в проведении терапии. По данным отечественных и зарубежных дерматологов,
заболеваемость АД среди взрослого населения составляет до 1,5–2,0% от общей популяции
, варьируя в различных странах в зависимости от уровня урбанизации и состояния экологической чистоты жизненного пространства (Торопова Н.П. и соавт., 1997; Кунгуров Н.В. и соавт., 2000; Schultz–Larsen F., Hanifin J.M., 2002).
Клинически АД характеризуется интенсивным зудом, возникновением воспаления, инфильтрации, лихенификации в типичных местах локализации кожного процесса, а также общей повышенной сухостью кожного покрова.
Первые симптомы дерматоза, как правило, возникают в младенческом и раннем детском возрасте, рецидивы чаще связаны с нарушением пищевого режима, стрессами, обострениями соматических заболеваний. Более чем у трети пациентов процесс с периодическими обострениями сохраняется и во взрослом состоянии, что приводит к значимому снижению качества жизни пациентов (Emerson R.M. et al., 1998; Lewis–Jones M.S. et al., 2002).
Ключевая роль в формировании АД принадлежит наследственной предрасположенности, которая реализуется дисфункцией иммунной системы: гиперпродукцией IgE, нарушением цитокиновой регуляции и соотношения Th1/|Th2 лимфоцитов, детерминированным дефицитом Т–лимфоцитов супрессоров, нарушением процессов апоптоза. В патогенезе заболевания существенное значение имеют дисбаланс внутриклеточных регуляторных механизмов (соотношение цАМФ/цГМФ), нарушение мембранной рецепции, активация неиммунных механизмов высвобождения медиаторов аллергии, нарушение нейровегетативной и периферической циркуляции с сосудистой нестабильностью и нарушением рецепции эндотелия); психофизиологические и психосоматические отклонения (Скрипкин Ю.К. и соавт., 1997, Hanifin J.M., Rajka G., 1980, Bos J.D., Sillevis J H., 1996).
Лечение больных атопическим дерматитом
Лечение больных АД представляет сложную проблему для специалиста ввиду особенностей патогенеза заболевания, многообразия фенотипических проявлений и стадийного течения процесса и, по общему мнению исследователей, должно носить этиопатогенетический характер (Балаболкин И.И., Гребенюк В.Н., 1999; Сергеев Ю.В. и соавт., 2001; Феденко Е.С., 2001; Смолкин Ю.С., Чебуркин А.А., 2002).
Наружная терапия АД
входит в базовый стандарт лечения заболевания и является неотъемлемой частью терапевтического комплекса. Практика последних лет свидетельствует о преобладающей тенденции использования в терапии АД у взрослых и детей широкого спектра наружных средств, содержащих в качестве действующего вещества различные глюкокортикостероидные гормоны (ГКСГ). В настоящее время в распоряжении врачей дерматологов имеется значительное количество средств местного лечения с ГКСГ, обладающих универсальным противоаллергическим действием: снижающим высвобождение медиаторов аллергического воспаления, миграцию клеток в зону поражения, пролиферацию иммунокомпетентных клеток в очаге поражения. Современные наружные средства с ГКСГ умеренного и сильного действия, не содержащие в своем составе атомов фтора, зарекомендовали себя в клинической практике, как эффективные и достаточно безопасные. Тактика и технологии терапии с применением различных лекарственных форм метилпреднизолона ацепоната, мометазона фуроата, алклометазона описаны в значительном числе публикаций (Емельянов А.В., Монахов К.Н., 2002; Смирнова Г.И., 2003; Tofte S.J., Hanifin J.M., 2001).
В то же время в практическом плане сохраняется опасность формирования местных нежелательных явлений и осложнений при длительном и бесконтрольном использовании препаратов ГКСГ. И эта опасность значительно возрастает при использовании у детей, а также при длительных аппликациях ГКСГ препаратов на кожу с высокой чувствительностью – лицо, шея, складки кожи.
Современный концептуальный подход
к стратегии и тактике лечения АД был представлен в материалах II Международной согласительной конференции по атопическому дерматиту (International Consensus Conference on Atopic Dermatitis II, 2003), проходившей в США в феврале 2002 года. В Согласительном заявлении, принятом по итогам конференции, были определены
основные цели проведения терапии больных с АД:
– снижение активности проявлений и симптомов АД;
– предупреждение или минимизация обострений;
– обеспечение долгосрочного контроля над заболеванием и меры по предупреждению обострений;
– облегчение течения заболевания.
Для проведения местного лечения больных с АД были представлены основные типы топической терапии заболевания: увлажняющие средства, наружные кортикостероиды, нестероидные препараты, дополнительная терапия. Новым стратегическим классом средств топического воздействия были названы препараты, содержащие ингибиторы кальциневрина и отвечающие указанным потребностям в терапии АД (Ellis C, Luger T., 2003).
Одним из таких препаратов, с недавнего времени доступным в отечественной клинической практике, является пимекролимус крем 1% (Элидел®).
Элидел (Э)
– это нестероидный, клеточно–селективный ингибитор воспалительных цитокинов, специально разработанный для терапии АД и других воспалительных заболеваний кожи.
1 г крема Элидел содержит 10 мг пимекролимуса, а также вспомогательные вещества: триглицериды, олеиловый спирт, пропиленгликоль, стеариловый спирт, цетиловый спирт, моно– и диглицериды, цетостеарил сульфат натрия, бензиловый спирт, лимонная кислота, гидроксид натрия, очищенная вода.
Пимекролимус относится к производным макролактама аскомицина. Механизм действия и фармакологические свойства
пимекролимуса были изучены
in vitro
и
in vivo
. Исследования установили, что молекула пимекролимуса высокоаффинно связывается со своим рецептором, находящимся в цитозоле Т–лимфоцита – макрофилином–1. Комплекс пимекролимус–макрофилин ингибирует кальциневрин, который представляет собой кальций–зависимую фосфатазу (Grassberger M. et al., 1999). Вследствие этого ингибирования угнетается транскрипция матричной РНК, соответствующих генов воспалительных цитокинов, синтез и последующее высвобождение из Т–лимфоцитов этих активаторов аллергического воспаления (IL–2, IL–4, IL–10 и INF–g), уменьшается выраженность пролиферации Т–лимфоцитов дермального инфильтрата кожи, которая стимулируется этими воспалительными цитокинами (Winiski A et al, 2002).
Пимекролимус также ингибирует синтез TNF–a и высвобождение медиаторов воспаления, таких как гистамин, из тучных клеток (Hultsch T et al., 1998; Zuberbier T. et al., 2001). Экспериментальные исследования на животных и клиническое изучение влияния пимекролимуса у здоровых добровольцев с использованием морфометрии, локального ультразвукового исследования установили, что препарат не оказывает патологического эффекта на кератиноциты, фибробласты, эндотелиальные клетки или клетки Лангерганса, не вызывает атрофии кожи (Meingassner J.G. et al., 1997; Zuberbier T. et al., 2001). Было установлено высокоэффективное подавление пимекролимусом воспаления кожи и слабое системное иммуносупрессивное действие у животных моделей (Meingassner J.G. et al, 1997; Stuetz A. et al., 2001; Queille–Roussel C. et al., 2001; Billich A. et al., 2002).
Клинические исследования Э в терапии больных АД продемонстрировали быстрое начало действия препарата, при котором интенсивность зуда уменьшалась уже после 2–3 дня применения крема Э, а все симптомы АД регрессировали у большинства больных в течение курса терапии (Eichenfield L. et al., 2002). Благоприятный эффект лечения пимекролимусом наблюдался на протяжении всего исследования (в сроки до 43 дней) у младенцев 3–23 месяцев и у детей 2–17 лет, причем особенно эффективен Э был при локализации процесса на лице и шее, а при последующем клиническом наблюдении отсутствие выраженных симптомов АД сохранялось в сроки до 6 месяцев (Eichenfield L et al., 2002; Ho V et al., 2003). Последующие клинические исследования подтвердили эффективность использования Э в терапии АД у детей и взрослых, установили, что долгосрочное (до 6 месяцев) применение Э способствует контролю над заболеванием и предотвращает развитие выраженных обострений АД, в то же время не приводит к развитию значимых побочных явлений, таких как пиогенная или вирусная суперинфекция (Kapp A. et al., 2002; Wahn U. et al., 2002; Meurer M. et al., 2002).
Появление на российском фармацевтическом рынке нового наружного средства для лечения АД и указанные положения определили актуальность накопления и анализа собственного клинического опыта по использованию крема Элидел (1% пимекролимус).
Целью
открытого несравнительного клинического исследования, проведенного в Уральском НИИ дерматовенерологии и иммунопатологии МЗ РФ, а также на базе КВУ г. Тюмени, Магнитогорска и Самары, было изучение эффективности применения препарата Элидел (крем) в лечении больных АД детей, подростков и взрослых.
Всего в исследование было включено 49 больных АД:
– детей в возрасте от 6 месяцев до 15 лет – 16;
– подростков в возрасте от 16 до 18 лет – 9 пациентов;
– взрослых в возрасте от 19 до 30 лет и от 31 года до 50 лет – 24.
Системная терапия АД определялась в соответствии с тяжестью течения дерматоза и включала применение энтеральных сорбентов, антигистаминных и седативных препаратов, симптоматического лечения. В период проведения исследования исключалось введение системных и применение топических глюкокортикостероидных препаратов. У пациентов всех групп в качестве топической монотерапии использовали крем Элидел с 2–х кратным в сутки нанесением препарата на кожу в области клинических проявлений АД. Длительность основного курса составляла 2–4 недели.
Методы мониторинга и контроля
включали клиническое наблюдение за пациентами с фиксацией и описанием исходного состояния кожи (до начала лечения), выраженности субъективных симптомов, динамики изменения данных параметров под влиянием терапии после 7, 14 и 28 дня лечения. Результаты наблюдения фиксировались в стандартизованной карте наблюдения, содержавшей в том числе комплексную оценку тяжести течения АД по индексу SCORAD в динамике терапии. Индекс SCORAD определяли по формуле:
S=A/5+7B/2+C
.
Результаты исследования:
Всего лечение было проведено 49 больным АД, из числа которых мужчин – 21, женщин – 28. У большинства больных заболевание дебютировало в первые годы жизни, имело рецидивирующий характер с сезонными обострениями. В таблице 1 представлена клиническая характеристика больных АД, включенных в исследование (составляющие индекса SCORAD и его значение), до начала лечения кремом Элидел.
Из данных таблицы 1 видно, что в исследование были включены больные со значительной тяжестью течения АД, в стадии обострения кожного процесса, о чем свидетельствовали высокие показатели индекса SCORAD и его составляющих. Особенно выраженным процесс был в группах детей раннего возраста (6 месяцев – 3 года) и подростков, где средние показатели SCORAD составил 65,3±6,9 и 61,1±7,1 единиц соответственно, как за счет распространенности кожных проявлений, так и по выраженности объективных и субъективных симптомов.
Всем больным в режиме специализированного стационара (18 больных) или амбулаторно (31 больной) было проведено лечение. Клиническое улучшение после окончания терапии было зафиксировано у 47 из 49 пролеченных больных с АД (95,9%), причем у 26 (53,0%) достигнута клиническая ремиссия процесса, у 42,9% больных – значительное клиническое улучшение. Клинические наблюдения свидетельствовали в целом о равномерном регрессе проявлений АД в местах типичной локализации: лицо, шея, конечности, где проводилось лечение кремом Элидел. Однако нами было отмечено, что гиперемия, отечность, воспалительная инфильтрация кожи в области лица разрешались все же несколько более активно, зуд исчезал в этих локализациях раньше, чем в других локализациях (конечности, туловище). Серия фотографий иллюстрирует регресс проявлений АД после 2–х недель применения крема Элидел.
Фото 1,2. Б-я А., 5 лет, до и после лечения с 2-х недельным применением крема Элидел
Фото 3,4. Б-я Н., 4 лет, до и после лечения с 2-х недельным применением крема Элидел
Исследование закончили все 49 больных. Только у 2 больных (4,1%) в процессе терапии выраженной положительной динамики не было.
В таблице 2 приведены среднегрупповые данные изменения составляющих индекса SCORAD в динамике терапии у пациентов различного возраста.
Фактические данные, приведенные в таблице 2, демонстрируют однонаправленное снижение в процессе терапии всех проявлений АД в группах пациентов различного возраста. Благоприятная динамика регресса проявлений АД в процессе терапии и после ее окончания, снижение выраженности объективных симптомов (отек, гиперемия, наличие папулезных высыпаний, корок), а также уменьшение интенсивности зуда и нарушений сна отражались и в значительном снижении показателя интегративного индекса SCORAD. Для проведения анализа данных было предпринято исчисление соотношения (или коэффициента – К) каждой из составляющих индекса SCORAD и общей его величины, полученной до начала лечения, к аналогичному показателю после 1 недели терапии и после окончания терапии (1/2; 2/3; 1/3).
Распространенность (площадь) высыпаний
пропорционально уменьшалась в процессе проведения (1 и 2 неделя) терапии во всех возрастных группах, а коэффициенты снижения составляли 1,1–1,5 после первой недели; 1,2–2,2 после второй недели лечения. Коэффициент регресса площади распространения высыпаний был максимальным в группе больных детей до 3–х лет (3,1) и у подростков 16–18 лет (2,4). В группах пациентов более старшего возраста (19–50 лет) уменьшение площади пораженной кожи составило 1,4–1,5 раза.
Интенсивность объективных симптомов АД
(В) у детей в возрасте 6 месяцев – 3 года, подростков и лиц старшей возрастной группы более значимо снижалась после 2–й недели лечения. После окончания лечения максимальный регресс симптомов заболевания фиксировался у детей до 3–х лет (5,6) и у подростков (3,9). Хорошие результаты были получены также у группы больных в возрасте 31–50 лет (3,2).
Изучение динамики регресса зуда
и нарушения сна показало, что уже после 1 недели лечения выраженность указанных субъективных симптомов значительно уменьшалась (в 2,3–2,6 раза), а на 2 неделе снижение интенсивности зуда также продолжалось (2,0–1,3). Итоговое соотношение показателя С к сроку окончания терапии составило 4,4–2,3 раза, что подтверждало клинический эффект проведенного курса лечения. Интересным оказался факт значительного снижения интенсивности зуда и нарушений сна у больных в возрасте 31–50 лет (4,4), где этот показатель был максимальным среди всех исследованных возрастных групп.
Анализ данных изменения интегративного индекса SCORAD
показал его снижение, сравнимое в 1 и 2 неделю проведения лечения. Наибольший клинический эффект был достигнут у детей до 3–х лет (уменьшение показателя S в 4,8 раза), в группе подростков (в 3,3 раза).
Переносимость крема Элидел
была оценена, как «хорошая» у 31 из 49 больных (63,3%); как «удовлетворительная» – у 16 больных (32,6%). Применение крема Элидел вызвало значительное усиление зуда, гиперемию кожи у 2 больных (4,1%). За время применения крема Элидел и в течение 4 недель последующего наблюдения пиогенных, вирусных, грибковых инфекций не возникало, нежелательных явлений, осложнений зафиксировано не было.
Таким образом, проведенные клинические исследования терапии больных АД различных возрастных групп с применением нового топического препарата крема Элидел продемонстрировали эффективность у 95,9% пациентов. Действие препарата отмечалось уже в первую неделю применения, когда площадь поражения кожи, выраженность симптомов АД уменьшались в 1,4–1,8 раза, а интенсивность зуда и нарушений сна практически в 2 раза. Проведение 2–х недельного курса лечения способствовало достижению клинической ремиссии у 53% больных и значительному улучшению процесса у 42,9% пациентов, при снижении показателя SCORAD по сравнению с таковым до лечения в 4,8–3,3 раза. Крем Элидел был особенно клинически эффективен в терапии больных АД детей до 3–х лет и подростков, что подтверждалось значительным снижением индекса SCORAD и его составляющих. У взрослых пациентов было отмечено значительное уменьшение интенсивности зуда после окончания терапии.
За время исследования отсутствовали нежелательные явления и осложнения, переносимость крема Элидел была хорошей у большинства пациентов.
Клинические исследования показали, что крем Элидел эффективен в терапии больных АД детей, подростков, взрослых и его использование в широкой клинической практике дерматологами позволяет оптимизировать лечение больных АД.
Литература:
1. Балаболкин И.И., Гребенюк В.Н. Атопический дерматит у детей, – М.: Медицина, 1999. –238 с.
2. Емельянов А.В., Монахов К.Н. Топические кортикостероиды в терапии аллергодерматозов: значение внегеномного эффекта // Вестник дерматологии и венерологии. –2002. –№3. –С.59–61.
3. Кунгуров Н.В., Герасимова Н.М., Кохан М.М. Атопический дерматит (типы течения, принципы терапии) ,– Екатеринбург: изда–во Урал. ун–та, 2000.–266 с.
4. Сергеев Ю.В., Иванов О.Л., Новиков Д.К. Атопический дерматит: современная диагностика и лечение // Иммунопатология, аллергология, инфектология. –2001. –№4. –С. 28–48
5. Скрипкин Ю.К., Самсонов В.А., Селисский Г.Д., Гомберг М.А. Современные проблемы дерматовенерологии // Вестник дерматологии и венерологии. –1997. –N6. –С.4–8.
6. Смирнова Г.И. Современные технологии местного лечения атопического дерматита у детей // Иммунопатология, аллергология, инфектология. –2003. –№3. –С. 75–82.
7. Смолкин Ю.С., Чебуркин А.А. Атопический дерматит у детей: принципы диагностики и рациональной терапии // Лечащий врач. –2002. – №9.
8. Торопова Н.П., Синявская О.А., Градинаров А.М. Тяжелые (инвалидизирующие) формы атопического дерматита у детей. Методы медико–социальной реабилитации // Русск. мед. журнал. –1997. –Том 5. –№11. –С. 713–720
9. Феденко Е. С. Атопический дерматит: обоснование поэтапного подхода к терапии // Consilium medicum. –2001. –№3 (4). –С. 176–184.
10. Billich A. et al. Pimecrolimus permeates less through skin than corticosteroids and tacrolimus // J. Invest. Dermatol. – 2002. –Vol.119. –P.346
11. Bos J.D., Sillevis J. H. Atopic dermatitis // JEADV. – 1996. – Vol.7.– P.101–114.
12. Ellis C., Luger T. International Consensus Conference on Atopic Dermatitis II (ICCAD II) Clinical update and current treatment strategies // Br. J. Dermatol. –2003. –Vol.148. –P.3(10.
13. Emerson R.M., Williams H.C., Allen B.R. Severity distribution of atopic dermatitis in the community and its relationship to secondary referral // Br. J. Dermatol. –1998. –Vol. 139(1). –P.73–76.
14. Grassberger M. et al. A novel anti–inflammatory drug, SDZ ASM 981, for the treatment of skin diseases: in vitro pharmacology // Br. J. Dermatol. – 1999. –Vol.141. –P. 264–273.
15. Hanifin J.M., Rajka G. Diagnostic features of atopic dermatitis // Acta Dermatol. Venereol., 1980.– Vol.92. –P.44.
16. Hultsch T. et al. Ascomycin macrolactam derivative SDZ ASM 981 inhibits the release of granule–associated mediators and of newly synthesized cytokines in RBL 2H3 mast cells in an immunophilin–dependent manner // Arch. Dermatol. Res. – 1998. –Vol.290. –P.501–507.
17. Kapp A. et al. Long–term management of atopic dermatitis in infants with topical pimecrolimus, a nonsteroid anti–inflammatory drug // J. Allergy Clin. Immunol. – 2002. –Vol.110. –P.277–284.
18. Lewis–Jones M.S., Finlay A.Y., Dykes P.J. The Infants’ Dermatitis Quality of Life Index // Br. J. Dermatol. – 2001. –Vol. 144. –P. 104–110.
19. Meingassner J.G. et al. A novel anti–inflammatory drug, SDZ ASM 981, for the topical and oral treatment of skin diseases: in vivo pharmacology // Br. J. Dermatol. – 1997. –Vol.137. –P.568–576.
20. Meurer M. et al. Pimecrolimus cream in the long–term management of atopic dermatitis in adults: A six–month study // Dermatology. – 2002. –Vol. 205. –P.271–277.
21. Queille–Roussel C. et al. The new topical ascomycin derivative SDZ ASM 981 does not induce skin atrophy when applied to normal skin for four weeks: a randomized, double–blind controlled study // Br. J. Dermatol. – 2001. –Vol.144. –P.507–513.
22. Schultz–Larsen F, Hanifin JM. Epidemiology of atopic dermatitis // Immunol. Allergy Clin. North Am. –2002. –Vol.22. –P.1–24.
23. Stuetz A et al. Pimecrolimus does not affect Langerhans’ cells in murine epidermis, in contract to corticosteroids // J. Invest. Dermatol. – 2002. –Vol.119. P. 347
24. Tofte S.J., Hanifin J..M. Current management and therapy of atopic dermatitis // J. American Acad. Dermatol. –2001. –Vol. 44 (1). –Р. 13–16.
25. Wahn U et al. Efficacy and safety of pimecrolimus cream in the long–term management of atopic dermatitis in children // Pediatrics.– 2002. –Vol.110. –P.158–159.
26. Winiski A et al. Inhibitory activity of pimecrolimus and tacrolimus on induced cytokine mRNA and protein expression in a human T cell line (Jurkat) measured via RT PCR and ELISA // J. Invest. Dermatol. – 2002. –Vol.119. –P. 347
27. Zuberbier T et al. The ascomycin macrolactam pimecrolimus (Elidel(r), SDZ ASM 981) is a potent inhibitor of mediator release from human dermal mast cells and peripheral blood basophils // J. Allergy Clin. Immunol. – 2001. –Vol.108. –P.275–280.
Фармакокинетика
Взрослые. Концентрацию пимекролимуса в крови определяли у 12 взрослых пациентов с атопическим дерматитом (экземой) при поражении 15–59% площади поверхности тела, получавших лечение кремом Элидел 2 раза в сутки на протяжении 3 нед. В 77,5% наблюдений концентрация пимекролимуса в крови была ниже 0,5 нг/мл (минимальная определяемая концентрация), а в 99,8% — ниже 1 нг/мл. Cmax пимекролимуса в крови, зарегистрированная у 1 пациента, составила 1,4 нг/мл.
У 98% из 40 взрослых больных с исходным поражением 14–62% площади поверхности тела после 1 года лечения кремом Элидел концентрации пимекролимуса в крови оставались на низком уровне и в большинстве случаев были ниже минимальной определяемой концентрации.
Значение Cmax, составившее 0,8 нг/мл, было зарегистрировано после 6 нед лечения только у 2 пациентов. Ни у одного из пациентов не было отмечено нарастания концентрации на протяжении 12 мес лечения. За 3-недельный период лечения кремом Элидел 2 раза в сутки у 13 взрослых пациентов с дерматитом кистей (с применением крема на область ладоней и тыльную сторону кистей и бинтованием на ночь) максимальное зарегистрированное значение концентрации пимекролимуса в крови составило 0,91 нг/мл.
У 8 пациентов с содержанием пимекролимуса в крови выше минимальной определяемой концентрации значение AUC составляло 2,5–11,4 нг/мл.
Дети. Фармакокинетические исследования пимекролимуса были проведены у 58 детей в возрасте от 3 мес до 14 лет с атопическим дерматитом (экземой) при поражении 10–92% площади поверхности тела, получавших лечение кремом Элидел 2 раза в сутки на протяжении 3 нед. Пятеро детей получали лечение в течение 1 года по мере необходимости.
Концентрации пимекролимуса в крови были на стабильно низком уровне, независимо от площади поражения кожных покровов и длительности терапии и находились в том же диапазоне значений, что и у взрослых пациентов, получавших терапию кремом Элидел в тех же дозах. В 97% случаев концентрации пимекролимуса в крови были ниже 2 нг/мл, а в 60% — ниже 0,5 нг/мл (минимальная определяемая концентрация). Cmax пимекролимуса, зарегистрированная у 2 пациентов в возрасте 8 мес и 14 лет, составила 2 нг/мл.
Среди детей самого младшего возраста (от 3 до 23 мес) Cmax пимекролимуса составила 2,6 нг/мл и была зарегистрирована у 1 пациента.
У 5 детей, получавших лечение кремом Элидел в течение 1 года, концентрации пимекролимуса находились на стабильно низком уровне. Максимальное значение, зарегистрированное у 1 ребенка, составило 1,94 нг/мл. На протяжении всего периода лечения рост концентраций препарата не наблюдался ни у одного из пациентов.
У 8 детей в возрасте от 2 до 14 лет с содержанием пимекролимуса в крови выше минимальной определяемой концентрации при трехкратном измерении значение AUC составляло от 5,4–18,8 нг/мл. Значения AUC у пациентов с площадью поражения кожных покровов менее или более 40% были сопоставимы.
В исследованиях in vitro связывание пимекролимуса с белками плазмы (в основном с различными липопротеинами) составило 99,6%.
Поскольку при местном применении концентрации пимекролимуса в крови очень низкие, определение параметров метаболизма не представляется возможным.
Фармакокинетика в особых клинических случаях
Атопический дерматит (экзема) редко наблюдается у больных в возрасте 65 лет и старше. Количество пациентов такого возраста в клинических исследованиях 15% крема Элидел было недостаточным, чтобы выявить какие-либо различия в эффективности лечения по сравнению с молодыми пациентами.
Рекомендации по дозированию для младенцев (3–23 мес), детей (2–11 лет) и подростков (12–17 лет) не отличаются от рекомендаций для взрослых пациентов.
Элидел и кортикостероиды: союзники или соперники?
Н
аружные кортикостероиды (КС) являются основой лечения атопического дерматита (АД), так как обладают противовоспалительными, иммуносупрессивными и антипролиферативными свойствами. Эти препараты действуют быстро и эффективно, что удовлетворяет и врача и больного. Вместе с тем стероиды обладают целым рядом серьезных побочных эффектов. Особенно опасны системные осложнения, развивающиеся, как правило, вследствие всасывания препаратов у очагов поражения большой площади при длительном применении. Группой риска №1 в этом отношении являются дети до 2 лет, у которых проницаемость кожи гораздо выше, чем у взрослых [1]. К наиболее грозным системным осложнениям относят угнетение гипоталамо–гипофизарно–адреналовой системы и связанные с этим задержку роста, синдром Кушинга, гипертензию, диабет [2–6]. Длительное использование местных стероидов сопряжено с риском иммуносупрессии, что проявляется бактериальной, вирусной и грибковой инфекцией. Преимущественно эти эффекты характерны для ранних поколений КС, особенно фторированных КС. В последние десятилетия созданы препараты, всасываемость которых при наружном применении не превышает 1%, однако и они обладают целым рядом недостатков. Среди местных осложнений преобладает атрофия кожи, стрии, телеангоэктазии, нарушения пигментации, акнеиформные высыпания [7]. К важным недостаткам наружных КС относится и тахифилаксия – привыкание и утрата эффективности.
Все эти побочные эффекты и осложнения привели тому, что 73% больных АД страдают так называемой «стероидной фобией» – беспокойством разной степени, вплоть до полного отказа от применения КС [8]. По этой причине 24% взрослых пациентов и 36% родителей больных детей признаются в нарушении режима наружной терапии. «Стероидной фобией» страдают не только пациенты, но и сами врачи, поэтому зачастую лечение этими препаратами начинают применять с опозданием, длительность терапии недостаточна, а дозы, особенно у детей, слишком малы. Все это приводит к неполноценному купированию обострения, раннему рецидиву и формированию тахифилаксии.
В этой связи возникает вопрос: как сократить срок использования КС при обострении АД и вместе с тем продлить ремиссию заболевания?
Для решения этой проблемы в настоящее время используется селективный ингибитор синтеза и высвобождения провоспалительных цитокинов – пимекролимус (SDZ ASM 981). Установлено, что это вещество In vitro
избирательно связывается с макрофилином–12, и ингибирует кальциневрин и тем самым – синтез воспалительных цитокинов в Т–клетках (ИЛ–2, INF–g), а также высвобождение медиаторов воспаления (например, гистамина) из тучных клеток [9–12]. В то же время пимекролимус не влияет на кератиноциты, фибробласты, эндотелиальные клетки и клетки Лангерганса. In vivo препарат обладает высокой противовоспалительной и незначительной иммуносупрессивной активностью [9–12], не вызывает атрофии [13]. Пимекролимус обладает высоким сродством к коже, поэтому хорошо пенетрирует внутрь нее и практически не проникает через кожу [11].
Клиническими испытаниями установлена безопасность и эффективность 1% крема пимекролимуса – Элидела® (фирма Novartis, Швейцария) при его кратковременном и длительном применении у детей и взрослых, больных АД.
Для того, чтобы попытаться сократить с помощью Элидела частоту и длительность рецидивов и зависимость пациентов от наружных КС при АД у взрослых было проведено многоцентровое рандомизированное контролируемое исследование двойным слепым методом длительностью 24 недели [14].
Наблюдали 192 больных АД в возрасте от 18 лет и старше. Диагноз установлен в соответствии с критериями Hanifin [15] и Rajka [16]. Площадь поражения до начала лечения составляла не менее 5%, в среднем – 17% в обеих группах. В каждой группе преобладали больные АД средней тяжести (по шкале IGA – 3 балла).
По результатам рандомизации 96 пациентов были включены в основную, 96 – в контрольную группу. Статистически значимых демографических и клинических различий между группами не было (табл. 1).
Пациенты основной группы получали наружное лечение кремом Элидел 2 раза в сутки, контрольной – только основу крема. В первую неделю исследования такая схема лечения была обязательной. В дальнейшем в случае развития обострения назначались наружные КС (предникарбат 0,25% крем) два раза в сутки в течение 7 дней и один раз в сутки – в течение следующей недели. После терапии КС лечение исследуемым препаратом проводилось еще в течение 1 недели для купирования остаточных явлений обострения (табл. 2). Основным критерием эффективности было количество дней (%), в течение которых КС применялись для неотложной терапии обострения. Дополнительную оценку эффективности проводили по следующим параметрам: количество обострений, результаты IGA, EASI, интенсивность зуда. Последний параметр оценивали сами пациенты, используя следующую шкалу в баллах: 0 – отсутствие зуда, 1 – незначительный зуд, 2 – умеренный зуд, 3– сильный зуд, 4 – очень сильный зуд. Переносимость оценивали по клиническим и лабораторным данным.
Обследование пациентов проводили во время первичного осмотра, а затем на 1, 3, 6, 12 и 24–й неделях лечения. Кроме этого, осуществляли дополнительный телефонный контакт на 9 и 18–й неделях. В случае сильного обострения проводили незапланированные осмотры.
Результаты
В основной группе пациентов, получавших лечение кремом Элидел, зарегистрировано статистически достоверное (по сравнению с контрольной группой) уменьшение количества дней, в течение которых пациенты вынуждены были применять КС (рис. 1).
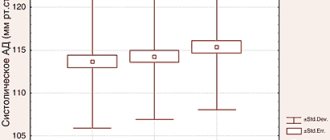
Рис. 1. Количество дней, в течение которых пациенты использовали кортикостероиды (%)
В основной группе пациенты использовали КС в среднем в течение 14,2%±24,2% из 168 дней (общая продолжительность исследования), а в контрольной – в 37,2%±34,6% (р<0,001). При этом половина больных, получавших Элидел, не нуждалась в применении КС в течение всех 24 недель (рис. 2).
Рис. 2. Количество дней, когда пациентам требовалось лечение местными кортикостероидами (%)
Частота обострений и время до наступления первого обострения также значимо различались между двумя группами пациентов. В основной группе в среднем зарегистрирован 1,1±1,4 случай обострения, в контрольной – 2,4±2,3 (р<0,001). Почти у половины (44,8%) больных, леченных Элиделом, констатировано отсутствие обострений в течение полугода. У лиц, получавших традиционную терапию, этот показатель составил 18,8% (рис. 3,4).
Рис. 3 Частота обострений (%)
Рис. 4. Время до первого обострения
При оценке по шкале IGA у 82.3% пациентов основной группы отмечено улучшение по крайней мере на один балл против 51,0% – в контрольной, а показатель EASI снизился в среднем на 48.3% против 15,9% (соответственно) (р<0,001). Среди больных, леченных Элиделом, вдвое меньше лиц прекратили лечение в связи с его неэффективностью по сравнению с традиционной терапией (15,3% и 27,1% соответственно).
Динамика зуда представлена на рисунке 5. Обращает на себя внимание уменьшение зуда в течение первых трех дней терапии в основной группе и временное усиление – в контрольной.
Рис. 5. Динамика зуда в течение первой недели лечения
Крем Элидел хорошо переносился больными, патологии традиционных лабораторных анализов на протяжении всего исследования ни у кого из пациентов не выявлено.
Таким образом, наружное лечение больных АД кремом Элидел позволяет:
- сократить применение местных КС или совсем отказаться от них,
- снизить количество обострений,
- увеличить длительность периода без обострений АД,
- оставить КС в качестве резерва для кратких курсов терапии обострения АД и свести к минимуму риск осложнений от длительной стероидной терапии,
- улучшить контроль заболевания в целом, общее самочувствие пациентов, а, следовательно, качество жизни больных.
Литература:
1. Giusti F, Martella A, Bertoti L, Seidenari S. Skin Barrier, Hydration, and pH of the Skin of infants under 2 years of age. Ped Derm 2001; 18: 93–6.
2. Keipert JA, Kelly R. Temporary Cushing’s syndrome from percutaneous absorption of betamethasone–17–valerate. Med J Austr 1971; 1: 542–4.
3. Pascher F. Systemic reactions to topically applied drugs. Int Dermatol 1978; 17: 768–75.
4. Bode HH. Dwarfish following long long–term topical corticosteroid therapy. J M Med Assoc 1980; 244: 813–14.
5. Bartorelli A, Rimondini A. Severe hypertension in childhood due to prolonged skin application of mineralocorticoid ointment. Hypertension 1984; 6: 586–8.
6. Walsh P, Aeling JL, Huff L, Weston WL. Hypothalamus–pituitary–adrenal axis suppression by superprotent steroids. J Am Acad Dermatol 1999; 29: 501–3.
7. Fisher DA. Adverse effects of topical corticosteroid use. West J Med 1995; 162: 123–6.
8. Charman C, Morris A, Willians H. Topical corticosteroid phobia in patients with atopic dermatitis. Br J Dermatol 2000;142: 931–6.
9. Meingassner JG, Grassberger M, Fahrngruber H et al. A novel anti–inflammatory drug, SDZ ASM 981, for the topical and oral treatment of skin diseases: in vivo pharmacology. Br J Dermatol 1997; 137: 568–76.
10. Grassberger M, Baumruker T, Enz A et al. A novel anti–inflammatory drug, SDZ ASM 981, for the treatment of skin diseases: in vitro pharmacology. Br J Dermatol. 1999 Aug;141(2):264–73
11. Stuetz A, Grassberger M, Meingassner JG. Pimecrolimus (Elidel(, SDZ ASM 981) – Preclinical pharmacological profile and skin selectivity. Seminars Cutan Med Surg 2001; 20(4):233–41.
12. Zuberbier T, Chong SU, Grunow K et al. The ascomycin macrolactam pimecrolimus (Elidel, SDZ ASM 981) is a potent inhibitor of mediator release from human dermal mast cells and peripheral blood basophils. J Allergy Clin Immunol. 2001 Aug; 108(2): 275–80.
13. Queille–Roussel C, Paul C, Duteil L et al. The new topical ascomycin derivative SDZ ASM 981 does not induce skin atrophy when applied to normal skin for 4 weeks: a randomized, double–blind controlled study. Br J Dermatol. 2001 Mar; 144(3): 507–13.
14. Meurer M, Folster–Holst R, Brautigam M. Pimecrolimus (SDZ ASM 981) cream reduces the need for corticosteroids in the long–term management of atopic dermatitis in adults. Study, presented at the 60–th annual meeting of the American Academy of Dermatology in New Orleans, USA, February 2002
15. Hanifin JM, Thurston M, Omoto M et al. The eczema area and severity index (EASI): assessment of reliability in atopic dermatitis. EASI Evaluator Group. Exp Dermatol. 2001 Feb; 10(1): .11–8.
16. Rajka G. Natural history and clinical manifestations of atopic dermatitis. Clin Rev Allergy. 1986 Feb; 4(1): 3–26.
Противопоказания
повышенная чувствительность к тимекролимусу или любым компонентам препарата;
детский возраст до 3 мес (безопасность и эффективность применения крема Элидел у детей младше 3 мес не изучалась);
наличие острой вирусной, бактериальной или грибковой инфекций кожи.
С осторожностью:
пациенты с синдромом Нетертона (данных по безопасности применения нет) — возможен риск повышения системной абсорбции препарата;
тяжелые формы воспаления или поражения кожи, в т.ч. генерализованная эритродермия (данных по безопасности применения нет) — возможен риск повышения системной абсорбции препарата;
ослабленный иммунитет — т.к. эффективность и безопасность использования не изучались.
Данные по безопасности длительного применения крема Элидел отсутствуют.
Поскольку влияние длительного применения препарата на иммунную защиту кожи и частоту развития злокачественных новообразований не изучено, крем Элидел не следует наносить на поврежденные участки кожного покрова с возможным озлокачествлением или диспластическими изменениями.
В случае бактериального или грибкового поражения кожи применение крема Элидел на пораженных участках возможно только после излечения инфекции.
Применение при беременности и кормлении грудью
Данных по применению препарата у беременных женщин нет. В экспериментальных исследованиях при местном применении препарата прямого или опосредованного повреждающего действия крема Элидел на течение беременности, развитие эмбриона/плода, течение родов и постнатальное развитие потомства не выявлено. Следует соблюдать осторожность при назначении беременным женщинам. Однако учитывая минимальную степень всасывания пимекролимуса при местном применении, потенциальный риск у человека считается незначительным.
Выделение препарата с грудным молоком после местного применения на экспериментальных моделях не изучалось. Данных по содержанию пимекролимуса в грудном молоке кормящих женщин нет.
Поскольку многие препараты выделяются с грудным молоком, следует соблюдать осторожность при назначении 1% крема Элидел кормящим женщинам. Однако учитывая минимальную степень системного всасывания пимекролимуса при местном применении, потенциальный риск для человека считается незначительным.
Кормящие женщины не должны наносить 1% крем Элидел на область молочных желез.
Влияние крема Элидел на фертильность у мужчин и женщин не установлено.
Побочные действия
Применение крема Элидел может вызывать незначительные преходящие реакции в месте нанесения, такие как чувство тепла и/или жжения. При значительной выраженности этих реакций пациенты должны проконсультироваться у врача.
Наиболее часто реакции в месте применения препарата отмечались у 19% пациентов, получавших лечение кремом Элидел, и у 16% пациентов контрольной группы. Эти реакции в основном возникали на раннем этапе лечения, были незначительными/умеренными и непродолжительными.
Определение частоты побочных реакций: очень часто (≥1/10); часто (≥1/100, <1/10); иногда (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000), включая отдельные сообщения.
Очень часто — жжение в месте нанесения крема.
Часто — местные реакции (раздражение, зуд и покраснение кожи), кожные инфекции (фолликулит).
Иногда — нагноение, ухудшение заболевания, простой герпес, дерматит, обусловленный вирусом простого герпеса (герпетическая экзема), контагиозный моллюск; местные реакции, такие как сыпь, боль, парестезии, шелушение, сухость, отечность, кожные папилломы, фурункулы.
Представленные ниже нежелательные реакции отмечались при постмаркетинговом применении препарата (оценка частоты по количеству случаев развития нежелательных явлений в неустановленной популяции).
Со стороны иммунной системы: очень редко — анафилактические реакции.
Со стороны обмена веществ (метаболические нарушения): редко — непереносимость алкоголя.
Со стороны кожи и ее придатков: редко — аллергические реакции (сыпь, крапивница, ангионевротический отек); изменения цвета кожи (гипопигментация, гиперпигментация).
В большинстве случаев сразу же после приема алкоголя развивалось покраснение лица, сыпь, жжение, зуд или припухлость.
При применении крема Элидел в редких случаях отмечалось развитие злокачественных новообразований, включая кожные и другие типы лимфом, рак кожи. Причинно-следственная связь между данными нежелательными явлениями и применением препарата не установлена.
Взаимодействие
Потенциальное взаимодействие крема Элидел с другими препаратами не изучалось. Учитывая, что системная абсорбция пимекролимуса очень незначительна, какое-либо взаимодействие крема Элидел с препаратами для системного применения маловероятно.
При применении крема Элидел у детей в возрасте 2 лет и старше препарат не оказывал влияния на эффективность вакцинации.
Не рекомендуется нанесение крема на области введения вакцины до полного исчезновения местных проявлений поствакцинальной реакции.
Несовместимость. Поскольку исследования совместимости не проводились, не рекомендуется применять препарат совместно с другими средствами для местного применения.
Способ применения и дозы
Наружно.
Лечение следует начинать при первых проявлениях заболевания для предотвращения резкого развития его обострения.
Крем наносят тонким слоем на пораженную поверхность 2 раза в сутки и осторожно втирают до полного впитывания.
Крем можно наносить на кожу любых частей тела, включая голову, лицо, шею, а также на области опрелостей. Крем Элидел следует применять 2 раза в сутки, до полного исчезновения симптомов заболевания. При сохранении выраженности симптомов через 6 нед применения препарата необходимо провести повторное обследование пациента для подтверждения диагноза атопического дерматита. После прекращения лечения, во избежание последующих обострений, при первых признаках рецидива атопического дерматита терапию следует возобновить. Смягчающие средства можно применять сразу после нанесения 1% крема Элидел. Однако после водных процедур смягчающие средства следует применять перед нанесением крема Элидел.
Учитывая очень незначительное системное всасывание пимекролимуса, ограничений общей суточной дозы наносимого препарата, площади обрабатываемой поверхности кожи или длительности лечения не существует. При попадании крема Элидел в глаза, на слизистые оболочки (ротовой или носовой полости) следует немедленно удалить крем и промыть глаза и слизистые оболочки проточной водой.
Применение крема Элидел при атопическом дерматите
Аида
18 февраля 2020
Здравствуйте. Ребёнку 6 месяцев. С 3 месяцев начались высыпания в виде покраснения и шелушения с мокнутием кожи на складках под коленками и шее, редко на внутренней стороне логтевых сгибов и на щеках. Кожа в местах высыпаний сильно зудит. Поставили диагноз «Атопический дерматит». Ребёнок на ГВ. Прикорм только собираемся вводить. Соблюдаю диету, не ем яйца, молоко и молочные продукты, мясо вообще не ем, помидоры, грибы, цитрусовые, рыбу и морепродукты, орехи, красные фрукты и овощи, ягоды, периодически исключаю глютеносодержащие продукты. Особого эффекта от диеты не вижу (разве что при вводе в мой рацион кисломолочных продуктов и сыра в кале ребёнка появляются белые комочки, которые исчезает сразу после исключения данных продуктов из рациона…эспериментировала уже несколько раз, результат всегда повторяется). По итогам последнего посещения аллерголога были сданы кое какие анализы, результаты: Витамин Д (total): 16 (норма от 30), аллерген яйцо, IgE:15,7, аллерген молоко коррвье, IgE: 0.71. Доктор назначил лечение: приём витамина Д длительно, Адвантан — две недели, затем Элидел 14 дней 2 раза в день, затем 14 дней 1 раз в день. Исключить из рациона молоко и молочные продукты и яйца. Но вот какое дело — Элидел нам так хорошо помогает (даже лучше чем адвантан) , что через два дня после начала применения от высыпаний не остаётся и следа и на третий день я фактически мажу здоровую кожу. Но в аннотации к препарату указано что его наносят только на поврежденную кожу. Получается, схема, предложенная доктором, нам не подходит. Но при этом отмечу, что после достижения «чистой» кожи на третий день я пробовала отменить препарат, как правило, через пару дней высыпания снова появляются. С учётом изложенного прошу посоветовать схему лечения кожи Элиделом, которая подойдёт нам с учётом очень быстрого, но при этом кратковременного эффекта от использования препарата. Или может пользоваться им по ранее предложенной нам схеме, несмотря на рекомендации в аннотации к препарату. И ещё прошу подсказать, есть ли на данном этапе развития медицины возможность выявить причину данного заболевания для того, чтобы устранить «корень» проблемы, а не её проявления в виде высыпаний? В каком направлении нам двигаться? Какие анализы сдать? К каким врачам обратиться? Ведь Элиделом можно пользоваться в целом не больше 6 месяцев (так сказала аллерголог), а что нам делать дальше?? Диета, как я указала ранее, не даёт эффекта. Так же добавлю, что я в детстве страдала от этого недуга. В период до года у меня были высыпания на щеках, потом они прошли, а лет с 2 до 5 высыпало внутреннюю часть логтевых сгибов. Я так понимаю, что атопический дерматит — это мой генетический «подарок» сыну. Но может всё таки можно что-нибудь сделать? Благодарю за Ваше мнение.
Вопрос закрыт
аллергия
атопический дерматит
элидел
Особые указания
При лечении ингибиторами кальциневрина для местного применения, включая Элидел, в редких случаях отмечалось развитие злокачественных новообразований (например кожных опухолей и лимфом). Причинно-следственная связь между данными нежелательными явлениями и применением препарата не установлена.
В клинических исследованиях при применении крема Элидел у 0,9% пациентов (14 из 1544) отмечалось развитие лимфаденопатии. Обычно лимфаденопатия была обусловлена инфекционными заболеваниями и исчезала после проведения курса соответствующей антибиотикотерапии. У всех пациентов или удавалось выявить причину развития лимфаденопатии, или отмечалось исчезновение данного нежелательного явления. У больных, получающих лечение Элиделом, при развитии лимфаденопатии необходимо установить этиологию процесса и обеспечить наблюдение за пациентами до полного исчезновения данного нежелательного явления. При неустановленной этиологии лимфаденопатии или при наличии у пациента острого мононуклеарного воспаления препарат следует отменить.
При лечении кремом Элидел пациентам рекомендуется уменьшить до минимума искусственную или естественную инсоляцию кожи или полностью исключить УФ облучение. Возможное влияние применения препарата при поражениях кожи, вызванных УФ облучением, неизвестно.
Влияние на способность к вождению автотранспорта и управлению механизмами. Влияние применения крема Элидел на способность к управлению автотранспортом или работе с механизмами не установлено.
Инструкция по применению ЭЛИДЕЛ® (ELIDEL®)
Элидел® не следует наносить на пораженные острой вирусной инфекцией кожные покровы.
В случае бактериального или грибкового поражения кожи необходимо применение соответствующих противомикробных средств. Если инфекционный процесс не уменьшается, применение Элидел® нужно отменить до тех пор, пока инфекция не будет соответственно вылечена.
Поскольку влияние на местный иммунный ответ кожи и проявления злокачественных новообразований при длительном лечении Элидел® не известно, его применение при потенциально злокачественных новообразованиях кожи или при возможности возникновения таких заболеваний не рекомендуется. Хотя причинная взаимосвязь не установлена, зарегистрированы редкие случаи злокачественных новообразований (например, кожи) и лимфом у пациентов, местно применявших ингибиторы кальциневрина, в т.ч. Элидел® .
Данное лекарственное средство не рекомендуется применять у пациентов с синдромом Нетертона или генерализованной эритродермией, при которых имеет место повышенное всасывание, т.к. безопасность данного препарата у такой категории больных однозначно не установлена.
Не рекомендуется применять Элидел® у пациентов с нарушениями иммунитета, поскольку безопасность и эффективность его не изучена у таких больных. При клинических исследованиях крема Элидел® установлено 0.9% случаев лимфаденопатий. Как правило, они были связаны с различными инфекциями и проходили после проведения адекватной антибиотикотерапии. Однако большинство из них были понятной этиологии или исчезали сами по себе. При появлении признаков лимфаденопатий у пациентов, применяющих крем Элидел®, необходимо установить причину процесса. При отсутствии очевидной причины лимфаденопатий или при возникновении острого инфекционного мононуклеоза, необходимо приостановить лечение данным препаратом. Также необходимо проводить мониторинг пациентов с лимфаденопатией, возникшей во время лечения Элиделом, с целью подтверждения факта ее исчезновения.
Целесообразно, чтобы на протяжении лечения данным препаратом пациенты избегали или максимально ограничивали свое пребывание на солнце или под искусственными ультрафиолетовыми лучами, даже если препарат не нанесен на пораженные участки кожи, поскольку потенциальное воздействие крема Элидел® на пораженную кожу под действием ультрафиолетового облучения не изучено.
Атопический дерматит (экзема) редко наблюдается у больных 65 лет и старше. Количество пациентов такого возраста в клинических исследованиях крема Элидел® было недостаточным для того, чтобы выявить какие-либо различия в эффективности лечения по сравнению с молодыми пациентами.
Применение препарата Элидел® может вызывать незначительные преходящие реакции в месте нанесения, такие как чувство тепла и/или жжения. Пациенты должны быть предупреждены о необходимости обратиться к врачу при значительной выраженности этих реакций.
Крем нельзя наносить на слизистые оболочки. При случайном попадании препарата на слизистые оболочки и в глаза следует немедленно промыть их водой.
Влияние на способность к вождению автотранспорта и управлению механизмами
Влияние применения крема Элидел® на способность управлять автомобилем и работать с механизмами не установлено.