Ферритин: что это такое
Ферритином называют сложносоставной комплекс белков, который играет роль аккумулятора молекул железа. От латинского названия химического элемента железа (феррум, Fe) произошло название железосодержащего белкового комплекса – ферритин. Именно ферритин снабжает железом каждую клетку, которая в нем нуждается.
Организм человека сам не синтезирует железо. Этот элемент поступает к нам с пищей. Уровень усвоенного количества железа напрямую зависит от возраста. Чем человек младше, тем выше его способность вычленить этот элемент из пищи и сохранить в виде ферритина. Максимум железа могут усвоить дети первого года жизни – до 70% от потребляемого количества. В возрасте до 10 лет организм бреет уже в 7 раз меньше от поступившего объема. Взрослые же люди получают всего 10% железа от того количества, что было съедено за день.
Химические процессы организма здорового человека четко контролируют количество железа в крови, и при необходимости корректируют распределение полученного объема элементов. Например, при достаточном количестве железа в оргпнизме, усвоенная его часть может быть отложена в качестве некой заготовки «на черный день» — это и есть ферритин, который при возникновении первой же потребности доставит железо в требуемом объеме нуждающемуся органу. А при пониженной концентрации железа в организме ферритин не пополняет свои запасы, так как весь усвоенный объем тут же распределяется по тканям.
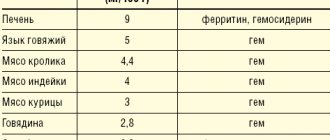
Располагается ферритин в печени, плазме, костном мозге, плаценте и селезенке. Определяют уровень содержания общего ферритина в организме через изучения состава плазмы крови.
Цены
| Ферритин | 360 ₽ |
Все цены
Наименование на английском языке: ferritin.
Ферритин — сложный белковый комплекс (железопротеид), выполняющий роль основного внутриклеточного депо железа у человека и животных. Структурно состоит из белка апоферритина и атома трехвалентного железа в составе фосфатного гидроксида. Одна молекула ферритина может содержать до 4000 атомов железа. Содержится практически во всех органах и тканях и является донором железа в клетках, которые в нём нуждаются.
В ситуации, когда железа начинает не хватать (частые кровопотери или нехватка его поступления вместе с пищей), организм человека начинает использовать его резерв из ткани. Уровень ферритина начинает снижаться. Длительная нехватка поступающего железа может привести к анемии. Уровень ферритина же бывает сниженным задолго до появления симптомов железодефицита и позволяет вовремя диагностировать анемию.
Наряду с этим снижается также уровень гемоглобина. Состояние сопровождается недостаточным снабжением кислородом клеток и тканей органов всего организма. В большей степени при этом страдает центральная и периферическая нервная система.
Ферритин: показатели в норме
Различные заболевания или некоторые физиологические процессы могут влиять на уровень ферритина. К естественным причинам снижения показателей относятся:
- периодические женские кровотечения;
- беременность;
- соблюдение диеты.
Для контроля состояния здоровья в качестве профилактики, а также в случае проявления симптомов, типичных для дефицита железа проводят биохимический анализ крови на ферритин. Собранный биоматериал исследуют, чтобы понять, сколько микрограмм железа содержится в одном литре плазмы.
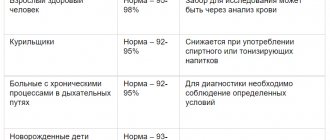
Показания нормы для каждой возрастной группы свои:
- у новорожденных от 25 до 600 мкг/л;
- у детей старше 28 дней, но еще не достигших 9-недельного возраста норма составляет 20-600 мкг/л;
- у детей от 2 до 5 месяцев должно быть от 50 до 200 мкг/л;
- дети, возрастом от полугода до года должны иметь от 70 до 140 мкг/л;
- девочки и женщины, старше 12 лет должны иметь в норме от 22 до 180 мкг/л;
- мальчик и мужчины, старше 12 лет – от 30 до 310 мкг/л.
Женская кровь содержит меньше ферритина, потому как в ней меньше гемоглобина, эритроцитов и молекул железа. Кроме того, беременность вносит свои коррективы в содержание ферритина:
- в первом триместре беременности показатели могут достигать 90 мкг/л;
- во втором триместре кровь содержит до 74 мкг/л;
- а третий триместр знаменит своей низкой нормой содержания ферритина – всего 10-15 мкг/л.
Железодефицитная анемия во время беременности — профилактика и лечение
М.А. ВИНОГРАДОВА
, к.м.н., Т.А. ФЁДОРОВА, д.м.н., профессор,
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова Минздрава России
Данный обзор посвящен проблеме профилактики и лечения анемии во время беременности. Железодефицитная анемия (ЖДА) является самым распространенным дефицитным состоянием и наиболее частой формой анемии у беременных женщин. Клинические последствия ее крайне важны, т. к. неблагоприятные эффекты железодефицита затрагивают не только организм женщины, но и способны влиять на исходы беременности и здоровье новорожденных. Первая линия терапии железодефицита — это препараты железа, предназначенные для приема внутрь, наиболее эффективной и безопасной формой которых в настоящее время считается железо-полимальтозный комплекс. При недостаточной эффективности и тяжелой форме анемии предпочтительным альтернативным методом является внутривенное введение препарата железа. Своевременная диагностика и адекватная терапия позволяют в кратчайшие сроки восстановить показатели обмена железа у беременной женщины и не допустить развития осложнений.
Введение
Известно, что недостаток железа является наиболее распространенным пищевым дефицитным состоянием в мире [1] и наиболее распространенной причиной анемии у беременных (до 75%) [2]. По определению Всемирной организации здравоохранения, анемией при беременности считается снижение гемоглобина крови менее 110 г/л [1], а во втором триместре — менее 105 г/л [3]. Известно, что при беременности в организме женщины происходит ряд физиологических изменений, в том числе и со стороны крови. Общий объем плазмы увеличивается до 50% от исходного, а глобулярный объем возрастает только на 25% [4, 5]. Вследствие этого повышается потребность в микроэлементах и витаминах, необходимых для синтеза гемоглобина и обеспечения нормального развития плода и плаценты. При отсутствии адекватного восполнения возрастающих потребностей развивается дефицит микроэлементов, в первую очередь железа, и, как следствие, анемия. Обусловлено это множеством факторов: нередко беременность наступает при исходно сниженном уровне гемоглобина или недостаточных запасах железа в организме, которые могут быть обусловлены особенностями диеты, хроническими заболеваниями желудочно-кишечного тракта или длительными обильными менструациями. Железо является важнейшим микроэлементом для человека. Во время беременности адекватный статус железа является значимой предпосылкой для нормального развития плода и зрелости новорожденного. Показано, что тяжелая анемия со снижением гемоглобина менее 90 г/л может способствовать осложнениям беременности и неблагоприятно влиять на ее исходы [6]. Существуют доказательства того, что дефицит железа, даже при отсутствии железодефицитной анемии (ЖДА), может оказывать негативное влияние и на небеременных женщин, например, по отношению к когнитивным способностям и физической работоспособности. Кроме того, ЖДА во время беременности связана с риском преждевременных родов и низкого веса новорожденного [7].
Оценка статуса железа в организме
Для адекватной оценки показателей обмена железа и своевременного выявления железодефицита необходимо применение ряда лабораторных тестов. Кроме общего анализа крови, дающего представление об уровне гемоглобина и характеристиках эритроцитов, статус железа может быть оценен в первую очередь с помощью исследования ферритина сыворотки. Дополнительные тесты включают исследование насыщения трансферрина и сывороточного «растворимого» рецептора трансферрина (sTfR). Железо сыворотки не является надежным диагностическим параметром, поэтому его исследования недостаточно для уточнения причины анемии. Изолированное исследование уровня гемоглобина не подходит для оценки анемии во время беременности в связи с наличием у пациенток различной степени гемодилюции [8]. Ферритин предоставляет информацию о полноте запасов железа в организме, sTfR и насыщение трансферрина — информацию о развитии дефицита железа на клеточном уровне, а гемоглобин дает информацию о дефиците железа на функциональном уровне. Для практических целей общий анализ крови и сывороточный ферритин являются достаточным объемом обследования для оценки статуса железа и диагностики ЖДА у большинства женщин. Важно, что при наличии воспалительного процесса значение ферритина может быть недостоверно высоким. В таком случае повышение С-реактивного белка (СРБ) является подтверждением воспалительного процесса, требующего лечения. Диагностический алгоритм при выявлении анемии представлен на рисунке 1 [9].
Потребность в железе во время беременности
Потребность в железе во время беременности возрастает от 0,8 мг/день в первом триместре до 7,5 мг/день в третьем триместре беременности (в среднем 4,4 мг/день). В среднем при нормальной беременности необходимо дополнительно около 1,240 мг железа [10, 11]. Исследования показали, что многие небеременные женщины имеют сниженные запасы железа: у 42% ферритин сыворотки менее 30 мкг/л, и только у 14—20% из них содержание ферритина превышает 70 мкг/л, [12], т. е. запасы железа уравновешивают потребности нормальной беременности [10].
Можно выделить группы беременных женщин, которые имеют более высокий риск развития дефицита железа: многоплодная беременность, несколько беременностей с коротким интергравидарным интервалом, доноры крови, вегетарианцы, женщины с низким социально-экономическим статусом, пациенты с хроническими заболеваниями желудочно-кишечного тракта [13]. Доказано, что существуют значимые различия между уровнем гемоглобина у женщин, получающих дополнительно железо во время беременности и не получающих [14]. Кроме того, гемодилюция вызывает физиологические колебания уровня гемоглобина во время беременности [15]. У женщин, получающих во время беременности препараты с добавлением железа, по концентрации гемоглобина отображается устойчивое снижение с конца первого триместра из-за гемодилюции, достигнув минимума в 25 недель беременности. Впоследствии, гемоглобин повышается в течение оставшегося периода беременности, чтобы достичь пикового уровня незадолго до родов.
Профилактика железодефицита
Плацебо-контролируемые исследования неизменно показывают, что беременные женщины, употребляющие железо в виде добавок, имеют значительно более высокий запас железа по сравнению с женщинами, принимающими плацебо [16]. Следовательно, женщины, принимающие железо, имеют более низкую частоту анемии.
Ранее в качестве профилактики железодефицита у беременных применялись высокие дозы двухвалентного железа в диапазоне 100—200 мг/день. Доза 100 мг двухвалентного железа в сутки индуцирует максимальный рост гемоглобина, а 200 мг железа в день увеличивает ферритин и гемоглобин при родах также, как у небеременных женщин. Тем не менее результаты работы подчеркнули потенциальные негативные эффекты применения таких доз железа [14], и, следовательно, были начаты исследования по изучению эффективности меньших доз железа с попытками определить наименьшую эффективную дозу [17]. Результаты европейских исследований показали, что добавление 45—66 мг двухвалентного железа в сутки на сроке от 12—20 недель беременности до родов достаточно, чтобы предотвратить ЖДА у здоровых беременных женщин. Даже меньшие дозы 20—27 мг двухвалентного железа в сутки оказывают благоприятное влияние на статус железа [16]. Главные выводы из этих исследований, во-первых, что 30—40 мг двухвалентного железа в день является достаточным для предотвращения ЖДА, и, во-вторых, что низкие дозы препаратов железа в диапазоне 20—27 мг/день лучше, чем отсутствие добавок, тогда как исследования ежедневного употребления поливитаминных препаратов, содержащих 14—18 мг двухвалентного железа, показали отсутствие влияния на статус железа у женщин [13]. В настоящее время с целью профилактики железодефицита у беременных женщин рекомендовано применение препарата железа внутрь в дозе 30-40 мг/день с начала беременности до родов [14].
Таким образом, в настоящее время рекомендован индивидуальный подход к профилактике ЖДА, который основывается на оценке запасов железа (ферритин плазмы) до и в начале беременности. Женщинам с уровнем ферритина более 70 мкг/л не показаны препараты железа; при значениях ферритина 30—70 мкг/л следует принимать 30—40 мг двухвалентного железа в сутки и при показателях ферритина менее 30 мкг/л необходимо принимать 80—100 мг двухвалентного железа в сутки [14].
Лечение анемии
В случае выявления ЖДА должно быть произведено восполнение дефицита пероральным или внутривенным введением препаратов железа. Внутримышечное введение железа в настоящее время фактически не применимо в связи с ограничением дозы железа, вводимой за инъекцию, и высокой частотой болезненных местных реакций.
Препараты железа для приема внутрь
Всасывание железа регулируется в соответствии с запасами железа в организме и интенсивностью эритропоэза. Доказано, что в случае истощения запасов железа в организме увеличивается кишечная абсорбция железа [18]. Кроме того, повышенный эритропоэтин-индуцированный эритропоэз во втором и третьем триместре [19] стимулирует абсорбцию железа.
Такая сочетанная стимуляция всасывания железа была подтверждена в исследованиях, показавших, что с увеличением срока беременности происходит повышение поглощения железа, причем наиболее выраженно это происходит после 20 недель беременности. Способность усвоения через желудочно-кишечный тракт значительного количества железа благоприятна для лечения ЖДА таблетированными препаратами железа у беременных женщин. В связи с этим назначение препаратов железа внутрь является терапией первой линии, особенно в течение первого и второго триместров беременности [20]. При нетяжелой анемии с гемоглобином 90—105 г/л рекомендуемая доза составляет 100—200 мг элементарного железа в день. После перорального лечения препаратами железа в течение 2 нед. следует оценить эффект. Если гемоглобин увеличился более чем на 10 г /л, терапию следует продолжать в течение оставшегося периода беременности с последующим контролем гемоглобина и ферритина [13].
Рефрактерность анемии к терапии может быть следствием несоблюдения режима приема препарата вследствие субъективных причин, желудочно-кишечных побочных эффектов, нарушения всасывания железа из-за ахлоргидрии или воспалительного заболевания кишечника или скрыто продолжающегося кровотечения с потерями железа. Желудочно-кишечные нарушения, такие как колики, тошнота, рвота, диарея, возникают примерно у 6—12% пациентов, принимающих препараты железа [21]. Наиболее широко до последнего времени применялись внутрь соли железа. Однако их использование ограничено низким и неравномерным усвоением, в частности зависимым от пищевых продуктов [22]. Соединения трехвалентного железа были созданы, чтобы избежать этих проблем. В первом триместре беременности выраженность дефицита железа, с одной стороны, и достаточный запас времени — с другой, позволяют осуществить плавную коррекцию железодефицитных состояний с помощью наиболее безопасных препаратов перорального железа.
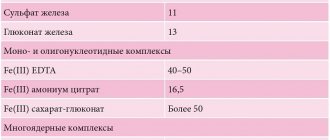
Железо-полимальтозный комплекс был разработан в качестве молекулы, которая растворяется при нейтральном рН. Препарат содержит железо в виде полимальтозного комплекса гидроксида железа (III) (ПКЖ), например Мальтофер. Этот комплекс стабилен и не выделяет железо в виде свободных ионов в кишечник. Структура препарата схожа с ферритином. Благодаря такому сходству железо (III) поступает из кишечника в кровь путем активного всасывания. Железо, входящее в состав ПКЖ, не имеет прооксидантных свойств, присущих простым солям железа. Исследования для оценки эффективности и безопасности полимальтозных препаратов в сравнении с сульфатом железа у беременных женщин показали их несомненное преимущество. Полимальтозный комплекс железа был разработан таким образом, что элементарная форма железа находится в неионогенном состоянии. Это гарантирует, что его применение не вызывает раздражение слизистой оболочки желудка. Кроме того, высокое содержание железа исключает необходимость частой дозировки и, следовательно, улучшает соблюдение графика приема. Полимальтозный комплекс (препарат Мальтофер) следует принимать во время или сразу же после приема пищи, что также повышает удобство применения. Интересные данные были получены в эксперименте применения солей железа и ПКЖ у беременных крыс. Все методы лечения были эффективны в отношении коррекции анемии. Однако в результате применения солей железа отмечены признаки повреждения печени и окислительного стресса при исследовании состояния плода и плаценты. ПКЖ восстанавливает нормальную экспрессию TNF-α и IL-6 в плаценте, в то время как в случае применения сульфата железа наблюдались самые высокие уровни цитокинов, предполагая местную воспалительную реакцию. Большинство негативных эффектов, связанных с ЖДА, были решены назначением ПКЖ. Исходы беременности при использовании солей железа были хуже в случае назначения ПКЖ [23].
Изучение применения различных препаратов железа у взрослых людей проводилось многократно. Исследование Badhwar и коллег [24] с участием как женщин, так и мужчин с ЖДА продемонстрировали эквивалентную эффективность и лучшую биодоступность ПКЖ в сравнении с фумаратом железа. Тем не менее это исследование было проведено у небеременных женщин. Исследование Pakar и коллег [25] также продемонстрировало эффективность и безопасность ПКЖ как у беременных, так и у небеременных женщин.
Важные результаты получены в рандомизированном двойном слепом контролируемом исследовании применения ПКЖ во время беременности [26].
Частота побочных эффектов была значительно выше в группе, получавшей соли железа, чем в группе ПКЖ (78 против 31%, р < 0,001). Увеличение числа случаев неблагоприятных эффектов приема солей железа может быть связано с высвобождением свободных радикалов, что приводит к повреждению и гибели клеток [27], тогда как ПКЖ не освобождает свободные радикалы. Снижение частоты побочных эффектов улучшает соблюдение пациентами режима приема и обеспечивает регулярное лечение. Кроме того, лучшая переносимость крайне важна для обеспечения длительной терапии во время беременности. ПКЖ является эффективным терапевтическим подходом в лечении ЖДА у беременных женщин. Улучшенный профиль переносимости в сравнении с препаратами солей железа и эквивалентный профиль эффективности убедительно свидетельствуют, что ПКЖ является предпочтительной формой железа для приема внутрь при лечении ЖДА во время беременности. Значимо лучшая переносимость ПКЖ в сравнении с быстро насыщающими, но хуже переносимыми препаратами неорганических солей железа обеспечивает более высокую комплаентность пациенток, способствуя формированию положительного стереотипа ежедневного приема лекарственного средства вплоть до конца беременности, что является принципиально необходимым.
Препараты железа для внутривенного введения
Лечение внутривенным препаратом железа превосходит пероральные препараты железа по быстроте восстановления гемоглобина и пополнения запасов железа в организме. Однако безопасность таких препаратов в I триместре недостаточно доказана, поэтому они могут быть рекомендованы к применению со II или III триместра беременности. Внутривенное железо уменьшает потребность в переливании крови и является альтернативой трансфузиям при тяжелой ЖДА. В настоящее время наиболее эффективным терапевтическим подходом, позволяющим в кратчайшие сроки безопасно получить максимальный эффект, является применение карбоксимальтозата железа [28]. Это комплекс, не содержащий декстран, который может быть использован в максимальных дозах (до 1000 мг на одно внутривенное введение) в короткий промежуток времени (на одну инфузию требуется 15—30 мин). Повторные инфузии проводятся еженедельно из расчета 15 мг железа на кг массы тела. По данным Cochrane Database [29], из препаратов для внутривенного применения именно карбоксимальтозат железа является препаратом выбора терапии ЖДА при беременности. Внутривенные препараты железа считаются безопасными во втором и третьем триместрах беременности [30], и тем не менее внутривенные инфузии препаратов железа должен осуществлять персонал медицинского учреждения во избежание возможных аллергических или других реакций. Лечение препаратами внутривенного железа показано в случаях неэффективности железо-содержащих средств для приема внутрь (отсутствие повышения гемоглобина на 10 г/л в течение 2 нед.), при тяжелой ЖДА (гемоглобин <90 г/л на сроках беременности более 14 нед., а также в качестве терапии первой линии ЖДА в третьем триместре. На данном сроке остается недостаточно времени, чтобы препараты для пероральной терапии могли быть эффективны. Это важно, чтобы снизить проявления ЖДА и пополнить запасы железа до родов в целях предотвращения анемии в родах и избежать переливания крови. Доза внутривенного железа должна быть достаточной для достижения уровня гемоглобина более 105 г/л. У большинства женщин суммарная доза 1 000—1 250 мг внутривенного железа является адекватной. При достижении уровня гемоглобина 105 г/л осуществляется перевод на поддерживающую терапию препаратом железа внутрь 100 мг/день до конца беременности.
Заключение
Железодефицитная анемия является наиболее частой формой анемии у беременных женщин (до 95%). Диагноз ЖДА основывается на выявлении снижения гемоглобина крови и уровня сывороточного ферритина. Среди небеременных женщин репродуктивного возраста до 40% имеют недостаточные запасы железа по отношению к предстоящей беременности, поэтому вопросы своевременной коррекции дефицита железа до развития анемии крайне важны при планировании беременности. С этой целью применяются комплексные препараты, содержащие от 30 до 80 мг железа в зависимости от значений сывороточного ферритина. Учитывая возрастающие потребности в железе во время беременности, диетические меры являются недостаточными для коррекции железодефицита. Лечение ЖДА во время беременности должно проводиться с применением препаратов для приема внутрь, наиболее предпочтительным из которых является полимальтозный комплекс гидроксида железа (III) и препаратов железа для внутривенного введения. При ЖДА с уровнем гемоглобина более 90 г/л первой линией терапии является ПКЖ в дозе 100—200 мг/день. Показаниями для назначения внутривенного препарата железа является анемия с уровнем гемоглобина менее 90 г/л, недостаточный эффект от терапии пероральными препаратами (гемоглобин менее 100 г/л в течение 2 нед.) либо плохая переносимость. Своевременное выявление и эффективная терапия, безопасная для беременных, позволяет в кратчайшие сроки нормализовать уровень гемоглобина и улучшить показатели запасов железа, что, в свою очередь, улучшает качество жизни женщин и предотвращает развитие осложнений беременности. Принимая во внимание неизбежность развития той или иной степени железодефицита в период гестации у абсолютного большинства беременных и учитывая негативные отдаленные последствия недостатка железа на анте- и постнатальное развитие ребенка, наиболее оправданной следует признать тактику раннего начала терапии анемии.
Литература
1. WHO Iron Deficiency Anaemia: Assessment, Prevention and Control. WHO/NHD/01.3, World Health Organization, 2001, Geneva, Switzerland. 2. Sifakis S and Pharmakides G. Anemia in pregnancy. Ann. N. Y. Acad. Sci., 2000, 900: 125–36. 3. Ramsey M, James D & Steer P. Normal Values in Pregnancy, 2nd edn. WB Saunders, London, 2000. 4. Coad J, Conlon C. Iron deficiency in women: assessment, causes and consequences. Current opinion in clinical nutrition and metabolic care. 2011, 14, 625-634. 5. Friedman AJ et al. Iron deficiency anemia in women across the life span. Journal of women’s health, 2012, 21: 1282-1289. 6. The Obstetric Hematology Manual edited by Sue Pavord, Beverley Hunt. Cambridge University Press 2010. P. 13-27. 7. Ren A, Wang J, Ye RW, Li S, Liu JM, Li Z (2007). Low first trimester hemoglobin and low birth weight, preterm birth and small for gestational age newborns. Int J Gynaecol Obstet, 98: 124–128. 8. Koller O (1982). The clinical significance of hemodilution during pregnancy. Obstet Gynecol Surv, 37:649–652. 9. Breymann Сh et al. Diagnosis and treatment of iron-deficiency anaemia during pregnancy and postpartum. Arch Gynecol Obstet , 2010, 282: 577-580. 10. Milman N (2006). Iron and pregnancy — a delicate balance. Ann Hematol, 85: 559–565. 11. Bothwell TH (2000). Iron requirements in pregnancy and strategies to meet them. Am J Clin Nutr, 72: 257–264. 12. Milman N, Byg K-E, Ovesen L (2000). Iron status in Danes updated 1994. II. Prevalence of iron deficiency and iron overload on 1319 women aged 40–70 years. Influence of blood donation, alcohol intake, and iron supplementation. Ann Hematol, 79: 612–621. 13. Milman N. Prepartum anaemia: prevention and treatment. Ann Hematol, 2008, 87: 949–959. 14. Milman N (2006). Iron prophylaxis in pregnancy—general or individual and in which dose? Ann Hematol, 85: 821–828 doi:10.1007/s00277-006-0145-x. 15. Milman N, Bergholdt T, Byg K-E, Eriksen L, Hvas A-M (2007). Reference intervals for haematological variables during normal pregnancy and postpartum in 433 healthy Danish women. Eur J Haematol, 79: 39–46. 16. Makrides M, Crowther CA, Gibson RA, Gibson RS, Skeaff CM (2003). Efficacy and tolerability of low-dose iron supplements during pregnancy: a randomised controlled trial. Am J Clin Nutr, 78: 145–153. 17. Milman N, Bergholt T, Eriksen L, Byg K-E, Graudal N, Pedersen P, Hertz J (2005). Iron prophylaxis during pregnancy — how much iron is needed? A randomised, controlled study of 20 to 80 mg ferrous iron daily to pregnant women. Acta Obstet Gynecol Scand, 84: 238–247. 18. Skikne B, Baynes RD (1994). Iron absorption. In: Brock JH, Halliday JW, Pippard MJ, Powell LW (eds) Iron metabolism in health and disease. Saunders, London, pp 151–187. 19. Milman N, Graudal N, Nielsen OJ, Agger AO (1997). Serum erythropoietin during normal pregnancy: relationship to hemoglobin and iron status markers and impact of iron supplementation in a longitudinal, placebo-controlled study on 118 women. Int J Hematol, 66: 159–168. 20. Beris P, Maniatis A on behalf of the NATA working group on intravenous iron therapy (2007). Guidelines on intravenous iron supplementation in surgery and obstetrics/gynecology. TATM transfus Altern Transfus Med 9 (Suppl 1): 29. 21. Adamson JW. Fauci AS. Kasper DL, et al. Iron deficiency and other hypoproliferative anaemias. In: Braunwald E, editor; Harrison’s Principles of Internal Medicine.15th edition. Mc Graw Hill; 2001. pp 660–66. 22. Sharma N. Iron absorption: IPC therapy is superior to conventional iron salts. Obstet Gynecol., 2001: 515–19. 23. Toblli JE, Cao G, Oliveri L, Angerosa M. Effects of iron polymaltose complex, ferrous fumarate and ferrous sulfate treatments in anemic pregnant rats, their fetuses and placentas. Inflamm Allergy Drug Targets, 2013, 12(3): 190-8. 24. Badhwar VR, Rao S, Fonseca MM. Comparative efficacy and safety of iron polymaltose+folic acid and oral ferrous fumarate in the treatment of adult patients with iron deficiency anemia. Indian Med Gazette, 2003, 136: 296–301. 25. Patkar VD, Patkar S, Khandeparker PS, Dingankar NS, Shetty RS. Evaluation of efficacy and tolerability of iron (III) – hydroxide polymaltose complex tablets in the treatment of iron deficiency anaemia in women. Indian Med Gazette, 2001, 135: 306–309. 26. Saha L, Pandhi P, Gopalan S, Malhotra S and Saha PK. Comparison of Efficacy, Tolerability, and Cost of Iron Polymaltose Complex With Ferrous Sulphate in the Treatment of Iron Deficiency Anemia in Pregnant Women. MedGenMed, 2007, 9(1): 1. 27. McCord JM. Iron, free radicals, and oxidative injury. Semin Hematol., 1998, 35: 5–12. 28. Christoph P, Schuller C, Studer H et al. Intravenous iron treatment in pregnancy: comparison of high-dose ferric carboxymaltose vs. iron sucrose. J Perinat Med, 2012, 13, 40(5), 469-474. 29. Reveiz L, Gyte GML, Cuervo LG, Casasbuenas A. Treatments for iron-deficiency anaemia in pregnancy (Review), Cochrane library, 2011. 30. Beris P, Maniatis A, on behalf of the NATA working group on intravenous iron therapy (2007) Guidelines on intravenous iron supplementation in surgery and obstetrics/gynecology. TATM transfus Altern Transfus Med 9 (Suppl 1): 29.
Источник:
Медицинский совет, № 9, 2015
Чем опасен низкий ферритин
Снижение уровня ферритина в первую очередь является показанием к анализу системы питания. Чаще всего недостаточное содержание железа в крови вызывается неправильными диетами или голоданиями. Второй по популярности причиной являются кровотечения и заболевания органов пищеварения. С кровопотерей из организма уходят большие объемы железа, а из-за нарушения функции всасываемости дефицит не может быть восполнен.
При недостатке ферритина появляются следующие симптомы:
- ломкость ногтей;
- выпадение волос;
- снижение либидо;
- перепады настроения;
- повышение частоты сердечных сокращений;
- головокружения;
- ухудшение памяти.
Низкий ферритин если вовремя не выявить, и не начать корректировку питания и необходимое лечение, может стать толчком развития железодефицитной анемии.
Показания к назначению исследования
- Наследственный гемохроматоз. При этом заболевании из пищи всасывается слишком много железа, которое откладывается в различных органах, вызывая их повреждение.
- Множественные переливания крови, введение железа внутримышечно, назначение таблетированных препаратов железа.
- Воспаления, например инфекции верхних дыхательных путей, мочевыводящих путей, аутоиммунные заболевания. Причем повышение ферритина в острой фазе воспаления может маскировать имеющийся дефицит железа.
- Острые или хронические заболевания печени.
- Алкоголизм.
- Гемолитические анемии: связанные с разрушением эритроцитов, B12-дефицитная анемия, талассемия.
- Гипертиреоз — повышение функции щитовидной железы.
- Онкологические заболевания костного мозга, рак молочной железы, болезнь Ходжкина — злокачественное новообразование лимфоидной ткани. Уровень ферритина при этом будет повышен значительно.
Высокие показатели ферритина
Высокий ферритин, близкий к границе нормы, говорит о том, что ткани и органы получают ежедневно достаточное количество железа с питанием, благодаря чему организм имеет возможность делать запасы важного элемента. Если значения, полученные в результате лабораторных исследований, дали завышенные показатели, существенно выходящие за пределы допустимых значений, это повод обследовать на предмет выявления:
- онкологии;
- инфицирования вирусом иммунодефицита;
- проблем в работе эндокринной системы.
Отдельно нужно проанализировать свой рацион. Возможно, избыток железа легко объяснит насыщенная этим элементом диета.